结肠癌是世界常见的恶性肿瘤之一,年新发病率位列第三[1]。在中国癌症患者中,结肠癌发病率约为8.77%,为第五大常见恶性肿瘤,发病率和致死率有逐年上升趋势[2]。目前对II、III期结肠癌治疗是以手术为主的综合治疗,化学治疗作为一种辅助治疗在结肠癌综合治疗中起着重要作用。奥沙利铂(oxaliplatin,OXA)是第三代铂类化疗药物,杀死肿瘤细胞的主要机理是抑制DNA合成,主要应用于结肠直癌、卵巢癌、胃癌、乳腺癌等化学辅助治疗。化疗耐药是结肠癌治疗失败的主要原因之一,并且与患者的不良预后密切相关。因此,能增加肿瘤细胞对化疗药物敏感性的逆转剂成为了目前研究肿瘤耐药的热点。
甲基莲心碱(neferine,Nef)是从睡莲科植物莲成熟种子的绿色胚芽中提取出的一种双苄基异喹啉生物碱[3]。有研究发现Nef具有抗肿瘤作用并可增强肿瘤化疗敏感性。例如Nef可逆转胃癌SGC7901/VCR细胞的多药耐药性[4]。然而,Nef在结肠癌中研究尚未见报道。本研究通过观察Nef对耐OXA结肠癌HCT116细胞株耐受性的影响,探讨其对耐OXA细胞耐药性的逆转作用及其可能机制,为Nef应用于结肠癌的临床化疗增敏治疗提供一定的理论依据。
1 材料与方法
1.1 实验材料
1.1.1 细胞 人结肠癌细胞株HCT116购自中国科学院细胞库。
1.1.2 主要试剂及仪器 RARI-1640培养基(美国GIBCO公司);青霉素链霉素双抗、胎牛血清、胰蛋白酶(美国INVITROGEN公司);CCK8试剂盒(日本同仁化工)。Annexin V-FITC凋亡检测试剂盒(美国BD Biosciences)。兔抗人单克隆抗体 PARP、Bcl-2、Bax(美国 CST公司 )。HRP标记山羊抗兔IgG抗体(英国Abcam公司产品);ChemiDoc™ XRS+成像系统、Elx808型酶标仪(美国BIO-RAD公司),FACS Canto II流式细胞仪(美国 BD Biosciences)。
1.1.3 药物及制备 注射用OXA购自法国SANOFI-AVENTIS公司。将OXA配置成5 mmol/L母液,过滤除菌后分装,-20 ℃闭光保存,2周内使用。
1.2 实验方法
1.2.1 细胞培养及构建 OXA耐药株HCT116/OXA HCT116细胞用含10%胎牛血清RARI-1640和1%青链霉素双抗的完全培养基,置于37 ℃、5%CO2饱和湿度的恒温孵育箱中培养。将2 μmol/L OXA加入HCT116细胞中培养,连续4个周期,依次将 4、8、12、24、48 μmol/L 的OXA加入HCT116培基中诱导培养,直至细胞可在含48 μmol/L OXA的培基中生长,此时HCT116/OXA细胞构建成功。
1.2.2 细胞增殖抑制作用检测 ⑴ HCT116/OXA、HCT116对OXA耐受性的测定:CCK8法检测OXA对HCT116和HCT116/OXA细胞的增殖抑制作用。选取对数生长期的HCT116和HCT116/OXA制成单细胞悬液,调整浓度为每孔5×103个细胞接种于96孔培养板,待细胞贴壁后分别加入7个梯度浓度的OXA(0.1、1、10、20、50、100、1 000 μmol/L),同时设置空白对照组和调零孔,每组均设5个复孔。其中对照组加入细胞和完全培养基,调零组只加入完全培养基。分别于培养24、48 h时加入10%CCK8 100 μL,孵育3 h后用酶标仪在450 nm波长检测吸光度OD值。采用GraphPad Prism 5.0软件计算各组细胞半数抑制率(IC50),IC50(%)=[1-(OD值实验组-OD 值调零组)/(OD 值对照组-OD 值调零组)]×100%;并计算耐药指数(resistance index,RI)=耐药株IC50/亲本细胞IC50。⑵ Nef最适逆转浓度的确定:CCK8法检测Nef对HCT116/OXA细胞的增殖抑制作用。选取对数生长期的细胞制成单细胞悬液,调整浓度为每孔5×103个细胞接种于96孔培养板,待细胞贴壁后分别加入7个梯度浓度的Nef(2.5、5、10、20、40、80、160 μmol/L), 同时设置空白对照组和调零孔,每组均设5个复孔。作用 24、48 h时加入 10% CCK8 100 μL,孵育3 h后检测并计算IC50,检测Nef对HCT116/OXA的毒性作用,计算细胞存活率(%)=(1-细胞抑制率%)。以细胞存活率为90%时的Nef浓度作为最适逆转浓度。逆转倍数=OXA组IC50/Nef+OXA 组 IC50。
1.2.3 细胞凋亡检测 取对数生长期的HCT116/OXA细胞,以胰酶消化制成单细胞悬液,接种于6孔板内。设置空白组、OXA组、Nef组和Nef+OXA组。OXA处理浓度为对HCT116/OXA的IC50浓度;Nef处理浓度为最适逆转浓度。在37 ℃、5%CO2条件下培养,待细胞贴壁后给予不同处理。处理24 h时收集不同处理组细胞,4 ℃预冷的PBS洗涤1次后加入300 μL 1×结合缓冲液重悬细胞,加入5 μL Annexin V-FITC避光室温孵育15 min,然后加入5 μL PI避光孵育5 min后上机检测。细胞凋亡率(%)=(早期凋亡细胞数+晚期凋亡细胞数)/全部细胞数×100%。
1.2.4 细胞蛋白表达检测 将HCT116/OXA细胞接种于6孔板内。设置空白组、OXA组、Nef组和Nef+OXA组。不同处理组经处理24 h时PBS缓冲液洗涤细胞3次,加入细胞裂解液裂解缓冲液(含1×磷酸酶抑制剂混合物)后,置冰上30 min后刮取细胞,以500 W功率超声处理后在4 ℃条件下12 000 r/min离心30 min,取上清即为样品总蛋白。Western blot法检测 Bcl-2、Bax、PARP、p-PARP蛋白,采集图片并分析结果。
1.3 统计学处理
数据使用GraphPad Prism 5.0统计软件分析。3个及以上样本用Kuskal-Wallis H检验进行分析,两样本均数比较用Mann-Whitney U检验,计量资料均数±标准差(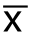 ±s)表示,P<0.05为差异有统计学意义。
±s)表示,P<0.05为差异有统计学意义。
2 结 果
2.1 人结肠癌耐OXA耐药株HCT116/OXA的建立
经过9个月逐步递增OXA浓度、间歇诱导,获得可稳定耐受OXA浓度为48 μmol/L且能正常生长的人结肠癌耐OXA细胞株HCT116/OXA。CCK8检测结果显示,OXA对人结肠癌细胞增殖有明显抑制作用。与48 h比较,处理24 h时HCT116/OXA的增殖抑制作用随浓度增加更为明显(P<0.001),因此选择24 h作为后续实验的处理时间(图1)。不同浓度OXA处理HCT116及HCT116/OXA 24 h时,CCK8法检测表明HCT116/OXA细胞对OXA的IC50浓度为(112.00±2.31)μmol/L,而HCT116细胞对OXA的IC50浓度为(21.00±0.64)μmol/L,因此HCT116/OXA的RI为5.33(图2)。
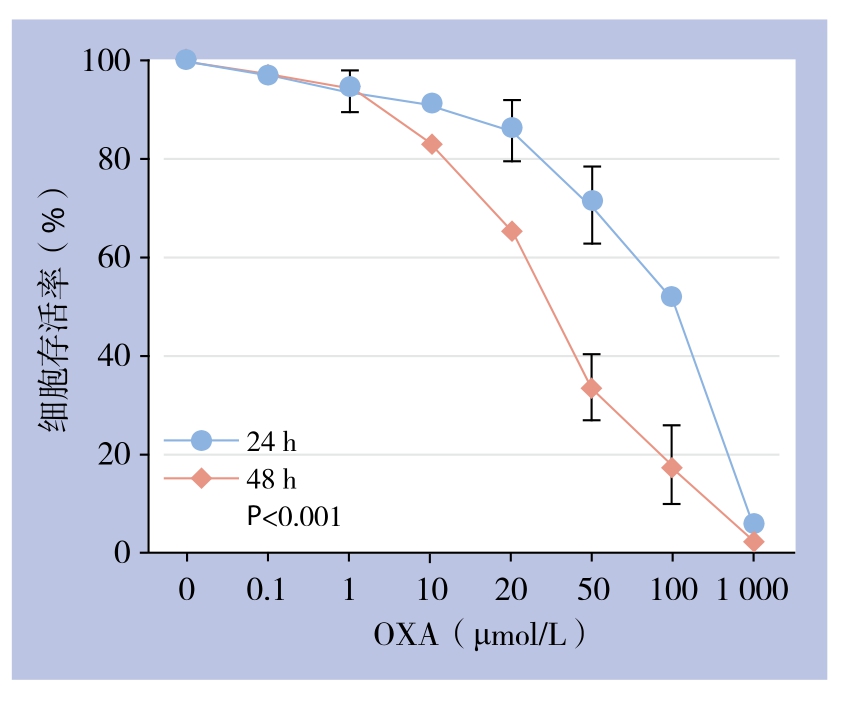
图1 不同浓度OXA作用24、48 h对HCT116/OXA细胞生长的影响
Figure 1 In fluences of diあerent concentrations of OXA on growth of HCT116/OXA cells after culture for 24 and 48 h
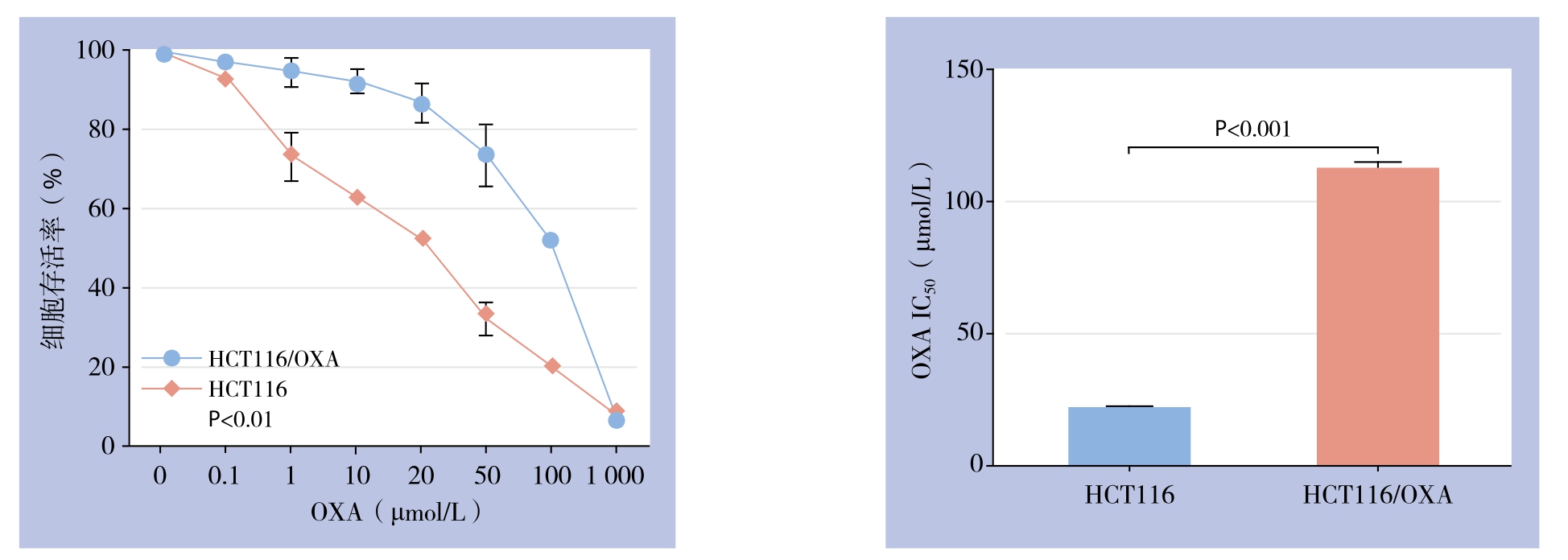
图2 不同浓度OXA作用24 h对HCT116/OXA与HCT116细胞生长的影响及IC50比较
Figure 2 In fluences of diあerent concentrations of OXA on growth of HCT116/OXA and HCT116 cells culture for 24 h and comparison of IC50 values
2.2 Nef对HCT116/OXA耐药性的逆转作用
Nef对HCT116/OXA的细胞毒性成一定浓度依赖关系。CCK8检测发现处理时间为24、48 h时,Nef对HCT116/OXA的作用差异不大(P>0.05),因此选择24 h作为Nef的处理时间(图3A)。梯度浓度Nef作用HCT116/OXA 24 h时,CCK8检测当Nef浓度为(4.95±0.68)μmol/L时HCT116/OXA细胞存活率为90%,因此将5 μmol/L设为Nef的最适逆转浓度。OXA单独作用于HCT116/OXA细胞时IC50为(112.00±2.31)μmol/L;当5 μmol/L的Nef与梯度浓度OXA作用HCT116/OXA细胞时IC50为(45.47±2.78)μmol/L,逆转倍数为2.46,差异有统计学意义(P<0.001)(图3B)。
2.3 Nef联用OXA前后对HCT116/OXA细胞凋亡率的影响
流式细胞术检测结果显示,Nef处理HCT116/OXA细胞24 h时,细胞凋亡率无明显变化(P>0.05);OXA(112 μmol/L)处理HCT116/OXA细胞24 h时,细胞凋亡率增加(P<0.05);但与OXA组比较,Nef(5 μmol/L)+OXA处理组细胞凋亡率增加更为明显(P<0.001)(图4)。
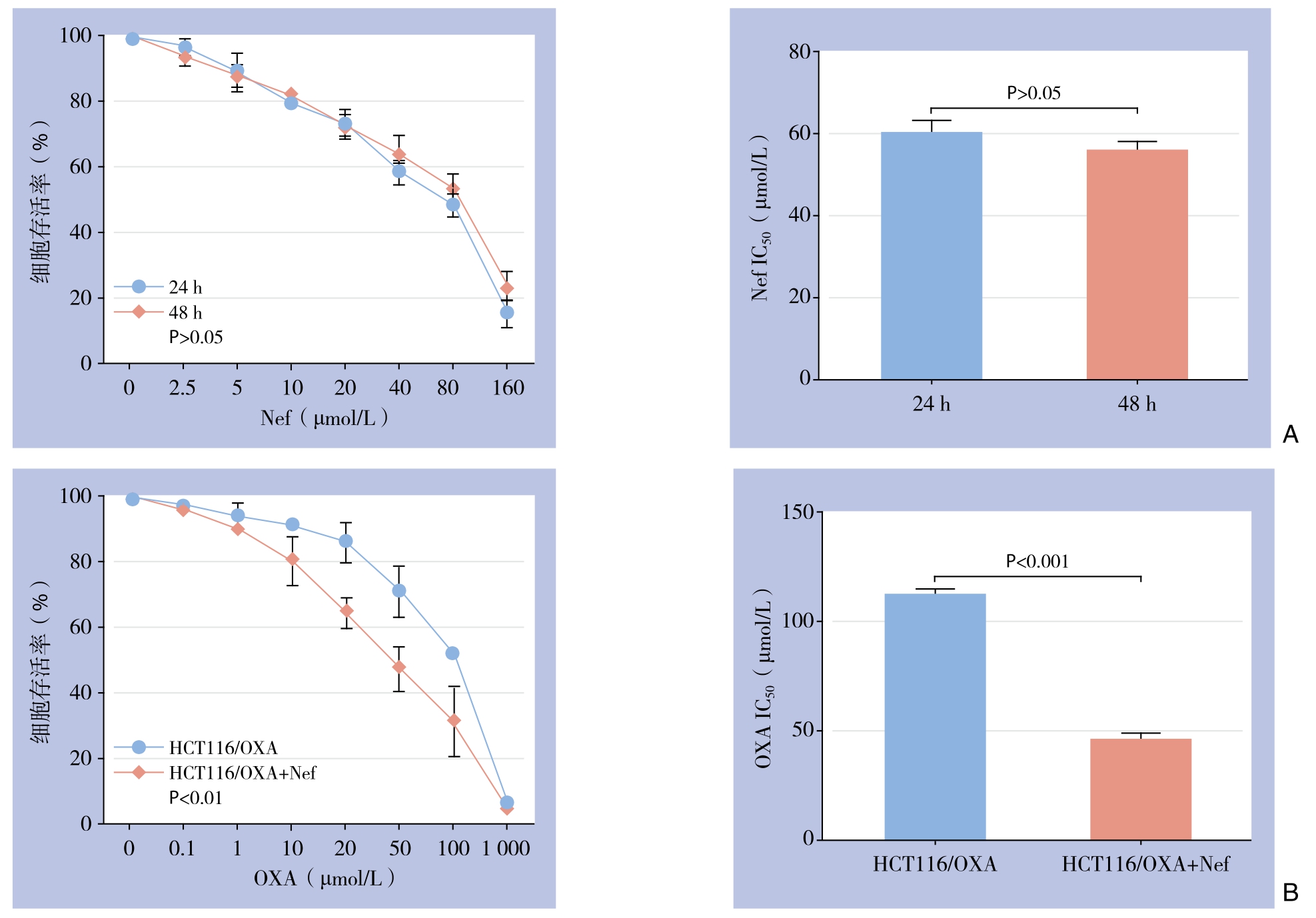
图3 Nef对HCT116/OXA细胞生长及耐药性的影响 A:不同浓度Nef作用HCT116/OXA细胞24、48 h细胞存活率;B:不同浓度的OXA与不同浓度的OXA联合Nef(5 μmol/L)作用24 h对HCT116/OXA细胞生长的影响及IC50比较
Figure 3 Influences of Nef on growth and durg-resistance of HCT116/OXA cells A:Survival rates of HCT116/OXA cells after exposure to different concentrations of Nef for 24 and 48 h; B:Influences of treatment of different concentrations of OXA or different concentrations of OXA plus Nef (5 μmol/L) for 24 h and comparison of IC50 values

图4 细胞凋亡检测
Figure 4 Apoptosis analysis
2.4 Nef与OXA联用前后对HCT116/OXA细胞PARP、p-PARP、Bcl-2、Bax蛋白表达的影响
Western blot方法检测凋亡相关蛋白的表达结果显示,OXA处理HCT116/OXA细胞24 h时,促凋亡蛋白Bax表达呈上升趋势,但与空白对照组比较差异无统计学意义(P>0.05);与OXA组相比较,Nef+OXA组凋亡蛋白Bax、p-PARP/PARP表达水平均增加,抗凋亡蛋白Bcl-2表达水平降低,差异均有统计学意义(均P<0.05);与Nef组比较,OXA组p-PARP/PARP表达增加(P<0.05),但Bax、Bcl-2蛋白的表达水平无统计学差异(均P>0.05)(图5)。
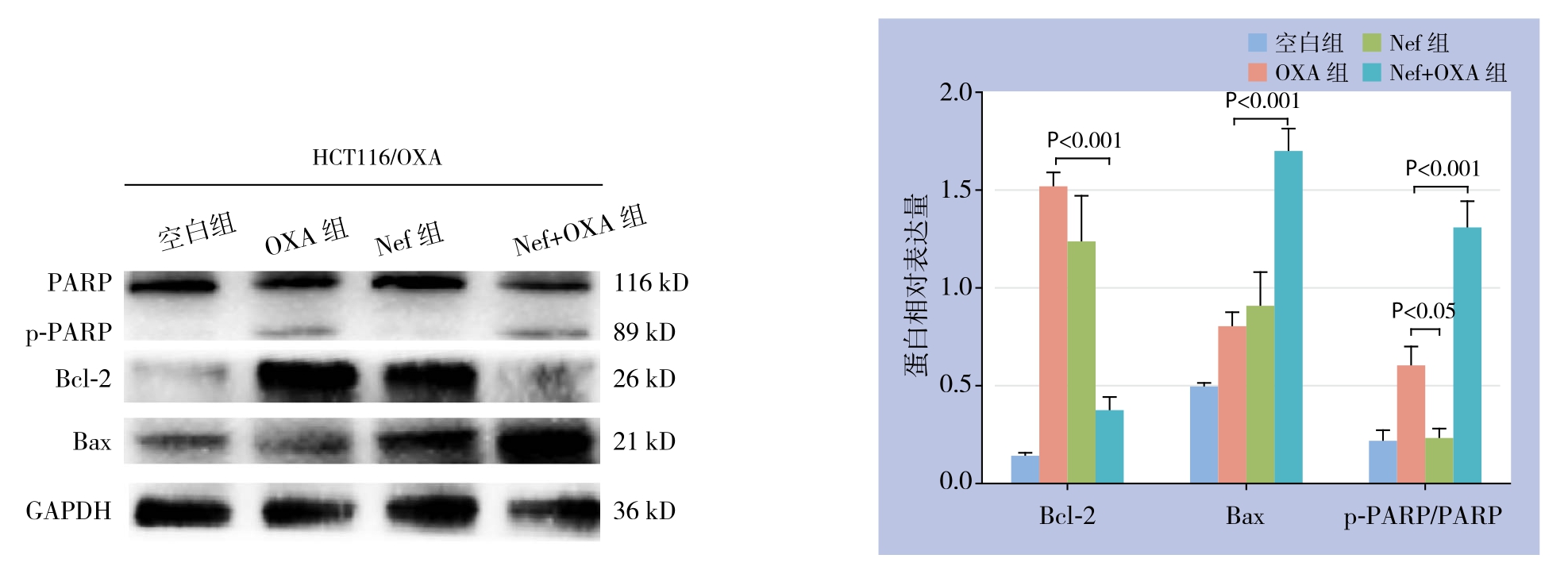
图5 凋亡相关蛋白表达检测
Figure 5 Determination of expressions of the apoptosis-related proteins
3 讨 论
Nef是的一种双苄基异喹啉生物碱,具有钙离子通道阻滞剂作用,近年来其在肿瘤的研究愈来愈多。Qin等[5]发现Nef可通过抑制ABC转运蛋白P-gp的表达从而增加人慢性髓性白血病细胞株K562/G01对伊马替尼的药物敏感性。Huang等[6]也证实Nef联合高热可抑制ABC转运蛋白P-gp和MDR1 mRNA的表达增加SGC7901/ADM的多药耐药性。此外,此类作用在乳腺癌耐药株MCF-7/ADR中也被验证[7]。Nef可通过激活P38 MAPK/JNK通路、抑制mTOR通路的激活而诱导自噬,从而抑制卵巢癌细胞的增殖[8]。在肺癌A549细胞株中,Poornima等[9]研究表明Nef可通过富集氧自由基、抑制PI3K/Akt/mTOR而诱导自噬,从而抑制肺癌细胞增殖。另外有学者艾小红等[10]证实在肝癌耐热细胞株中,Nef可通过下调Bcl-2的表达增加肝癌细胞对阿霉素的药物敏感性。但Nef与结肠癌细胞的相关性却未见报道。
结肠癌化疗耐药成为结肠癌患者预后不良的主要原因。目前大量研究致力于增加结肠癌的药物敏感性。结肠癌化疗耐药的主要机制有错配修复基因的缺失[11]、CpG岛甲基化[12]、KRAS、P53基因突变[13-14]、慢性缺氧[15]、上皮间质转化[16]、细胞亚群存在[17]等。其中细胞凋亡也是导致结肠癌耐药性的机制之一。Bcl-2、Bax是细胞凋亡家族中的重要成员,Bcl-2/Bax的比例下降则提示细胞凋亡增加[18]。Bcl-2与结肠癌耐药相关[3];细胞凋亡的减少可诱发基因突变、免疫紊乱,从而致使细胞对缺氧和乏养耐受增加,从而对抗癌药物和放疗射线产生抵抗[19];Yang等[20]发现在结肠癌中,结缔组织生长因子可通过FAK/MEK/ERK通路上调Bcl-2的表达从而减少细胞凋亡,从而增加对5-氟尿嘧啶的耐药性。然而,Manne等[21]研究107例南美和149例高加索结肠癌患者时发现Bcl-2的高表达提示远端结直肠腺癌预后较好。这可能提示人种、肿瘤部位的不同,Bcl-2的表达高低与结肠癌的预后不同,其机制有待进一步研究。
有研究[22]表明,miR-409-3p可通过下调Beclin-1介导的自噬作用增加结肠癌细胞对OXA的敏感性。另有研究指出结肠癌患者对OXA产生耐药性可能与lncRNA长基因间的非编码RNA 152(LincRNA00152)有关,LincRNA00152通过修饰Erb-b2受体酪氨酸激酶4来减少结肠癌细胞凋亡从而产生耐药性[23]。Wang等[24]研究表明转染Bcl-2促凋亡家族中BNIP3质粒的结肠癌细胞对OXA的敏感性增加。另有学者指出下调PI3K的催化亚基p110β可通过抑制OXA所致的细胞凋亡和细胞周期阻滞来增加结肠癌对OXA的敏感性[25]。本实验研究发现Nef可增加HCT116/OXA细胞对OXA的敏感性,同时发现Bax的表达水平增加,Bcl-2的表达水平明显降低,表明Bcl-2/Bax可能参与了HCT116/OXA细胞耐药,提示Nef可能通过下调Bcl-2/Bax表达水平逆转人结肠癌耐OXA细胞株HCT116/OXA的耐药性。但是Nef如何调节结肠癌细胞凋亡还需要更加深入探讨。在接下来的研究中,有必要构建另一株恶性程度不同的结肠癌耐OXA细胞株,比较并研究Nef对其他结肠癌细胞的耐药增敏作用,并通过体内动物实验进一步探讨其作用机制,为结肠癌化疗增敏提供新的思路和方法。
参考文献
[1]Siegel RL,Miller KD,Jemal A.Cancer Statistics,2017[J].CA Cancer J Clin,2017,67(1):7–30.doi:10.3322/caac.21387.
[2]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115–132.doi:10.3322/caac.21338.
[3]Liu S,Wang B,Li XZ,et al.Preparative separation and puri fication of liensinine,isoliensinine and neferine from seed embryo of Nelumbo nucifera GAERTN using high-speed counter-current chromatography[J].J Sep Sci,2009,32(14):2476–2481.doi:10.1002/jssc.200800766.
[4]Cao JG,Tang XQ,Shi SH.Multidrug resistance reversal in human gastric carcinoma cells by neferine[J].World J Gastroenterol,2004,10(20):3062–3064.
[5]Qin Q,Chen XP,Yang ZS,et al.Neferine increases STI571 chemosensitivity via inhibition of P-gp expression in STI571-resistant K562 cells[J].Leuk Lymphoma,2011,52(4):694–700.
[6]Huang C,Li Y,Cao P,et al.Synergistic effect of hyperthermia and neferine on reverse multidrug resistance in adriamycin-resistant SGC7901/ADM gastric cancer cells[J].J Huazhong Univ Sci Technolog Med Sci,2011,31(4):488–496.doi:10.1007/s11596–011–0478–0.
[7]黄程辉,曹培国,谢兆霞,等.不同方式加热联合甲基莲心碱对耐药乳腺癌MCF-7/Adr细胞γH2AX及mdr-1/P-gp表达的影响[J].中南大学学报:医学版,2011,36(4):317–322.doi:10.3969/j.issn.1672–7347.2011.04.007.Huang CH,Cao PG,Xie ZX,et al.Effect of different heating methods combined with neferine on the expressions of gammaH2AX and mdr-1/P-gp in MCF-7/Adr breast cancer cells[J].Journal of Central South University:Medical Science,2011,36(4):317–322.doi:10.3969/j.issn.1672–7347.2011.04.007.
[8]Xu L,Zhang X,Li Y,et al.Neferine induces autophagy of human ovarian cancer cells via p38 MAPK/ JNK activation[J].Tumour Biol,2016,37(7):8721–8729.doi:10.1007/s13277–015–4737–8.
[9]Poornima P,Weng C F,Padma V V.Neferine from Nelumbo nucifera induces autophagy through the inhibition of PI3K/Akt/mTOR pathway and ROS hyper generation in A549 cells[J].Food Chem,2013,141(4):3598–3605.doi:10.1016/j.foodchem.2013.05.138.
[10]艾小红,唐小卿,刘艳萍,等.甲基莲心碱逆转肝癌HepG2/thermotolerance细胞对阿霉素耐受性的作用[J].癌症,2007,26(4):357–360.Ai XH,Tang XQ,Liu YP,et al.Effect of neferine on adriamycinresistance of thermotolerant hepatocarcinoma cell line HepG2/thermotolerance[J].Chinese Journal of Cancer,2007,26(4):357–360.
[11]Ma J,Zhang Y,Shen H,et al.Association between mismatch repair gene and irinotecan-based chemotherapy in metastatic colon cancer[J].Tumour Biol,2015,36(12):9599–9609.doi:10.1007/s13277–015–3723–5.
[12]Shiovitz S,Bertagnolli MM,Renfro LA,et al.CpG island methylator phenotype is associated with response to adjuvant irinotecan-based therapy for stage III colon cancer[J].Gastroenterology,2014,147(3):637–645.doi:10.1053/j.gastro.2014.05.009.
[13]Linardou H,Dahabreh IJ,Kanaloupiti D,et al.Assessment of somatic k-RAS mutations as a mechanism associated with resistance to EGFR-targeted agents:a systematic review and metaanalysis of studies in advanced non-small-cell lung cancer and metastatic colorectal cancer[J].Lancet Oncol,2008,9(10):962–972.doi:10.1016/S1470–2045(08)70206–7.
[14]Li XL,Zhou J,Chen ZR,et al.P53 mutations in colorectal cancer -molecular pathogenesis and pharmacological reactivation[J].World J Gastroenterol,2015,21(1):84–93.doi:10.3748/wjg.v21.i1.84.
[15]Wang L,Xue M,Chung DC.c-Myc is regulated by HIF-2alpha in chronic hypoxia and influences sensitivity to 5-FU in colon cancer[J].Oncotarget,2016,7(48):78910–78917.doi:10.18632/oncotarget.12911.
[16]Kubiliūtė R,Šulskytė I,Daniūnaitė K,et al.Molecular features of doxorubicin-resistance development in colorectal cancer CX-1 cell line[J].Medicina (Kaunas),2016,52(5):298–306.doi:10.1016/j.medici.2016.09.003.
[17]Xiong B,Ma L,Hu X,et al.Characterization of side population cells isolated from the colon cancer cell line SW480[J].Int J Oncol,2014,45(3):1175–1183.doi:10.3892/ijo.2014.2498.
[18]Czabotar PE,Lessene G,Strasser A,et al.Control of apoptosis by the BCL-2 protein family:implications for physiology and therapy[J].Nat Rev Mol Cell Biol,2014,15(1):49–63.doi:10.1038/nrm3722.
[19]Reed JC.Dysregulation of apoptosis in cancer[J].J Clin Oncol,1999,17(9):2941–2953.
[20]Yang K,Gao K,Hu G,et al.CTGF enhances resistance to 5-FU-mediating cell apoptosis through FAK/MEK/ERK signal pathway in colorectal cancer[J].Onco Targets Ther,2016,9:7285–7295.
[21]Manne U,Weiss HL,Grizzle WE.Bcl-2 expression is associated with improved prognosis in patients with distal colorectal adenocarcinomas[J].Int J Cancer,2000,89(5):423–430.
[22]Tan S,Shi H,Ba M,et al.miR-409–3p sensitizes colon cancer cells to oxaliplatin by inhibiting Beclin-1-mediated autophagy[J].Int JMol Med,2016,37(4):1030–1038.doi:10.3892/ijmm.2016.2492.
[23]Yue B,Cai D,Liu C,et al.Linc00152 Functions as a Competing Endogenous RNA to Confer Oxaliplatin Resistance and Holds Prognostic Values in Colon Cancer[J].Mol Ther,2016,24(12):2064–2077.doi:10.1038/mt.2016.180.
[24]Wang Z,Huang C,Zeng J,et al.Effects of the proapoptotic regulator Bcl-2/adenovirus EIB 19-kDa-interacting protein 3 on the chemosensitivity of human colon cancer cell lines[J].Oncol Lett,2012,4(6):1195–1202.
[25]Liu W,Wang G,Cao X,et al.Down-regulation of p110beta expression increases chemosensitivity of colon cancer cell lines to oxaliplatin[J].J Huazhong Univ Sci Technolog Med Sci,2012,32(2):280–286.doi:10.1007/s11596–012–0049–z.