现我国结直肠癌发病率以每年3.9%速度递增,而世界平均水平则只是在2%增速。在我国直肠癌发病率有以下特点:发病率比结肠癌高、趋于年轻化、中晚期直肠癌居多(75%以上)及中低位直肠癌达70%~80%。手术切除仍是治疗直肠癌的主要手段,随着各种微创技术的进步,直肠癌的微创手术也不断发展。手术技巧的演化和先进仪器的使用带来了更好的优势,如更好的美容效果、术后的快速康复、术后的疼痛减轻及住院时间的减少等。就短期效果而言,近期的随机临床研究进一步证实了腹腔镜-全直肠系膜切除(total mesorectal excision,TME)比开腹-TME更有优势[1],并且大规模的临床研究证实了相似的结果在比较腹腔镜与开腹结直肠癌切除术关于肿瘤学的安全性和长期随访结果[2]。然而,腹腔镜外科手术用于直肠癌的缺陷被提出[3-4]。腹腔镜用于这类有深而狭窄盆腔的直肠癌患者时,其器械的有限活动范围和欠灵活性等因素造成在腹腔镜下行TME手术存在一定难度[4]。此外,传统腹腔镜还需要1名训练有素且手势稳定的扶镜助手。
然而,机器人手术系统改善腹腔镜的缺陷发展为一种用于直肠癌手术的治疗方式,其优势:稳定的高清立体视觉、精准的直觉式动作控制、滤除的手部震颤、缩短的手术曲线以及可远程操控[5]。并且主刀医师无需长期站立,坐于操纵台前,同步控制床旁机械臂的动作,显著降低其生理疲劳[6]。机器人直肠癌手术由于技术要求高,手术难度大,其安全性和临床疗效仍是目前研究的焦点。
1 资料与方法
1.1 临床资料
收集2016年1月—2017年2月初在重庆医科大学附属第一医院施行直肠癌手术的患者资料。入选标准:⑴ 术前肠镜活检诊断直肠癌明确,肿瘤距肛缘至少5 cm且15 cm以内,术前予以CT、MRI或直肠腔内超声检查进行术前TNM分期;⑵ 无严重心、肝、脑、肺及肾等疾病,无腹腔镜手术禁忌症。排除标准:肿瘤多发远处转移的、开腹直肠癌手术、经腹会阴联合切除手术、机器人联合传统腹腔镜的混合手术、术前行新辅助治疗、复发再次手术及需联合器官切除的直肠癌患者。共纳入124例患者,其中26例机器人手术(机器人组)和98例行腹腔镜手术(腹腔镜组)。
两种手术方式(达芬奇机器人手术和腹腔镜手术)的选择均根据患者的意愿,并签署手术知情同意书。
1.2 手术方法
1.2.1 达芬奇机器人全腹腔镜-单吻合直肠癌手术 麻醉成功后,取截石位。于脐右上方置入12 mm Trocar为镜头孔,左侧锁骨中线,略高于于镜头孔水平置入8 mm Trocar,为2号臂孔。左侧腋前线,髂前上脊上方约 4 cm 置入 8 mm Trocar,为3号臂孔。右侧麦氏点置入8 mm Trocar,为1号臂孔,1号臂与镜头臂连线中垂线5 cm处置入12 mm Trocar,为助手孔。引导机器人手臂车从患者左下方呈45°角靠近患者,连接机械臂和Trocar,调整机械臂至最佳分布位置,调整Trocar的remote center使其位于腹壁。在腔镜直视下1号孔置入超声刀,2号孔置入无损抓钳持针器,3号孔置入持针器。若为女性,将子宫悬吊于腹壁上。3号臂无损伤抓钳提起乙状结肠并牵向左侧,显露其系膜右侧根部,用超声刀在系膜根部切开腹膜,进入Toldt's间隙,沿间隙向上分离至肠系膜下血管根部,清扫血管周围淋巴脂肪组织并裸化血管,于根部上Hemolock夹后切断血管。向左打开乙状结肠系膜显露肠系膜下静脉,上Hemolock夹并切断。将乙状结肠拉向右侧切开乙状结肠系膜根部左侧腹膜,使左右贯穿。沿Toldt's间隙向上游离降结肠,向下沿骶前间隙游离直肠至腹膜反折。根据术前肿瘤评估于肿瘤下方合适地方切开脂肪套,裸化直肠。用直线切割闭合器切断直肠,切开直肠断端(用于中上段直肠癌),或用丝带结扎直肠,再超声刀切断直肠(下段直肠癌);经肛门置入末端连有12号尿管的蘑菇头,于肿瘤近端合适位置裸化肠管并用哈巴狗钳,远端系束带阻断后切断肠管。断端缝荷包后置入蘑菇头。从肛门置入电线套,到腹腔,将标本塞入电线套,从肛门取出。荷包缝合直肠断端(图1),从肛门置入腔内管型吻合器,旋出中心杆,收紧荷包线后与蘑菇头对接,完成吻合。肛门充气实验显示吻合良好。
1.2.2 传统腹腔镜直肠癌手术 按照《腹腔镜结直肠癌根治手术操作指南(2008)版》[7]要求完成手术。
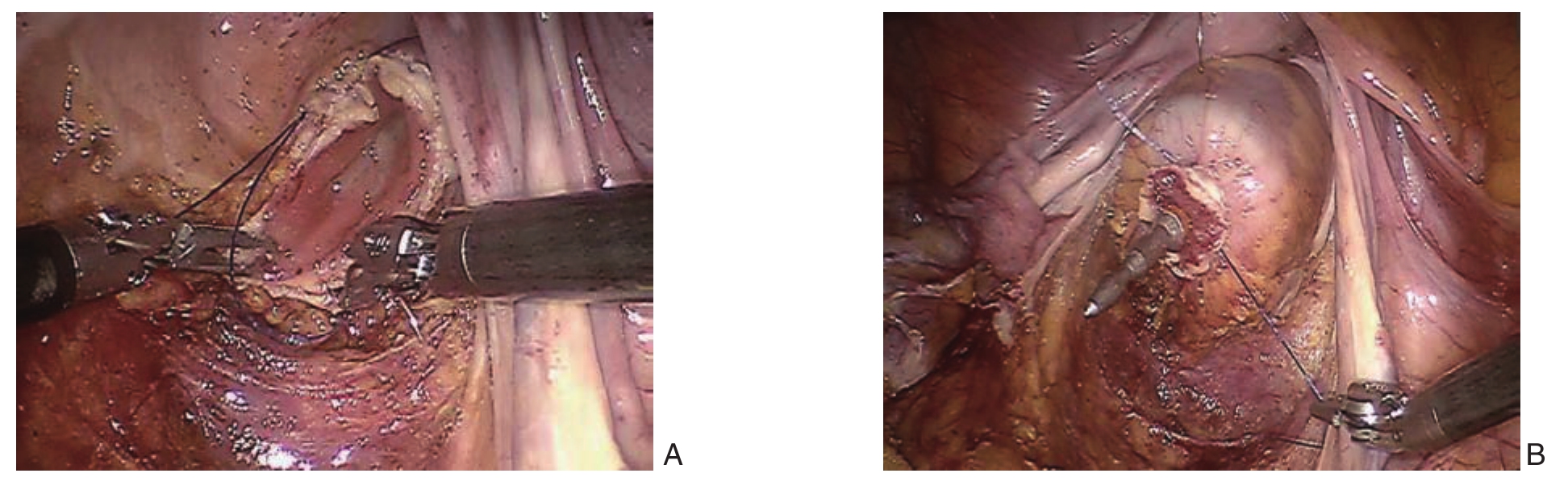
图1 术中照片 A:机器人-全腔镜下直肠断端荷包缝合;B:机器人-全腔镜下单吻合
Figure 1 Intraoperative views A: Robotic total-endoscopic purse–string suture of the rectal stump; B: Robotic total-endoscopic single anastomosis
1.3 统计学处理
采用SPSS 20.0软件进行统计学分析,计数资料比较采用χ2检验或Fisher精准检验,计量资料参数用均数±标准差(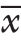 ±s)表示,计量资料比较采用t检验,P<0.05为有统计学意义。
±s)表示,计量资料比较采用t检验,P<0.05为有统计学意义。
2 结 果
2.1 两组患者基本临床资料比较
机器人组中男女比例16:10,腹腔镜组中男女比例57:41(P=0.756);机器人组患者平均年龄为(64±6.5)(50~73)岁,腹腔镜组为(62.1±10.2)(35~83)岁(P=0.251);机器人组平均BMI为(21.5±2.2)kg/m2,腹腔镜组平均BMI为(62.1±10.2 kg/m2)(P=0.193);机器人组中2例患者(1.6%)和腹腔镜组中19例(15.3%)有手术史(如阑尾切除、胆囊切除及胃穿孔修补等)(P=0.425);ASA、肿瘤下缘距肛缘距离、TNM分期、CEA及CA19-9而言,在两组之间无统计学差异(均P>0.05)(表1)。
2.2 临床病理结果
平均手术时间在机器人组明显长于腹腔镜组,差异有统计学意义(P=0.001);机器人组术中平均出血量较腹腔镜组明显较少(P=0.007);两组中均无中转开腹。两组远切缘(DRM)距离(指肿瘤下缘到下切缘的距离)(P=0.180)、淋巴结清扫枚数(P=0.2 7 5)及标本长度(P=0.194)的差异均无统计学意义;腹腔组中有6例患者的环周切缘(CRM,指肿瘤浸润最深处与直肠周围软组织切除边缘之间的部分,在距离切缘1 mm内存在肿瘤被定义为切缘阳性)为阳性,而机器人组中无1例,差异无统计学意义(P=0.583),两组远DRM阳性率也无统计学差异(P>0.999)。
术后膀胱及胃肠功能的恢复快慢可由术后排气及拔除尿管的时间来反应。腹腔镜组患者排气时间为(4.4±1.2)d、拔尿管时间为(6.8±2.0)d,机器人组排气时间为(3.3±1.4)d、拔管时间(5.0±1.6)d,差异有统计学意义(均P<0.05);进流食时间、下床时间及术后住院时间,机器人组均明显短于腹腔镜组(均P<0.05);在机器人组中有1例直肠阴道瘘、3例尿潴留、3例肠梗阻及1例吻合口瘘,腹腔镜组中2例尿潴留、1例肺部感染、2例切口感染、1例肠梗阻、1例血栓及5例吻合口瘘,机器人组患者的术后并发症发生率明显少于腹腔镜组(P=0.037)。就平均住院总费用而言,机器人组较腹腔镜组多0.3~1.7万元,差异有统计学意义(P=0.007)(表2)。
表1 机器人组与腹腔镜组患者临床资料比较
Table 1 Comparison of the general data between robotic group and laparoscopic group
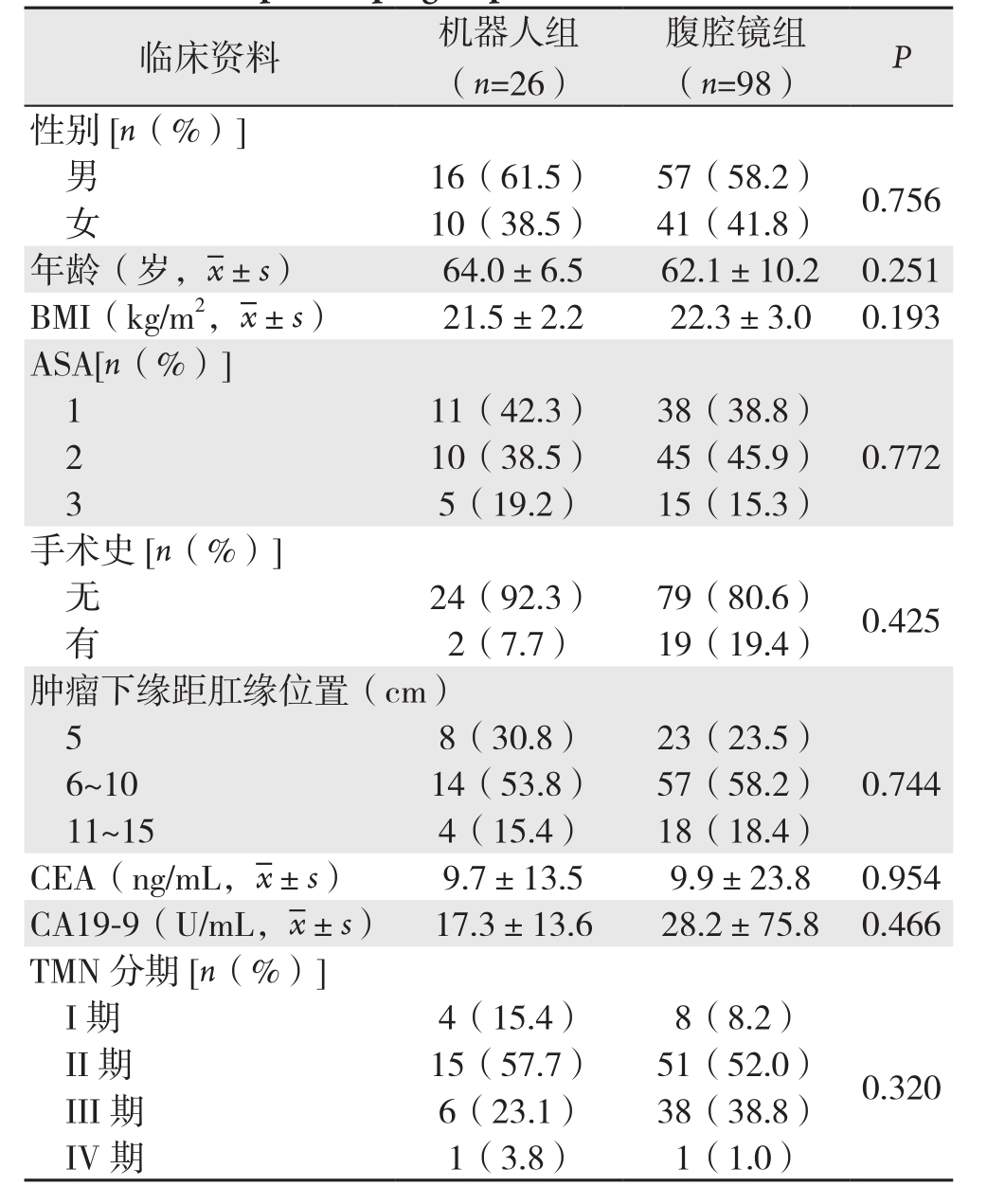
临床资料 机器人组(n=2 6)腹腔镜组(n=9 8) P性别[n(%)]男1 6(6 1.5) 5 7(5 8.2) 0.7 5 6女1 0(3 8.5) 4 1(4 1.8)年龄(岁,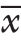 ±s) 6 4.0±6.5 6 2.1±1 0.2 0.2 5 1 B M I(k g/m 2,
±s) 6 4.0±6.5 6 2.1±1 0.2 0.2 5 1 B M I(k g/m 2,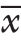 ±s) 2 1.5±2.2 2 2.3±3.0 0.1 9 3 A S A[n(%)]1 1 1(4 2.3) 3 8(3 8.8)0.7 7 2 1 0(3 8.5) 4 5(4 5.9)3 5(1 9.2) 1 5(1 5.3)手术史[n(%)]无2 2 4(9 2.3) 7 9(8 0.6) 0.4 2 5有2(7.7) 1 9(1 9.4)肿瘤下缘距肛缘位置(c m)5 8(3 0.8) 2 3(2 3.5)0.7 4 4 6~1 0 1 4(5 3.8) 5 7(5 8.2)1 1~1 5 4(1 5.4) 1 8(1 8.4)C E A(n g/m L,
±s) 2 1.5±2.2 2 2.3±3.0 0.1 9 3 A S A[n(%)]1 1 1(4 2.3) 3 8(3 8.8)0.7 7 2 1 0(3 8.5) 4 5(4 5.9)3 5(1 9.2) 1 5(1 5.3)手术史[n(%)]无2 2 4(9 2.3) 7 9(8 0.6) 0.4 2 5有2(7.7) 1 9(1 9.4)肿瘤下缘距肛缘位置(c m)5 8(3 0.8) 2 3(2 3.5)0.7 4 4 6~1 0 1 4(5 3.8) 5 7(5 8.2)1 1~1 5 4(1 5.4) 1 8(1 8.4)C E A(n g/m L,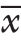 ±s) 9.7±1 3.5 9.9±2 3.8 0.9 5 4 C A 1 9-9(U/m L,
±s) 9.7±1 3.5 9.9±2 3.8 0.9 5 4 C A 1 9-9(U/m L,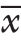 ±s) 1 7.3±1 3.6 2 8.2±7 5.8 0.4 6 6 T M N分期[n(%)]I期 4(1 5.4) 8(8.2)0.3 2 0 I I期 1 5(5 7.7) 5 1(5 2.0)I I I期 6(2 3.1) 3 8(3 8.8)I V 期 1(3.8) 1(1.0)
±s) 1 7.3±1 3.6 2 8.2±7 5.8 0.4 6 6 T M N分期[n(%)]I期 4(1 5.4) 8(8.2)0.3 2 0 I I期 1 5(5 7.7) 5 1(5 2.0)I I I期 6(2 3.1) 3 8(3 8.8)I V 期 1(3.8) 1(1.0)
表2 机器人组与腹腔镜组手术情况、术后短期结果及费用比较
Table 2 Comparison of the surgical variables and short-term results between robotic group and laparoscopic group
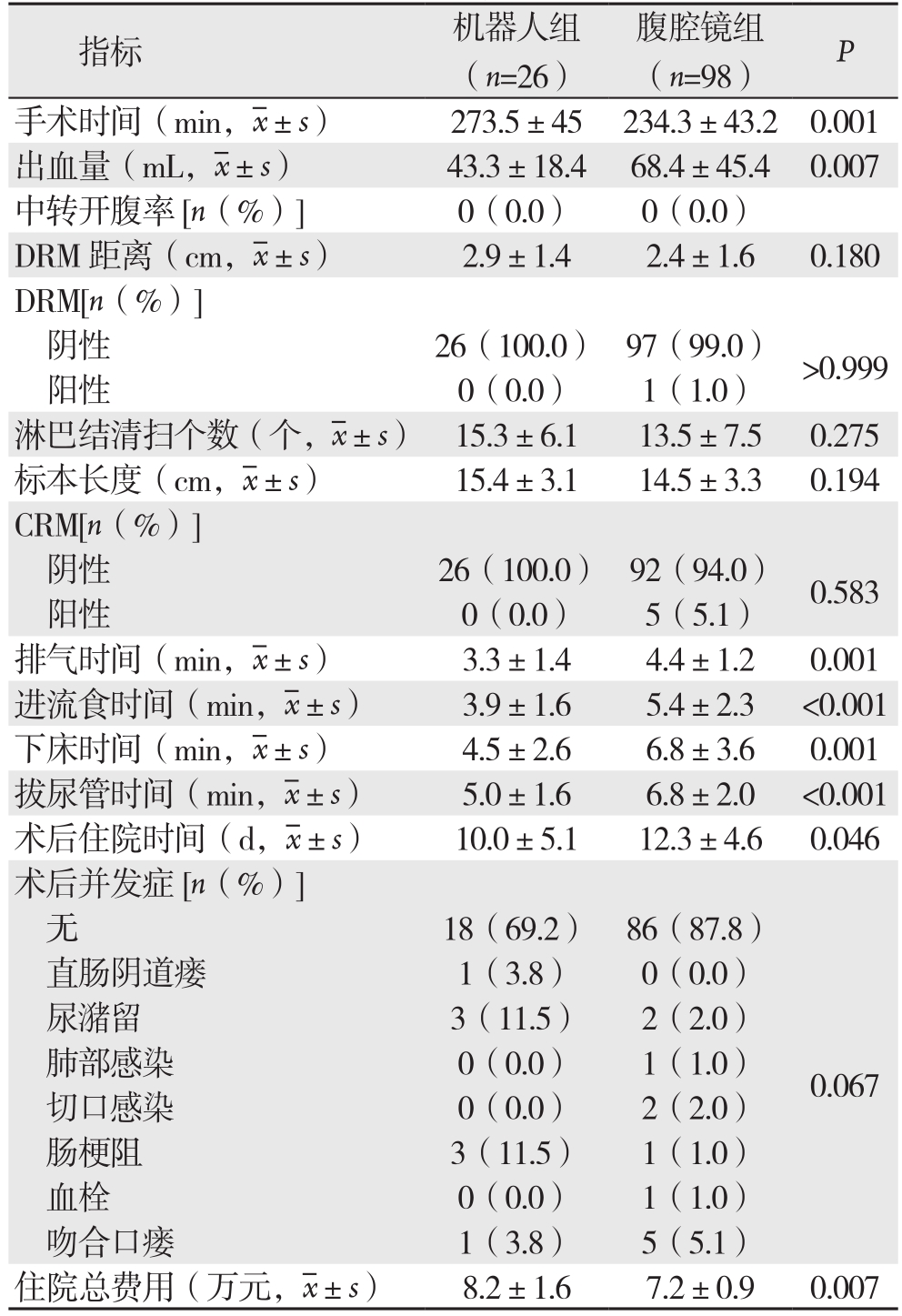
指标 机器人组(n=26)腹腔镜组(n=98) P手术时间(min,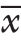 ±s) 273.5±45 234.3±43.2 0.001出血量(mL,
±s) 273.5±45 234.3±43.2 0.001出血量(mL,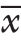 ±s) 43.3±18.4 68.4±45.4 0.007中转开腹率[n(%)] 0(0.0) 0(0.0)DRM 距离(cm,
±s) 43.3±18.4 68.4±45.4 0.007中转开腹率[n(%)] 0(0.0) 0(0.0)DRM 距离(cm,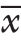 ±s) 2.9±1.4 2.4±1.6 0.180 DRM[n(%)]阴性 26(100.0) 97(99.0) >0.999阳性 0(0.0) 1(1.0)淋巴结清扫个数(个,
±s) 2.9±1.4 2.4±1.6 0.180 DRM[n(%)]阴性 26(100.0) 97(99.0) >0.999阳性 0(0.0) 1(1.0)淋巴结清扫个数(个,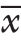 ±s) 15.3±6.1 13.5±7.5 0.275标本长度(cm,
±s) 15.3±6.1 13.5±7.5 0.275标本长度(cm,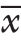 ±s) 15.4±3.1 14.5±3.3 0.194 CRM[n(%)]阴性 26(100.0) 92(94.0) 0.583阳性 0(0.0) 5(5.1)排气时间(min,
±s) 15.4±3.1 14.5±3.3 0.194 CRM[n(%)]阴性 26(100.0) 92(94.0) 0.583阳性 0(0.0) 5(5.1)排气时间(min,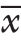 ±s) 3.3±1.4 4.4±1.2 0.001进流食时间(min,
±s) 3.3±1.4 4.4±1.2 0.001进流食时间(min,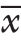 ±s) 3.9±1.6 5.4±2.3 <0.001下床时间(min,
±s) 3.9±1.6 5.4±2.3 <0.001下床时间(min,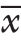 ±s) 4.5±2.6 6.8±3.6 0.001拔尿管时间(min,
±s) 4.5±2.6 6.8±3.6 0.001拔尿管时间(min,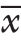 ±s) 5.0±1.6 6.8±2.0 <0.001术后住院时间(d,
±s) 5.0±1.6 6.8±2.0 <0.001术后住院时间(d,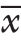 ±s) 10.0±5.1 12.3±4.6 0.046术后并发症[n(%)]无18(69.2) 86(87.8)直肠阴道瘘 1(3.8) 0(0.0)尿潴留 3(11.5) 2(2.0)肺部感染 0(0.0) 1(1.0)切口感染 0(0.0) 2(2.0)肠梗阻 3(11.5) 1(1.0)血栓 0(0.0) 1(1.0)吻合口瘘 1(3.8) 5(5.1)0.067住院总费用(万元,
±s) 10.0±5.1 12.3±4.6 0.046术后并发症[n(%)]无18(69.2) 86(87.8)直肠阴道瘘 1(3.8) 0(0.0)尿潴留 3(11.5) 2(2.0)肺部感染 0(0.0) 1(1.0)切口感染 0(0.0) 2(2.0)肠梗阻 3(11.5) 1(1.0)血栓 0(0.0) 1(1.0)吻合口瘘 1(3.8) 5(5.1)0.067住院总费用(万元,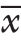 ±s) 8.2±1.6 7.2±0.9 0.007
±s) 8.2±1.6 7.2±0.9 0.007
3 讨 论
腹腔镜手术早已广泛应用于外科临床,且用于直肠癌的治疗比开腹手术更具优势[1-2,8]。由于传统二维成像技术缺乏立体视觉信息,术者只能凭借“运动视差”、“透视投影”等技巧和经验来判断各脏器解剖结构及器械操作,可能因空间位置判断不准确而造成操作迟缓甚至失误[9-10]。随着科技发展,3D高清腹腔镜也随之问世,现已投入临床使用,并且存在大量的临床对比研究。曾庆敏等[11]通过回顾性对比分析发现:3D腹腔镜较传统2D腹腔镜运用于直肠癌根治术中可以显著的节省手术时间。这与多数研究[12-13]一致。这是因为三维成像技术可以为临床医生提供高清立体空间结构图像,能够像开腹手术一样具有良好的空间触觉感知[14-15]。立体图像效果逼真、清晰,为判断体内相邻脏器和层次结构关系提供有力条件,同时也为手术流畅性提供保证[16]。但是,3D腹腔镜的双镜头不能够像传统腹腔那样通过旋转来改变视野角度,显示器屏幕较小,眼睛需要专注于屏幕,稍有偏离就会影响三维效果,长时间操作会带来视觉疲劳[12, 14]。另外3D腹腔镜还存在其他不足,比如:主刀的生理疲劳、扶镜手的生理震颤、器械活动度差等。然而,达芬奇机器人直手术弥补了这些缺陷。其首次于2006年报道完成直肠癌根治术后,经过几年的讯猛发展,它已逐渐成为治疗直肠癌的新手段,其安全性及可行性逐步得到些证实[15, 17]。术后恢复情况及根治效果仍是结直肠外科医师关注的焦点,本研究比较机器人全腹腔镜-单吻合与传统腹腔镜直肠癌切除术的近期疗效。
本研究中机器人直肠癌手术是在全腔镜下完成,避免了术中挪动及拆除机器人设备和更换为传统腹腔镜的时间,缩短手术时间。而本研究结果还是机器人组平均手术时间长于腹腔镜组(约40 min),与文献[18-19]报道一致。考虑这与早期使用机器人熟悉程度、机器的安置调整、机械臂的位置、术中更换器械及医护配合默契等有关。另外,有机器人手术的Meta分析研究显示,机器人组手术时间与腹腔镜组无统计学差异(P=0.08)[20]。并且有学者[21-22]研究发现机器人组手术时间的学习曲线处于下降趋势,而腹腔镜组处于波动趋势(无下降趋势)。相信以后机器人手术操作的不断成熟及系统安装时间的不断优化,手术时间会逐渐缩短,甚至会少于腹腔镜组手术时间。另外,本研究结果发现,机器人组术中出血量、排气时间、进食流质时间、下床时间、拔尿管时间及术后住院时间要比腹腔镜组较短 ,与文献 [18-19, 21, 23]报 道相似;这与达芬奇手术系统的高清3D图像(放大10~15倍)、可以540°旋转活动度(类似手腕)有关,让解剖层面更加清晰(特别是在男性狭窄的盆腔时),重要结构更易识别,解剖血管、神经及裸化肠管时更加精细[24],在很大程度上减少了对分支血管和盆腔神经的误伤,减少术中出血量和胃肠及膀胱功能恢复时间,从而让患者可提早下床,缩短住院时间。虽然两者之间无术后性功能障碍的比较,但利用达芬奇机器人的优势可极大的减小对盆腔神经的损伤,相信会降低男性直肠癌患者(特别是中青年)术后性功能障碍的发生,提高其生活质量。有文献[25]通过机器人直肠癌手术后1、6、9个月的术前主观评分比较性功能情况,虽然术后1、6个月的评分低于术前(P<0.05),但术后1年后的评分基本和术前相似。
远切缘距离是衡量TME的指标,它和切除淋巴结个数也是评价直肠癌手术是否达到根治性的主要指标。此外,CRM可作为直肠癌术后生存预后指标和外科手术质量评价的指标,也是为直肠癌术后复发的危险分层提供信息。本研究结果发现,机器人组的远切缘距离、切除淋巴结个数及环周切缘阳性率与腹腔镜组无统计学差异,与文献[21]报道相一致。虽然也有文献[19]报道机器人组远切缘距离更短、切除淋巴个数更少[20]及CRM存在阳性更多[19]与腹腔镜组相比较,但其在统计学上无差异。这也就表明机器人直肠癌手术与腹腔镜手术具有相同根治性效果,可达到腹腔镜的安全性和可行性。更何况,本研究中利用达芬奇机器人的高清立体视野、滤除人的自然颤抖及仿真手腕,以机器人全腔镜-单吻合的手术方式,对于中上段直肠癌,切除断端直肠上用直线闭合器闭合的几毫米肠管再行荷包缝合,可增加远切缘距离,降低远切缘阳性率,进而降低直肠癌患者术后局部复发率,提高生存率。
就术后并发症方面而言,本研究结果显示机器人组与腹腔镜组无统计学差异,考虑是否与样本量较少有关系。另外有文献[18, 20]报道机器人组术后并发症发生率比腹腔镜组少。因此,笔者认为机器人运用其独特优势解剖各层结构,更精准、精细,减少不必要的创伤,更减轻术后疼痛,促进早期下床活动,可以减低血栓形成、切口感染及肺部感染等。
两组在住院总费用方面比较同大多文献相一致,机器组费用比腹腔镜组贵。Beak等[26]在分析机器人与腹腔镜直肠癌手术的成本经济效益中显示,机器组住院费用昂贵的原因是机器人手术费用较腹腔镜多。相信随着手术技巧的不断成熟,手术及麻醉时间逐渐缩短,康复进一步加快,除了手术费之外其他费用也会减少;而且随着机器人系统的不断优化,手术费用会大幅度下降,住院费用也就会减少。但是,对于目前的阶段水平,将机器人手术用于低位(合并狭窄盆腔)直肠癌患者时,其成本经济效益应放在肿瘤的根治性与术后功能的完整性之后考虑。
综上所述,达芬奇机器人手术系统与腹腔镜比较,是有安全性及可行性的。机器人手术在出血少、术后恢复早、自主神经的保护等方面较腹腔镜具有明显优势,在许多医疗中心开始逐步成为治疗直肠癌的手术方式。并且我国关于机器人手术用于结直肠癌已形成共识-《机器人结直肠癌手术专家共识(2015版)》[27]。但是,本研究对直肠癌术后远期疗效及生活治疗的情况有待进一步增加样本量并随访观察。
参考文献
[1] van der Pas MH, Haglind E, Cuesta MA, et al. Laparoscopic versus open surgery for rectal cancer (COLOR II): short-term outcomes of a randomised, phase 3 trial[J]. Lancet Oncol, 2013, 14(3):210–218.doi: 10.1016/S1470–2045(13)70016–0.
[2] Green BL, Marshall HC, Collinson F, et al. Long-term follow-up of the Medical Research Council CLASICC trial of conventional versus laparoscopically assisted resection in colorectal cancer[J]. Br J Surg, 2013, 100(1):75–82. doi: 10.1002/bjs.8945.
[3] Sammour T, Kahokehr A, Srinivasa S, et al. Laparoscopic colorectal surgery is associated with a higher intraoperative complication rate than open surgery[J]. Ann Surg, 2011, 253(1):35–43.
[4] Bianchi PP, Petz W, Luca F, et al. Laparoscopic and robotic total mesorectal excision in the treatment of rectal cancer. Brief review and personal remarks[J]. Front Oncol, 2014, 4:98. doi: 10.3389/fonc.2014.00098.
[5] 张旋, 沈焘. 达芬奇手术机器人:结直肠外科的新挑战[J]. 中国普通外科杂志, 2016, 25(10):1494–1499. doi:10.3978/j.issn.1005–6947.2016.10.021.Zhang X, Shen X. Da Vinci surgical robots: new challenges in colorectal surgery[J]. Chinese Journal of General Surgery, 2016,25(10):1494–1499. doi:10.3978/j.issn.1005–6947.2016.10.021.
[6] Heemskerk J, Zandbergen HR, Keet SW, et al. Relax, it's just laparoscopy! A prospective randomized trial on heart rate variability of the surgeon in robot-assisted versus conventional laparoscopic cholecystectomy[J]. Dig Surg, 2014, 31(3):225–232. doi:10.1159/000365580.
[7] 中华医学会外科学分会腹腔镜与内镜外科学组, 中国抗癌协会大肠癌专业委员会腹腔镜外科学组. 腹腔镜结直肠癌根治手术操作指南(2008版)[J]. 中华胃肠外科杂志, 2009, 12(3):310–312.doi:10.3760/cma.j.issn.1671–0274.2009.03.030.Laparoscopic and Endoscopic Group of Surgery Branch of Chinese Medical Association, Laparoscopic Surgery Group of Colorectal Cancer Specialized Committee of Chinese Anti-Cancer Association.Operation guidelines for laparoscopic radical rectal cancer surgery(2008 edition)[J]. Chinese Journal of Gastrointestinal Surgery, 2009,12(3):310–312. doi:10.3760/cma.j.issn.1671–0274.2009.03.030.
[8] 何志国, 熊焰, 余铖, 等. 腹腔镜及开腹结直肠癌根治术的临床对比[J]. 中国普通外科杂志, 2012, 21(9):1175–1177.He ZG, Xiong Y, Yu C, et al. Clinical comparison of laparoscopic versus open radical resection for colorectal cancer[J]. Chinese Journal of General Surgery, 2012, 21(9):1175–1177.
[9] Cologne KG, Zehetner J, Liwanag L, et al. Three-dimensional Laparoscopy: Does Improved Visualization Decrease the Learning Curve Among Trainees in Advanced Procedures?[J]. Surg Laparosc Endosc Percutan Tech, 2015, 25(4):321–323. doi: 10.1097/SLE.0000000000000168.
[10] Czuba TB, Huk AC, Cormack LK, et al. Area MT encodes threedimensional motion[J]. J Neurosci, 2014, 34(47):15522–15533.doi: 10.1523/JNEUROSCI.1081–14.2014.
[11] 曾庆敏, 王延召, 黄文生, 等. 3D与2D腹腔镜直肠癌根治术近期疗效的观察[J]. 中国普通外科杂志, 2016, 25(4):622–626.doi:10.3978/j.issn.1005–6947.2016.04.027.Zeng QM, Wang YZ, Huang WS, et al. A retrospective study of the short-term therapeutic effect of 2D versus 3D laparoscopic radical resection of rectal cancer[J]. Chinese Journal of General Surgery,2016, 25(4):622–626. doi:10.3978/j.issn.1005–6947.2016.04.027.
[12] 余佩武, 郝迎学. 机器人优于2D和3D腹腔镜[J]. 中华胃肠外科杂志, 2015, 18(8):767–768. doi:10.3760/cma.j.issn.1671–0274.2015.08.008.Yu PW, Hao YX. Superiority of robot to 2D and 3D laproscope[J].Chinese Journal of Gastrointestinal Surgery, 2015, 18(8):767–768.doi:10.3760/cma.j.issn.1671–0274.2015.08.008.
[13] Kinoshita H, Nakagawa K, Usui Y, et al. High-de finition resolution three-dimensional imaging systems in laparoscopic radical prostatectomy: randomized comparative study with high-de finition resolution two-dimensional systems[J]. Surg Endosc, 2015,29(8):2203–2209. doi: 10.1007/s00464–014-3925–8.
[14] Heath MD, Cohen-Gadol AA. Intraoperative stereoscopic 3D video imaging: pushing the boundaries of surgical visualisation and applications for neurosurgical education[J]. Br J Neurosurg, 2012,26(5):662–667. doi: 10.3109/02688697.2012.672057.
[15] Usta TA, Karacan T, Naki MM, et al. Comparison of 3-dimensional versus 2-dimensional laparoscopic vision system in total laparoscopic hysterectomy: a retrospective study[J]. Arch Gynecol Obstet, 2014, 290(4):705–709. doi: 10.1007/s00404–014–3253–1.
[16] Liao G, Zhao Z, Lin S, et al. Robotic-assisted versus laparoscopic colorectal surgery: a meta-analysis of four randomized controlled trials[J].World J Surg Oncol, 2014, 12:122. doi: 10.1186/1477–7819–12–122.
[17] Xiong B, Ma L, Zhang C, et al. Robotic versus laparoscopic total mesorectal excision for rectal cancer: a meta-analysis[J]. J Surg Res, 2014, 188(2):404–414. doi: 10.1016/j.jss.2014.01.027.
[18] Kim CW, Kim CH, Baik SH. Outcomes of robotic-assisted colorectal surgery compared with laparoscopic and open surgery: a systematic review[J]. J Gastrointestsurg, 2014, 18(4):816–830. doi:10.1007/s11605–014–2469–5.
[19] Feroci F, Vannucchi A, Bianchi PP, et al. Total mesorectal excision for mid and low rectal cancer: laparoscopic vs robotic surgery[J].World J Gastroenterol, 2016, 22(13):3602–3610. doi: 10.3748/wjg.v22.i13.3602.
[20] Sun YL, Xu HR, Li ZJ, et al. Robotic versus laparoscopic low anterior resection for rectal cancer: a meta-analysis[J]. World J Surg Oncol, 2016, 14:61. doi: 10.1186/s12957–016–0816–6.
[21] D'Annibale A, Pernazza G, Monsellato I, et al. Total mesorectal excision: a comparison of oncological and functional outcomes between robotic and laparoscopic surgery for rectal cancer[J]. Surg Endosc, 2013, 27(6):1887–1895. doi: 10.1007/s00464–012–2731–4.
[22] Moore LJ, Wilson MR, Waine E, et al. Robotic technology results in faster and more robust surgical skill acquisition than traditional laparoscopy[J]. J Robot Surg, 2015, 9(1):67–73. doi: 10.1007/s11701–014–0493–9.
[23] Lim S, Kim JH, Baek SJ, et al. Comparison of perioperative and short-term outcomes between robotic and conventional laparoscopic surgery for colonic cancer: a systematic review and metaanalysis[J]. Ann Surg Treat Res, 2016, 90(6):328–339. doi: 10.4174/astr.2016.90.6.328.
[24] Szold A, Bergamaschi R, Broeders I, et al. European Association of Endoscopic Surgeons (EAES) consensus statement on the use of robotics in general surgery[J]. Surg Endosc, 2015, 29(2):253–288.doi: 10.1007/s00464–014–3916–9.
[25] Luca F, Valvo F, Ghezzi TL, et al. Impact of robotic surgery on sexual and urinary functions after fully robotic nerve-sparing total mesorectal excision for rectal cancer[J]. Ann Surg, 2013 257(4):672–678. doi: 10.1097/SLA.0b013e318269d03b.
[26] Baek SJ, Kim SH, Cho JS, et al. Robotic versus conventional laparoscopic surgery for rectal cancer: a cost analysis from a single institute in Korea[J]. World J Surg, 2012, 36(11):2722–2729. doi:10.1007/s00268–012–1728–4.
[27] 中国医师协会外科医师分会结直肠外科医师委员会, 中国研究型医院学会机器人与腹腔镜外科专业委员会. 机器人结直肠癌手术专家共识(2015版)[J]. 中华消化外科杂志, 2015, 14(11):891–897. doi:10.3760/cma.j.issn.1673–9752.2015.11.002.Chinese Society of Colon and Rectal Surgeons, Robotic and Laparoscopic Surgery Committee of Chinese Research Hospital Association. Expert consensus on robotic surgery for colorectal cancer (2015 edition)[J]. Chinese Journal of Digestive Surgery, 2015, 14(11):891–897. doi:10.3760/cma.j.issn.1673–9752.2015.11.002.
