胃癌是世界上常见恶性肿瘤,致死率位于所有恶性肿瘤中的第三位[1]。晚期胃癌预后往往较差,平均生存时间约为半年[2]。阿帕替尼(apatinib)可以通过抑制血管内皮细胞生长因子(VEGF)信号通路抑制肿瘤内新生血管生成,达到抗胃癌效果[3]。2014年,apatinib作为晚期胃腺癌或胃-食管结合部腺癌患者三线及三线以上治疗方案获得中国食品药品监管局批准上市[4]。apatinib明显改善了晚期胃癌患者的生存期,但也存在着一些副作用[4-6]。虽然apatinib的副作用可通过减药或者停药来改善,但这降低了apatinib的抗肿瘤效果。近期的一项研究[7]表明,间断使用抗VEGF治疗可能诱发肿瘤转移。因此,有必要寻找一种能降低apatinib的副作用促使apatinib能够长期不间断应用的方法,使apatinib更好的发挥抗肿瘤作用。
目前,纳米载药技术是实现药物缓释作用、改善药物副作用、增加药物反应时间的有效手段[8-10]。本实验拟合成一种载apatinib纳米胶束,并在此基础上进行细胞实验及安全性实验,以评价纳米载apatinib对脐静脉内皮细胞(HUVECs)的抑制作用。
1 材料与方法
1.1 实验材料与设备
HUVECs、内皮细胞基础培养基(BM)、内皮细胞生长因子(ECGS)、胰蛋白酶、胎牛血清(FBS)、双抗(P/S)、牛纤维蛋白均购自于美国Sciencell公司;重组人内皮细胞血管生长因子(rhVEGF121)购自南京Genscript公司;磷酸缓冲盐溶液(PBS)购自于Hyclone公司;十二烷基硫酸钠(SDS)购自于国药集团化学试剂有限公司;CCK-8购自于日本同仁公司;基底胶(Matrigel)购自于美国BD公司;T-25培养瓶、96孔培养板、Transwell小室购自于Corning公司;apatinib由江苏恒瑞公司提供;单甲醚聚乙二醇嵌段聚己内酯载apatinib纳米胶束(MPEG5000-b-PCL5000-apatinib)由合作单位华东理工大学材料学院合成,其最佳载药率为16.21%,对应的包封率为56.74%,平均粒径(55.7±4.1)nm,呈球形、近单分散体系;MCO15AC型CO2培养箱(日本Sanyo公司);台式离心机(美国Thermo science);Olympus显微镜BX-53(日本Olympus公司)。
1.2 实验方法
1.2.1 载apatinib纳米胶束的体外释放实验 紫外光谱全波长200~500 nm扫描apatinib在PBS中的紫外吸收曲线,得出apatinib的特征吸收峰在347 nm,再根据5组不同浓度对应的吸收度绘制一条标准曲线。将10 mL的载apatinib胶束加入透析袋中(截留分子量:3 500),将透析袋两段封紧后浸入50 mL的PBS(含0.2%SDS以满足漏槽条件)缓冲溶液中(pH=7.4),置于37 ℃恒温振荡箱中振荡(振荡速度为100 r/min);分别于1、2、4、8、16、24、36、48、72 h等时间点从外液相缓冲溶液中取出5 mL缓冲溶液,同时补入5 mL的新鲜PBS缓冲溶液(含0.2%SDS)。对于取出的溶液,测试其在347 nm处的紫外-可见光谱吸光强度,代入标准曲线求出浓度,最终得到载apatinib纳米胶束所释放出的apatinib的量。
1.2.2 载apatinib纳米胶束的体外溶血实验 取大鼠血2 mL,4 ℃ 2 000 r/min离心5 min,而后利用冰PBS洗涤后离心5 min,如是3次。弃去上清液,加入PBS,制备成8%体积比浓度的红细胞悬液。设计4组红细胞悬液,分别加入载apatinib纳米胶束使终浓度(以apatinib浓度计算)为10.0、5.0、2.5、1.25 μmol/L,另设计两组分别加入PBS和Trixon-100以设立阴性和阳性对照组。放入37 ℃培养 30 min后4 ℃ 2 000 r/min离心 5 min。取各组上清液100 μL加入96孔板,并在自动微板读数仪测定414 nm的吸光度。
1.2.3 HUVECs正常培养及传代 将1 mL 细胞悬液转移到T-25培养瓶中,加4 mL完全型内皮细胞专用培养基(ECM,含BM、FBS、ECGS、P/S,配制比例为500:25:0.5:0.5)混匀;将细胞培养瓶放入37 ℃、5% CO2培养箱中;待细胞培养长至90%~95%进行传代;将原ECM移除,用1 mL稀释至0.125% 的胰酶消化3 min,后加入1 mL ECM终止消化,800 r/min 离心4 min,弃去上清液并加入1 mL ECM进行重悬,而后将细胞悬液转移至新的培养瓶中并放入CO2培养箱培养。本实验所用原代细胞传代均不大于7次。
1.2.4 HUVECs的饥饿及VEGF的诱导培养 利用ECM培养新传代的HUVECs,待6 h细胞贴壁后,弃去原ECM,换用BM培养12 h进行饥饿。待细胞饥饿完毕后,弃去BM,加入VEGF诱导培养基(VCM;含 BM、FBS、rhVEGF121、P/S,配制比例为500:5:0.5:0.5)进行培养。
1.2.5 CCK-8实验 取对数生长期细胞,制备成用ECM重悬、密度为5×105/mL的细胞悬液,以每孔100 μL接种于96孔培养板上,待细胞贴壁后,弃去原ECM并加入BM进行饥饿12 h。待饥饿完毕后,加入VCM进行VEGF诱导培养。而后每孔分别加入1 μL不同浓度的单纯apatinib和载apatinib纳米胶束,使终浓度(以apatinib的含量计算)分别为 10、5、2.5、1.25 μmol/L与 625、312.5、156.25 nmol/L;设立空白纳米胶束(不载药物的纳米胶束)对照组:按上述浓度设计(以纳米胶束的对应含量计算)加入相同体积的空白纳米胶束;设立空白对照组:加入等体积的PBS;培养至48 h后,每孔加入10 μL CCK-8溶液,继续培养4 h,后用BIO-TEK自动微板读数仪测定450 nm的吸光度(A)。为研究载apatinib纳米胶束对增殖的抑制与时间的关系,取1 μmol/L(以apatinib的含量计算)的载apatinib纳米胶束及单纯apatinib,加入按上述方法细胞铺板并饥饿处理的96孔板内,连续培养3 d,分别设计12、24、36、48、60、72 h 6个时间点,培养结束后加入10 μL CCK-8,4 h后测定吸光度。抑制率按如下公式进行计算,抑制率(%)=(空白对照孔A值-实验孔A值)/空白对照孔A值×100%。采用Bliss法计算 IC50。
1.2.6 HUVECs迁移实验 利用牛纤维蛋白包被Transwell小室并将小室放在37 ℃恒温箱内培养12 h对Transwell小室做预处理。取对数生长期细胞制成利用BM重悬、密度为2×105/mL的细胞悬液,以每孔100 μL接种于Transwell小室的上腔内,设立实验组:在Transwell下腔加入VCM 500 μL,并按上述CCK-8实验步骤中的方法加入单纯apatinib以及载apatinib纳米胶束使药物浓度(以apatinib的含量计)为 10、1、0.1 μmol/L;设立VEGF诱导阳性对照组:下腔内只加入VCM以观察VEGF诱导的迁移;设立FBS诱导对照组:下腔内不加入VCM而只加入ECM以观察FBS诱导的迁移;设计空白对照组:下腔内加入BM。为探究载apatinib纳米胶束释放时间对迁移的影响,在下腔内加入已释放0、1、2、3 d的载apatinib纳米胶束及单纯apatinib,使药物浓度(以apatinib的含量计)为1 μmol/L,并按上述设立VEGF诱导阳性对照组。在37 ℃含5%CO2恒温箱内培养12~24 h后,用90%乙醇固定30 min,完毕后利用结晶紫染色20 min。利用PBS清洗3次,每次5 min。而后在Olympus显微镜下观察计数,每小室取5个视野。抑制率计算=(VEGF诱导阳性对照孔-实验孔)/VEGF诱导阳性对照孔×100%。
1.2.7 HUVECs小管成型实验 将50 μL Matrigel加入预冷的96孔板内进行包被并在37 ℃培养箱内过夜进行预处理。因单纯的VEGF不能诱导HUVECs进行体外小管成型[3],故实验设计中将VCM内的FBS含量提升至5%。设立实验组:制备以VCM重悬、密度为2×105/mL的脐静脉内皮细胞悬液,在各已被Matrigel包被的孔内加入100 μL细胞悬液,并加入载apatinib纳米胶束及单纯apatinib,使药物浓度(以apatinib 含量计)为10、1 μmol/L;设立VCM阳性对照组:加入PBS进行处理VCM重悬的细胞悬液;设立空白对照组:各孔内加入100 μL利用BM重悬的细胞悬液而不加入任何药物;设立ECM对照组:各孔内加入100 μL利用ECM重悬的细胞悬液而不加入任何药物。为探究载apatinib纳米胶束释放时间对小管成型的影响,按上述方法加入VCM重悬的细胞悬液,并于各孔内加入1 μmol/L单纯apatinib及已释放0、1、2、3 d的载apatinib纳米胶束;按上述设立VCM阳性对照组。在37 ℃ 5%CO2培养箱内培养6 h后,利用倒置相差显微镜进行观察、拍照,每孔拍摄5个视野。小管成型率计算=(VCM阳性对照孔-实验孔)/VCM阳性对照孔×100%。
1.3 统计学处理
所有实验均重复3次。统计资料结果以均数±标准差(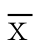 ±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用SNK法,P<0.05表示差异有统计学意义。使用SPSS 20.0软件进行统计分析,利用Graphpad软件及Image J软件进行图片处理。
±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用SNK法,P<0.05表示差异有统计学意义。使用SPSS 20.0软件进行统计分析,利用Graphpad软件及Image J软件进行图片处理。
2 结 果
2.1 载apatinib纳米胶束在体外的释放
体外释放实验显示,载apatinib纳米胶束的释放率在前2 h达20.5%,后释放逐渐减慢,至72 h后释放率达到62.9%(图1)。
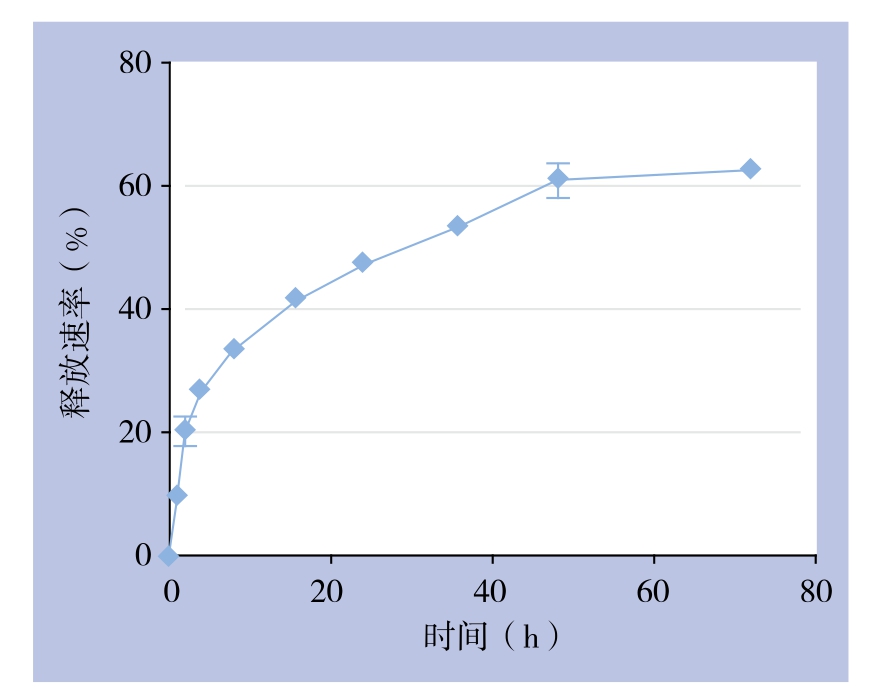
图1 载apatinib纳米胶束的体外释放
Figure 1 Release of apatinib-loaded nanomicelles in vitro
2.2 载apatinib纳米胶束的溶血测试
体外溶血实验显示,与Trixion-100可以引起明显的溶血相比,所有载apatinib纳米胶束组溶血率均<5%(均P<0.05)(图2)。
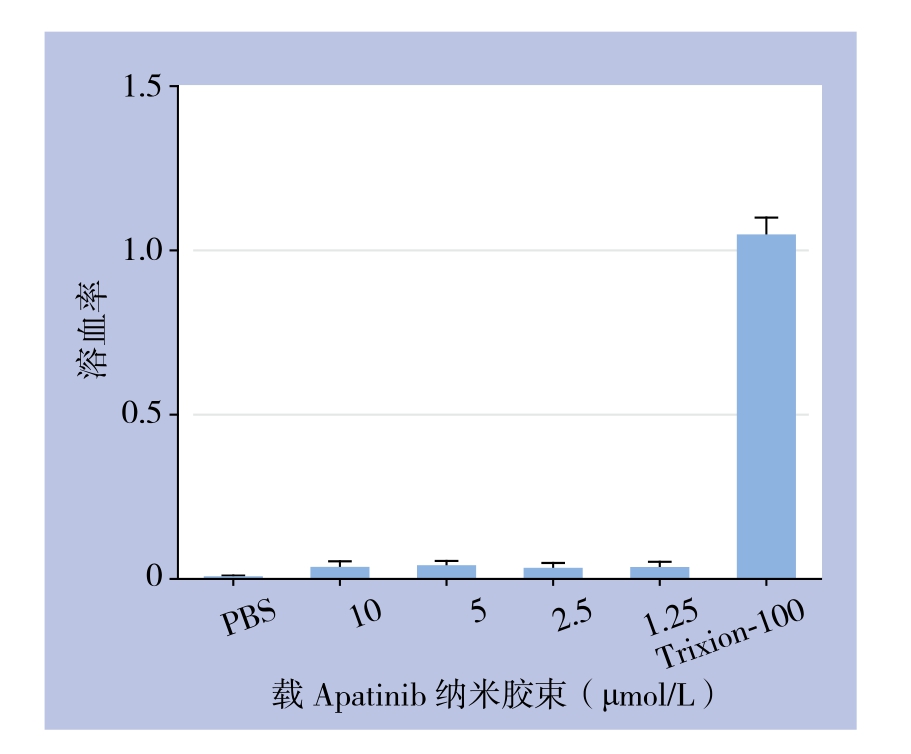
图2 载apatinib纳米胶束的溶血实验
Figure 2 Hemolysis tests of apatinib-loaded nanomicelles
2.3 载apatinib纳米胶束对HUVECs增殖的抑制作用
CCK-8结果显示,研究中所有设计的空载纳米胶束组中,HUVECs增值率都在95%以上(均P>0.05)。单纯apatinib及载apatinib纳米胶束按apatinib药物浓度10、5、2.5、1.25 µmol/L与625、312.5、156.25 nmol/L分别作用48 h之后,对HUVECs增殖的抑制率随药物浓度上升而增加(图3A),此时载apatinib纳米胶束对HUVECs增殖的抑制率平均仍然小于单纯apatinib(IC50:1.385 µmol/L vs. 0.768 µmol/L,P=0.012)。但通过延长作用时间并进行不同时间点测试,在浓度同是1 µmol/L下,虽然载apatinib纳米胶束组在作用开始时弱于原药apatinib组,但随着时间延长,载apatinib纳米胶束的抑制作用逐渐增加并于72 h接近并超过单纯apatinib组(63.34% vs. 59.70%,P=0.005);且单纯apatinib的抑制率初始抑制率增加很高,后随时间变化逐渐趋于平缓,而载apatinib纳米胶束抑制率稳定增加(图3B)。
2.4 载apatinib纳米胶束对HUVECs迁移的抑制作用
为进一步证明载apatinib纳米胶束对HUVECs的抑制作用,本研究进行了Transwell迁移实验。迁移实验结果显示,载apatinib纳米胶束及单纯apatinib均可以抑制HUVECs的迁移,抑制能力随药物浓度上升而增加(图4);随着载apatinib纳米胶束释放时间变长,其对HUVECs迁移的抑制能力也会增强(图5),且释放3 d的apatinib纳米胶束抑制迁移能力大于单纯apatinib(P=0.005)。
图3 载apatinib纳米胶束与单纯apatinib对HUVECs增殖的抑制作用 A:不同浓度的载apatinib纳米胶束及单纯apatinib作用48 h对HUVECs增殖的抑制率;B:1 μmol/L载apatinib纳米胶束及单纯apatinib作用不同时间对HUVECs增殖的抑制率
Figure 3 Inhibitory effects of apatinib-loaded nanomicelles and free apatinib on proliferation of HUVECs A: Inhibition rates of various concentrations of apatinib-loaded nanomicelles and free apatinib on HUVECs at 48 h; B: Inhibition rates of 1 μmol/L apatinibloaded nanomicelles and free apatinib on HUVECs at different time points
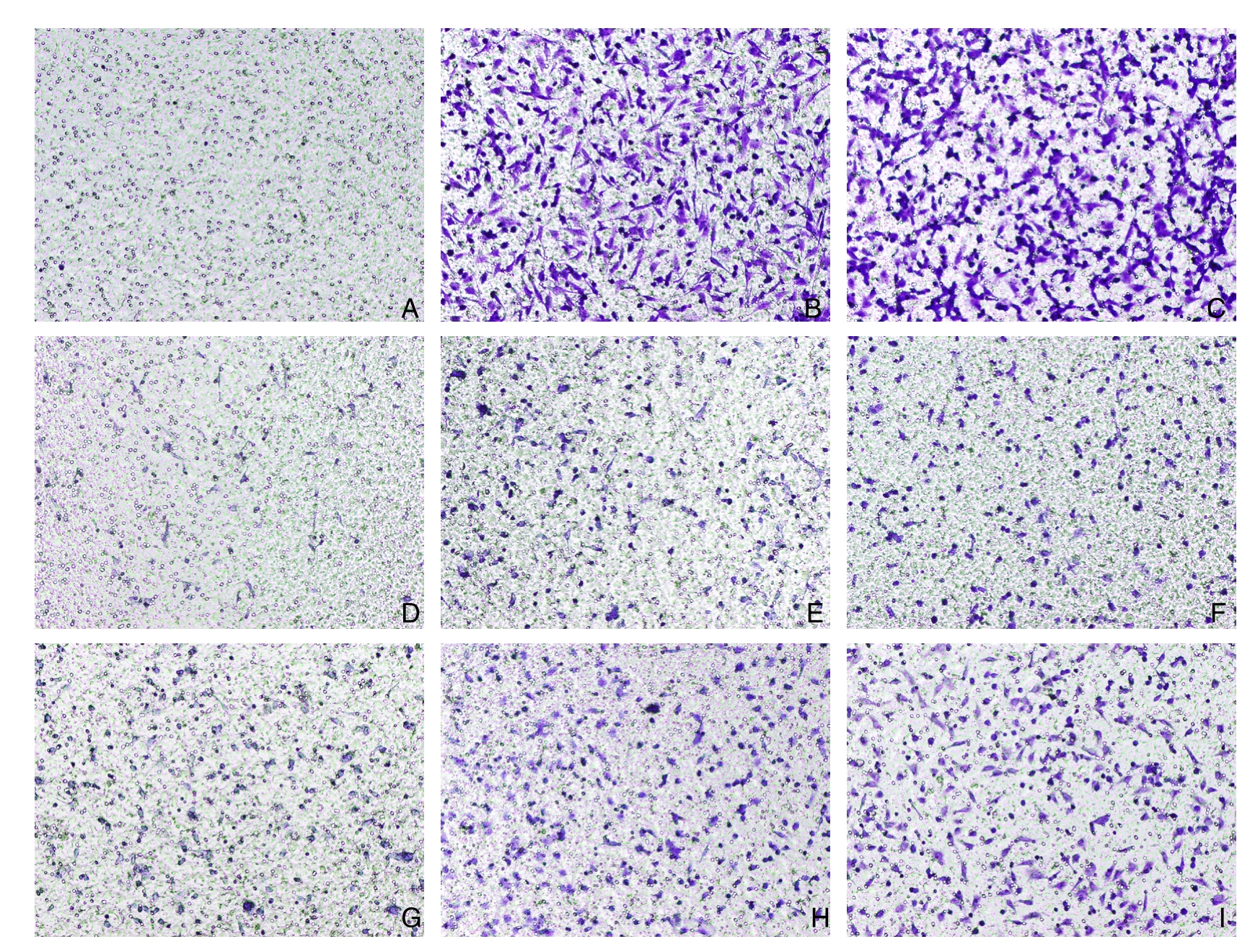
图4 不同浓度的载apatinib纳米胶束及单纯apatinib对HUVECs迁移的抑制 A:BM对照;B:ECM对照;C:VCM对照;D:apatinib 10 μmol/L;E:apatinib 1 μmol/L;F:apatinib 0.1 μmol/L;G:载 apatinib 纳米胶束 10 μmol/L;H:载 apatinib纳米胶束 1 μmol/L;I:载 apatinib 纳米胶束 0.1 μmol/L
Figure 4 Inhibitory effects of various concentrations of apatinib-loaded nanomicelles and free apatinib on migration of HUVECs A: BM control; B: ECM control; C:VCM control; D: 10 μmol/L apatinib; E: 1 μmol/L apatinib; F: 0.1 μmol/L apatinib; G: 10 μmol/L apatinib-loaded nanomicelles; H: 1 μmol/L apatinib-loaded nanomicelles; I: 0.1 μmol/L apatinib-loaded nanomicelles
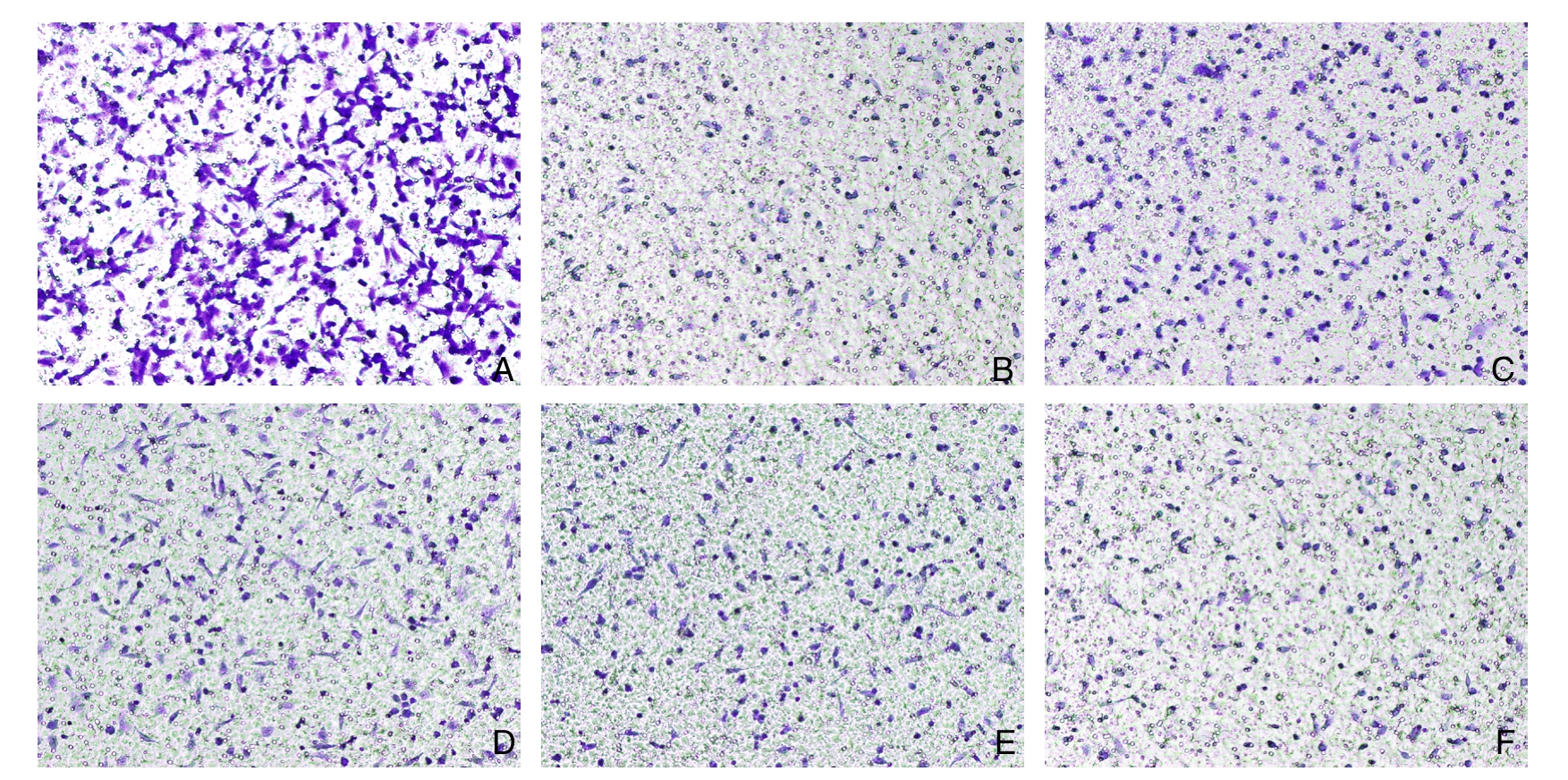
图5 1 μmol/L单纯apatinib及1 μmol/L不同释放时间的载apatinib纳米胶束对HUVECs迁移的抑制 A:VCM对照;B:apatinib 1 μmol/L;C:1 μmol/L 载 apatinib 纳米胶束释放 0 d;D:1 μmol/L 载 apatinib 纳米胶束释放 1 d;E:1 μmol/L载apatinib纳米胶束释放2 d;F:1 μmol/L载apatinib纳米胶束释放3 d
Figure 5 Inhibitory effects of 1 μmol/L free apatinib and 1 μmol/L apatinib-loaded nanomicelles with different releasing time on migration of HUVECs A: VCM control; B: 1 μmol apatinib L; C: 1 μmol/L 0-d releasing apatinib-loaded nanomicelles;D:1 μmol/L 1-d releasing apatinib-loaded nanomicelles; E: 1 μmol/L 2-d releasing apatinib-loaded nanomicelles; F: 1 μmol/L 3-d releasing apatinib-loaded nanomicelles
2.5 载apatinib纳米胶束对HUVECs成管能力的抑制作用
为模拟载apatinib纳米胶束对肿瘤新生血管的抑制作用,本研究进行了HUVECs成管实验。成管实验结果显示,单纯apatinib及载apatinib纳米胶束均对HUVECs成管能力的抑制可随浓度增加而增加;药物浓度增加至10 µmol/L时,单纯apatinib可以使HUVECs成管能力完全消失,而载apatinib纳米胶束即使达到10 µmol/L,对HUVECs成管能力的抑制依然不是很强(图6);但随着载apatinib纳米胶束释放时间延长,载apatinib纳米胶束对HUVECs成管能力的抑制会逐渐增加,且释放3 d的载apatinib纳米胶束抑制迁移能力会超越单纯apatinib(P=0.042)(图7)。

图6 不同浓度的载apatinib纳米胶束及单纯apatinib对HUVECs成管能力的抑制作用 A:VCM对照;B:apatinib 10 μmol/L;C:apatinib 1 μmol/L;D:载apatinib纳米胶束10 μmol/L;E:载apatinib纳米胶束1 μmol/L
Figure 6 Inhibitory effects of various concentrations of apatinib-loaded nanomicelles and free apatinib on tube formation of HUVECs A: VCM control; B: 10 μmol/L apatinib; C: 1 μmol/L apatinib; D: 10 μmol/L apatinib-loaded nanomicelles; E: 1 μmol/L apatinib-loaded nanomicelles
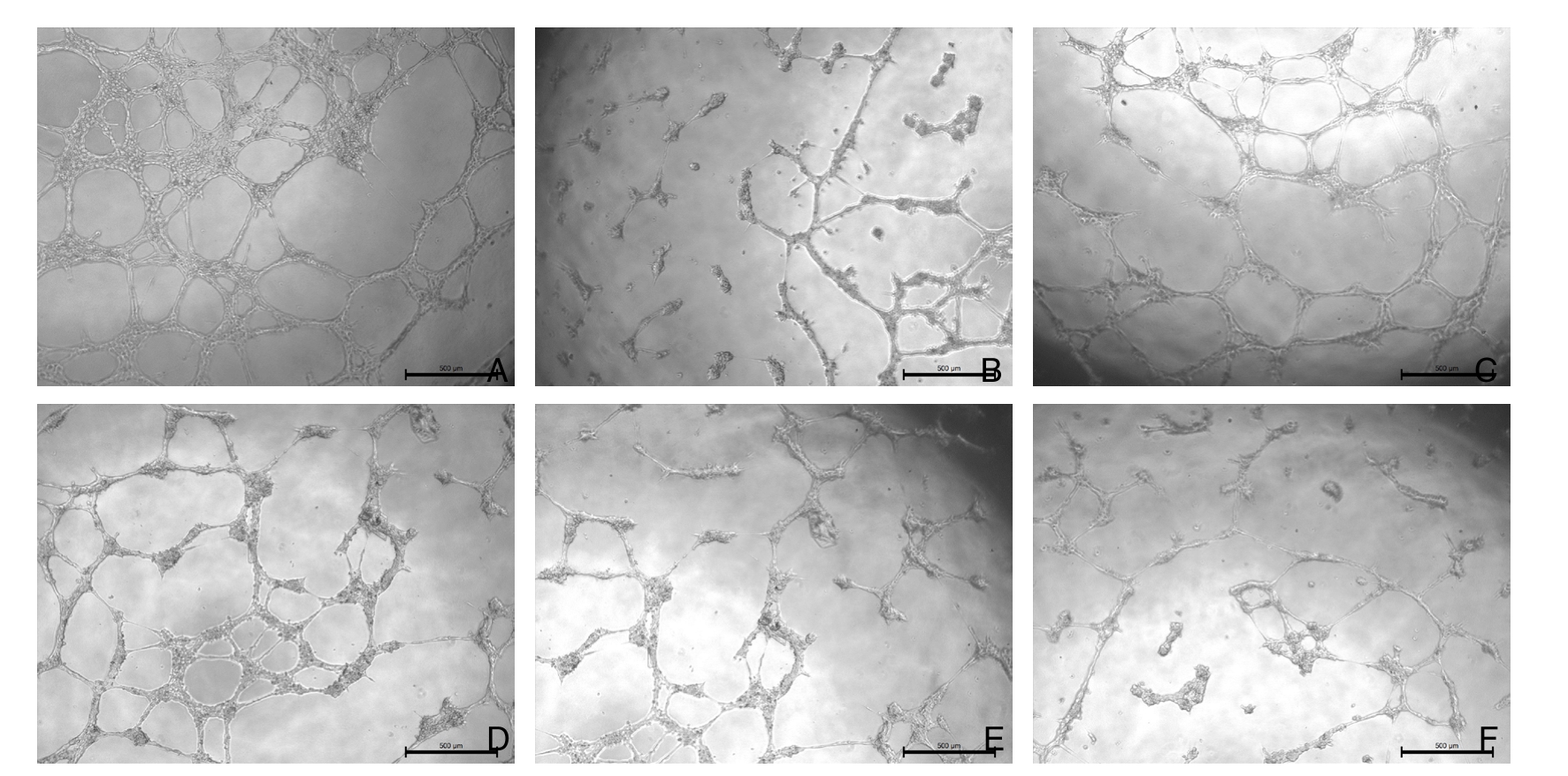
图7 1 μmol/L单纯apatinib及1 μmol/L不同释放时间的载apatinib纳米胶束对HUVECs成管能力的抑制 A:VCM对照;B:apatinib 1 μmol/L;C:1 μmol/L 载 apatinib 纳米胶束释放 0 d;D:1 μmol/L 载 apatinib 纳米胶束释放 1 d;E:1 μmol/L载apatinib纳米胶束释放2 d;F:1 μmol/L载apatinib纳米胶束释放3 d
Figure 7 Inhibitory effects of 1 μmol/L free apatinib and 1 μmol/L apatinib-loaded nanomicelles with different releasing time on tube formation of HUVECs A: VCM control; B: 1 μmol/L apatinib; C: 1 μmol/L 0-d releasing apatinib-loaded nanomicelles;D: 1 μmol/L 1-d releasing apatinib-loaded nanomicelles; E: 1 μmol/L 2-d releasing apatinib-loaded nanomicelles; F: 1 μmol/L 3-d releasing apatinib-loaded nanomicelles
3 讨 论
晚期或者转移性的胃癌预后往往较差,平均生存时间约为半年,在接受一线化疗方案后,晚期或转移性胃癌患者可以延长6个月左右的生存时间[1],但在一线化疗方案不起作用的情况下,只能选用二线或三线化疗治疗方案(多西他赛、伊利替康或紫杉醇等),但平均生存时间往往也会减短[11]。血管新生在肿瘤的发展及转移过程中具有重要作用[12],而VEGF/VEGFR-2通路是控制血管新生最重要的管理器[13],因此,VEGF/VEGFR-2通路可以作为以抑制血管新生而达到抗肿瘤目的的关键靶点。目前,已经研究出的VEGF/VEGFR-2通路的抑制剂包括3类:特异性结合抗体、可溶性VEGF干扰分子及小分子酪氨酸激酶抑制剂(TKI)[3]。apatinib作为小分子TKI,可通过特异性结合VEGFR2受体的酪氨酸激酶位点,抑制磷酸化反应,从而抑制VEGF/VEGFR2信号通路产生的反应,进一步抑制血管内皮细胞增殖、迁移,产生抗肿瘤的效果 [14]。目前,apatinib在中国进行II期和III期临床试验后,已经证明可以显著改善晚期胃癌患者的生存时间[5-6]。在apatinib的两个临床试验内,apatinib明显改善了晚期胃癌患者生存期,但也存在着较为明显的副作用。这些高频率的副作用可通过减药或者停药来改善,但也降低了apatinib的抗肿瘤效果[4-6,15]。近期的一项研究[7]表明:间断使用抗VEGF治疗可能诱发肿瘤转移。因此,需要寻找一种能降低apatinib的副作用促使apatinib能够长期不间断应用的方法。分析apatinib导致副作用发生的原因,可能有两种:⑴ apatinib具有新生血管区域靶向性,这种靶向性不仅使其作用于肿瘤新生区域,还作用于微血管较密集的区域比如黏膜、手足末端等,从而导致了并发症;⑵ apatinib的部分症状可以通过减药来实现,可以推测,非靶向部位过高释放浓度的apatinib可能导致了并发症的发生。因此,有必要寻求一种可以降低局部非靶向部位apatinib的浓度并且使apatinib具有缓释性的方法。
纳米技术与生命科学进行了广泛的交叉[16],新型的利用无毒高分子材料作为纳米级药物载体,已经成为药物研究领域重要的研究方向。由于肿瘤细胞有较强的吞噬能力以及肿瘤等病变部位的血管内皮细胞缝隙远大于正常内皮细胞间隙,因此当纳米胶束循环至肿瘤所在部位的时候其进入肿瘤等病变部位的机会增多,同时纳米胶束缓释抗肿瘤药物延长了药物在肿瘤内的存留时间,减慢了肿瘤的生长,与游离药物相比,延长了药效时间。因此,纳米载药系统是实现药物缓释作用的有效手段[17]。聚己内酯(PCL)是一种半结晶性脂肪族聚酯,在生物安全性方面,聚己内酯聚合物材料现已被证明具有良好的生物相容性,且已被美国食品与药品管理局(FDA)批准用作生物医用材料[18],但PCL由于结晶性强、熔点低、降解速率慢、缺乏反应性官能团等特点,部分限制了其在生物应用领域的应用范围,因而需要对其进行改性[19]。单甲醚聚乙二醇(mPEG)于常态下比较稳定,但其活性羟基端也可以在特殊条件下引起环状物质的开环及聚合[20-23];此外,mPEG具有良好的生物降解性及优越的生物相容性,其在生物体内可以直接通过生物降解,且其本身具有免疫学惰性,在生物体内引起免疫反应的几率较小[20,24],因此,mPEG对生物体影响较小,产生的毒性低[25]。因此,利用mPEG作为引发剂、诱导CL开环合成的单甲醚聚乙二醇嵌段聚己内酯材料(mPEG-b-PCL)是一种可用于载药的安全有效的生物可降解材料。目前,mPEG-b-PCL已经应用于包载依托泊苷[26]、表柔比星[27]等化疗药物,也可以通过修饰后作为干扰RNA的靶向载体[28]。虽然有许多研究表明纳米载药系统应用于改善化疗药物的药效,但很少有研究表明纳米载药系统可用来改善抗血管生成药物的药效。本实验创新性的利用纳米载药系统mPEG-b-PCL包载抗血管生成药物apatinib,并对其进行了缓释性检测及细胞学方面的研究。
本实验所使用的载apatinib纳米胶束的最佳载药率为16.21%,对应的包封率为56.74%,平均粒径(55.7±4.1)nm,呈球形、近单分散体系,具有稳定的形态。根据纳米载药系统的缓释性理论[8,17],载apatinib纳米胶束可以持续缓慢释放apatinib可能由于:载apatinib纳米胶束由于逐步的水解作用或者缓慢的降解作用导致的结构稳定性破坏,从而使apatinib通过扩散的方式释放至胶束外部。为验证其缓释性,本研究进行了体外释放实验。体外药物缓释实验结果表明:载apatinib纳米胶束的释放在前2 h达20.5%,说明载apatinib纳米胶束具有一定突释作用,后释放趋于平稳,至72 h后达到62.9%,这说明载apatinib纳米胶束具有良好的药物缓释作用。载apatinib纳米胶束的缓释性可能会延长apatinib在肿瘤内部的存留时间,与游离的apatinib相比,载apatinib纳米胶束可以延长apatinib的作用时间,减小apatinib的使用剂量[25]。载apatinib纳米胶束的合成原料mPEG、PCL都具有良好的生物安全性及生物相容性[18,20,24],多项研究[25-28]表明:利用mPEG、PCL合成的纳米材料mPEG-b-PCL安全性良好。为检测mPEG-b-PCL是否可以安全地作为apatinib的载药系统,应用于静脉制剂,本研究进行了体外溶血实验。体外溶血试验结果表明,高浓度的载apatinib纳米胶束也不会引起细胞的溶血,这说明载apatinib纳米胶束具有较好的生物安全性;mPEG-b-PCL可以作为改善apatinib作用的纳米材料。为了研究载apatinib纳米胶束是否可以改善apatinib对新生血管抑制能力,本研究进行了增殖及迁移实验。在Tian等[3]的研究中,apatinib对HUVECs增殖抑制的IC50为0.17 μmol/L,而本研究中的IC50为0.768 μmol/L,这可能是由于本研究与Tian等[3]的研究所使用的VEGF种类及含量不同导致。在48 h时,单纯apatinib对HUVECs增殖的抑制率仍然高于载apatinib纳米胶束,根据前述缓释性的研究,此时载apatinib纳米胶束此时释放的apatinib抑制能力仍然低于单纯apatinib;而随着时间的进一步延长,载apatinib纳米胶束对HUVECs增殖的抑制于72 h超越单纯apatinib,这可能是因为[8]:单纯apatinib通过扩散的方式进入HUVECs内部作用于VEGFR2的磷酸化位点[29];而载apatinib纳米胶束既可以通过释放出的apatinib的扩散进入HUVECs内部,而且一部分载apatinib纳米胶束可能可以被HUVECs通过胞吞作用进入HUVECs内部,两者所释放出的apatinib抑制能力超越单纯apatinib。迁移实验结果表明,载apatinib纳米胶束对HUVECs的迁移也可以产生抑制作用,且抑制能力表现出浓度依赖性及释放时间依赖性;这两项实验结果说明,载apatinib纳米胶束可增加apatinib的利用率,改善apatinib对HUVECs的抑制作用。为了进一步研究载apatinib纳米胶束是否可以改善apatinib对新生血管抑制能力,本研究还进行了体外小管成型实验来模拟体内的微血管形成。10 μmol/L单纯apatinib可以使HUVECs完全丧失成管能力,而10 μmol/L载apatinib纳米胶束对HUVECs成管能力的抑制并不是很强甚至弱于1 μmol/L单纯apatinib,这可能是因为成管实验的实验时间为6 h[3],而此时载apatinib纳米胶束大部分药物尚未释放的缘故。随着释放天数的延长,载apatinib纳米胶束对HUVECs成管能力的抑制也会逐渐增强,这与增殖与迁移实验的结果相一致。以上实验表明了载apatinib纳米胶束可以抑制血管的形成,也说明了载apatinib纳米胶束缓释性及对apatinib进行纳米包载的可行性及优越性。
综上,载apatinib纳米胶束良好的生物安全性、缓释作用。本研究结果可以进一步加深对药物利用的理解,为抗血管生成药物的研究提供新的思路和研究方法,也为以后肿瘤药物的治疗提供新的手段。
参考文献
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J].CA Cancer J Clin, 2015, 65(2):87–108. doi: 10.3322/caac.21262.
[2] Nashimoto A, Akazama K, Isobe Y, et al. Gastric cancer treated in 2002 in Japan: 2009 annual report of the JGCA nationwide registry [J]. Gastric Cancer, 2013, 16(1):1–27. doi: 10.1007/s10120–012–0163–4.
[3] Tian S, Quan H, Xie C, et al. YN968D1 is a novel and selective inhibitor of vascular endothelial growth factor receptor-2 tyrosine kinase with potent activity in vitro and in vivo [J]. Cancer Sci, 2011,102(7):1374–1380. doi: 10.1111/j.1349–7006.2011.01939.x.
[4] Roviello G, Ravellia A, Polom K, et al. apatinib: A novel receptor tyrosine kinase inhibitor for the treatment of gastric cancer[J]. Cancer Lett, 2016, 372(2): 187–191. doi: 10.1016/j.canlet.2016.01.014.
[5] Li J, Qin S, Xu J, et al. Apatinib for chemotherapy-refractory advanced metastatic gastric cancer: results from a randomized,placebo-controlled, parallel-arm, phase II trial[J]. J Clin Oncol,2013, 31(26):3219–3225. doi: 10.1200/JCO.2013.48.8585.
[6] Li J, Qin S, Xu J, et al. Randomized, Double-Blind, Placebo-Controlled Phase III Trial of apatinib in Patients With Chemotherapy-Refractory Advanced or Metastatic Adenocarcinoma of the Stomach or Gastroesophageal Junction[J]. J Clin Oncol,2016, 34(13):1448–1454. doi: 10.1200/JCO.2015.63.5995.
[7] Yang Y, Zhang Y, Iwamoto H, et al. Discontinuation of anti-VEGF cancer therapy promotes metastasis through a liver revascularization mechanism[J]. Nat Commun, 2016, 7:12680. doi: 10.1038/ncomms12680.
[8] Cagel M, Tesan FC, Bernabeu E, et al. Polymeric mixed micelles as nanomedicines: Achievements and perspectives [J]. Eur J Pharm Biopharm, 2017, 113:211–228. doi: 10.1016/j.ejpb.2016.12.019.
[9] 李永盛, 贺思佳, 江翰, 等. 载5-氟脲嘧啶聚己内酯纳米粒子对人胆管癌细胞的体外杀伤作用 [J]. 中国普通外科杂志, 2015,24(2):206–210. doi:10.3978/j.issn.1005–6947.2015.02.010.Li YS, He SJ, Jiang H, et al. Killing effect of 5-fluorouracil loaded polycaprolactone nanoparticles on human cholangiocarcinoma cells in vitro[J]. Chinese Journal of General Surgery, 2015, 24(2):206–210. doi:10.3978/j.issn.1005–6947.2015.02.010.
[10] 李永盛, 江翰, 王子豪, 等. 叶酸靶向修饰纳米粒加载5-氟尿嘧啶治疗胆管癌的实验研究[J]. 中国普通外科杂志, 2013, 22(8):976–981. doi:10.7659/j.issn.1005–6947.2013.08.004 Li YS, Jiang H, Wang ZH, et al. 5-fluorouracil carrying nanoparticles with folate-targeted modification for cholangiocarcinoma: an experimental study [J]. Chinese Journal of General Surgery, 2013,22(8):976–981. doi:10.7659/j.issn.1005–6947.2013.08.004.
[11] Takahari D. Second-line chemotherapy for patients with advanced gastric cancer [J]. Gastric Cancer, 2017, 20(3):395–406. doi:10.1007/s10120–017–0707–8.
[12] Carmeliet P, Jain RK. Angiogenesis in cancer and other diseases[J].Nature, 2000, 407(6801):249–57. doi: 10.1038/35025220.
[13] Ellis LM, Hicklin DJ. VEGF-targeted therapy: mechanisms of anti-tumour activity [J]. Nat Rev Cancer, 2008, 8(8):579–591. doi:10.1038/nrc2403.
[14] Roviello G, Ravelli A, Fiaschi AI, et al. apatinib for the treatment of gastric cancer [J]. Expert Rev Gastroenterol Hepatol, 2016,10(8):887–892. doi: 10.1080/17474124.2016.1209407.
[15] Scott AJ, Messersmith WA, Jimeno A. apatinib: a promising oral antiangiogenic agent in the treatment of multiple solid tumors[J]. Drugs Today (Barc), 2015, 51(4):223–229. doi: 10.1358/dot.2015.51.4.2320599.
[16] 熊青, 邹孟达, 邓青松, 等. 载VEGF siRNA环五肽RGD偶联纳米金颗粒的基本特性及在射频消融中的应用[J]. 中国普通外科杂志, 2015, 24(1):45–51. doi:10.3978/j.issn.1005–6947.2015.01.009.Xiong Q, Zou MD, Deng QS, et al. General properties and application of VEGF siRNA-loaded RGD-conjugated gold nanoparticles in radiofrequency ablation[J]. Chinese Journal of General Surgery, 2015, 24(1):45–51. doi:10.3978/j.issn.1005–6947.2015.01.009.
[17] Bale S, Khurana A, Reddy AS, et al. Overview on Therapeutic Applications of Microparticulate Drug Delivery Systems[J]. Crit Rev Ther Drug Carrier Syst, 2016, 33(4):309–361. doi: 10.1615/Cri tRevTherDrugCarrierSyst.2016015798.
[18] Li Z, Tan BH. Towards the development of polycaprolactone based amphiphilic block copolymers: molecular design, self-assembly and biomedical applications[J]. Mater Sci Eng C Mater Biol Appl, 2014,45:620–634. doi: 10.1016/j.msec.2014.06.003.
[19] Xiao Y, Yuan M, Zhang J, et al. Functional poly(epsiloncaprolactone) based materials: preparation, self-assembly and application in drug delivery[J]. Curr Top Med Chem, 2014,14(6):781–818. doi: 10.2174/1568026614666140118222820.
[20] Hong J, Liu Y, Xiao Y, et al. High drug payload curcumin nanosuspensions stabilized by mPEG-DSPE and SPC: in vitro and in vivo evaluation[J]. Drug Deliv, 2017, 24(1):109–120. doi:10.1080/10717544.2016.1233589.
[21] Alalaiwe A, Roberts G, Carpinone P, et al. Influence of PEG coating on the oral bioavailability of gold nanoparticles in rats[J]. Drug Deliv, 2017, 24(1):591–598. doi: 10.1080/10717544.2017.1282554.
[22] Dong X, Chen H, Qin J, et al. Thermosensitive porphyrinincorporated hydrogel with four-arm PEG-PCL copolymer (II):doxorubicin loaded hydrogel as a dual fluorescent drug delivery system for simultaneous imaging tracking in vivo[J]. Drug Deliv,2017, 24(1):641–650. doi: 10.1080/10717544.2017.1289570.
[23] Hu X, Yang F, Liu CY, et al. In vitro uptake and transport studies of PEG-PLGA polymeric micelles in respiratory epithelial cells[J]. Eur J Pharm Biopharm, 2017, 114:29–37. doi: 10.1016/j.ejpb.2017.01.004.
[24] Wei X, Gong C, Gou M, et al. Biodegradable poly(epsiloncaprolactone)-poly(ethylene glycol) copolymers as drug delivery system[J]. Int J Pharm, 2009, 381(1):1–18. doi: 10.1016/j.ijpharm.2009.07.033.
[25] Kheiri Manjili H, Ghasemi P, Malvandi H, et al. Pharmacokinetics and in vivo delivery of curcumin by copolymeric mPEGPCL micelles[J]. Eur J Pharm Biopharm, 2016, pii: S0939–6411(16)30693–2. doi: 10.1016/j.ejpb.2016.10.003.
[26] Ukawala M, Rajyaguru T, Chaudhari K, et al. Investigation on design of stable etoposide-loaded PEG-PCL micelles: effect of molecular weight of PEG-PCL diblock copolymer on the in vitro and in vivo performance of micelles[J]. Drug Deliv, 2012,19(3):155–167. doi: 10.3109/10717544.2012.657721.
[27] Sun C, Zhou L, Gou M, et al. Improved antitumor activity and reduced myocardial toxicity of doxorubicin encapsulated in MPEGPCL nanoparticles[J]. Oncol Rep, 2016, 35(6):3600–3606. doi:10.3892/or.2016.4748.
[28] Kanazawa T, Sugawara K, Tanaka K, et al. Suppression of tumor growth by systemic delivery of anti-VEGF siRNA with cellpenetrating peptide-modified MPEG-PCL nanomicelles[J].Eur J Pharm Biopharm, 2012, 81(3):470–477. doi: 10.1016/j.ejpb.2012.04.021.
[29] Zhang H. Apatinib for molecular targeted therapy in tumor [J].Drug Des Devel Ther, 2015, 13(9):6075–6081. doi: 10.2147/DDDT.S97235.
