主动脉夹层(aortic dissection,AD)指主动脉血流经内膜破口进入主动脉壁内,沿管壁中膜层进一步剥离延伸,形成假腔,从而造成主动脉真、假腔分离的一种病理改变。主动脉壁(尤其是中膜层)结构的改变是发生AD的形态学基础[1]。主动脉属弹性大动脉,其中膜层是维持主动脉弹性和承载动脉壁搏动性应力的关键结构,其主要结构成份是弹力纤维(elastic fibers)和胶原纤维组成的细胞外基质[2],弹性蛋白(elastin)则是弹力纤维的最主要结构成份[3]。目前国内关于AD患者主动脉中膜层弹性蛋白和弹力纤维表达的研究较少,本研究拟从弹性蛋白和弹力纤维在Stanford A型AD升主动脉管壁的差异表达方面探讨AD发生的结构基础。
1 材料与方法
1.1 标本与分组
AD组织标本于2016年1月—2017年3月间在海南省人民医院和中国医学科学院阜外医院术中采集(AD组),入组标准:诊断Stanford A型AD[4],并在术中证实。排除标准:排除合并有Ehlers-Danlos综合征、Marfan综合征等结缔组织疾病,外伤、妊娠和医源性损伤引起的AD,主动脉瓣二瓣畸形,明显的动脉粥样硬化以及有明确家族遗传史的AD患者。对照组标本取自海南省人民医院同期脑死亡患者行多器官捐献时和冠状动脉旁路移植(CABG)术中的升主动脉标本 ,并且排除肉眼检查发现合并AD或动脉瘤等主动脉疾病的标本。两组标本术中采集后立即冲洗,修剪成形,一部分置液氮或–80 ℃冰箱冷冻保存,另一部分置10%中性甲醛溶液固定。
AD组10例,其中男7例,女3例;年龄42~67岁,中位年龄53岁。对照组10例,其中男性8例,女性2例;年龄31~72岁,中位年龄51岁,对照组中4例标本为脑死亡患者行多器官捐献时采集,其余为CABG术中升主动脉的打孔标本。两组标本所采集患者的年龄及性别差异无统计学意义,具有可比性(t=0.628、χ2=1.715,均P>0.05)。
本研究方案经医院伦理委员会批准,所有标本采集均获得患者本人或家属的知情同意,并签署知情同意书。
1.2 主要试剂
兔抗人弹性蛋白多克隆抗体(ab23747)及鼠抗人β-actin单克隆抗体(ab8226)购自美国Abcam公司,辣根过氧化物酶(HRP)标记的羊抗兔IgG、HRP标记的羊抗鼠IgG购自北京中杉金桥。Bradford法蛋白质定量试剂盒购自大连美仑。ECL显色试剂盒购自上海榕柏。EVG染色所用部分试剂均购于珠海贝索。
1.3 方法
1.3.1 Western blot检测升主动脉中膜层弹性蛋白表达 取冻存升主动脉标本中膜层组织150 mg经冰上研磨、匀浆、裂解,4 ℃ 12 000 r/min离心10 min,收集含蛋白上清液。Bradford法测定总蛋白浓度。蛋白样品(25 μg)与5×上样缓冲液1:4配比后与蛋白Marker在100 ℃水浴5 min后上样。经十二烷基硫酸钠-聚丙烯酰胺凝胶(SDSPAGE)电泳分离,电转至PVDF(polyvinylidene fluoride)膜,常温封闭60 min,漂洗。分别加入稀释的兔抗人弹性蛋白多克隆抗体、鼠抗人β-actin单克隆抗体,4 ℃孵育过夜,次日洗膜后加入稀释的二抗(HRP标记的羊抗兔、羊抗鼠IgG),ECL显色,暗室曝光显示条带。实验重复3次。各条带显影图像用Image J图像分析软件处理、分析,以目的蛋白(弹性蛋白)/内参(β-actin)灰度积分比值代表弹性蛋白的相对表达量。
1.3.2 EVG弹力纤维染色检测升主动脉中膜层弹力纤维形态和表达 升主动脉标本用10%中性甲醛固定,沿管壁横断面取材。石蜡包埋切片,厚4 μm,脱蜡至水;滴加0.5%高锰酸钾溶液氧化5 min,水洗;滴加2%草酸漂白,水洗;95%乙醇稍洗,浸Weigert氏雷锁辛品液,室温1~2 h;95%乙醇分化至背景清晰,水洗;Van Gieson染液对比染色1 min,95%乙醇快速分化5 s,水洗;无水乙醇脱水、二甲苯透明、中性树胶封固[5]。染色结果:弹力纤维呈蓝黑色、细胞核呈蓝色、胶原纤维呈红色。在每张玻片显示的中膜层选择5个视野,采用Image-Pro Plus 6.0软件对每个视野进行累积光密度(integrated optical density,IOD)分析,分析选取目标为蓝黑色的区域(弹力纤维),通过IOD值可大致判定每个视野中蓝黑色颜色区域颜色及深浅程度的相对累积值。比较两组升主动脉中膜层形态及弹力纤维形态与表达。
1.4 统计学处理
采用SPSS 18.0软件包进行统计学分析。符合正态分布计量资料采用均数±标准差( ±s)表示,偏态分布计量资料以中位数表示。组间比较,计量资料采用独立样本t检验,计数资料采用χ2检验,弹性蛋白与弹力纤维表达的相关性采用双变量直线相关分析。以P<0.05为差异有统计学意义。
±s)表示,偏态分布计量资料以中位数表示。组间比较,计量资料采用独立样本t检验,计数资料采用χ2检验,弹性蛋白与弹力纤维表达的相关性采用双变量直线相关分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 弹性蛋白表达检测结果
AD组升主动脉管壁中膜层弹性蛋白表达量为0.32±0.07,对照组为1.12±0.17,AD组升主动脉管壁中膜层弹性蛋白表达量较对照组明显降低(t=6.722, P=0.003)(图1)。
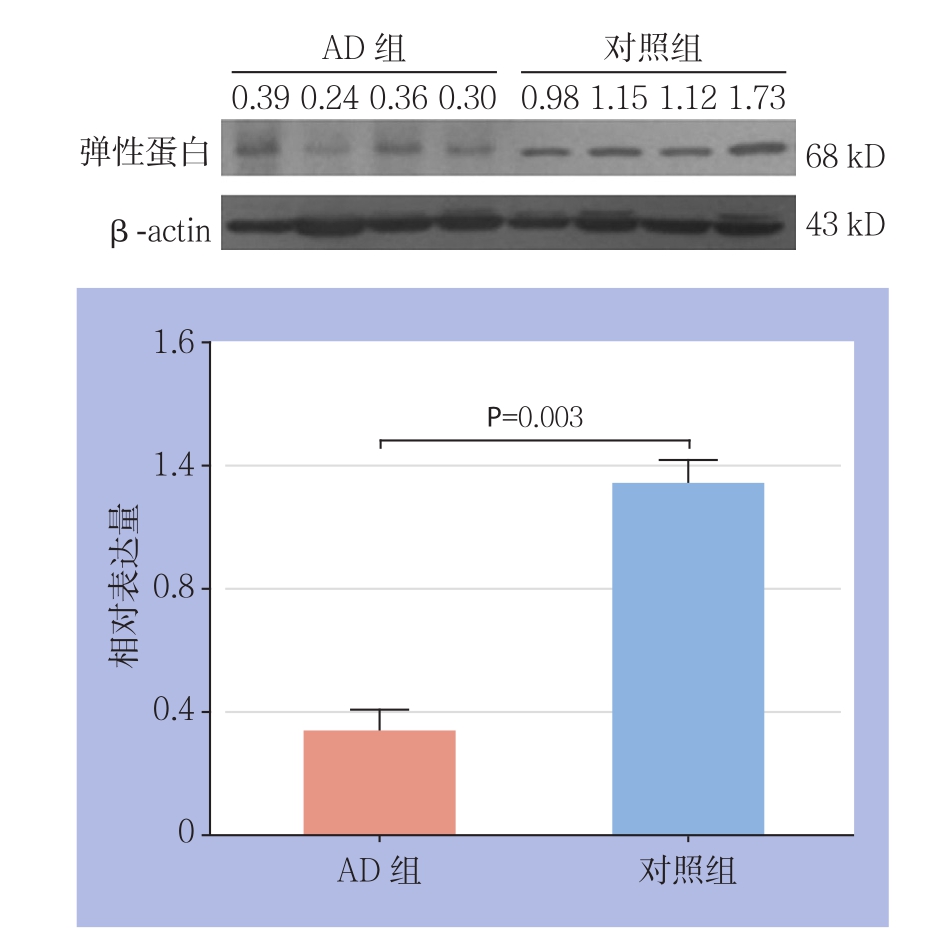
图1 Western blot检测升主动脉管壁中膜层弹性蛋白表达
Figure 1 Western blot analysis of the elastin expressions in the tunica media of the ascending aortas
2.2 弹力纤维表达及形态检测结果
对照组见主动脉壁中膜层结构完整、层次分明,中膜层血管平滑肌细胞排列整齐,弹力纤维排列紧密、有序,弹力板结构完整(图2A)。AD组见主动脉中膜撕裂,其内可见血栓附着;平滑肌细胞明显减少,部分区域成片消失;弹力纤维破碎、断裂、稀释、丢失,排列不规则,弹力板层断裂、丢失,尤其在中膜撕裂处更为明显;中膜外层及外膜层胶原纤维增生(图2B)。IOD值显示AD组为85 762.8±106.2,对照组为164 482.8±161.4,AD组较对照组IOD值明显降低(t=5.902,P<0.001)。
2.3 两组升主动脉中膜层弹性蛋白和弹力纤维表达的相关性
根据弹性蛋白与弹力纤维的(相对)表达量进行双变量直线相关分析,结果显示,AD组和对照组的升主动脉管壁中膜层弹性蛋白与弹力纤维表达均呈明显正相关关系(r=0.953、0.973,均P<0.001)(图3)。
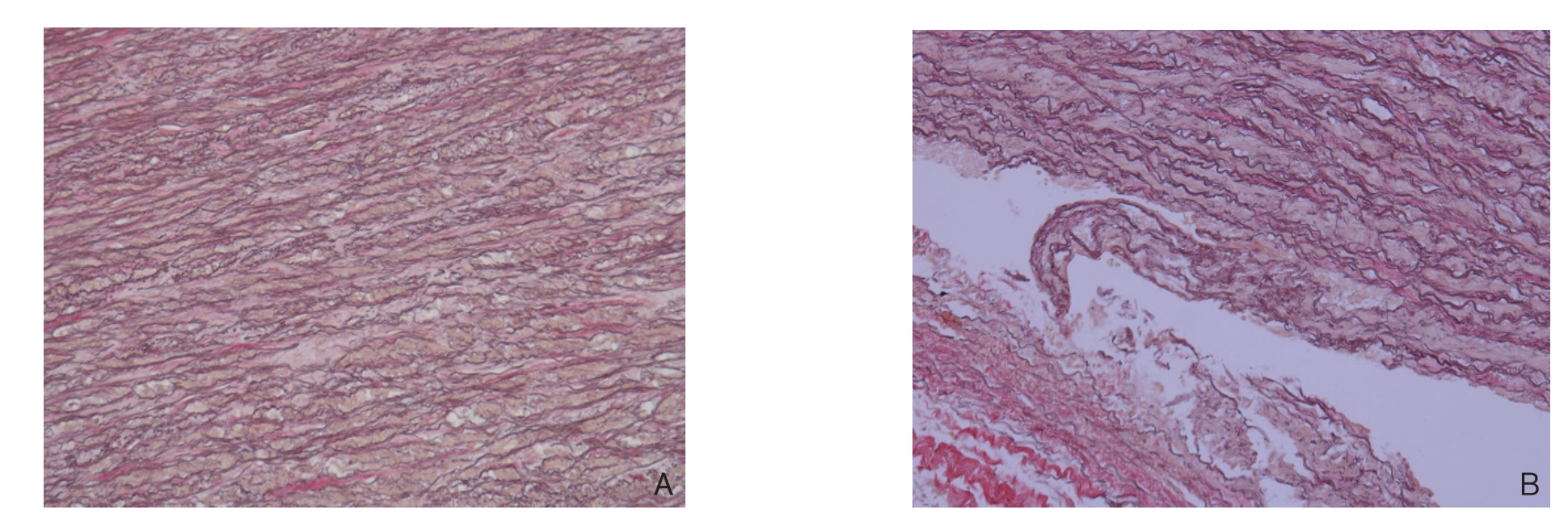
图2 升主动脉管壁EVG染色(×200) A:对照组;B:AD组
Figure 2 EVG staining of the ascending aortic walls (×200) A: Control group; B: AD group
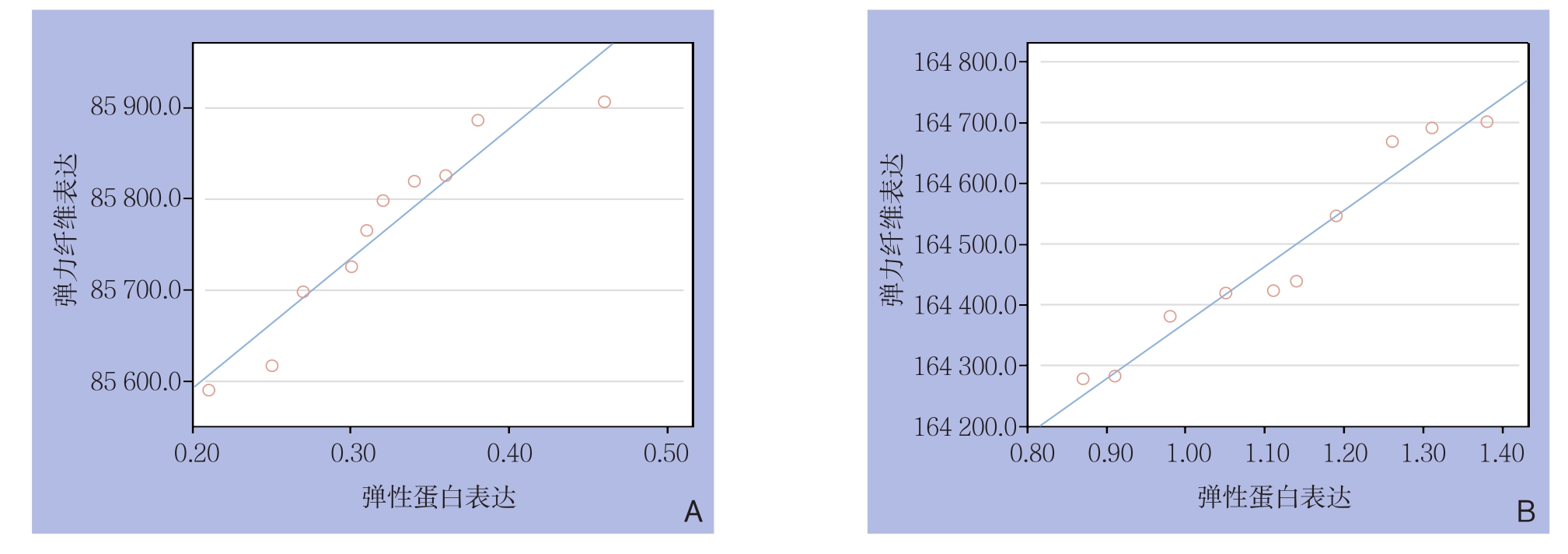
图3 升主动脉中膜层弹性蛋白与弹力纤维表达的相关性分析 A:对照组;B:AD组
Figure 3 Correlation analysis of the elastin and elasticfiber contents in the tunica media of the ascending aortas A: Control group;B: AD group
3 讨 论
AD是一种致死率极高的主动脉急症,其每年发病率约0.5~3/10万,并逐年呈上升趋势,严重威胁人类健康,消耗大量的医学资源和社会财富,因而越来越受到重视,深入研究AD的病因与发病机制具有重大意义[6-8]。但是AD的病因至今尚未完全明了,主动脉壁中层退行性变、遗传性结缔组织病、先天性主动脉畸形、妊娠、医源性因素及外伤等均有报道参与AD的形成[9-11],上述因素可能造成主动脉管壁结构和功能的改变而诱发AD。遗传性疾病如Marfan综合征患者有糖蛋白fibrillin-1的缺陷,而Ehlers-Danlos综合征患者则有Ⅲ型前胶原的合成异常,都导致主动脉壁强度减弱,发生AD。但是我们所见大部分散发性AD患者并没有上述明确的综合征,是否存在主动脉壁结构和性质的改变以及何种因素导致这种改变,有待深入研究。
在主动脉中膜层结构中,弹力纤维与管壁顺应性有关,在外力作用下弹力纤维可伸长70%,是维持主动脉轴向回缩力的主要成份;胶原纤维则与管壁的极限强度有关,伸缩性不及弹力纤维1%。在生理血压条件下弹力纤维是主要的受力纤维,大部分胶原纤维处于功能储备状态,只是在管壁扩张幅度过大时才受力。中膜层由数十层环形排列的弹力层组成,每层弹力层由弹力纤维相互交叉形成网状结构,胶原纤维穿插其中,相邻两薄层间为一层平滑肌细胞。既往研究[12]认为主动脉壁弹力纤维表达或排列的改变可能导致夹层、动脉瘤等主动脉疾病,管壁中层弹力层结构的毁损和缺失是AD特征性病理改变之一[13]。目前对疾病病因的研究已经深入到基因水平,但是生物功能的主要体现或执行者是蛋白质,所以本研究先从弹性蛋白和弹力纤维水平探讨其在AD病因和发病机制中的作用。
3.1 AD时主动脉管壁的弹性蛋白表达
弹力纤维主要由有序排列的无定型核心(amorphous core,AC)和微纤维“框架”在Loxl-1等赖氨酰氧化酶家族成员交联“组装”下,按照一定比例和程序逐级组装而成,合成过程异常精密,涉及弹性蛋白分泌、激活、吸附、聚合、沉积、交联等过程[14-15]。弹性蛋白是无定型核心的主要成份,主要由中膜层血管平滑肌细胞合成。弹性蛋白表达下降可导致多种弹力纤维相关疾病,如盆腔器官脱垂、颅内动脉瘤、年龄相关性黄斑退行性病变等[16-18]。既往有关弹性蛋白在AD发病机制中作用的研究多从弹性蛋白酶、炎症反应等对弹力纤维降解的角度展开[19-20],然而AD时是否存在弹性蛋白合成和表达异常值得关注。本研究显示AD组主动脉中膜层弹性蛋白的表达明显较对照组低,说明弹性蛋白的低表达有可能通过改变主动脉管壁的机械强度,导致AD发生[21]。
3.2 AD时主动脉管壁的弹力纤维表达
弹力纤维是主动脉管壁最重要的纤维,是维持主动脉壁结构和功能的最主要结构成份。Schmitto等[22]研究认为胸主动脉夹层患者升主动脉血管组织中弹力纤维及胶原纤维稀疏、断裂、结构紊乱,伴血管组织细胞凋亡明显增加,血管壁病理性重构。因此,可以推测任何造成造成主动脉中膜弹力纤维损害的因素,均可能诱发AD。本研究通过EVG染色显示:AD组升主动脉中膜层弹力纤维形态和排列不规则,出现弹力纤维破碎、断裂、稀疏、丢失,弹力板断裂、丢失,层状结构受到破坏,弹力板层间相互连接减少,黏附性减弱,从而使主动脉易于发生夹层。结合弹性蛋白的Western blot实验结果,可以推测弹力纤维形态和结构紊乱可能与弹性蛋白的表达下调有关,继而导致主动脉中膜层纤维结构改变,导致AD发生。本研究也显示AD组和对照组的升主动脉中膜层弹性蛋白与弹力纤维表达均呈明显的正相关关系。
当然AD发生是一个复杂的病理过程,弹性蛋白的表达差异仅仅是AD主动脉壁结构、成份改变的一个重要方面,弹性蛋白“组装”成弹力纤维过程中的任何微纤维蛋白、酶类(如Loxl-1)的缺陷都有可能导致AD发生[23],需要进一步行主动脉管壁差异蛋白质组学的研究,以了解是否存在其他更多的重要结构蛋白在AD和正常主动脉之间存在差异表达。
综上所述,根据上述实验结果,可以推知弹性蛋白在主动脉中膜层表达下调,可能影响弹力纤维的合成,从而导致主动脉中膜层薄弱,承受血流张力和剪切力能力下降,可能在AD的发生中起重要作用。而关于弹性蛋白表达改变的分子生物学机制及其在AD发病机制的作用有待进一步深入研究。
参考文献
[1]Tsamis A, Phillippi JA, Koch RG, et al. Extracellular matrix fiber microarchitecture is region-specific in bicuspid aortic valveassociated ascending aortopathy[J]. J Thorac Cardiovasc Surg,2016, 151(6):1718–1728. doi: 10.1016/j.jtcvs.2016.02.019.
[2]Tsamis A, Krawiec JT, Vorp DA. Elastin and collagen fibre microstructure of the human aorta in ageing and disease: a review[J]. J R Soc Interface, 2013, 10(83):20121004. doi: 10.1098/rsif.2012.1004.
[3]Yeo GC, Tarakanova A, Baldock C, et al. Subtle balance of tropoelastin molecular shape and flexibility regulates dynamics and hierarchical assembly[J]. Sci Adv, 2016, 2(2):e1501145. doi:10.1126/sciadv.1501145.
[4]Listijono DR, Pepper JR. Current imaging techniques and potential biomarkers in the diagnosis of acute aortic dissection[J]. JRSM Short Rep, 2012, 3(11):76. doi: 10.1258/shorts.2012.012079.
[5]陈书媛, 张彦宁. EVG 弹力纤维染色方法的改良和效果观察[J].临床和实验医学杂志, 2016, 15(7):716–718. doi:10.3969/j.issn.1671–4695.2016.07.035.Chen SY, Zhang YN. Study on the modification of EVG elastic fiber staining and its results[J]. Journal of Clinical and Experimental Medicine, 2016, 15(7):716–718. doi:10.3969/j.issn.1671–4695.2016.07.035.
[6]Russo CF, Mariscalco G, Santé P. Acute aortic dissection type A: from the past to the present[J]. G Ital Cardiol (Rome), 2016,17(11):908–914. doi: 10.1714/2498.26194.
[7]林长泼, 符伟国. 主动脉夹层的治疗进展[J]. 中国普通外科杂志,2016, 25(6):790–794. doi:10.3978/j.issn.1005–6947.2016.06.002.Lin CP, Fu WG. Advances in treatment of aortic dissection[J].Chinese Journal of General Surgery, 2016, 25(6):790–794.doi:10.3978/j.issn.1005–6947.2016.06.002.
[8]谭孟杰, 张磊, 周建, 等. 炎性反应与主动脉夹层诊断及预后关系的研究进展[J]. 中国普通外科杂志, 2015, 24(6):865–869.doi:10.3978/j.issn.1005–6947.2015.06.020.Tan MJ, Zhang L, Zhou J, e al. Relations of inflammatory reactions with diagnosis and prognosis of aortic dissection: recent progress[J].Chinese Journal of General Surgery, 2015, 24(6):865–869.doi:10.3978/j.issn.1005–6947.2015.06.020.
[9]Zhu JM, Ma WG, Peterss S, et al. Aortic Dissection in Pregnancy:Management Strategy and Outcomes[J]. Ann Thorac Surg, 2017,103(4):1199–1206. doi: 10.1016/j.athoracsur.2016.08.089.
[10]Parve S, Ziganshin BA, Elefteriades JA. Overview of the current knowledge on etiology, natural history and treatment of aortic dissection[J]. J Cardiovasc Surg (Torino), 2017, 58(2):238–251. doi:10.23736/S0021–9509.17.09883–4.
[11]Dziekiewicz M, Witkowski A, Maciąg R, et al. The case of an acute thoracic aorta dissection in the patient with Marphan syndrome[J].Kardiol Pol, 2013, 71(7):738–740. doi: 10.5603/KP.2013.0162.
[12]Yamada H, Sakata N, Wada H, et al. Age-related distensibility and histology of the ascending aorta in elderly patients with acute aortic dissection[J]. J Biomech, 2015, 48(12):3267–3273. doi: 10.1016/j.jbiomech.2015.06.025.
[13]Roberts WC, Vowels TJ, Kitchens BL, et al. Aortic medial elastic fiber loss in acute ascending aortic dissection[J]. Am J Cardiol,2011, 108(11):1639–1644. doi: 10.1016/j.amjcard.2011.09.005.
[14]Heiny M, Shastri VP. Nanofibers of Elastin and Hydrophilic Segmented Polyurethane Solution Blends Show Enhanced Mechanical Properties through Intermolecular Protein-Polymer H Bonding[J]. Biomacromolecules, 2016, 17(4):1312–1320. doi:10.1021/acs.biomac.5b01681.
[15]Schriefl AJ, Schmidt T, Balzani D, et al. Selective enzymatic removal of elastin and collagen from human abdominal aortas:Uniaxial mechanical response and constitutive modeling[J].Acta Biomaterialia, 2015, 17:125–136. doi: 10.1016/j.actbio.2015.01.003.
[16]董晓燕, 张荣, 陈信良. 慢病毒载体介导RNA干扰LOX表达对人阴道壁成纤维细胞弹性蛋白、基质金属蛋白酶2表达的影响[J].同济大学学报: 医学版, 2016, 37(4):19–24.Dong XY, Zhang R, Chen XL. Effect of lentivirus-mediated LOX RNA interference on expression of elastin and matrix metahoproteinase-2 in human vaginal wall fibroblasts[J]. Journal of Tongji University: Medical Science, 2016, 37(4):19–24.
[17]Yang S, Wang T, You C, et al. Association of polymorphisms in the elastin gene with sporadic ruptured intracranial aneurysms and unruptured intracranial aneurysms in Chinese patients[J]. Int J Neurosci, 2013, 123(7):454–458. doi:10.3109/00207454.2013.763803.
[18]Park CY, Marando CM, Liao JA, et al. Details of the Collagen and Elastin Architecture in the Human Limbal Conjunctiva, Tenon's Capsule and Sclera Revealed by Two-Photon Excited Fluorescence Microscopy[J]. Invest Ophthalmol Vis Sci, 2016, 57(13):5602–5610. doi: 10.1167/iovs.16–19706.
[19]Li Z, Zhou C, Tan L, et al. Variants of genes encoding collagens and matrix metalloproteinase system increased the risk of aortic dissection[J]. Sci China Life Sci, 2017, 60(1):57–65. doi: 10.1007/s11427–016–0333–3.
[20]Cai YL, Wang ZW. The expression and significance of IL-6, IFN-γ,SM22α, and MMP-2 in rat model of aortic dissection[J]. Eur Rev Med Pharmacol Sci, 2017, 21(3):560–568.
[21]Zheng X, Ren J. Effects of the three-dimensional residual stresses on the mechanical properties of arterial walls[J]. J Theor Biol, 2016,393:118–126. doi: 10.1016/j.jtbi.2015.12.015.
[22]Schmitto JD, Popov AF, Coskun KO, et al. Morphological investigations of type A aortic dissection[J]. Ann Thorac Cardiovasc Surg, 2010, 16(5):331–334.
[23]Di Gregoli K, Mohamad Anuar NN, Bianco R, et al. MicroRNA-181b Controls Atherosclerosis and Aneurysms Through Regulation of TIMP-3 and Elastin[J]. Circ Res, 2017, 120(1):49–65. doi:10.1161/CIRCRESAHA.116.309321.
