肝脏是腹部最大的实质性脏器,因其组织脆弱,面积较大,在腹部外伤中发生率位于第2位,肝脏血管丰富,且多为多发伤,损伤后病死率高。肝外伤的治疗标准不统一,以往多数认为肝外伤出血一确诊应立即手术探查,研究[1]表明肝外伤手术治疗并发症高达38%,病死率达8%~14%,且肝外伤行手术时常需游离肝脏相关韧带,因此破坏肝脏伤口凝血块,增加出血量及感染机会,给伤者带来更多的创伤及麻醉打击。现在随着腹部影像学技术的发展与应用,创伤病理生理学的深入研究,血管介入技术、材料及介入医生的技能的发展,肝外伤的治疗观念发生了改变,近80%肝外伤患者首选非手术治疗[2],在非手术治疗中血管介入动脉栓塞术具有重要的作用,欧美等发达国家80%~90%的肝外伤出血患者都采用肝动脉栓塞术(HAE)[3],可有效的控制肝外伤动脉出血,成功率达82%~100%,且并发症少[4]。现对我院19例III、IV级肝外伤首选行肝动脉介入栓塞治疗与手术治疗进行回顾性分析对比比较,旨在探讨其临床意义。
1 资料与方法
1.1 一般资料
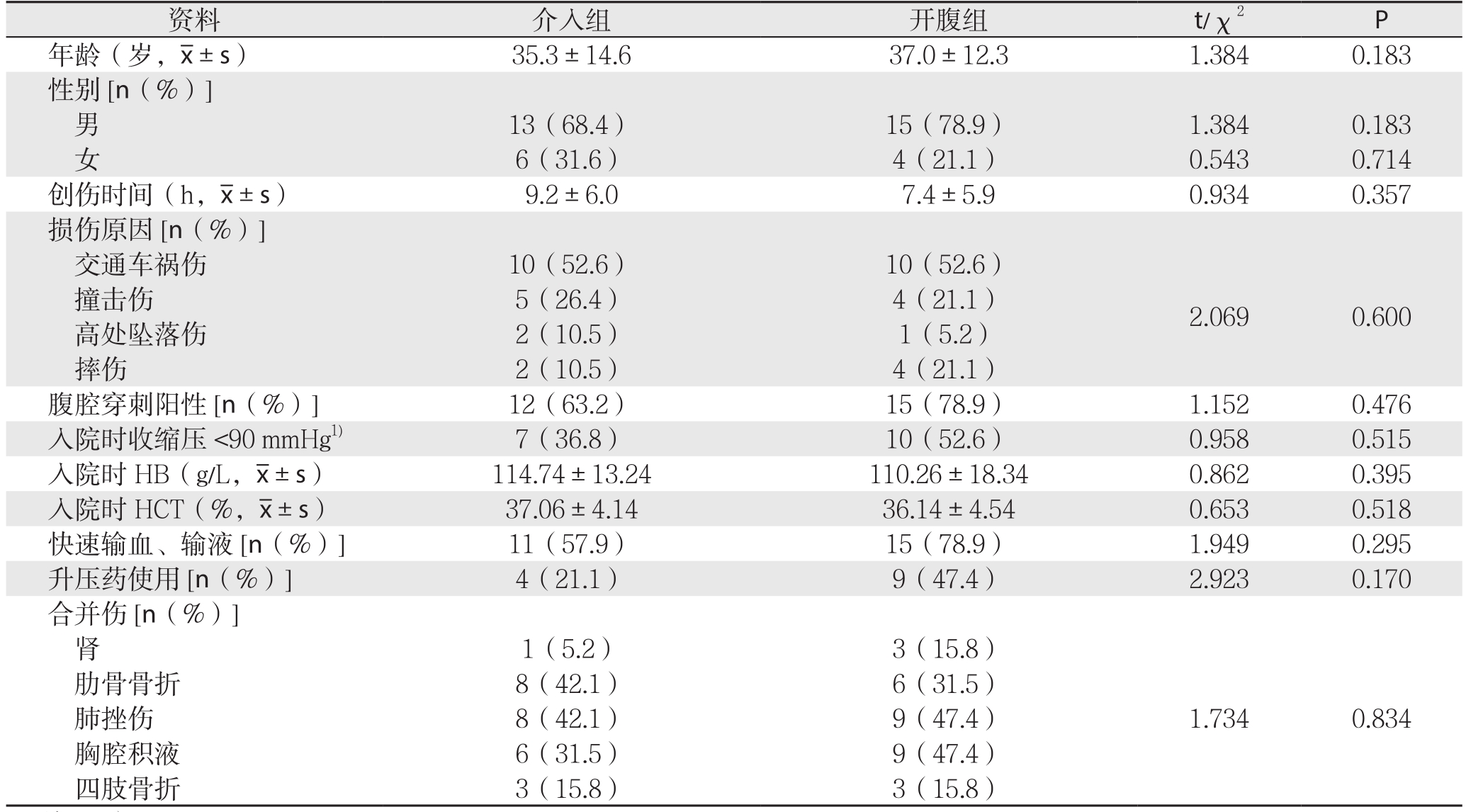
福州总医院2006年1月—2016年10月收治的208例肝外伤患者中有19例III、IV级肝外伤行肝动脉介入栓塞治疗,按以下纳入标准选取31例III、IV级肝外伤行手术治疗的患者,并采用损伤等级相同、年龄相近(最大相差13岁)、入院时间相近(最长相差1年零5个月)配对的方法配成19对患者临床资料进行回顾性分析。病例纳入标准:⑴ 血流动力学稳定,或经积极抗休克、输血、输液后血流动力学稳定;⑵ 经CT诊断Becker分级[5]为III、IV级肝外伤;⑶ 闭合性肝外伤;⑷ 患者及家属自愿签署了知情同意书。病例排除标准:⑴ 经积极抗休克、输血、输液后血流动力学仍不稳定;⑵ 腹部其他脏器严重损伤需开腹者,如空腔脏器损伤;⑶ 肝静脉或肝后下腔静脉损伤,引起腹腔大量积血者;⑷ 合并肝脏自身疾病(如肝硬化、肝癌破裂、肝血管瘤破裂等)以及其它可能;纳入患者均为急诊入院,均有明确的外伤史,均有腹痛表现。患者受伤至入院时间为0.5~24 h,入院时伴不同程度休克17例,腹腔穿刺抽出不凝血27例。纳入患者按入院后首选治疗方法不同分为两组:采用选择性肝动脉介入栓塞治疗组(介入组)19例,其中男13例,女6例;年龄15~68岁,平均年龄35.3岁。入院均通过CT明确诊断,行CT影像学Becker分级,Becker等[5]研究显示CT的诊断准确性高、并认为该分级标准能很好的指导治疗方法的选择和监测并发症的发生,与ASST分级一致性好,故按Becker分级III级17例,Ⅳ级2例。采用开腹探查手术治疗(开腹组)19例,其中男15例,女4例;年龄15~55岁,平均年龄37.0岁。入院完善相关后,急诊行剖腹探查手术治疗,术中按美国创伤外科协会(AAST)[6]肝损伤分级:Ⅲ级17例,Ⅳ级2例。两组在年龄、性别、受伤至就诊时间、外伤原因,入院时血压、血红蛋白(HB)、血细胞压积(HCT)、合并伤等方面比较,差异均无统计学意义(均P>0.05),具有可比性(表1)。
表1 介入组与开腹组患的一般资料比较(n=19)
Table 1 Comparison of general data between patients in intervention group and laparotomy group (n=19)
注:1)1 mmHg=0.133 kPa
Note: 1) 1 mmHg=0.133 kPa
资料 介入组 开腹组 t/χ2 P年龄(岁, ±s) 35.3±14.6 37.0±12.3 1.384 0.183性别[n(%)]男13(68.4) 15(78.9) 1.384 0.183女6(31.6) 4(21.1) 0.543 0.714创伤时间(h,
±s) 35.3±14.6 37.0±12.3 1.384 0.183性别[n(%)]男13(68.4) 15(78.9) 1.384 0.183女6(31.6) 4(21.1) 0.543 0.714创伤时间(h, ±s) 9.2±6.0 7.4±5.9 0.934 0.357损伤原因[n(%)]交通车祸伤 10(52.6) 10(52.6)2.069 0.600撞击伤 5(26.4) 4(21.1)高处坠落伤 2(10.5) 1(5.2)摔伤 2(10.5) 4(21.1)腹腔穿刺阳性[n(%)] 12(63.2) 15(78.9) 1.152 0.476入院时收缩压<90 mmHg1) 7(36.8) 10(52.6) 0.958 0.515入院时 HB(g/L,
±s) 9.2±6.0 7.4±5.9 0.934 0.357损伤原因[n(%)]交通车祸伤 10(52.6) 10(52.6)2.069 0.600撞击伤 5(26.4) 4(21.1)高处坠落伤 2(10.5) 1(5.2)摔伤 2(10.5) 4(21.1)腹腔穿刺阳性[n(%)] 12(63.2) 15(78.9) 1.152 0.476入院时收缩压<90 mmHg1) 7(36.8) 10(52.6) 0.958 0.515入院时 HB(g/L, ±s) 114.74±13.24 110.26±18.34 0.862 0.395入院时 HCT(%,
±s) 114.74±13.24 110.26±18.34 0.862 0.395入院时 HCT(%, ±s) 37.06±4.14 36.14±4.54 0.653 0.518快速输血、输液[n(%)] 11(57.9) 15(78.9) 1.949 0.295升压药使用[n(%)] 4(21.1) 9(47.4) 2.923 0.170合并伤[n(%)]肾1(5.2) 3(15.8)1.734 0.834肋骨骨折 8(42.1) 6(31.5)肺挫伤 8(42.1) 9(47.4)胸腔积液 6(31.5) 9(47.4)四肢骨折 3(15.8) 3(15.8)
±s) 37.06±4.14 36.14±4.54 0.653 0.518快速输血、输液[n(%)] 11(57.9) 15(78.9) 1.949 0.295升压药使用[n(%)] 4(21.1) 9(47.4) 2.923 0.170合并伤[n(%)]肾1(5.2) 3(15.8)1.734 0.834肋骨骨折 8(42.1) 6(31.5)肺挫伤 8(42.1) 9(47.4)胸腔积液 6(31.5) 9(47.4)四肢骨折 3(15.8) 3(15.8)
1.2 治疗方法
1.2.1 介入组 入院后详细问病史,体格检查,明确致伤因素,心电监护,建立静脉通道,备输血、止血、补液、扩容治疗,急抽血,对于合并休克者积极抗休克治疗,必要时予以血管活性药物使用,完善床边彩超及CT检查,评估病情,对生命体征平稳、或经积极抗休克、输血、输液后血流动力学稳定、CT示肝包膜下血肿、肝实质裂伤深度浅、征得患者及家属知情同意后术前均行CTA检查后再行肝动脉造影并栓塞治疗。操作方法在局麻下采用Seldinger穿刺法选择右侧股动脉穿刺插管,将5 F Cobra导管超选择至腹腔干动脉,行DSA造影(碘佛醇,30 mL,6 mL/s),判断有无肝总动脉出血,后导管置于肝固有动脉内,造影观察动脉期、门静脉期,确定肝动脉损伤的部位及程度,必要时再行肠系膜上动脉造影并延迟至静脉期,观察门静脉有无损伤情况,然后依据不同的造影表现选择相应的栓塞材料。一般的靶血管常用明胶海绵碎块及细条或PVA(聚乙烯醇颗粒栓塞剂)颗粒(500 µm),较粗的血管则采用适当直径的弹簧圈。栓塞成功后10~20 min造影复查,原异常血管染色未见显示,未见对比剂溢出,证实栓塞止血效果后,常规拔管,穿刺点加压包扎,患者安返病房。
1.2.2 开腹组 和介入组一样明确外伤,建立血管通道输血、补液、抗休克、止血,完善相关检查床边彩超及CT检查后,告知患者及家属病情及可行的治疗方案,在征得患者及家属知情同意后在全麻下给予剖腹探查术。具体术式根据术中探查而定:本组中单纯清创缝合术4例,15例肝组织毁损伤或边缘肝叶裂伤行部分肝切除术;依据彻底清创止血、消灭死腔、缝合创缘、充分引流等原则,并注意全面仔细探查,避免遗漏腹腔内其他脏器损伤。
1.3 统计学处理
对患者资料数据用EXCEL 2003进行整理,采用SPSS 19.0统计软件包进行统计学分析。计数资料组间比较采用χ2检验或Fisher精确概率法;等级资料采用Wilcoxon U检验;近似正态分布的计量资料以均数±标准差( ±s)表示,呈偏态分布的计量资料以中位数(第一四分位数,第三四分位数)[M(Q25,Q75)]表示,组间比较采用t检验、配对t检验、Wilcoxon U检验。P<0.05为差异有统计学意义。
±s)表示,呈偏态分布的计量资料以中位数(第一四分位数,第三四分位数)[M(Q25,Q75)]表示,组间比较采用t检验、配对t检验、Wilcoxon U检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者手术情况及相关指标比较
介入组介入成功率100%(19/19),治疗成功率94.7%(18/19);开腹组顺利完成手术操作治疗。操作中无意外损伤,术后无院内死亡。两组患者输血例数比较,无统计学差异(P>0.05);介入组手术时间、禁食时间、住院时间、住院费用均明显低于开腹组,差异均有统计学意义(均P<0.05)(表2)。
表2 两组患者手术相关指标及术后一般情况比较(n=19)
Table 2 Comparison of the surgical variables and postoperative conditions between the two groups of patients (n=19)
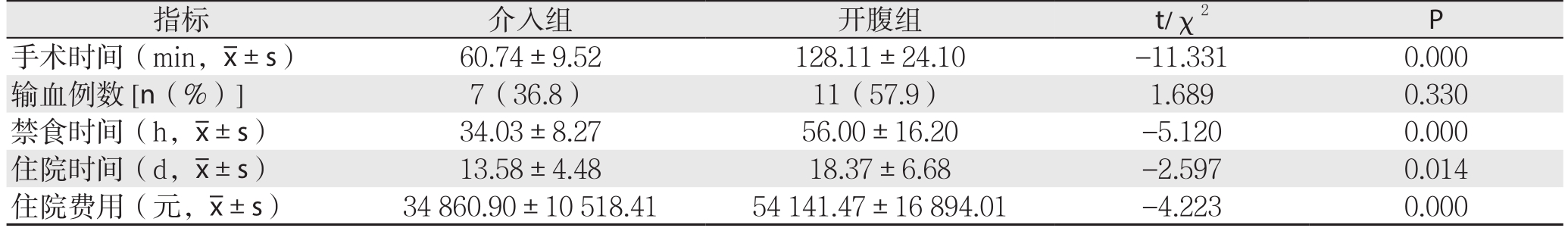
指标 介入组 开腹组 t/χ2 P手术时间(min, ±s) 60.74±9.52 128.11±24.10 -11.331 0.000输血例数[n(%)] 7(36.8) 11(57.9) 1.689 0.330禁食时间(h,
±s) 60.74±9.52 128.11±24.10 -11.331 0.000输血例数[n(%)] 7(36.8) 11(57.9) 1.689 0.330禁食时间(h, ±s) 34.03±8.27 56.00±16.20 -5.120 0.000住院时间(d,
±s) 34.03±8.27 56.00±16.20 -5.120 0.000住院时间(d, ±s) 13.58±4.48 18.37±6.68 -2.597 0.014住院费用(元,
±s) 13.58±4.48 18.37±6.68 -2.597 0.014住院费用(元, ±s) 34860.90±10518.41 54141.47±16894.01 -4.223 0.000
±s) 34860.90±10518.41 54141.47±16894.01 -4.223 0.000
2.2 两组患者手术前后红细胞计数(RBC)及血清生化指标的变化
两组患者术前血清RBC、HB、谷丙转氨酶(ALT)、谷草转氨酶(AST)及术后血清RBC、HB比较差异均无统计学意义(均P>0.05);开腹组术前血清肌酐(C r)水平高于介入组(P<0.05),但因Cr均值均<115 µmol/L,达不到肾功能不全诊断标准,无实际临床意义。术后第1天,两组患者RBC、HB均无统计学差异(均P>0.05);介入组血清ALT、AST、Cr水平均明显低于开腹组,且ALT回复正常时间明显短于开腹组(均P<0.05)(表3)。
表3 两组手术前后RBC血清生化指标的变化(n=19)
Table 3 Changes in RBC and the serum parameters of the two groups of patients before and after operation (n=19)
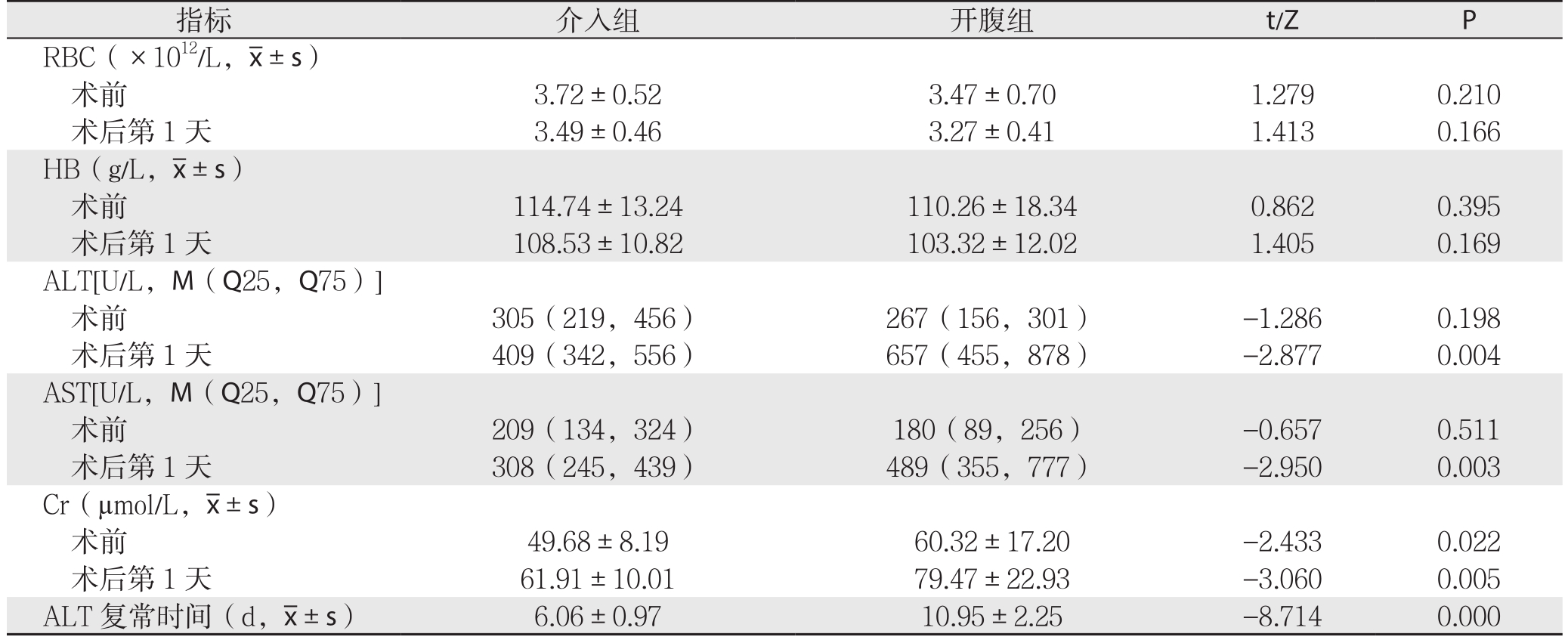
指标 介入组 开腹组 t/Z P RBC(×1012/L, ±s)术前 3.72±0.52 3.47±0.70 1.279 0.210术后第1天 3.49±0.46 3.27±0.41 1.413 0.166 HB(g/L,
±s)术前 3.72±0.52 3.47±0.70 1.279 0.210术后第1天 3.49±0.46 3.27±0.41 1.413 0.166 HB(g/L, ±s)术前 114.74±13.24 110.26±18.34 0.862 0.395术后第1天 108.53±10.82 103.32±12.02 1.405 0.169 ALT[U/L,M(Q25,Q75)]术前 305(219,456) 267(156,301) -1.286 0.198术后第1天 409(342,556) 657(455,878) -2.877 0.004 AST[U/L,M(Q25,Q75)]术前 209(134,324) 180(89,256) -0.657 0.511术后第1天 308(245,439) 489(355,777) -2.950 0.003 Cr(µmol/L,
±s)术前 114.74±13.24 110.26±18.34 0.862 0.395术后第1天 108.53±10.82 103.32±12.02 1.405 0.169 ALT[U/L,M(Q25,Q75)]术前 305(219,456) 267(156,301) -1.286 0.198术后第1天 409(342,556) 657(455,878) -2.877 0.004 AST[U/L,M(Q25,Q75)]术前 209(134,324) 180(89,256) -0.657 0.511术后第1天 308(245,439) 489(355,777) -2.950 0.003 Cr(µmol/L, ±s)术前 49.68±8.19 60.32±17.20 -2.433 0.022术后第1天 61.91±10.01 79.47±22.93 -3.060 0.005 ALT 复常时间(d,
±s)术前 49.68±8.19 60.32±17.20 -2.433 0.022术后第1天 61.91±10.01 79.47±22.93 -3.060 0.005 ALT 复常时间(d, ±s) 6.06±0.97 10.95±2.25 -8.714 0.000
±s) 6.06±0.97 10.95±2.25 -8.714 0.000
2.3 两组术后并发症及预后
介入组患者术后1例监测血流动力学不稳定,行床边彩超提示腹腔积液增多,予介入栓塞术后5.5 h急诊行剖腹探查术,术中见肝右叶栓塞后肝组织水肿明显,肝右后叶成粉粹性碎裂伴右肝静脉损伤破裂出血,予局部压迫后清创切除部分坏死肝组织暴露肝静脉出血点,5-0普利林线缝合静脉破口,直至观察未再出血后,手术结束,术后恢复可好转出院;另1例介入术后1个月出现腹痛、发热不适,返院就诊行彩超及CT示右肝脓肿形成,予住院行肝脓肿穿刺引流并抗感染治疗后好转出院。开腹组术后腹腔引流管淡红色液体,引流量>50 mL/d,24 h血色素下降10 g/L,考虑术后腹腔出血5例,均经药物止血保守治疗好转;胆汁漏1例,予B超引导穿刺引流、控制饮食、加强抗感染后好转;肺部感染伴胸腔积液3例,腹腔感染(膈下)1例,切口液化1例均予保守药物治疗后好转;无二次开腹手术及死亡病例。介入组并发症发生率明显低于开腹组[10.5%(2/19)vs. 57.9%(11/19)],差异有统计学意义(P<0.05)。
3 讨 论
创伤性肝破裂的治疗手段多种,包括非手术治疗和手术治疗,手术治疗包括肝缝合修补术、肝切除术、纱布填塞、肝脏网片包裹术、选择性肝动脉结扎术、肝移植术、微创治疗(微波凝固治疗、腹腔镜治疗、介入治疗)等;但其治疗标准不统一,以往多数认为肝外伤出血一确诊应立即手术探查,术中对于无法完整切除且较大面积粉碎性肝破裂只能行纱布填塞,术后4~5 d再取出纱布,术后可能出现脓毒症、胆瘘和继发性出血等严重并发症,研究[1]表明肝外伤手术治疗并发症高达38%,且病死率达8%~14%,且肝外伤行手术时常需游离肝脏相关韧带,因此破坏肝脏伤口凝血块,增加出血量及感染机会,给伤者带来更多的创伤及麻醉打击。迅速控制出血是肝外伤治疗的关键,但多数患者通常因出血部位不明、责任血管不明确或存在低血容量休克,从而影响术中及时准确的找到出血部位及责任血管,因此手术探查具有较大的盲目性,术中在探查的同时可能会带来医源性的副损伤。另外因破裂断面血管、胆管回缩,结扎不确切,存在术后再次出血的风险。随着微创技术的不断发展,微创观念逐步深入外科临床。血管介入技术(造影与栓塞)已成为闭合性肝外伤的安全和有效的治疗手段[7-8],能准确判断责任血管,又可减少输血和与肝脏相关的手术[9]。Letoublon等[10]报道9年期间(1999—2008年)治疗肝脏闭合性损伤183例的经验,其中对23例行选择性肝动脉栓塞术,II、III、IV级损伤分别占3%、38%、59%。栓塞技术成功率100%。Kanakis等[11]报道V级肝损伤行介入栓塞成功的案例;Hagiwara等[12]的研究,所有血流动力学稳定的III级或更高肝损伤患者行血管造影,其中近一半的III级受伤和几乎所有IV级受伤都显示存在活动出血,行血管栓塞控制肝损伤后出血有效率高达83%,有些患者需要重复血管造影,表明闭合性肝外伤伴动脉出血可以完全由肝动脉栓塞止血。Poletti等[13]发现CT检查提示肝损伤级别在AAST分级为III级或更高,证据显示伴有动脉损伤(造影剂外溢)的高危患者,这些征象的患者行肝血管造影栓塞以限制持续性或延迟出血或其他延迟并发症必是受益的;Asensio等[14]则认为外伤性肝破裂出血的患者应尽早施行血管造影及动脉栓塞,这样可降低病死率,尤其对损伤程度为V级的患者;Mohr等[7]报告36例重度肝损伤使用经动脉栓塞治疗结果,其中11例CT确诊后即刻应用经动脉栓塞治疗(早期),而15例是在手术后或住院期间约伤后2周应用经动脉栓塞治疗(晚期),结果发现早期应用动脉栓塞治疗对重度肝损伤是一项安全有效的治疗方法,经动脉栓塞治疗外伤性肝破裂出血与外科手术相比具有操作简单、止血及时、创伤小的优点,并避免了开腹手术和术后并发症。
本研究结果显示:19例III、IV级肝外伤早期首选肝动脉介入栓塞治疗,介入成功率100%(19/19),治疗成功率94.7%(18/19),并发症发生率10.5%(2/19),病死率0%(0/19),且与开腹手术探查治疗组对比,术后血清ALT、AST比较差异有统计学意义(均P<0.05)且两组术后ALT恢复时间组间比较差异有统计学意义(P<0.05),其统计值为(6.06±0.97)d、(10.95±2.25)d(t=-8.714,P<0.05),故动脉介入治疗创伤小,术后肝功能恢复快;两组手术时间、术后禁食时间、住院天数、住院费用比较差异均有统计学意义(P<0.05),介入组比开腹手术治疗组手术时间短、术后早期恢复饮食、住院天数短、住院费用低,故笔者认为:肝动脉栓塞对III、IV级肝外伤出血治疗是一种安全、有效、可行的治疗方式,相对于开腹手术治疗可以减少创伤、快速恢复、减少住院天数及住院费用,建议对于血流动力学稳定或经积极抗休克、输血、输液后血流动力学稳定的III、IV级肝外伤出血可选择介入造影栓塞治疗,早期诊断、明确责任血管并同时及时干预治疗,一举两得,不必像单纯药物保守治疗期间盲目观察延误病情而造成可能的不良后果。若合并有肝静脉损伤时介入治疗与手术治疗结合使用也可获得满意效果[12]。本研究中1例因肝静脉损伤出血导致介入术后中转开腹探查手术治疗,先介入栓塞后控制动脉出血,在联合手术修补肝静脉,避免术中出血量大,无法及时找出出血点和有效控制出血。
并发症是严重肝外伤不可避免的,随着肝外伤等级的加重并发症也会随之增多,评价肝动脉栓塞的疗效就得评估栓塞术后并发症的发病率。有临床意义并发症发生率约10%~20%[15],包括严重缺血(肝坏死、胆囊梗死)、肝脓肿、胆瘘及延迟性肝出血等。需要外科干预的并发症较少。Misselbeck等[16](美国多中心资料)报道8年期间(1997—2005年)诊疗707例肝脏外伤的经验,其中79例做血管造影术,40%(31例)需要做栓塞治疗。栓塞相关并发症发生率为11%(9例次):肝脏坏死19.4%、胆囊梗死19.4%、肝脓肿12.9%、胆瘘3.2%、肝衰竭3.2%。本研究结果显示:肝介入栓塞后并发症发生率(2/19,10.5%),与国外报道相近,与手术治疗组比较(11/19,54.89%)明显降低(P<0.05),因此,笔者认为:介入栓塞治疗肝外伤相对于手术治疗有其明显的优势。
综上所述,选择性肝动脉介入栓塞术治疗III、IV级肝外伤是一种安全、有效的方法,建议对于血流动力学稳定或经积极抗休克、输血、输液后血流动力学稳定的III、IV级肝外伤出血可选择介入造影栓塞治疗,早期诊断、明确责任血管并同时及时栓塞止血治疗。
参考文献
[1] 孙华朋, 张娜, 王敬忠, 等. 闭合性肝外伤超选择性血管造影及栓塞治疗的临床探讨[J]. 临床急诊杂志, 2012, 13(06):423–424.Sun HP, Zhang N, Wang JZ, et al. Application of super-selective hepatic artery angiography and embolization for diagnosis and treatment of non-penetrating hepatic trauma[J]. Journal of Clinical Emergency Call 2012, 13(06):423–424.
[2] Carrillo EH, Platz A, Miller FB, et al. Non-operative management of blunt hepatic trauma[J]. Br J Surg, 1998, 85(4):461–468.
[3] 孙亦晖, 金一琦, 吴浩荣, 等. 介入疗法在严重肝破裂术后再出血的应用[J]. 肝胆胰外科杂志, 2005, 17(2):132–133.Sun YH, Jin YQ, Wu HR, et al. Application of interventional therapy in postoperative rebleeding of severe liver lacerations[J].Journal of Hepatopancreatobiliary Surgery, 2005, 17(2):132–133.
[4] Monin V, Sengel C, Thony F, et al. Place of arterial embolization in severe blunt hepatic trauma: a multidisciplinary approach[J].Cardiovasc Intervent Radiol, 2008, 31(5):875–882. doi: 10.1007/s00270–007–9277–1.
[5] Becker CD, Metha G, Terrier F. Blunt abdominal trauma in adults:role of CT in the diagnosis and management of visceral injuries.Part 1: liver and spleen[J]. Eur Radiol, 1998, 8(4):553–562.
[6] Moore EE, Cogbill TH, Jurkovich GJ, et al. Organ injury scaling:spleen andliver(1994 revision)[J]. J Trauma,1995, 38(3):323–324.
[7] Mohr AM, Lavery RF, Barone A, et al. Angiographic embolization for liver injuries: low mortality, high morbidity[J]. J Trauma, 2003,55(6):1077–1081.
[8] Greco L, Francioso G, Pratichizzo A, et al. Arterial embolization in the treatment of severe blunt hepatic trauma[J].Hepatogastroenterology, 2003, 50(51):746–749.
[9] Wahl WL, Ahrns KS, Brandt MM, et al . The need for early angiographic embolization in blunt liver injuries[J]. J Trauma, 2002,52(6):1097–1101.
[10] Letoublon C, Morra I, Chen Y, et al. Hepatic arterial embolization in the management of blunt hepatic trauma: indications and complications[J]. J Trauma, 2011, 70(5):1032–1036. doi: 10.1097/TA.0b013e31820e7ca1.
[11] Kanakis MA, Thomas T, Martinakis VG, et al. Successful management of severe blunt hepatic trauma by angiographic embolization[J]. Updates Surg, 2012, 64(4):303–306. doi: 10.1007/s13304–011–0122–3.
[12] Hagiwara A, Murata A, Matsuda T, et al. The efficacy and limitations of transarterial embolization for severe hepatic injury[J].J Trauma, 2002, 52(6):1091–1096.
[13] Poletti PA, Mirvis SE, Shanmuganathan K, et al. CT criteria for management of blunt liver trauma: correlation with angiographic and surgicalfindings[J]. Radiology, 2000, 216(2):418–427.
[14] Asensio JA, Roldán G, Petrone P, et al. Operative management and outcomes in 103 AAST-OIS grades IV and V complex hepatic injuries: trauma surgeons still need to operate, but angioembolization helps[J]. J Trauma, 2003, 54(4):647–653.
[15] 常中飞, 李强, 刘凤永, 等. 血管内介入治疗肝脏破裂出血[J]. 中华介入放射学电子杂志, 2015, 3(2):95–99. doi:10.3877/cma.j.issn.2095–5782.2015.02.011.Chang ZF, Li Q, Liu FY, et al. Endovascular interventional therapy for liver lacerations[J]. Chinese Journal of Interventional Radiology:Electronic Edition, 2015, 3(2):95–99. doi:10.3877/cma.j.issn.2095–5782.2015.02.011.
[16] Misselbeck TS, Teicher EJ, Cipolle MD, et al. Hepatic angioembolization in trauma patients: indications and complications[J]. J Trauma, 2009, 67(4):769–773. doi: 10.1097/TA.0b013e3181b5ce7f.
