肝细胞癌是原发性肝癌的常见类型,是人类常见恶性肿瘤之一。该病发病率较高多见于男性,且病死率较高,在恶性肿瘤死亡中居第2位,严重危及患者生命安全[1]。而对于该病的发病原因,临床资料[2]显示,当患者伴有HBV 感染会加速病情恶化。目前,对于肝细胞癌临床上多采用肝切除术进行根治性的治疗,能够有效控制肿瘤复发[3]。但是外科手术并发症较多,手术风险较大。而关于手术风险的危险因素,相关报道较多,肝功能恢复、并发症发生率、术中出血量、HBV-DNA载量等均对手术成功率以及患者术后恢复造成一定的影响[4]。随着对乙肝病毒血清学研究的不断深入,HBV-DNA载量的变化所引起的生物学改变,以及对手术风险造成的影响越来越受到广泛关注。为深入研究HBV-DNA载量与手术风险的关系,本研究特选取86例肝细胞癌患者临床资料进行分析,旨在提高临床医生对HBV-DNA载量的认识,为肝细胞癌手术治疗提供一定的参考价值。
1 资料与方法
1.1 临床资料
经本院伦理委员会批准同意,回顾性分析本院2013年7月—2015年7月收治的86例行手术治疗的肝细胞癌患者的临床资料,根据术前HBVDNA载量将患者分为低复制组(40例)和高复制组(46例),其中低复制组男26例,女14例;高复制组男31例,女15例。两组患者临床资料在性别、年龄、肝功能分级、肿瘤直径、肿瘤分级、肝细胞癌分级、手术切除方式比较,差异无统计学意义(P>0.05)(表1)。
表1 两组患者临床资料对比
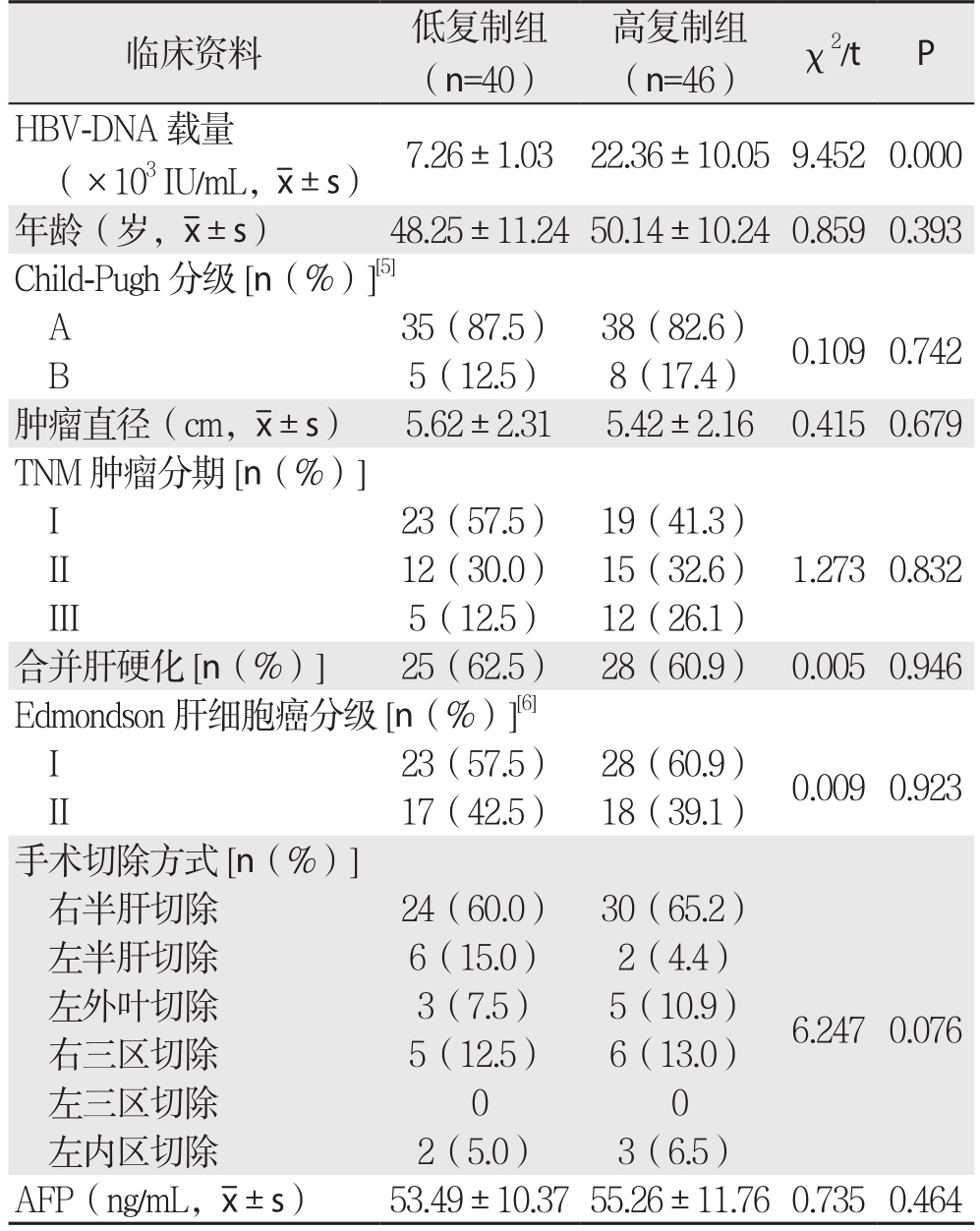
临床资料 低复制组(n=40)高复制组(n=46) χ2/t P HBV-DNA载量(×103 IU/mL, ±s) 7.26±1.03 22.36±10.059.4520.000年龄(岁,
±s) 7.26±1.03 22.36±10.059.4520.000年龄(岁, ±s) 48.25±11.2450.14±10.240.8590.393 Child-Pugh分级[n(%)][5]A 35(87.5) 38(82.6) 0.1090.742 B 5(12.5) 8(17.4)肿瘤直径(cm,
±s) 48.25±11.2450.14±10.240.8590.393 Child-Pugh分级[n(%)][5]A 35(87.5) 38(82.6) 0.1090.742 B 5(12.5) 8(17.4)肿瘤直径(cm, ±s) 5.62±2.31 5.42±2.16 0.4150.679 TNM肿瘤分期[n(%)]I 23(57.5) 19(41.3)II 12(30.0) 15(32.6) 1.2730.832 III 5(12.5) 12(26.1)合并肝硬化[n(%)] 25(62.5) 28(60.9) 0.0050.946 Edmondson肝细胞癌分级[n(%)][6]I 23(57.5) 28(60.9) 0.0090.923 II 17(42.5) 18(39.1)手术切除方式[n(%)]右半肝切除 24(60.0) 30(65.2)左半肝切除 6(15.0) 2(4.4)左外叶切除 3(7.5) 5(10.9)右三区切除 5(12.5) 6(13.0)左三区切除 0 0左内区切除 2(5.0) 3(6.5)6.2470.076 AFP(ng/mL,
±s) 5.62±2.31 5.42±2.16 0.4150.679 TNM肿瘤分期[n(%)]I 23(57.5) 19(41.3)II 12(30.0) 15(32.6) 1.2730.832 III 5(12.5) 12(26.1)合并肝硬化[n(%)] 25(62.5) 28(60.9) 0.0050.946 Edmondson肝细胞癌分级[n(%)][6]I 23(57.5) 28(60.9) 0.0090.923 II 17(42.5) 18(39.1)手术切除方式[n(%)]右半肝切除 24(60.0) 30(65.2)左半肝切除 6(15.0) 2(4.4)左外叶切除 3(7.5) 5(10.9)右三区切除 5(12.5) 6(13.0)左三区切除 0 0左内区切除 2(5.0) 3(6.5)6.2470.076 AFP(ng/mL, ±s) 53.49±10.3755.26±11.760.7350.464
±s) 53.49±10.3755.26±11.760.7350.464
1.2 纳入标准与排除标准
纳入标准:⑴ 符合《原发性肝癌诊疗规范》[7]中关于肝细胞癌的诊断标准,且行肝切除术;⑵ 无黄疸、腹水、远处多发转移等手术禁忌证,肝细胞癌分级为I-II级;⑶ HBsAg阳性且未合并HAV、HCV等其他病毒性肝炎。排除标准:⑴ 术前合并严重系统性疾病;⑵ 合并胃肠道肿瘤;⑶ 术中涉及除胆囊外脏器的切除;⑷ 术前接受免疫抑制剂治疗或抗病毒治疗或相应放射性治疗或化疗。
1.3 研究方法与观察指标
采用PCR荧光定量法检测HBV-DNA载量,当HBV-DNA载量≥1.0×104IU/mL时,记为高复制组,反之记为低复制组。
⑴ 收集所有研究对象的临床资料,主要包括手术情况(麻醉时间、手术时间、术中出血量及肝门阻断情况)。⑵ 于术前、术后1、3、7 d使用全自动生化仪(日立7600),采用酶联免疫吸附测定法测定肝功能相关指标变化情况,肝功能指标包括丙氨酸氨基转氨酶(Alanine aminotransferase,ALT)、门冬氨酸氨基转移酶(aspartate aminotransferase, AST),总胆红素(total bilirubin,TBIL)。⑶ 统计并比较术后30 d内并发症发生情况。并发症主要包括肝功能不全:出现明显肝细胞性黄疸,且连续2次检测TBIL≥60 μmol/L;术后出血:术后经腹腔引流管观察证实,需再次手术进行止血;胸腔积液:CT检查证实,液体量较多且需穿刺抽液;肺部感染:出现临床发热、咳嗽等相应症状,且胸片CT显著炎性改变;胸腔感染:影像学检查证实腹腔内有积液,且外周血及引流液培养为阳性致病菌。
1.4 统计学处理
利用统计学软件SPSS 20.0对本实验所得数据进行分析处理,以率描述计数资料,组间差异采用χ2检验,计量资料采用均数±标准差( ±s)描述,组间差异符合正态分布行t检验,不符合正态分布行秩和检验,不同时刻肝功能指标水平比较采用两因素重复测量方差分析;当P<0.05时,认为差异有统计学意义。
±s)描述,组间差异符合正态分布行t检验,不符合正态分布行秩和检验,不同时刻肝功能指标水平比较采用两因素重复测量方差分析;当P<0.05时,认为差异有统计学意义。
2 结 果
2.1 两组患者部分手术数据比较
高复制组在麻醉时间、手术时间、术中出血量水平高于低复制组,未阻断例数低于低复制组,但差异无统计学意义(P>0.05);高复制组住院时间较低复制组显著延长(P<0.05)(表2)。
表2 两组患者部分手术数据比较结果( ±s)
±s)
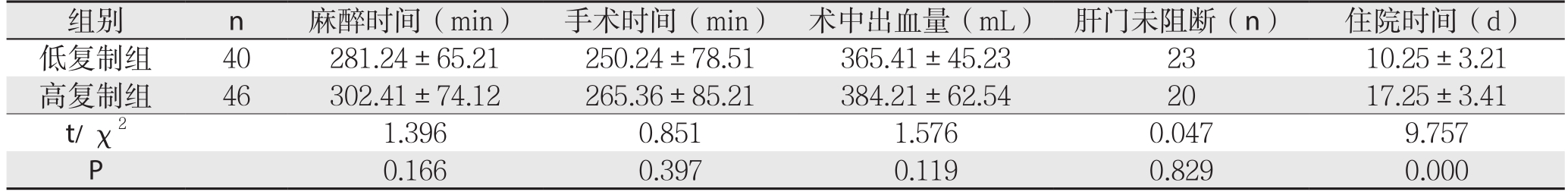
组别 n 麻醉时间(min) 手术时间(min) 术中出血量(mL) 肝门未阻断(n) 住院时间(d)低复制组 40 281.24±65.21 250.24±78.51 365.41±45.23 23 10.25±3.21高复制组 46 302.41±74.12 265.36±85.21 384.21±62.54 20 17.25±3.41 t/ χ2 1.396 0.851 1.576 0.047 9.757 P 0.166 0.397 0.119 0.829 0.000
2.2 两组患者术后不同时间点肝功能相关指标比较
术前两组患者ALT、AST、TBIL水平比较差异无统计学意义(P>0.05);术后1d ALT、AST均显著升高(P<0.05),高复制组显著高于低复制组(P<0.05);术后3、7 d ALT、AST水平均呈下降趋势,且术后7 d均下降至术前水平,组间比较差异无统计学意义(P>0.05),高复制组下降幅度显著高于低复制组(P<0.05);两组患者术后1、3、7 d TBIL水平较术前无明显变化(P>0.05),组间差异亦无统计学意义(P>0.05)(表3)。
表3 两组患者术后不同时间点肝功能相关指标比较结果( ±s)
±s)
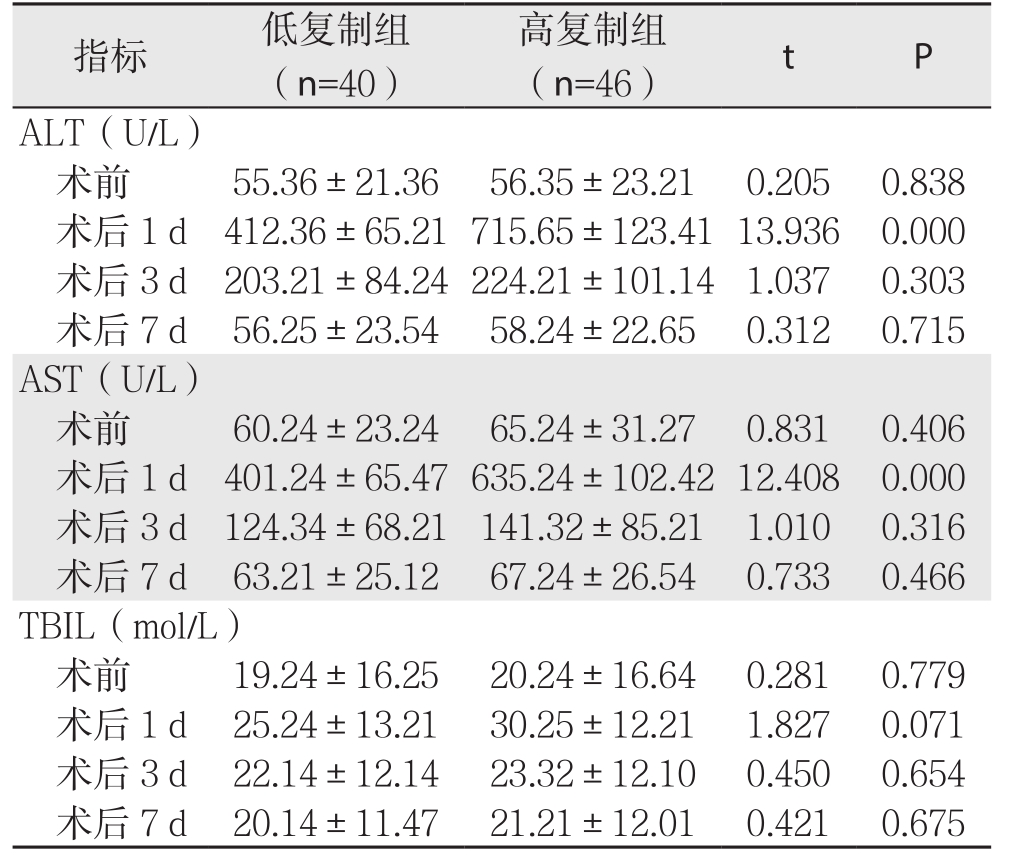
指标 低复制组(n=40)高复制组(n=46) t P A L T(U/L)术前 55.36±21.36 56.35±23.21 0.205 0.838术后1 d 412.36±65.21715.65±123.4113.936 0.000术后3 d 203.21±84.24224.21±101.14 1.037 0.303术后7 d 56.25±23.54 58.24±22.65 0.312 0.715 A S T(U/L)术前 60.24±23.24 65.24±31.27 0.831 0.406术后1 d 401.24±65.47635.24±102.4212.408 0.000术后3 d 124.34±68.21 141.32±85.21 1.010 0.316术后7 d 63.21±25.12 67.24±26.54 0.733 0.466 T B I L(m o l/L)术前 19.24±16.25 20.24±16.64 0.281 0.779术后1 d 25.24±13.21 30.25±12.21 1.827 0.071术后3 d 22.14±12.14 23.32±12.10 0.450 0.654术后7 d 20.14±11.47 21.21±12.01 0.421 0.675
2.3 两组并发症比较
低复制组出现胸腔积液2例,肺部感染3例,并发症发生率为5.00%;高复制组出现腹腔内出血4例,肝功能不全3例,腹腔感染5例,胸腔积液3例,并发症发生率为23.91%;低复制组并发症发生率显著低于高复制组,差异有统计学意义(χ2=4.582,P=0.032)。低复制组并发症Clavien-Dindo分级低于高复制组,差异有统计学意义(P<0.05)(表4)。
表4 两组患者术后并发症Clavien-Dindo分级对比(n)
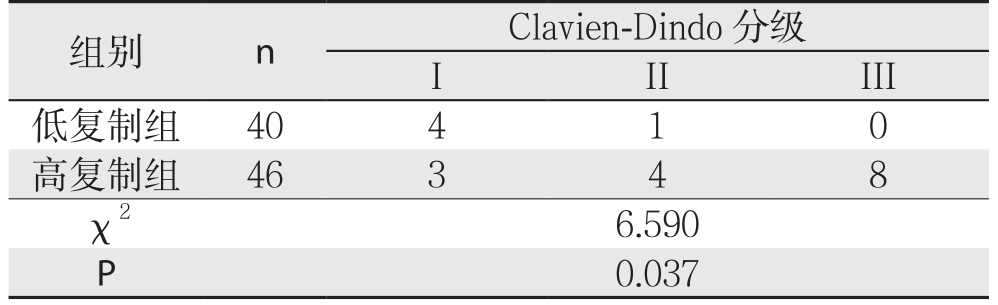
组别 n Clavien-Dindo分级I II III低复制组 40 4 1 0高复制组 46 3 4 8 χ2 6.590 P 0.037
3 讨 论
肝细胞癌患者中大多患者伴有乙型病肝炎病毒感染史,有关研究[8-9]表明,HBV-DNA基因组可通过整合转移到宿主染色体DNA组,整合完成后受到一系列刺激,直接导致宿主发生基因突变,造成复制错位,染色体丢失,异位等。此外,HBV-DNA可介入细胞信号传导、增殖、凋亡等生理功能的蛋白质编码基因中,从而引起细胞功能紊乱,引发癌变。对于肝细胞癌的最佳治疗方法为采用根治性切除手术,随着麻醉技术以及围手术期处理技术的不断提高,外科手术并发症的发生率虽有一定的控制,但肝切除手术仍是外科手术并发症较多的手术,而对于伴有乙型肝炎病毒感染时的患者,其手术风险较大,术后并发症更多,预后差,严重影响患者术后恢复[10-11]。因此,医学界对于HBV-DNA对肝细胞癌患者肝切除手术过程中的影响越来越重视。
HBV本身对机体无影响,其主要致病机制与机体免疫应答有关,机体免疫系统清除反应引起对肝细胞的损伤。HBV在肝细胞内生存、复制,其抗原表达在肝细胞膜上,激发机体免疫系统淋巴细胞辨认。持续HBV复制可诱发慢性肝纤维化及肝脏炎症损伤,从而发挥致癌作用[12-13]。因此,肝组织病理变化与血清HBV-DNA载量存在一定关系。临床上对于肝功能测定主要采用相关指标水平。ALT为一种由肝脏分泌的胞质酶,具有较高的肝脏特异性[14-15]。AST由线粒体和胞质分泌合成,主要存在于肝脏,当肝细胞出现损伤时,其水平升高变化较为明显,是肝细胞损伤的敏感指标[16-17]。TBIL是临床上判断肝功能状态的主要指标之一,可反映肝脏准备及代偿功能,当肝细胞受到损伤时,其水平显著升高。有关研究[18]显示,HBV-DNA载量与肝切除肝细胞癌患者术后肝功能恢复有密切关系。在本研究中,术后1d高复制组ALT、AST、TBIL水平显著高于低复制组,而TBIL水平在两组之间并无统计学差异,与上述研究结论是一致的。推测其主要原因为:高HBVDNA载量,病毒在复制的同时,可能在激发机体正常免疫系统对病毒清除的同时引发机体免疫病理反应,导致肝细胞破坏,造成肝功能异常,且高HBV-DNA载量可加重肝功能损伤,影响术后肝功能恢复。本组研究中高复制组住院时间较低复制组显著延长,更加证实上述论点。
有关研究[19]指出,高HBV-DNA载量可诱发肝切除术并发症增多,且是患者术后肿瘤复发的危险性因素,且对其机制探究显示高HBV-DNA载量提高与乙肝病毒抗原结合,促进肝细胞癌的发生。临床相关研究显示通过采用抗病毒核酸类药物治疗能够显著降低HBV含量,降低肝细胞癌的发生率,同时提高患者生存率,因此与患者预后相关[20]。在本研究中,高复制组并发症发生率显著高于低复制组,与上述研究结论是一致的。提示高HBV-DNA载量增加手术风险,推测其主要原因,高HBV-DNA载量增强HBV复制能力,使其与乙肝抗原结合率升高,导致机体肝癌细胞增多,降低术后疗效同时增加并发症发生率。此外,高HBV-DNA载量虽然对患者术后患者恢复及并发症发生率有一定影响,但对于手术时间、术中出血量、麻醉时间等手术相关数据并无影响。该结果排除手术本身对肝损伤及并发症增多的可能性,更加证实高HBV-DNA载量可引发机体肝损伤加重,造成并发症发生率升高等问题。
综上所述,高HBV-DNA载量对肝细胞癌患者感切除术存在较大影响,可加重患者肝损伤程度,提高并发症发生率,增加手术风险,临床上在手术前应针对性进行降低HBV-DNA载量治疗,以提高手术安全性。
参考文献
[1] 邵家胜, 卢洪洲, 张永信. 肝细胞癌流行病学研究进展[J]. 肝脏,2011, 16(6):503–505. doi:10.3969/j.issn.1008–1704.2011.06.026.Shao JS, Lu HZ, Zhang YX. Research progress in epidemiology of hepatocellular carcinoma[J]. Chinese Hepatology, 2011, 16(6):503–505. doi:10.3969/j.issn.1008–1704. 2011.06.026.
[2] 龙喜带, 姚金光, 黄小英, 等. 黄曲霉毒素B1相关性肝细胞癌的分子流行病学研究[J]. 上海交通大学学报: 医学版, 2013, 33(09):1187–1190. doi: 10.3969/j.issn.1674–8115.2013.09.001.Long XD, Yao JG, Huang XY, et al. Molecular epidemiology studies on aflatoxin B1-related hepatocellular carcinoma[J]. Journal of Shanghai Jiaotong University: Medical Science, 2013, 33(09):1187–1190. doi: 10.3969/j.issn.1674–8115.2013.09.001.
[3] 魏云生. 常规肝切除术与精准肝切除术治疗肝细胞癌的临床疗效比较[J]. 中国肿瘤临床与康复, 2013, 20(9):963–965.Wei YS. The comparison of clinical eきciency between normal liver resection and precise liver resection for patients with primary liver cancer[J]. Chinese Journal of Clinical Oncology and Rehabilitation,2013, 20(9):963–965.
[4] 郑专. e抗原阳性的乙型肝炎患者HBV-DNA载量与HBsAg以及肝功能关系的研究[J]. 医学研究杂志, 2012, 41(8):164–166.doi:10.3969/j.issn.1673–548X.2012.08.050.Zheng Z. Relationship Between HBV‐DNA and HBsAg, Aspartate Aminotransferase and Alanine Aminotransferase in Chronic Hepatitis B Patients with Positive e Antigen[J]. Journal of Medical Reaserch, 2012, 41(8):164–166. doi:10.3969/j.issn.1673–548X.2012.08.050.
[5] Omagari K, Ohba K, Kadokawa Y, et al. Comparison of the grade evaluated by "Liver damage" of Liver Cancer Study Group of Japan and Child‐Pugh classification in patients with hepatocellular carcinoma[J]. Hepatol Res, 2006, 34(4):266–272.
[6] 中国抗癌协会. 新编常见恶性肿瘤诊治规范: 合订本[M]. 北京:中国协和医科大学出版社, 1999:152–153.China anti-cancer association. Standard for diagnosis and treatment of common malignant tumors, new edition: One volume edition [M].Beiling, China Union Medical University Publishing House,1999:152–153.
[7] 中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版)[J]. 临床肿瘤学杂志, 2011, 16(10):929–946. doi:10.3969/j.issn. 1009–0460.2011.10.017.Standard for diagnosis and treatment of hepatic cancer (2011 edition): Ministry of Health, People's Republic of China[J].Chinese Clinical Oncology, 2011, 16(10):929–946. doi:10.3969/j.issn.1009–0460.2011.10.017.
[8] 成峰, 吕凌, 孙倍成, 等. 抗病毒治疗在伴高滴度HBV-DNA原发性肝癌术后复发中的作用[J]. 南京医科大学学报:自然科学版,2011, 31(6):882–884.Cheng F, Lu L, Sun BC, et al. A study of antiviral therapy in prevention of tumor recurrence after radical liver resection of hepatocellular carcinoma with high load of hepatitis B virus[J].Acta Universitatis Medicinalis Nanjing, 2011, 31(6):882–884.
[9] 张雪峰, 王斌, 钱冬萌, 等. 循环DNA和HBV-DNA载量与原发性肝癌的相关性探讨[J]. 现代生物医学进展, 2011, 11(19):3713–3715.Zhang XF, Wang B, Qian DM, et al. Correlation of Circulating DNA and HBV-DNA Load and Primary Liver Cancer[J]. Progress in Modern Biomedicine, 2011, 11(19):3713–3715.
[10] 王祖森, 吴力群, 李玉军, 等. 骨桥蛋白对乙型肝炎病毒相关肝细胞肝癌根治性肝切除术后患者预后的预测价值[J]. 中华肝脏外科手术学电子杂志, 2013, 2(2):119–125. doi:10.3877/cma.j.issn.2095–3232.2013.02.011.Wang ZS, Wu LQ, Li YJ, et al. Predictive value of osteopontin for the prognosis of patients with hepatitis B virus related hepatocellular carcinoma after radical liver resection[J]. Chinese Journal of Hepatic Surgery, 2013, 2(2):119–125. doi:10.3877/cma.j.issn.2095–3232.2013.02.011.
[11] 杨甲梅. 极量肝切除治疗肝细胞癌的适应证与疗效[J]. 中国普通外科杂志, 2013, 22(1):1–4. doi:10.7659/j.issn.1005–6947.2013.01.001.Yang JM. Extended hepatectomy for hepatocellular cancer:indications and efficacy[J]. Chinese Journal of General Surgery, 2013, 22(1):1–4. doi:10.7659/j.issn.1005–6947.2013.01.001.
[12] 袁琳, 万磊, 陈佳佳, 等. 术前TTV、NLR及HBV-DNA定量对预测肝癌术后复发的价值[J]. 现代消化及介入诊疗, 2015,20(2):99–102. doi:10.3969/j.issn.1672–2159.2015.02.006.Yuan L, Wan L, Chen JJ, et al. Values of TTV, NLR, and HBV-DNA in predicting tumor recurrence on patients with HCC after cura‐tive hepatectomy[J]. Modern Digestion & Intervention, 2015, 20(2):99–102. doi:10.3969/j.issn.1672–2159.2015.02.006.
[13] Di Martino M, Saba L, Bosco S, et al. Hepatocellular carcinoma(HCC) in non-cirrhotic liver:clinical,radiological and pathological findings[J]. Eur Radiol, 2014, 24(7):1446–1454. doi: 10.1007/s00330–014–3173–2.
[14] 罗小军, 邓和军, 沈艾, 等. 肝细胞癌患者围手术期病毒载量及肝功能变化[J]. 现代肿瘤医学, 2016, 24(11):1757–1760.doi:10.3969/j.issn.1672–4992.2016.11.024.Lou XJ, Deng HJ, Shen A, et al. Hepatocellular carcinoma(HCC) patients perioperative viral load and the change of liver function[J]. Journal of Modern Oncology, 2016, 24(11):1757–1760.doi:10.3969/j.issn.1672–4992.2016.11.024.
[15] 刘琦, 陈一杰, 江涛. 肝细胞癌患者围手术期病毒载量及肝功能变化研究[J]. 西部医学, 2015, 27(12):1835–1837. doi:10.3969/j.issn.1672–3511.2015.12.022.Liu Q, Chen YJ, Jiang T. Study on the transformation of viral load and liver function of hepatocellular carcinoma patients during perioperative period[J]. Medical Journal of West China, 2015,27(12):1835–1837. doi:10.3969/j.issn.1672–3511.2015.12.022.
[16] 张蕾, 周玉妮, 董景云, 等. 血清HBV-DNA载量、乙肝免疫学标志物定量与老年慢性乙肝患者肝功能的关系[J]. 中国老年学杂志, 2014, 34(13):3563–3564. doi:10.3969/j.issn.1005–9202.2014.13.023.Zhang L, Zhou YN, Dong JY, et al. Relationship of quantity of serum HBV-DNA load and quantity of hepatitis B immunologic markers to hepatic function in elderly patients with chronic hepatitis B[J]. Chinese Journal of Gerontology, 2014, 34(13):3563–3564.doi:10.3969/j.issn.1005–9202.2014.13.023.
[17] 袁明生. 肝功能指标正常慢性乙型肝炎患者的肝功能与HBVDNA病毒载量关系研究[J]. 中国实验诊断学, 2013, 17(12):2188–2191.Yuan MS. Relationship between Liver Function Index and HBV DNA Viral Load among Chronic Hepatitis B Patients(CHB) with Normal Liver Function Index[J]. Chinese Journal of Laboratory Diagnosis, 2013, 17(12):2188–2191.
[18] 林梅双, 李开飞, 吴茂锋, 等. HBV 感染相关的不同分化程度肝细胞癌患者实验室指标的探讨[J]. 医学理论与实践, 2015,28(24):3322–3324.Lin MS, Li KF, Wu MF, et al. The Exploration of Laboratory Markers in Different Degree of Differentiation Hepatocellular Carcinoma Related HBV In-fection[J]. The Journal of Medical Theory and Practice, 2015, 28(24):3322–3324.
[19] Patel RB, Gupta NR, Vasava NC, et al. Situs Inversus Totalis (SIT)with Hepatocellular Carcinoma (HCC): A Rare Case Report and Review of 12 Other Cases[J]. Indian J Surg, 2013, 75(6):424–429.doi: 10.1007/s12262–012-0744–9.
[20] 郑盛, 唐映梅, 杨晋辉. 乙型肝炎相关性肝癌患者围手术期HBV DNA的变化及其影响因素[J]. 中国肝脏病杂志:电子版, 2014,6(2):38–43. doi:10.3969/j.issn.1674–7380.2014.02.010.Zheng S, Tang YM, Yang JH. Changes in perioperative level of HBV DNA in patients with HBV‐related hepatocellular carcinoma and their inlfuences[J]. Chinese Journal of Liver Diseases: Electronic Version, 2014, 6(2):38–43. doi:10.3969/j.issn.1674–7380.2014.02.010.
