胰腺癌是常见的消化道恶性肿瘤之一,病死率位于恶性肿瘤的第4位,5年存活率仅为7%[1]。外科手术是提高5年生存率的有效手段之一,但是由于胰腺癌缺乏早期临床症状、缺乏早期诊断方法等,只有20%的患者具有手术切除的机会,大多数患者在被诊断出胰腺癌时已经处于进展期[2]。早期诊断治疗是延长胰腺癌患者生存时间、改善患者预后的关键[3]。
miRNA是一类长约22个核苷酸的小分子单链非编码RNA分子,它能与靶基因mRNA的3'非翻译区结合,通过使mRNA降解或者抑制mRNA的翻译来调节蛋白的表达水平[4]。miRNA在细胞凋亡、代谢、增殖、分化等过程中具有重要的作用;在肿瘤中,miRNA可能作为癌基因或者抑癌基因调控癌症的发生发展[5]。近年来,在人体血浆、血清、尿液、唾液等体液中的miRNA被用于包括肿瘤在内的多种疾病的诊断研究[6]。由于其在细胞外生物流体中的稳定性、疾病特异性、分析可及性以及测量时的高敏感性和可靠性使得循环miRNA成为重要的疾病诊断指标[7]。目前的研究[8]表明,miR-21在胰腺癌中是高表达的,血浆中高表达miR-21的胰腺癌患者生存期更短,肝脏和局部淋巴结转移率更高。Sicard等[9]的研究报道敲低miR-21可以抑制胰腺癌的增殖,诱导细胞凋亡;阻断miR-21联合化疗药物处理可以抑制胰腺癌的发生发展。因此,miR-21可能作为胰腺癌的诊断指标及治疗靶点。
然而,国内外关于miR-21诊断胰腺癌的研究结果并不一致,可能是因为样本量较小、样本的来源不同、疾病的状态差异及检测方法不同。本研究旨在通过Meta分析,综合评价miR-21诊断胰腺癌的价值,以期为miR-21的进一步研究和临床应用提供询证医学证据。
1 资料与方法
1.1 文献检索
检索Pubmed、OVID、Embase、CNKI、万方数据库,收集2017年5月之前公开发表的关于miR-21在胰腺癌血液中的浓度及其诊断意义的文献。使用的检索词包括:miR-21、miRNA-21、microRNA-21、Pancreatic Cancer、Pancreatic tumor、Pancreatic carcinoma、Pancreatic Neoplasms、Diagnosis、Sensitivity、Specificity、ROC curve。检索的语言包括英语和汉语。
1.2 文献的纳入与排除标准
文献纳入标准为:⑴ 研究类型为含有miR-21胰腺癌诊断价值的前瞻性或回顾性研究;⑵ 研究对象涵盖胰腺癌及胰腺良性疾患,采用病理诊断为金标准,文献需明确说明受试者为胰腺癌或其它病理类型;⑶ 检测样本为患者的血液标本;⑷ 文章提供了miR-21检测在各病例组的真阳性(true positive,TP)、真阴性(true negative,TN)、假阳性(false positive,FP)、假阴性(false negative,FN)例数或可以通过文章提供的数据计算得到。文献排除标准:⑴ miR-21的检测方法不是定量检测;⑵ 研究标本对象为病理组织或胰液、粪便等材料;⑶ 重复性实验中发表较早或样本量较小的文献;⑷ 每组病例数<10。
1.3 资料提取与质量评价
由2名评价者独立按照预先制定的纳入排除标准筛选文献、提取数据,根据QUADAS-2(quality assessment of diagnostic accuracy studies 2)评价标准[10]对纳入文献进行质量评价,如意见不统一则讨论解决或参考第三方意见。提取的资料包括文献基本信息(包括第一作者、发表时间、国家、检测方法等)、实验设计及实验原始数据。
1.4 统计学处理
对于诊断性Meta分析,所有纳入研究的TP、FP、FN、TN的例数通过直接获取或计算得到。计算真阳性率和假阳性率的Spearman相关系数r,分析是否存在阈值效应。采用Cochran's Q检验分析纳入研究之间是否存在异质性,以I2估算分析异质性的大小,根据异质性分析的结果选择用随机效应模型计算miR-21的合并敏感度(sensitivity)、特异度(specificity)、似然比(likelihood ratio,LR)及各自的95%可信区间(confidence interval,CI)。以Mose's constant线性模型拟合综合受试者工作特征曲线(summary receiver operating characteristic curve,SROC curve),以诊断比值比(diagnostic odd ratio,DOR)、曲线下面积(area under curve,AUC)评价诊断试验循环miR-21对胰腺癌诊断的准确性。以每次减少1篇文献的方法进行敏感性分析,评价本次分析的稳定性。以Deek漏斗图评价纳入的研究是否存在发表偏倚。本文统计分析采用软件STATA MP 14和Meta-Disc 1.4,以P<0.05为差异具有显著性。
2 结 果
2.1 检索结果及纳入文献
通过设定的检索词进行检索,共找到301篇文献。剔除重复后获得文献189篇,阅读文题和摘要排除157篇,初步纳入文献32篇。进一步阅读全文,按照纳入和排除标准,排除24篇,最终共纳入8篇文献进行Meta分析。文献的筛选流程详见图1。
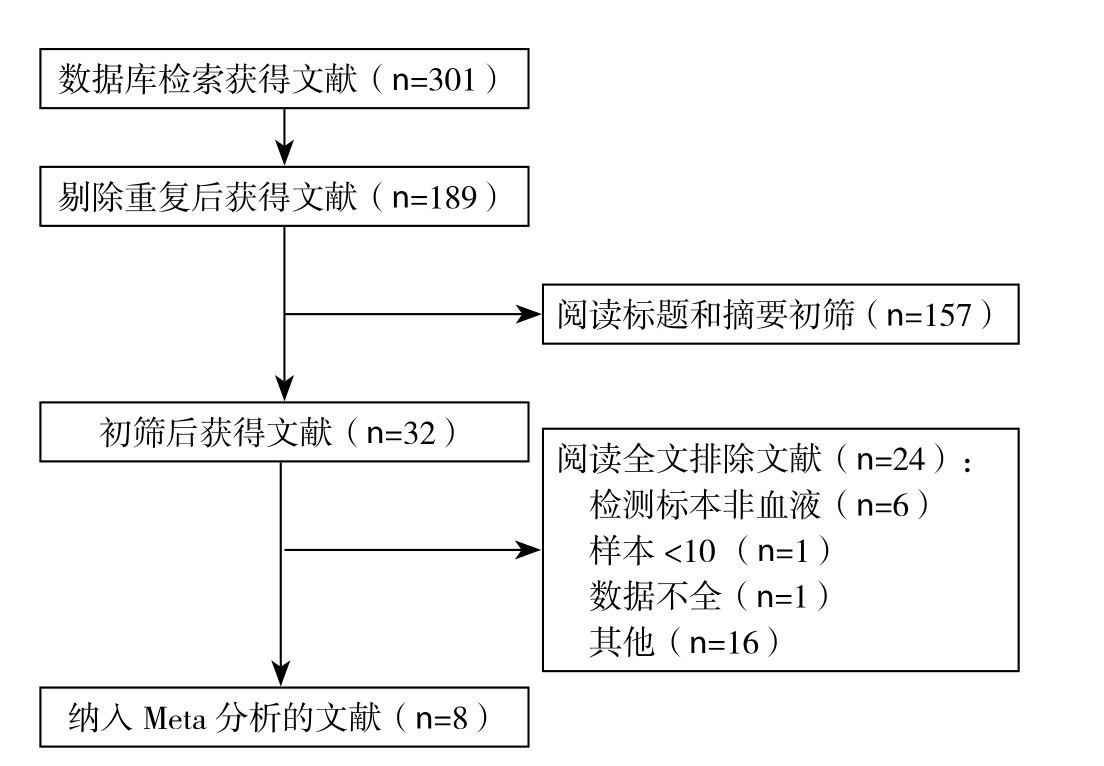
图1 文献筛选流程
Figure 1 Literature screening process
2.2 纳入研究的基本特征和质量评价
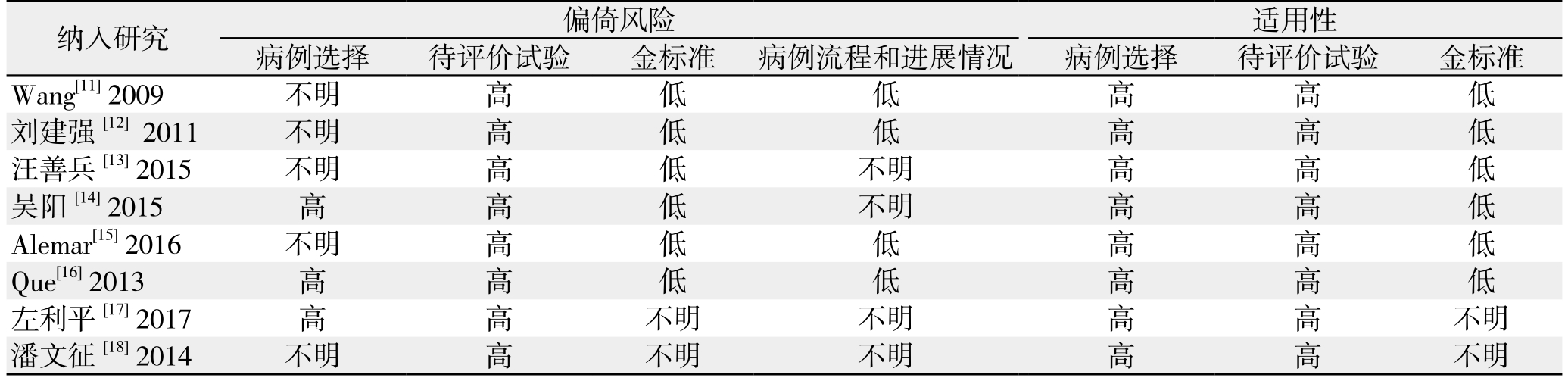
本文共纳入8项研究,累计病例261例,对照242例。各研究的基本信息、样本来源、TP、FP、FN和TN的例数参见表1。文献质量评价用QUADAS-2评价系统,结果如表2。
2.3 异质性检验
通过Meta-Disc计算灵敏度对数与(1-特异度)对数的Spearman相关系数,结果显示不存在阈值效应引起的异质性(r=-0.024,P=0.955)。以D O R作为效应量分析m i R-2 1的异质性,结果显示研究间存在非阈值效应引起的异质性(Cochran-Q=12.89,P<0.1,I2=45.7%),故以下分析选用随机效应模型。
表1 纳入研究的基本特征
Table 1 General feature of the included studies
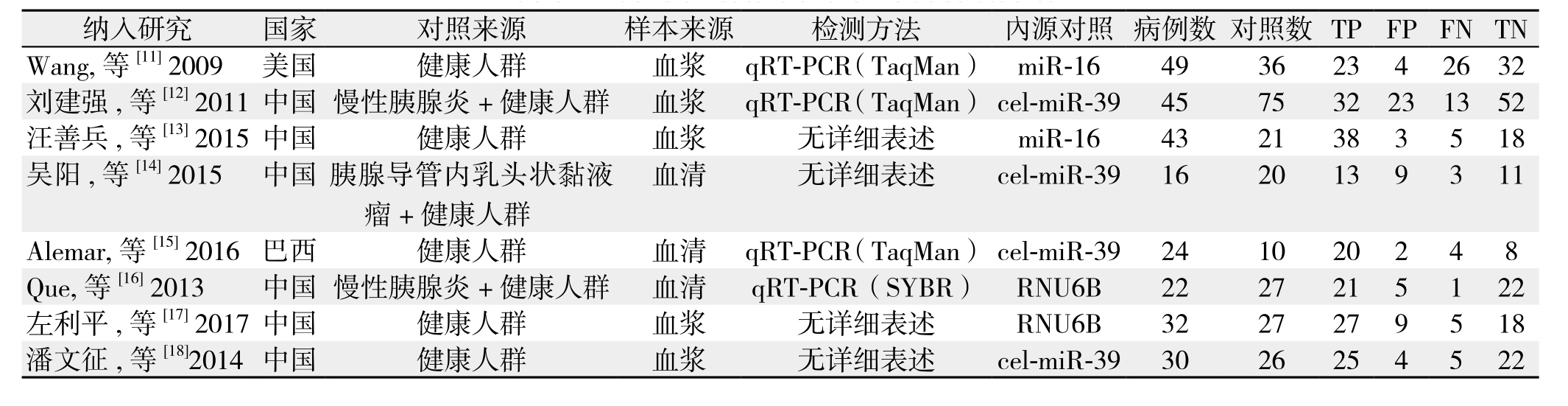
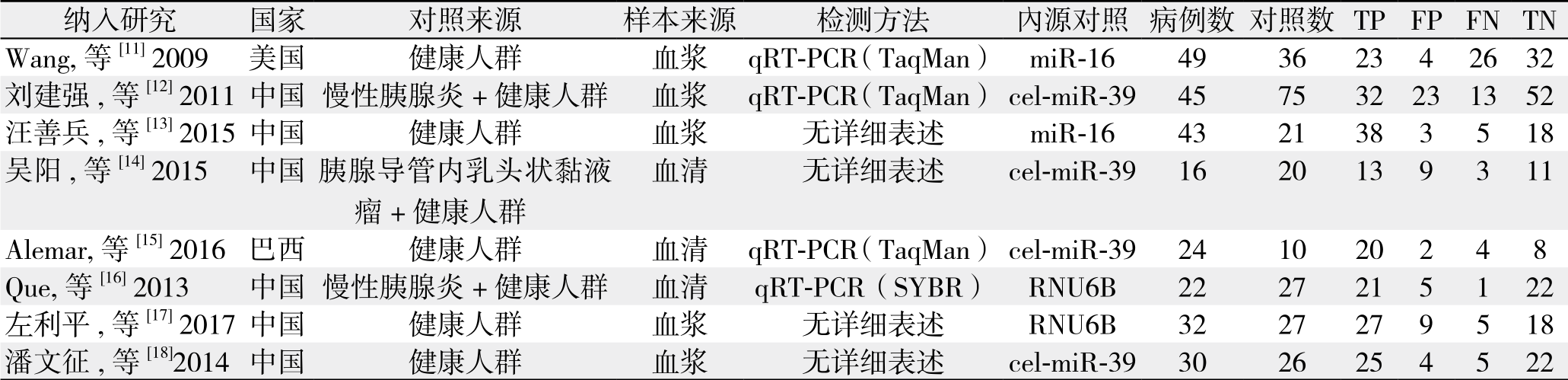
表2 文献质量评价Table 2 Quality assessment of the included studies
2.4 miR-21诊断胰腺癌的合并统计量分析
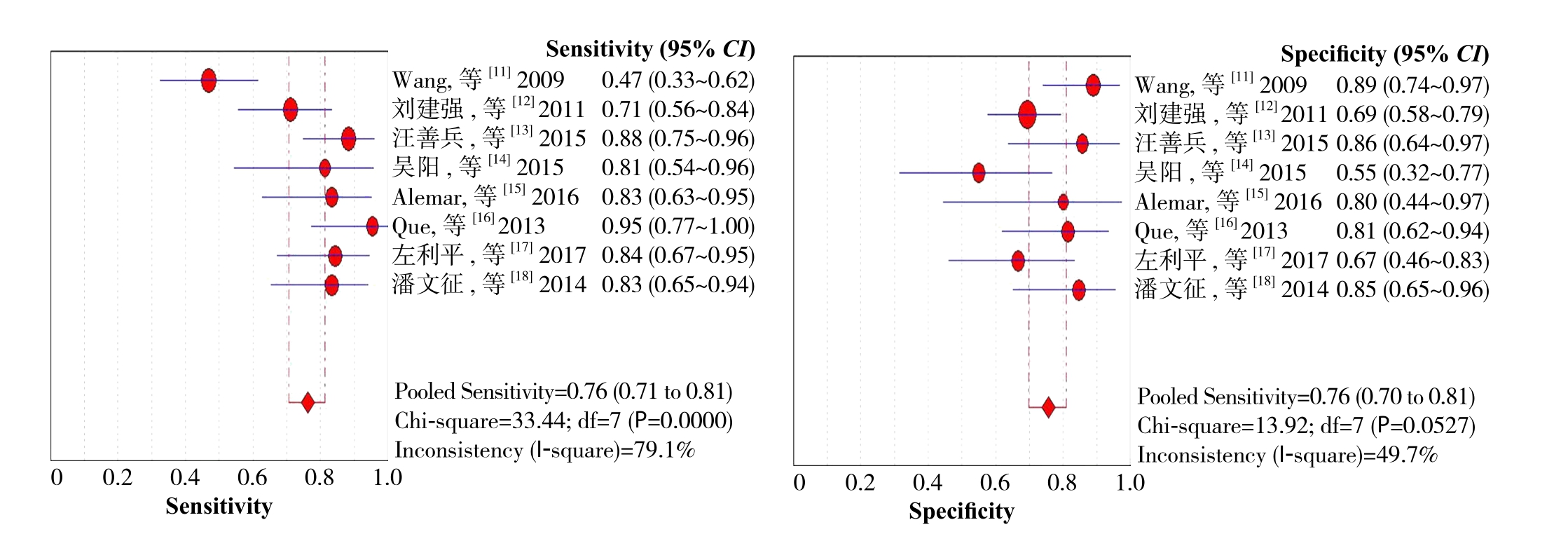
图2 敏感度和特异度的森林图
Figure 2 Forest plot of sensitivity and speci fi city
图2 所示为miR-21对胰腺癌诊断敏感度和特异度的森林图。miR-21诊断胰腺癌的合并敏感度为0.76(95% CI=0.71~0.81),合并特异度为0.76(95% CI=0.70~0.81)。图3所示为miR-21对胰腺癌诊断阳性似然比(positive likelihood ratio,PLR)和阴性似然比(negative likelihood ratio,NLR)的森林图。miR-21诊断胰腺癌的PLR为3.17(95% CI=2.24~4.47);NLR为0.26(95% CI=0.15~0.45),DOR为13.17(95% CI=6.78~25.58)。图4所示为miR-21诊断胰腺癌的SROC曲线,AUC=0.8518。
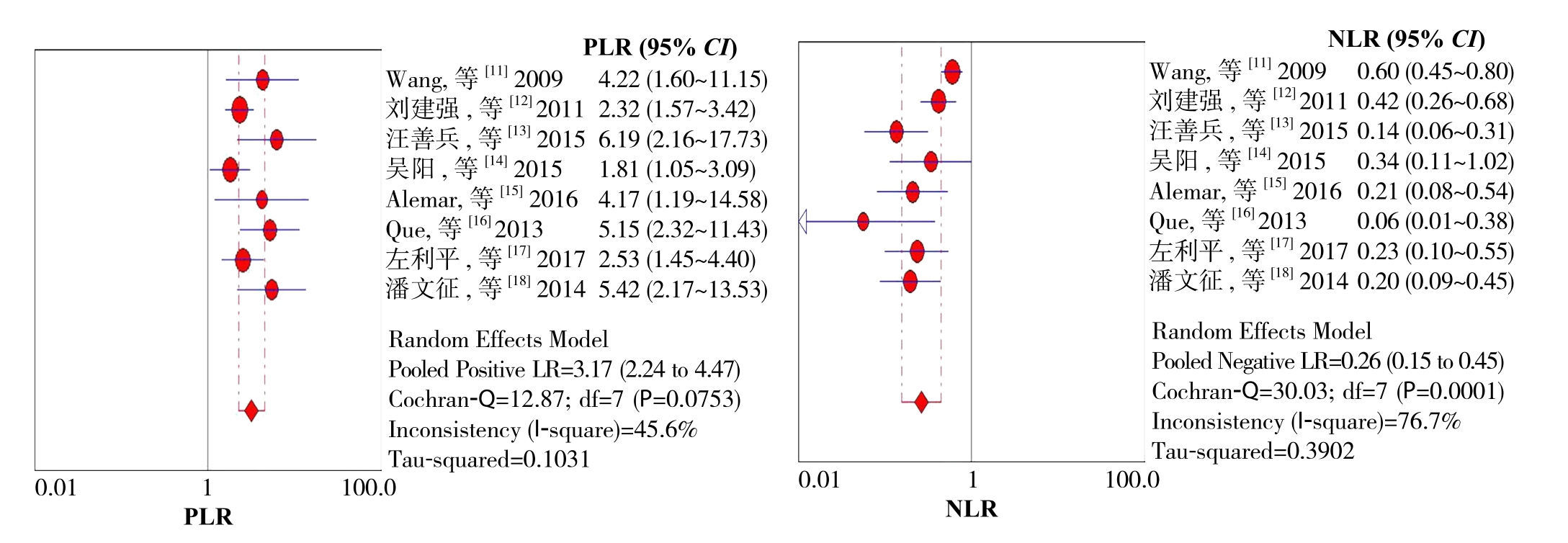
图3 PLR和NLR的森林图
Figure 3 Forest plot of PLR and NLR
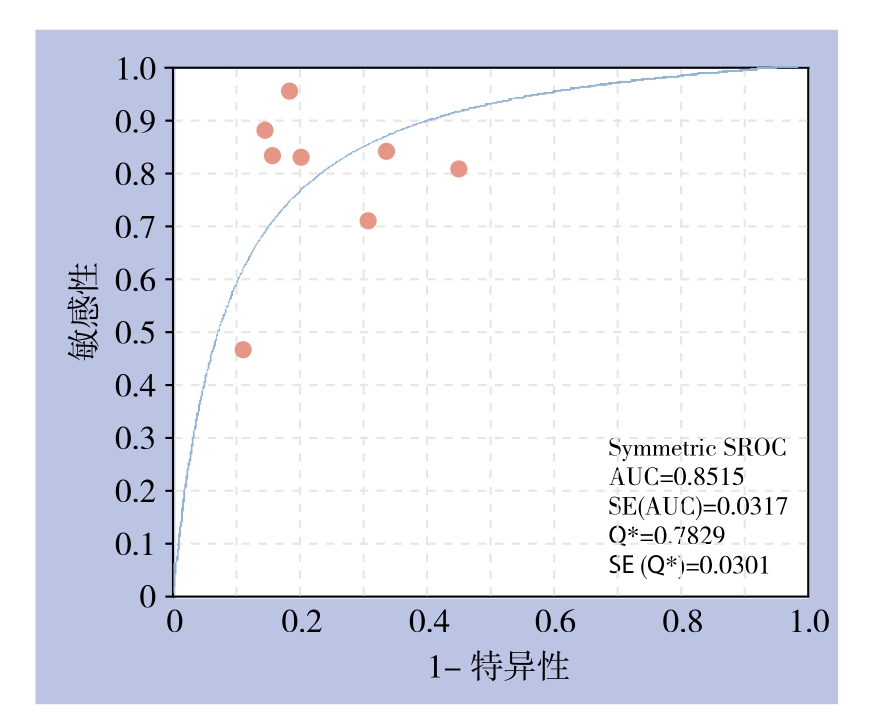
图4 循环miR-21诊断胰腺癌的SROC曲线
Figure 4 SROC curve of circulating miR-21for diagnosing pancreatic cancer
2.5 亚组分析
表3显示按照检测样本来源和病例对照的来源不同分组进行亚组分析的结果。结果显示,血清组合并敏感度比血浆组稍高(0.87 vs. 0.73),而两组的AUC值均为0.8513。按照对照来源不同分为健康人群组和健康人群+良性疾患组(慢性胰腺炎/胰腺导管内乳头状黏液瘤+健康人群),健康人群组的一致性较好(Cochran-Q=4.61,P=0.33,I2=13.2%),诊断的准确性优于健康人群+良性疾患组(AUC:0.876 vs. 0.72,P<0.05)。
表3 miR-21诊断胰腺癌的亚组分析
Table 3 Subgroup analysis of circulating miR-21 in diagnosing pancreatic cancer
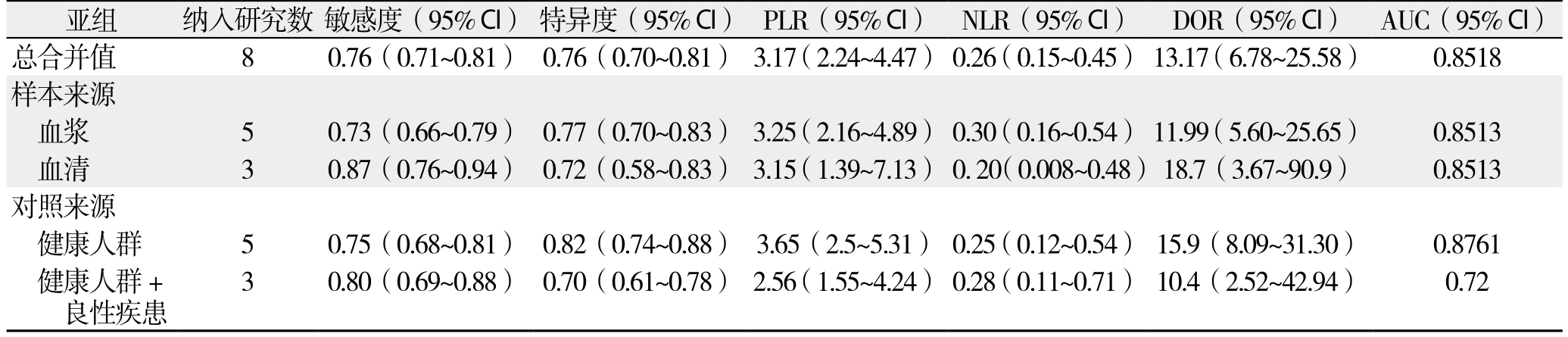
亚组 纳入研究数 敏感度(95% CI) 特异度(95% CI) PLR(95% CI) NLR(95% CI) DOR(95% CI) AUC(95% CI)总合并值 8 0.76(0.71~0.81) 0.76(0.70~0.81) 3.17(2.24~4.47) 0.26(0.15~0.45) 13.17(6.78~25.58) 0.8518样本来源血浆 5 0.73(0.66~0.79) 0.77(0.70~0.83) 3.25(2.16~4.89) 0.30(0.16~0.54) 11.99(5.60~25.65) 0.8513血清 3 0.87(0.76~0.94) 0.72(0.58~0.83) 3.15(1.39~7.13) 0. 20(0.008~0.48)18.7(3.67~90.9) 0.8513对照来源健康人群 5 0.75(0.68~0.81) 0.82(0.74~0.88) 3.65(2.5~5.31) 0.25(0.12~0.54) 15.9(8.09~31.30) 0.8761健康人群+良性疾患
2.6 发表偏倚
D e e k对称性检验结果显示漏斗图基本对称(图5),提示纳入研究无明显发表偏倚(Bias=17.38,P=0.241)。
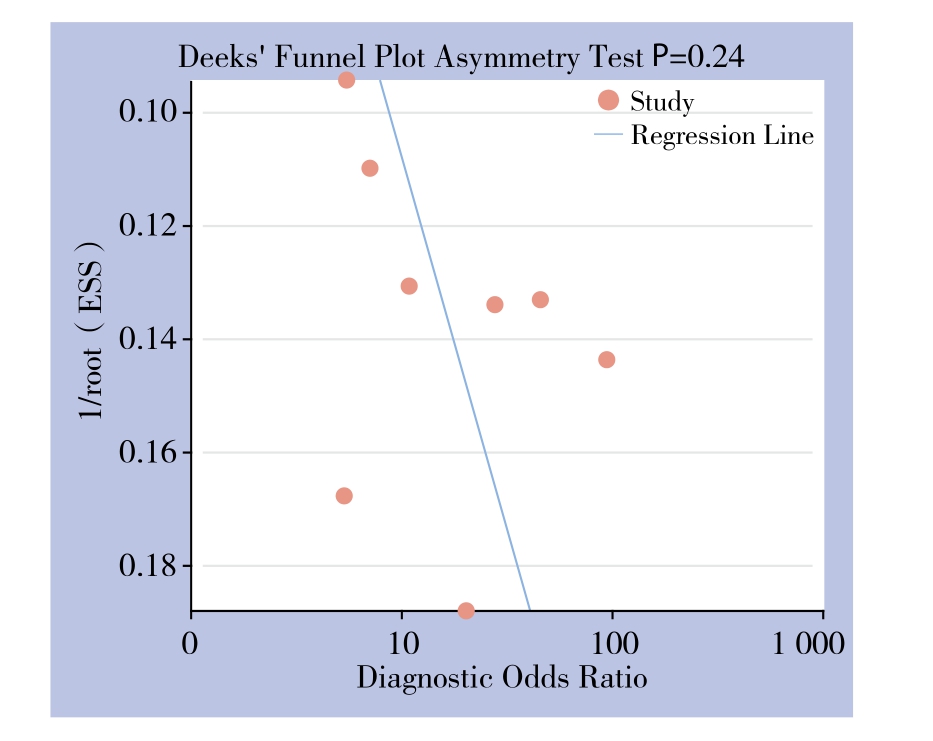
图5 纳入研究的发表偏倚分析
Figure 5 The publication bias analysis of included studies
2.7 敏感性分析
以每次减少1篇文献的方法进行敏感性分析,评估单个研究对本次Meta分析的影响。表4显示的是删除其中1篇文献后计算的合并DOR及其95% CI的结果。由表可见,剔除之后的合并DOR均未发生明显变化,提示本次分析结果并未过分依赖于某个研究,结论稳定。
表4 各研究对Meta分析结果的敏感性分析
Table 4 The in fl uence of each study for the outcome of the Meta-analysis
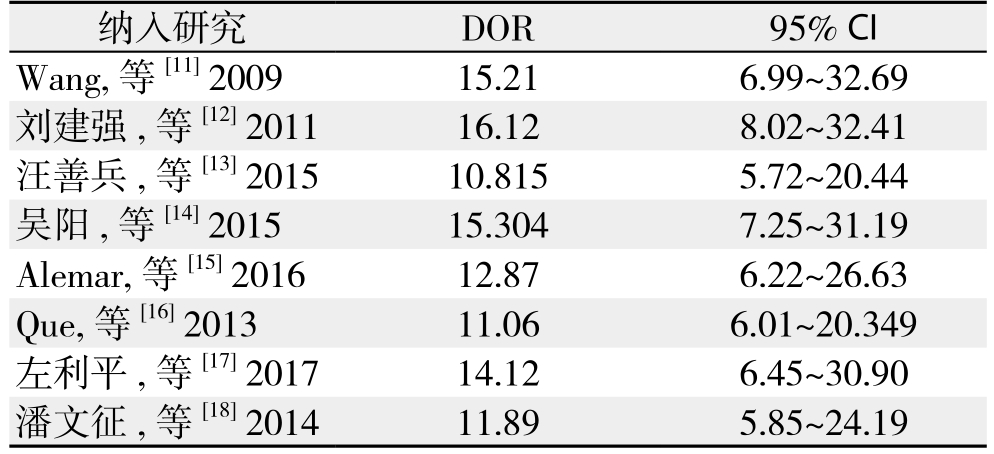
纳入研究 DOR 95% CI Wang, 等 [11] 2009 15.21 6.99~32.69刘建强 , 等 [12] 2011 16.12 8.02~32.41汪善兵 , 等 [13] 2015 10.815 5.72~20.44吴阳 , 等 [14] 2015 15.304 7.25~31.19 Alemar, 等 [15] 2016 12.87 6.22~26.63 Que, 等 [16] 2013 11.06 6.01~20.349左利平 , 等 [17] 2017 14.12 6.45~30.90潘文征 , 等 [18] 2014 11.89 5.85~24.19
3 讨 论
胰腺癌在癌症相关性死亡中占第4位,超过80%的患者在诊断为胰腺癌后由于肿瘤的进展无法进行手术切除[19];加上化疗效果不佳等原因,胰腺癌的5年存活率非常低。目前,用于胰腺癌诊断的常用肿瘤标志物有CA-199、CEA等,但正常人多种组织发生病变时CA-199及CEA分泌亦会增加,且易出现假阳性及假阴性,用于早期诊断的效果不佳[3, 16, 20]。
自1993年发现小分子干扰RNA以来[21],大量的研究关注于miRNA对疾病基因的调控。miRNA可以通过靶向mRNA负调控基因表达,为研究疾病的机制、靶向治疗提供了新的方向[22]。目前胰腺癌的诊断主要是通过传统的方法,比如组织活检,超声引导下的细针穿刺等。血浆或血清miRNA的检测可以作为一种非侵入性的检测方法,相比传统方法具有较大的优势。同时,循环miRNA可以通过与Argonaute蛋白结合避免被RNA酶降解[23],使其稳定存在于循环血中。miR-21在胰腺癌中是高表达的,血浆中高表达miR-21的胰腺癌患者生存期更短 [24]。这些研究结果提示,血液miR-21可能作为胰腺癌的重要诊断指标。但是由于不同研究结果的差异,循环miR-21对胰腺癌的诊断效能仍未明确。
本文一共纳入8项研究进行Meta分析,包括261例胰腺癌,242例对照。研究显示miR-21诊断胰腺癌文献的合并敏感度为0.76,合并特异度为0.76,说明miR-21对胰腺癌的诊断具有潜在的价值。SROC和DOR是用来评价诊断表现的指标。DOR值越高,说明诊断试验的辨别力越好[25]。而SROC曲线越接近左上角,AUC越大,说明诊断的准确性越高[26]。Meta分析结果显示DOR=13.17,AUC=0.8518,说明miR-21用于胰腺癌的诊断具有较高的准确性。通常,PLR>10 或NLR<0.1,可以确定或排除诊断。本研究结果显示PLR=3.17,NLR=0.26,提示有临床症状miR-21阳性还不能确诊胰腺癌,阴性时不能排除胰腺癌的可能,此结果与张英英等[27]研究miRNA诊断胰腺癌的结果比较相似。
由SROC曲线平面图可见,各研究对应的点散在分布,不呈“肩臂”状外观,Spearman相关系数检验显示异质性与阈值效应无关。以DOR作为效应量,纳入的研究间存在中等程度的异质性。按照样本来源不同分为血浆组和血清组进行亚组分析,血浆miR-21和血清miR-21检测具有相同的准确性。按照对照来源不同分为健康人群组和健康人群+良性疾患组,健康人群组的同质性和准确性高于健康人群+良性疾患组。以健康者为对照存在一定的局限性,可能降低了诊断效能。郑雷教授介绍在约翰霍普金斯医院,一种提高早期诊断的方法是研究胰腺癌的癌前病变,也称之为胰腺囊性疾病[28]。健康人群+良性疾患组的敏感度较健康人群组高特异度较健康人群组低,可能是因为miR-21的检测将一部分可能发展为胰腺癌的胰腺囊性疾病诊断为胰腺癌。这降低了整体的诊断准确性,但是可能提高早期诊断的效果,让一部分胰腺囊性疾病患者尽早的得到手术治疗。然而,该假设的证实和应用需要更多的临床和基础的研究的支持。另外,本文纳入的8项研究均采用qRTPCR的方法,但是TaqMan探针法和SYBR Green荧光染料法可能存在差异[29]。
综上所述,miR-21对胰腺癌具有一定的诊断价值,应用miR-21诊断胰腺癌在临床上具有可行性。但目前miR-21的临床相关研究尚缺乏大样本、多中心的数据论证,缺乏统一的检测方法及严格的质控标准,上述结论仍需要开展高质量的研究予以验证。此外,由于miRNA作用的多重性,其特异性作用机制等尚需进一步探讨。随着研究内容的不断深入,循环miR-21检测将在胰腺癌的早期诊断、预后判断等方面可能展现出广泛的应用价值。
参考文献
[1]Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1):7–30. doi: 10.3322/caac.21332.
[2]Chari ST, Kelly K, Hollingsworth MA, et al. Early detection of sporadic pancreatic cancer: summative review[J]. Pancreas, 2015,44(5):693–712. doi: 10.1097/MPA.0000000000000368.
[3]曾复, 葛春林. 胰腺癌185例诊治回顾分析[J]. 中国普通外科杂志,2015, 24(3):336–342. doi:10.3978/j.issn.1005–6947.2015.03.006.Zeng F, Ge CL. Diagnosis and treatment of pancreatic cancer:a retrospective analysis of 185 cases[J]. Chinese Journal of General Surgery,2015, 24(3):336–342. doi:10.3978/j.issn.1005–6947.2015. 03.006.
[4]Takahashi RU, Miyazaki H, Ochiya T. The role of microRNAs in the regulation of cancer stem cells [J]. Front Genet, 2014, 4:295.doi: 10.3389/fgene.2013.00295.
[5]Abreu FB, Liu X, Tsongalis GJ. miRNA analysis in pancreatic cancer: the Dartmouth experience[J]. Clin Chem Lab Med, 2017,55(5):755–762. doi: 10.1515/cclm–2017–0046.
[6]Tricoli JV, Jacobson JW. MicroRNA: Potential for Cancer Detection, Diagnosis, and Prognosis[J]. Cancer Res, 2007,67(10):4553–4555.
[7]Turchinovich A, Weiz L, Burwinkel B. Extracellular miRNAs: the mystery of their origin and function [J]. Trends Biochem Sci, 2012,37(11):460–465. doi: 10.1016/j.tibs.2012.08.003.
[8]Abue M, Yokoyama M, Shibuya R, et al. Circulating miR-483-3p and miR-21 is highly expressed in plasma of pancreatic cancer[J].Int J Oncol, 2015, 46(2):539–547. doi: 10.3892/ijo.2014.2743.
[9]Sicard F, Gayral M, Lulka H, et al. Targeting miR-21 for the therapy of pancreatic cancer[J]. Mol Ther, 2013, 21(5): 986–994. doi:10.1038/mt.2013.35.
[10]Whiting PF, Rutjes AW, Westwood ME, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies[J].Ann Intern Med, 2011, 155(8):529–536. doi: 10.7326/0003–4819–155–8-201110180–00009.
[11]Wang J, Chen J, Chang P, et al. MicroRNAs in plasma of pancreatic ductal adenocarcinoma patients as novel blood-based biomarkers of disease[J]. Cancer Prev Res (Phila), 2009, 2(9):807–813. doi:10.1158/1940–6207.CAPR–09–0094.
[12]刘建强, 高军, 任艳, 等. 血浆miR-21对胰腺癌的诊断价值[J]. 世界华人消化杂志, 2011, 19(8):860–863.Liu JQ, Gao J, Ren Y, et al. Diagnostic value of plasma miR-21 in pancreatic cancer[J]. World Chinese Journal of Digestology, 2011,19(8):860–863.
[13]汪善兵, 刘佳培, 雷开键, 等. 胰腺癌患者血浆中miRNAs异常高表达与临床特征相关性的研究[J]. 肿瘤, 2015, 35(8):905–910.doi:10.3781/j.issn.1000–7431.2015.33.123.Wang SB, Liu JP, Lei KJ, et al. Aberrant overexpressions of microRHAs in plasma and their correlations with the clinical features of patients with pancreatic cancer[J]. Tumor, 2015,35(8):905–910. doi:10.3781/j.issn.1000–7431.2015.33.123.
[14]吴阳, 王佐正, 黄李雅. 血清miRNAs作为胰腺癌诊断肿瘤标志物的初步研究[J]. 宁夏医学杂志, 2015, 37(8):675–677.doi:10.13621/j.1001–5949.2015.08.0675.Wu Y, Wang ZZ, Huang LY. A preliminary study on plasma microRNAs as a tumor marker in the diagnosis of pancreatic cancer[J]. Ningxia Medical Journal, 2015, 37(8):675–677.doi:10.13621/j.1001–5949.2015.08.0675.
[15]Alemar B, Izetti P, Gregório C, et al. miRNA-21 and miRNA-34a Are Potential Minimally Invasive Biomarkers for the Diagnosis of Pancreatic Ductal Adenocarcinoma[J]. Pancreas, 2016, 45(1):84–92.doi: 10.1097/MPA.0000000000000383.
[16]Que R, Ding G, Chen J, et al. Analysis of serum exosomal microRNAs and clinicopathologic features of patients with pancreatic adenocarcinoma[J]. World J Surg Oncol, 2013, 11:219.doi: 10.1186/1477–7819–11–219.
[17]左利平, 尚亚飞, 韩坤, 等. 胰腺癌患者血浆中MicroRNA的表达及临床意义[J]. 基层医学论坛, 2017, 21(7):777–779.doi:10.19435/j.1672–1721.2017.07.005.Zuo LP, Shang YF, Han K, et al. Expression and clinical significance of MicroRNA in peripheral blood of patients with pancreatic cancer[J]. The Medical Forum, 2017, 21(7):777–779.doi:10.19435/j.1672–1721.2017.07.005.
[18]潘文征, 唐万燕, 袁伟, 等. 微小 RNA 在胰腺癌患者血浆中的表达情况及临床意义[J]. 中华肿瘤杂志, 2014, 36(5):351–354.doi:10.3760/cma.j.issn.0253–3766.2014.05.007.Pan WZ, Tang WY, Yuan W, et al. Expression and clinical significance of plasma small RNA in patients with pancreatic cancer[J]. Chinese Journal of Oncology, 2014, 36(5):351–354.doi:10.3760/cma.j.issn.0253–3766.2014.05.007.
[19]Miller KD, Siegel RL, Lin CC, et al. Cancer treatment and survivorship statistics, 2016[J]. CA Cancer J Clin, 2016, 66(4):271–289. doi: 10.3322/caac.21349.
[20]刘书中, 李子全, 李政垚, 等. 外周血 miR-21检测在胰腺癌中的意义研究进展[J]. 中国实验诊断学, 2016, 20(6):1038–1042.Liu SZ, Li ZQ, Li ZY, et al. Research progress of detection of peripheral blood in pancreatic cancer[J]. Chinese Journal of Laboratory Diagnosis, 2016, 20(6):1038–1042.
[21]Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J]. Cell, 1993, 75(5):843–854.
[22]Vorvis C, Koutsioumpa M, Iliopoulos D. Developments in miRNA gene signaling pathways in pancreatic cancer[J]. Future Oncol,2016, 12(9):1135–1150. doi: 10.2217/fon–2015–0050.
[23]Arroyo JD, Chevillet JR, Kroh EM, et al. Argonaute2 complexes carry a population of circulating microRNAs independent of vesicles in human plasma[J]. Proc Natl Acad Sci U S A, 2011,108(12):5003–5008. doi: 10.1073/pnas.1019055108.
[24]Khan K, Cunningham D, Peckitt C, et al. miR-21 expression and clinical outcome in locally advanced pancreatic cancer: exploratory analysis of the pancreatic cancer Erbitux, radiotherapy and UFT(PERU) trial[J]. Oncotarget, 2016, 7(11):12672–12681. doi:10.18632/oncotarget.7208.
[25]Glas AS, Lijmer JG, Prins MH, et al. The diagnostic odds ratio:a single indicator of test performance[J]. J Clin Epidemiol, 2003,56(11):1129–1135.
[26]Walter SD. Properties of the summary receiver operating characteristic (SROC) curve for diagnostic test data[J]. Stat Med,2002, 21(9):1237–1256.
[27]张英英, 周晓彬, 朱小艳, 等. miRNAs 对胰腺癌诊断价值的 Meta分析 [J]. 中国循证医学杂志, 2017, 17(1):78–86.Zhang YY, Zhou XB, Zhu XY, et al. Diagnostic value of miRNAs for pancreatic cancer: a meta-analysis[J]. Chinese Journal of Evidence-based Medicine, 2017, 17(1):78–86.
[28]黄晓曼. 郑雷教授:胰腺癌的多学科综合诊疗[J]. 中国普通外科杂志, 2016, 25(3):318–320. doi:10.3978/j.issn.1005–6947.2016.03.002.Huang XM. Professor Lei Zheng: Multidisciplinary management for pancreatic cancer[J]. Chinese Journal of General Surgery, 2016,25(3):318–320. doi:10.3978/j.issn.1005–6947.2016.03.002.
[29]Wang Y, Gao X, Wei F, et al. Diagnostic and prognostic value of circulating miR-21 for cancer: a systematic review and metaanalysis[J]. Gene, 2014, 533(1):389–397. doi: 10.1016/j.gene.2013.09.038.
