高蛋白饮食、返流性胆管炎以及胰十二指肠溃疡等均为胰腺癌 的高危因素,临床上早期胰腺癌无明显症状,部分胰腺组织被后腹膜覆盖,临床体征以及影像学检查的早期确诊率不高[1]。40%以上的胰腺癌特别是胰尾部或者体部的肿瘤确诊时已处于晚期,临床上难以彻底手术切除。相关研究证实胰腺癌的总体术后生存时间为12~14个月,5年生存率不足20%[2]。
手术切除、化学药物治疗以及分子靶向治疗为现阶段治疗胰腺癌的主要方式,但手术总体切除率较低,氟尿嘧啶、顺铂、奥沙利铂以及替吉奥均已广泛应用于术前新型辅助化疗或者术后综合性治疗,但患者的5年生存率仍不足25%,具有一定的局限性[3-4]。本次研究重在探讨新型分子靶向药物树突状细胞(DC)-细胞因子诱导的杀伤细胞(CIK)治疗联合替吉奥化疗对于胰腺癌患者预后的影响。
1 资料与方法
1.1 一般资料
选取2015年1月—2016年7月在广州医科大学附属肿瘤医院腹外科收治的96例转移性胰腺癌患者采用随机数字表法分为两组:替吉奥化疗+DC-CIK治疗组(观察组)和单纯替吉奥化疗组(对照组),每组48例。
观察组48例患者,其中男28例,女20例;年龄32~69岁,平均年龄(48.8±9.7)岁;入组时体力状况ECOG评分1分32例,2分16例;肿瘤原发部位:胰头34例,胰体7例,胰尾7例;转移部位:肝脏转移33例,腹腔或腹膜后淋巴结转移19例。对照组48例患者,其中男32例,女16例;年龄34~69岁,平均年龄(50.2±10.4)岁;入组时体力状况ECOG评分1分34例,2分14例;肿瘤原发部位:胰头32例,胰体9例,胰尾7例;转移部位:肝脏转移35例,腹腔或腹膜后淋巴结转移18例。两组患者的年龄、性别的各项基础资料比较差异均无统计学意义(P>0.05),具有可比性。
1.2 纳入排除标准
1.2.1 纳入标准 ⑴ 胰腺癌患者的诊断主要依据穿刺活检、细胞学检查证实;⑵ 根据世界卫生组织(WHO)2010年胰腺癌临床分期诊治标准均为III、IV期患者;⑶ 至少具有1个可测量的实体病灶;⑷ 既往未接受手术、放化疗治疗;⑸ 患者ECOG-PS评分<70分,预计生存时间<3个月;⑹ 治疗前与患者签订相关协议,符合医学伦理委员会的要求。
1.2.2 排除标准 ⑴未经病理学证实的患者;⑵ 既往接受手术治疗或放化疗治疗的患者;⑶ 预计生存时间<3个月的患者;⑷ 对本研究治疗方法严重不耐受的患者。
1.3 方法
两组患者化疗前均常规检查血常规、肝肾功能以及电解质等,进而排除化疗禁忌证,对照组患者采用替吉奥(江苏凯基生物科技有限公司生存,批号:H0222309493),口服,40 mg/d,连续口服28 d为1个周期,停药14 d,3个周期为1个疗程。观察组在对照组的基础上联合使用DC-CIK治疗,治疗前采取静脉血,培养15 d成熟后测量DC-CIK的细胞浓度,>1×109时给与DC-CIK输注治疗,每例每疗程回输细胞总数>7×109。细胞输注的过程中注意无菌原则,同时两组患者均给与静脉补充保肝、止吐等液体,维持24 h补液量达2~2 500 mL。比较治疗前与2个疗程结束后两组患者相关指标。
1.4 疗效指标
1.4.1 观察指标 ⑴ 近期疗效评价标准参照RECIST实体瘤疗效评价标准分为:完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD);缓解率=(CR+PR)/本组样本量×100%、总有效率=(CR+PR+SD)/本组样本量×100%。⑵ 免疫学指标:对比两组患者化疗前后的外周血T淋巴细胞亚群(CD3+、CD4+、CD8+、CD4+/CD8+)、γ-干扰素(IFN-γ)、白细胞介素4(IL-4)的水平变化。⑶ 毒副反应参照WHO毒副反应5级分级标准 [5]:0度,无毒副作用;I度,轻度反应;II度,中度毒副反应;III度,毒副反应重度;IV度,有严重的并发症,根据患者可耐受程度,本研究将毒副反应II+III+IV度认为发生了毒副反应。⑷ 远期预后指标:远期预后主要对比两组患者的1、2、3年生存率差异,主要通过电话随访、患者到门诊接受随诊检查的方法进行随访观察,第1年每隔1个月进行1次随访,1年以后每3个月进行1次随访。
1.4.2 实验室检测 采集患者清晨空腹血5 mL,置于肝素钠抗凝管中,采用流式细胞仪双标法进行CD4+CD8+调节性T细胞以及T淋巴细胞亚群CD3、CD4、CD8以及CD4/CD8的表达检测。相关标记操作于5 mL抗凝管中进行,100 µL全血与CD4-FITC/CD8-PE抗体室温反应25min,采用红细胞裂解液Optilyse C溶血素溶解红细胞,PBS液体洗涤3遍,每次5min,生理盐水重新悬浮细胞,上机检测(FACS Calibur流式细胞仪购自美国BD公司)。IFN-γ、IL-4采用ELISA法进行蛋白水平的检测:经 1 500r/min离心 5min后得到血清,4℃保存待测,以标准品稀释液将标准品复溶,静置15min后混匀,背比稀释为7个浓度,取出板条,除了对照孔外每个孔加入不同浓度的标准品,剂量为100 µL/孔,采用封板盖封住,室温反应120min,使用PBS液体洗涤3次,除了空白对照孔,每孔加入检测液(100 µL),室温孵育1 h,PBS洗涤3次,加入底物(50 µL/孔),避光孵育25min,加入终止液5min后测定450 nm处吸光度。
1.5 统计学处理
数据分析在SPSS 16.0软件包中处理,正态分布的计量指标采用均数±标准差( ±s)表示,组间计量资料比较采用t假设检验,计数资料假设检验采用χ2检验,生存率估计和比较分别采用Kaplan-Meier法和Log-rank检验,P<0.05为差异有统计学意义。
±s)表示,组间计量资料比较采用t假设检验,计数资料假设检验采用χ2检验,生存率估计和比较分别采用Kaplan-Meier法和Log-rank检验,P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者的近期疗效
治疗结束后2周,观察组患者的缓解率与对照组的比较(39.58% vs. 27.08%),差异无统计学意义(P>0.05);观察组的总有效率高于对照组的(77.08% vs. 58.33%),差异有统计学意义(P<0.05)(表1)。
表1 两组患者的近期疗效比较(n=48)
Table 1 Comparison of the short-term efficacy of the two groups of patients (n=48)
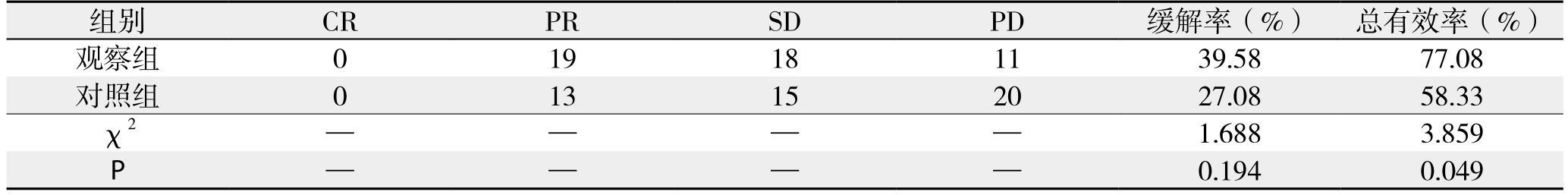
组别 CR PR SD PD 缓解率(%) 总有效率(%)观察组 0 19 18 11 39.58 77.08对照组 0 13 15 20 27.08 58.33 χ2 — — — — 1.688 3.859 P——0.194 0.049
2.2 两组患者的外周血T淋巴细胞亚群变化
观察组与对照组化疗前的CD3+细胞、CD4+细胞、CD8+细胞、CD4+/CD8+值差异无统计学意义(均P>0.05),化疗后观察组的CD3+细胞、CD4+细胞、CD4+/CD8+值明显的高于对照组,CD8+细胞明显低于对照组(均P<0.05)(表2)。
表2 两组患者的外周血T淋巴细胞亚群变化(n=48, ±s)
±s)
Table 2 Changes in T-lymphocyte subsets in the two groups of patients (n=48, ±s)
±s)
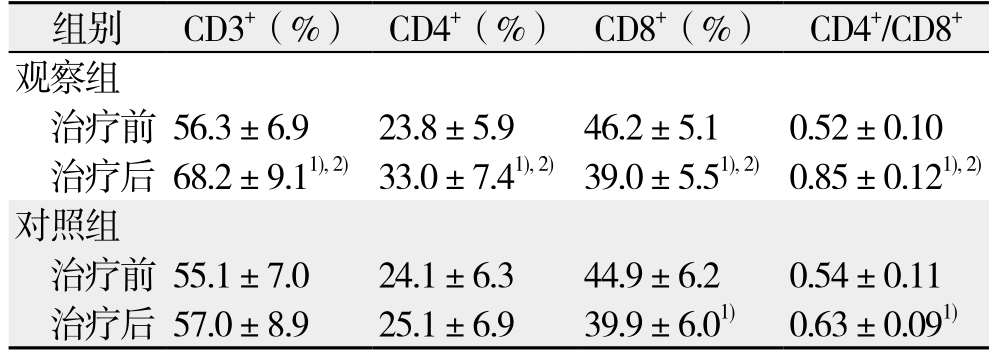
注:1)与本组治疗前比较,P<0.05;2)与对照组治疗后比较,P<0.05
Note: 1) P<0.05 vs. the same group before treatment; 2) P<0.05 vs. control group after treatment
组别 CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+观察组治疗前 56.3±6.9 23.8±5.9 46.2±5.1 0.52±0.10治疗后 68.2±9.11),2)33.0±7.41),2)39.0±5.51),2)0.85±0.121),2)对照组治疗前 55.1±7.0 24.1±6.3 44.9±6.2 0.54±0.11治疗后 57.0±8.9 25.1±6.9 39.9±6.01) 0.63±0.091)
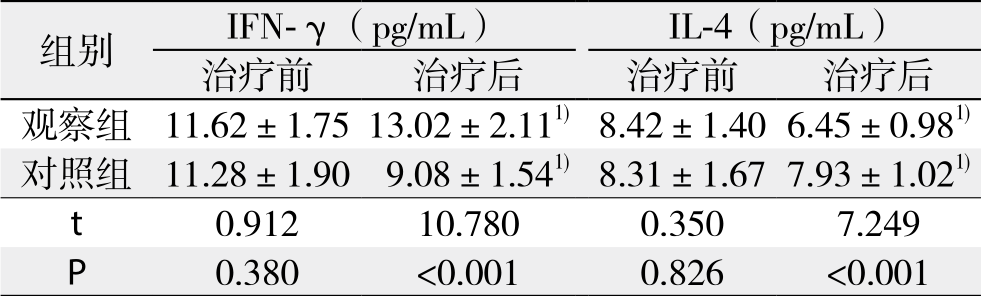
2.3 两组患者的外周血IFN-γ、IL-4水平比较
观察组和对照组化疗前的IFN-γ、IL-4水平差异无统计学意义(均P>0.05),化疗后观察组的IFN-γ明显的高于对照组、IL-4水平明显的低于对照组(均P<0.05)(表3)。
表3 两组患者的外周血IFN-γ、IL-4水平变化(n=48, ±s)
±s)
Table 3 Changes in peripheral blood IFN-γ and IL-4 levels in the two groups of patients (n=48, ±s)
±s)
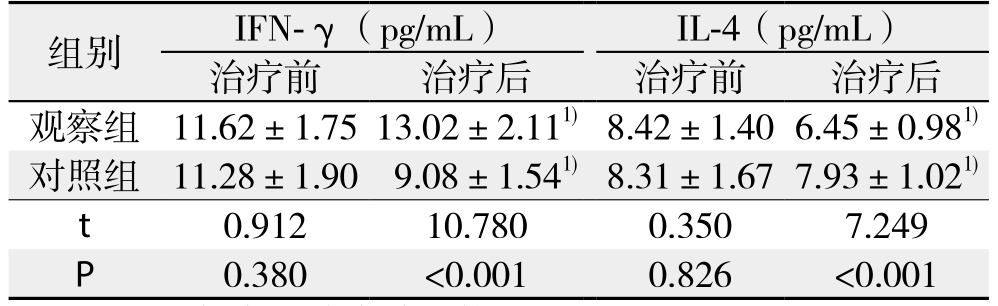
注:1)与本组治疗前比较,P<0.05
Note: 1) P<0.05 vs. the same group before treatment
2.4 两组患者的治疗过程中的毒副反应比较
观察组和对照组化疗过程中各种毒副反应(II+III+IV度)的发生率差异均无统计学意义(均P>0.05)(表4)。
2.5 两组患者的远期生存情况比较
治疗后,观察组的平均生存期为15.0个月,对照组组为10.0个月,差具有统计学意义(Logrank:Mantel-Cox=9.829,P=0.005)(图1)。观察组患者1、2、3年生存率分别为66.67%、29.17%、8.33%,对照组分别为43.75%、10.42%、0,观察组1、2、3年生存率均高于对照组,且差异均具有统计学意义(均P<0.05)(表5)。
表4 两组患者的治疗过程中的毒副反应比较[n=48,n(%)]
Table 4 Comparison of the incidence of adverse reactions in the two groups of patients [n=48, n (%)]
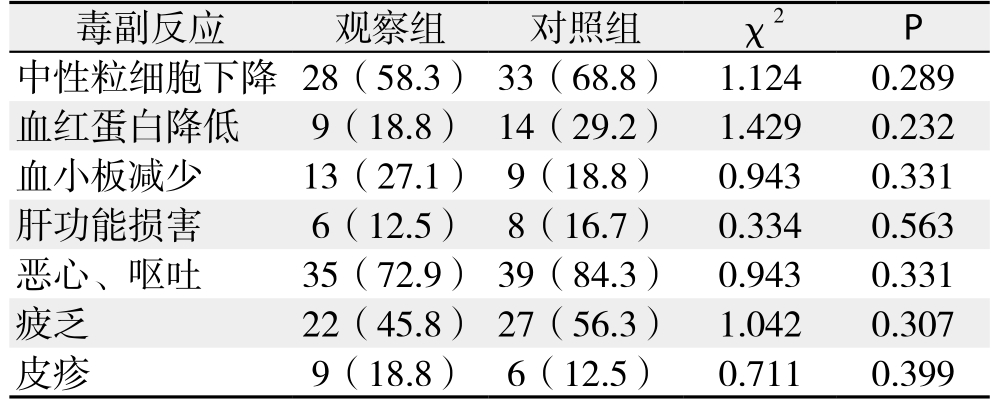
毒副反应 观察组 对照组 χ2 P中性粒细胞下降 28(58.3) 33(68.8) 1.124 0.289血红蛋白降低 9(18.8) 14(29.2) 1.429 0.232血小板减少 13(27.1) 9(18.8) 0.943 0.331肝功能损害 6(12.5) 8(16.7) 0.334 0.563恶心、呕吐 35(72.9) 39(84.3) 0.943 0.331疲乏 22(45.8) 27(56.3) 1.042 0.307皮疹 9(18.8) 6(12.5) 0.711 0.399
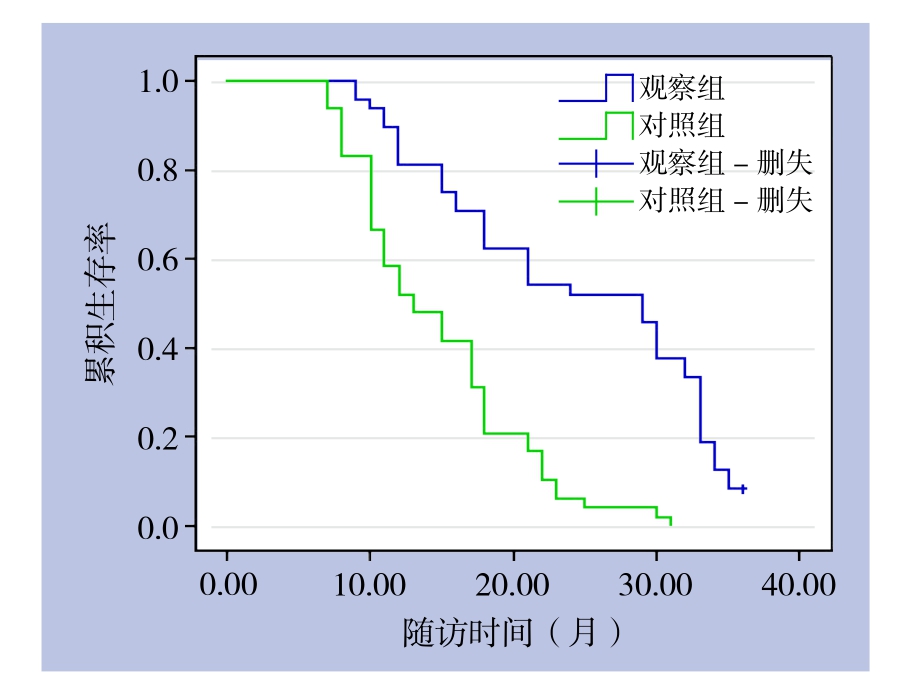
图1 两组患者的生存曲线
Figure 1 Survival curves of the two groups of patients
表5 两组患者生存率比较
Table 5 Comparison of the survival rates between the two groups of patients
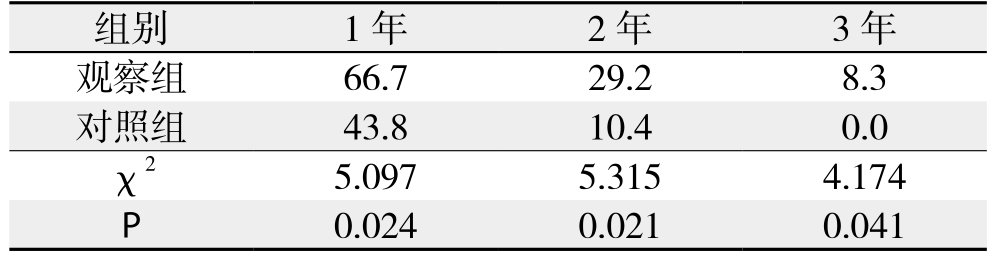
组别 1年 2年 3年观察组 66.7 29.2 8.3对照组 43.8 10.4 0.0 χ2 5.097 5.315 4.174 P 0.024 0.021 0.041
3 讨 论
胰腺癌是一种恶性程度很高、诊断和治疗都很困难的消化道恶性肿瘤,约90%为起源于腺管上皮的导管腺癌。其发病病因较为复杂,吸烟、饮酒、高脂肪和高蛋白饮食以及遗传因素均与胰腺导管上皮的病变有关,近年来在老年糖尿病患者以及代谢综合症患者中发生胰腺癌的基础发病率可增加至正常人群的2~3倍。呕心呕吐、乏力、阻塞性黄疸以及腹部包括多为患者的中晚期表现,早期临床表现以及特征缺乏特异性,通过血清肿瘤标志物CA19-9、CA125、腹部B超以及腹部CT平扫可以提高早期诊断水平,但仍然存在30%~45%左右的胰腺癌患者确诊时已处于晚期而失去手术机会[5-7]。局部侵犯、包膜浸润、淋巴结转移为胰腺癌常见的转移方式,神经束膜、束膜间隙等通过可以促进导管上皮腺体的血管侵犯[8],导致根治性手术术后残留以及复发。在胰腺癌手术术后以及对于无法手术的患者,均可以采用顺铂、氟尿嘧啶、吉西他滨以及伊立替康为基础进行化疗,临床效果较为显著,可改善25%左右的中晚期胰腺癌的生存时间以及生活质量[9-10]。然而对于分化程度较高、淋巴结转移较多的胰腺癌患者的效果存在一定的争议。近年来分子靶向治疗通过特异性抑制肿瘤发生发展过程中的相关信号通路或者作用靶点,进而抑制细胞增殖、促进免疫监察作用。
免疫治疗主要是通过注射患者自体的经体外活化、扩增的免疫活性细胞(DC、CIK等),激发或调动机体的免疫系统,增强肿瘤免疫性,进而杀死或抑制肿瘤细胞的增长。DC是有效的专职抗原提呈细胞,成熟的DC可以通过II型组织相容性抗原(MHC-II)等途径提呈肿瘤抗原,增强CIK的增殖以及杀肿瘤细胞作用。观察组胰腺癌患者采用分子靶向治疗后部分缓解率无明显改变,但处于疾病进展期的胰腺癌患者仅为11例,明显少于对照组的20例,总体有效率达77.08%,提示了联合DC-CIK治疗对于胰腺癌近期临床疗效的改善作用。以往的抗肿瘤效应细胞相比,新型分钟靶向药物DC-CIK细胞杀瘤活性更强[11-12],同时由于采自自体血而减少了白细胞表面抗原受体阳性导致的免疫排除反应的发生。曾复等[13-14]研究了185例胰头导管腺体采用65 mg/d卡铂化疗的临床效果,发现联合使用树突状细胞刺激诱导的杀伤细胞自体注射可以抑制25%左右处于疾病进展期患者短期内复发,总体缓解率可达85%。远期疗效的观察发现,观察组患者1、2、3年生存率分别为66.67%、29.17%、8.33%,且均显著的高于对照组,CD3+CD8+T细胞和CD3+CD56+T细胞对于免疫应答的增强以及Th1/Th2细胞平衡的稳定,可以显著影响机体的远期炎症反应以及体液免疫的负反馈调节机制[15-16],有利于抑制肿瘤复发和淋巴结转移,提高5年生存率。同时应用DC-CIK治疗具有一定的临床安全性,呕心呕吐、白细胞降低以及肝肾功能损伤均为常规化疗的副反应,经过集落细胞刺激因子以及易散复保肝治疗后均得以缓解[17-18]。本次研究在观察联合分子靶向化疗的基础上进一步探讨其作用机制,发现化疗后观察组的CD3+、CD4+、CD4+/CD8+值显著的高于对照组,CD4+、CD4+/CD8+表达的增强有利于促进机体的细胞免疫抗原提呈效应,而CD3+阳性率的增加可以显著促进替吉康对于DNA双链的损伤,导致染色体复制以及G0或者S期的细胞增殖明显受到抑制。IFN-γ、IL-4是评估机体肿瘤免疫应答过程中相关炎症损伤,IFN-γ可以诱导抗原提呈细胞(APC)以及树突状细胞对于NKT淋巴细胞活化作用[4,19-21],进而杀伤肿瘤细胞,而IL-4是机体局部炎症反应的枢纽性调控因子,IL-4的过度浓集可以增加组织损伤以及淋巴管侵犯的程度[22-24]。本研究发现,化疗后观察组的IFN-γ显著的高于对照组、IL-4水平显著的低于对照组,提示了联合DCCIK化疗对于机体炎症以及免疫诱导调控方面的整体获益性。
本研究显示:DC-CIK联合常规化疗治疗转移性胰腺癌患者,可以显著改善患者的疾病缓解率、提高生存率 ,DC-CIK对于胰腺癌分子靶向治疗的作用机制可能与CD4+/CD8+、IFN-γ等表达增强有关 。本研究为单中心研究,且样本量相对较小,虽可在一定程度上说明问题,但仍需多中心大样本的研究来证实。
参考文献
[1]朱斌, 刘腾, 余克富, 等.吉西他滨联合白蛋白结合型紫杉醇化疗方案在胰腺癌治疗中的应用研究[J]. 中国药学杂志, 2015,50(15):1309–1312. doi:10.11669/cpj.2015.15.010.Zhu B, Liu T, Yu KF, et al. Progress of Gemcitabine Plus Nab-Paclitaxel in Treatment of Metastatic Pancreatic Cancer[J]. Chinese Pharmaceutical Journal,2015,50(15):1309–1312. doi:10.11669/cpj.2015.15.010.
[2]伦俊杰,赵俊玲,孙建业,等.CT引导下125I放射性粒子植入联合化疗对中晚期胰腺癌的疗效[J].介入放射学杂志,2015, 24(6):494–497. doi:10.3969/j.issn.1008–794X.2015.06.007.Lun JJ, Zhao JL, Sun JY, et al. CT-guided 125I radioactive seed interstitial implantation combined with chemotherapy for advanced pancreatic carcinoma:analysis of therapeutic efficacy[J]. Journal of Interventional Radiology,2015, 24(6):494–497.doi:10.3969/j.issn.1008–794X.2015.06.007.
[3]汤忠祝, 刘冠, 郑晓, 等. C反应蛋白、白蛋白、血红蛋白与老年局部晚期胰腺癌放化疗的相关性[J].中国老年学杂志, 2014,34(19):5413–5414. doi:10.3969/j.issn.1005–9202.2014.19.039.Tang ZZ, Liu G, Zheng X, et al. Correlations of C-reactive protein,albumin and hemoglobin with efficacy of chemoradiotherapy in old patients with locally advanced pancreatic cancer[J]. Chinese Journal of Gerontology, 2014, 34(19):5413–5414. doi:10.3969/j.issn.1005–9202.2014.19.039.
[4]张太平, 曹喆, 赵玉沛. 胰腺癌的化疗与放疗[J]. 中华消化外科杂志, 2015, 14(8):619–622.doi:10.3760/cma.j.issn.1673–9752.2015.08.006.Zhang TP, Cao Z, Zhao YP. Development of chemotherapy and radiotherapy for pancreatic cancer[J]. Chinese Journal of Digestive Surgery, 2015, 14(8):619–622. doi:10.3760/cma.j.issn.1673–9752.2015.08.006.
[5]武春涛, 刘亮, 徐永峰, 等. 脾多肽对胰腺癌根治术后化疗患者细胞免疫功能的影响[J]. 中国癌症杂志, 2014, 24(12):906–913.doi:10.3969/j.issn.1007–3939.2014.12.005.Wu CT, Liu L, Xu YF, et al. Effect of lienal polypeptide injection on cellular immunity of patients with chemotherapy after pancreatic radical resection[J]. China Oncology, 2014, 24(12):906–913.doi:10.3969/j.issn.1007–3939.2014.12.005.
[6]欧阳华强, 潘战宇, 刘方, 等. 中药联合全身化疗和(或)动脉灌注化疗治疗胰腺癌肝转移的回顾性研究[J]. 中国中西医结合杂志,2015,33(6):654–658.Ouyang HQ, Pan ZY, Liu F, et al. A retrospective study of chinese herbal medicine combined with systemic chemotherapy and/or regional arterial perfusion for pancreatic cancer with liver metastases[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2015, 33(6):654–658.
[7]马超, 丁月超, 黄长山, 等. 微小RNA-200c逆转人胰腺癌干细胞化疗耐药的研究[J]. 中华实验外科杂志, 2015, 32(4):761–763.doi:10.3760/cma.j.issn.1001–9030.2015.04.033.Ma C, Ding YC, Huang CS, et al.Reversion of the chemo-resistance of human pancreatic cancer stem cells by microRNA-200c[J].Chinese Journal of Experimental Surgery, 2015, 32(4):761–763.doi:10.3760/cma.j.issn.1001–9030.2015.04.033.
[8]Kirillova EN, Zakharova ML, Muksinova KN, et al. Quantitative assessment of regulatory proteins in blood as markers of radiation effects in the late period after occupational exposure[J]. Health Phys, 2012, 103(1):28–36. doi: 10.1097/HP.0b013e31824f30e5.
[9]曾韦, 何剪太. siRNA沉默胰腺癌Panc-1中THOC1对吉西他滨敏感性的影响[J]. 中国现代医学杂志, 2014, 24(36):23–26.Zeng W, He JT. Effects of silencing THOC1 by siRNA on sensitivity of pancreas cancer cells Panc-1 to gemcitabine[J]. China Journal of Modern Medicine, 2014, 24(36):23–26.
[10]施惠斌, 陈颐, 程洁敏, 等. 无法手术切除的胰腺癌数字减影血管造影(DSA)的动脉造影分析及其对经动脉灌注化疗(TAI)的指导价值[J].复旦学报: 医学版, 2014, 41(3):352–356. doi:10.3969/j.issn.1672–8467.2014.03.013.Shi HB, Chen Y, Cheng JM, et al. The analysis of digital subtract angiography (DSA) in advanced pancreatic cancer and its value in transcathether infusion (TAI)[J]. Fudan University Journal of Medical Sciences, 2014,41(3):352–356. doi:10.3969/j.issn.1672–8467.2014.03.013.
[11]洪国斌, 徐启兰, 梁碧玲, 等. MRI常规序列评估胰腺癌化疗后的疗效[J]. 中国医学影像学杂志, 2012,20(7):489–491. doi:10.3969/j.issn.1005–5185.2012.07.003.Hong GB, Xu QL, Liang BL, et al. Evaluation of Conventional MRI Sequences for Post Chemotherapy Response in Pancreatic Carcinoma[J].Chinese Journal of Medical Imaging, 2012,20(7):489–491. doi:10.3969/j.issn.1005–5185.2012.07.003.
[12]沈伟生, 舒中琴, 邓立春, 等. 康莱特联合吉西他滨三维适形同步放化疗治疗局部晚期胰腺癌临床观察[J]. 中国中西医结合杂志,2012,32(7):902–905.Shen WS, Shu ZQ, Deng LC, et al. Curative Effect of 3D-CRT Combined with Gemcitabine Concurrently with Addition of Kanglaite Injection in Treatment of Locally Advanced Pancreatic Carcinoma[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2012, 32(7):902–905.
[13]曾复, 葛春林. 胰腺癌185例诊治回顾分析[J]. 中国普通外科杂志,2015, 24(3):336–342.doi:10.3978/j.issn.1005–6947.2015.03.006.Zeng F, Ge CL. Diagnosis and treatment of pancreatic cancer:a retrospective analysis of 185 cases[J]. Chinese Journal of General Surgery, 2015, 24(3):336–342. doi:10.3978/j.issn.1005–6947.2015.03.006.
[14]杜渐, 罗海峰, 谭广, 等. 下调miR-146a对树突状细胞诱导的抗胰腺癌免疫反应的影响[J]. 中华肝胆外科杂志, 2014, 20(9):686–688. doi:10.3760/cma.j.issn.1007–8118.2014.09.019.Du J, Luo HF, Tan G, et al. Effect of down-regulation of miR-146a on dendritic cell-induced anti-immunological reactions in pancreatic cancer[J]. Chinese Journal of Hepatobiliary Surgery, 2014,20(9):686–688. doi:10.3760/cma.j.issn.1007–8118.2014.09.019.
[15]马湘, 曲林林, 张明进, 等. 进展期胰腺癌患者姑息性旁路手术后的预后因素分析[J]. 中国普通外科杂志, 2014, 23(9):1195–1199.doi:10.7659/j.issn.1005–6947.2014.09.008.Ma X, Qu LL, Zhang MJ, et al. Prognostic factors in patients undergoing palliative bypass surgery for advanced pancreatic cancer[J]. Chinese Journal of General Surgery, 2014, 23(9):1195–1199. doi:10.7659/j.issn.1005–6947.2014.09.008.
[16]王树钢, 于巍巍, 费立明. 胰腺癌早期诊断方法及临床分析(附264例报告)[J]. 中国现代普通外科进展, 2014, 17(9):743–746.doi:10.3969/j.issn.1009–9905.2014.09.024.Wang SG, Yu WW, Fei LM, et al. Early detection methods and clinical analysis of pancreatic cancer: a report of 264 cases[J].Chinese Journal of Current Advances in General Surgery, 2014,17(9):743–746. doi:10.3969/j.issn.1009–9905.2014.09.024.
[17]吴梦瑶, 谢宇锋, 陶敏. Wnt/β-catenin信号通路及其在胰腺癌发生发展中的作用[J]. 现代仪器与医疗, 2013, 19(5):15–20.Wu MY, Xie YF, Tao M. Wnt/β-catenin Signaling Pathway And Its Function During Progression Of Pancreatic Cancer[J]. Modern Instruments, 2013, 19(5):15–20.
[18]Aisenstadt AA, Supilnikova OV, Bagaeva VV, et al. Mesenchymal stem cells in fl uence on leukocytes allergen-speci fi c reactions in case of atopic hypersencitivity[J]. Tsitologiia, 2015, 57(3):197–203.
[19]Schneider EM, Flacke S, Liu F, et al. Autophagy and ATP-induced anti-apoptosis in antigen presenting cells (APC) follows the cytokine storm in patients after major trauma[J]. J Cell Commun Signal, 2011, 5(2):145–156. doi: 10.1007/s12079–010-0113-z.
[20]Laprevotte E, Ysebaert L, Klein C, et al. Endogenous IL-8 acts as a CD16 co-activator for natural killer-mediated anti-CD20 B cell depletion in chronic lymphocytic leukemia[J]. Leuk Res, 2013,37(4):440–446. doi: 10.1016/j.leukres.2012.11.015.
[21]杨尹默. 胰腺癌外科治疗的现状、存在问题与展望[J]. 中国普通外科杂志, 2016, 25(9):1231–1235. doi:10.3978/j.issn.1005–6947.2016.09.001.Yang YM. Surgical managements of pancreatic cancer:current status and future directions[J]. Chinese Journal of General Surgery,2016, 25(9):1231–1235. doi:10.3978/j.issn.1005–6947.2016.09.001.
[22]牟一平, 金巍巍. 腹腔镜手术治疗胰腺癌的现状与展望[J].中华消化外科杂志, 2016, 15(9):872–877. doi:10.3760/cma.j.issn.1673–9752.2016.09.005.Mou YP, Jin WW. Present status and prospects of laparoscopic surgery for pancreatic caner[J]. Chinese Journal of Digestive Surgery, 2016, 15(9):872–877. doi:10.3760/cma.j.issn.1673–9752.2016.09.005.
[23]孙备, 李乐. 胰腺癌行标准与扩大的胰腺切除术定义与手术范围——大的胰腺国际胰腺外科研究组共识解读[J]. 中国实用外科杂志, 2015, 35(1):11–15. doi:10.7504/CJPS.ISSN1005–2208.2015.01.04.Sun B, Li L. The definition and excision extension of standard pancreatectomy and extended pancreatectomy-2013: interpretation of the International Study Group on Pancreatic Surgery by the consensus[J]. Chinese Journal of Practical Surgery, 2015, 35(1):11–15. doi:10.7504/CJPS.ISSN1005–2208.2015.01.04.
[24]杨尹默. 可能切除的胰腺癌外科治疗争议与共识[J]. 中国实用外科杂志, 2015, 35(1):54–56. doi:10.7504/CJPS.ISSN1005–2208.2015.01.16.Yang YM. Management strategies for borderline resectable pancreaticcancer[J]. Chinese Journal of Practical Surgery, 2015,35(1):54–56. doi:10.7504/CJPS.ISSN1005–2208.2015.01.16.
