肝细胞癌和肝内胆管结石目前最有效的治疗手段是手术切除[1-3],因肝脏解剖结构复杂、血管分布极其丰富,肝脏手术所面临着两个重大问题是出血和肝脏功能衰竭,直接影响着手术病死率和术后并发症的发生率[4-7],采取何种有效的肝脏血流控制技术一直为肝脏外科领域所关注的问题[8-9]。随着对肝脏解剖的认识、肝脏外科技术的发展以及对其生理病理的研究认识,肝脏血流阻断技术也在不断的革新。良好的肝脏血流阻断技术能在减少术中出血的同时最大限度的保护残肝的功能。本文旨在探讨肝叶血流阻断在右肝解剖性肝切除中的意义和价值。
1 资料及方法
1.1 一般资料
回顾性分析2016年1月—2017年4月南昌大学第二附属医院在右肝解剖性肝切除中采用肝叶血流阻断12例患者的临床资料,其中男7例,女5例;年龄32~75岁;2例患者有左半肝切除病史。原发性肝癌患者8例:局限在肝V段1例,肝VII段1例,肝VIII段1例,肝右后叶(VI、VII段)3例,肝右前叶(V、VIII段)2例;8例患者均为HBsAg(+)并伴有不同程度的肝硬化。肝内胆管结石患者4例:肝右后叶(VI、VII段)1例,肝VII段1例,肝VIII段2例。入选标准:术前、术中检查未发现肝外转移者;病变位于右肝且占据右肝右前叶或右后叶,或仅占据右肝一肝段;Child-Pugh分级A级或术前经治疗后转为Child-Pugh A级;无心肺功能不全不能耐受手术者。根据术前CT和(或)MRI、MRCP等影像学检查,12例患者肝脏病变均符合标准,且所有患者ICG试验明确的肝储备功能均能承受肝叶或肝段的切除。
1.2 手术方式
右上腹部反L型切口;常规探查腹腔并结合术中超声,明确肿瘤或结石情况:本组12例患者,术中探查与术前影像学均一致,8例肝占位性病变患者,肝脏均呈现不同程度的肝硬化,余肝脏和腹腔未见肿瘤转移情况;4例肝内胆管结石患者余肝脏均见结石情况,其中2例患者伴有局部肝萎缩表现。12例患者中2例患者有左半肝缺如。
右肝肝叶切除:常规方法切除胆囊,分离肝周组织及韧带,从胆囊三角处着手解剖第一肝门,骨骼化右肝蒂。在胆囊管切断处分离周围组织,显露肝外胆管,向上分离至三管汇合处。游离向左牵起肝总管,分离肝总管下方组织,显露肝右动脉,沿肝右动脉分离至右门静脉裂处,利用能量平台及吸引器精细分离周围组织,直至显露肝右动脉的右前、后叶分支。将肝右动脉向右下牵拉,分离肝右动脉下方组织,显露门静脉并分离至右前、右后叶分支。在分离门静脉右支时,精细解剖分离进入尾状叶的分支,避免损伤。分别悬吊并阻断进入预切除肝叶的肝动脉及门静脉,可见预切除肝叶出现明显缺血带,待缺血带完全显现之后标记。超声再次探查肿瘤或结石位置及肝内重要血管走形(尤其是肝静脉),用电刀标记肿瘤或结石位置及切除范围。松开阻断带5 min后再切断或阻断进入预切肝脏的肝动脉及门静脉。缝扎、牵拉切除标记线周围肝脏,利用超声刀和电刀对肝脏实质进行离断。切除肝右后叶时,需处理肝右后下静脉及肝短静脉;切除肝右前叶时,精细处理右门静脉干发出的尾状叶分支(图1)。
右肝肝段切除时第一肝门及右肝蒂骨骼化亦是如此。其主要确定肝段(V与VIII、VI与VII)之间的分界线,在明确局限在一肝段后,用术中超声定位门静脉肝段分支,在超声引导下用长针头穿刺肝段的门静脉分支并注入美蓝,对切除相应肝段进行染色(图2-3)。待完整切除病变肝段,检查有无出血及胆汁漏后,再解除入肝肝叶的血流阻断。
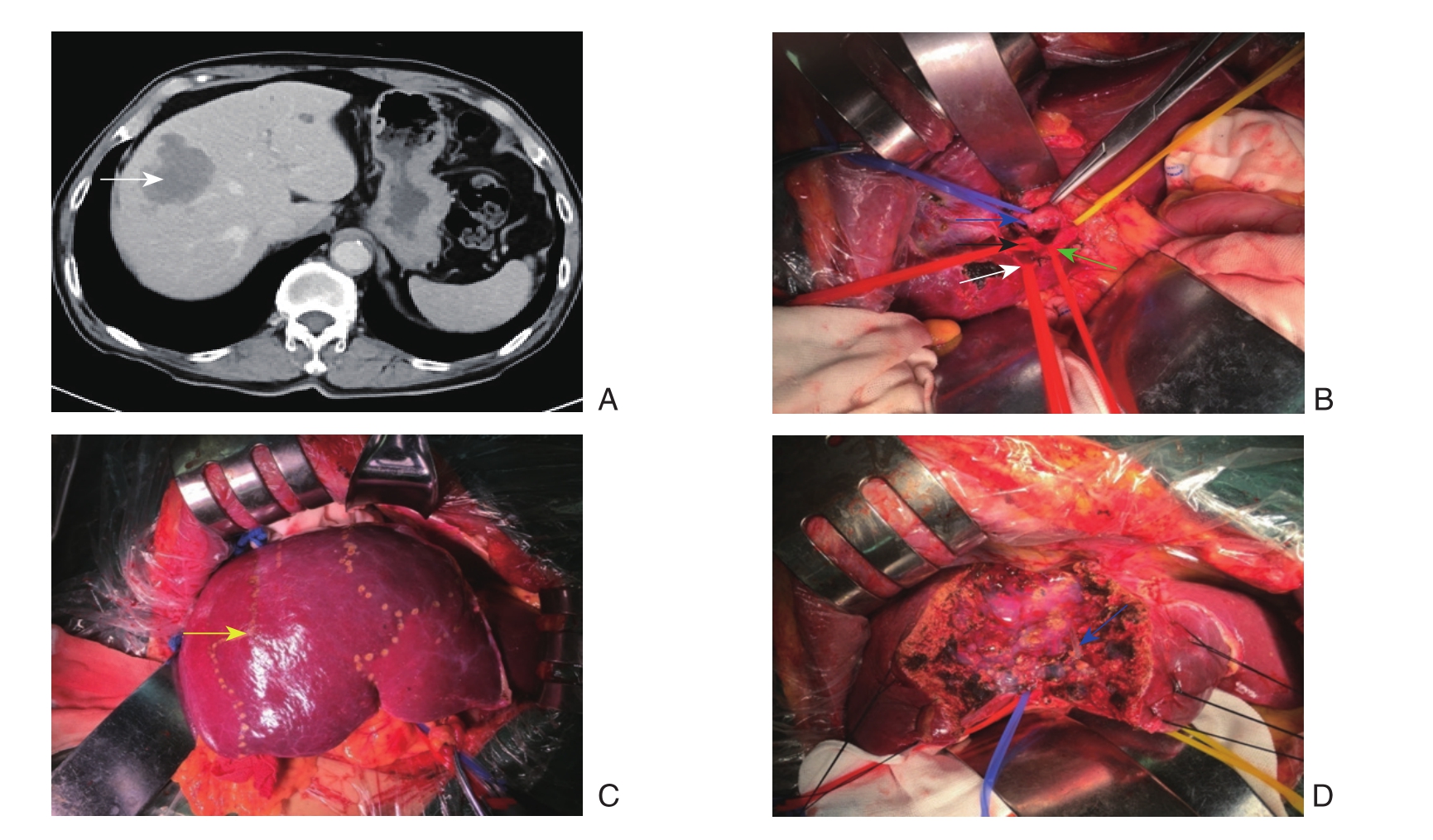
图1 右前叶血流阻断行右前叶原发性肝癌切除
A:上腹部CT示肝V、VIII原发性肝癌(白色箭头表示肝脏肿瘤);B:第一肝门骨骼化(蓝色箭头示门静脉右前叶分支;绿色箭头表示肝右动脉;黑色箭头示肝右动脉右前叶分支;白色箭头示肝右动脉右后叶分支);C:肝动脉与门静脉右前叶分支阻断后标记的缺血带(黄色箭头示缺血带);D:肿瘤切除后(蓝色箭头示肝中静脉)
Figure 1 Resection of the primary liver cancer in the right anterior lobe with vascular occlusion of the right anterior lobe of the liver
A: Upper abdominal CT showing primary liver cancer involving V and VIII hepatic segments (white arrow showing the liver tumor);B: Skeletonization of the fi rst hepatic portal (blue arrow showing the branch of the portal vein of the right anterior lobe; black arrow showing the branch of the right hepatic artery for the right anterior lobe; white arrow showing the branch of the right hepatic artery for the right posterior lobe); C: The ischemic zone after vascular occlusion of the branches of the right hepatic artery and portal vein for the right posterior lobe (yellow arrow showing the ischemic zone); D: View after tumor resection (blue arrow showing the middle hepatic vein)
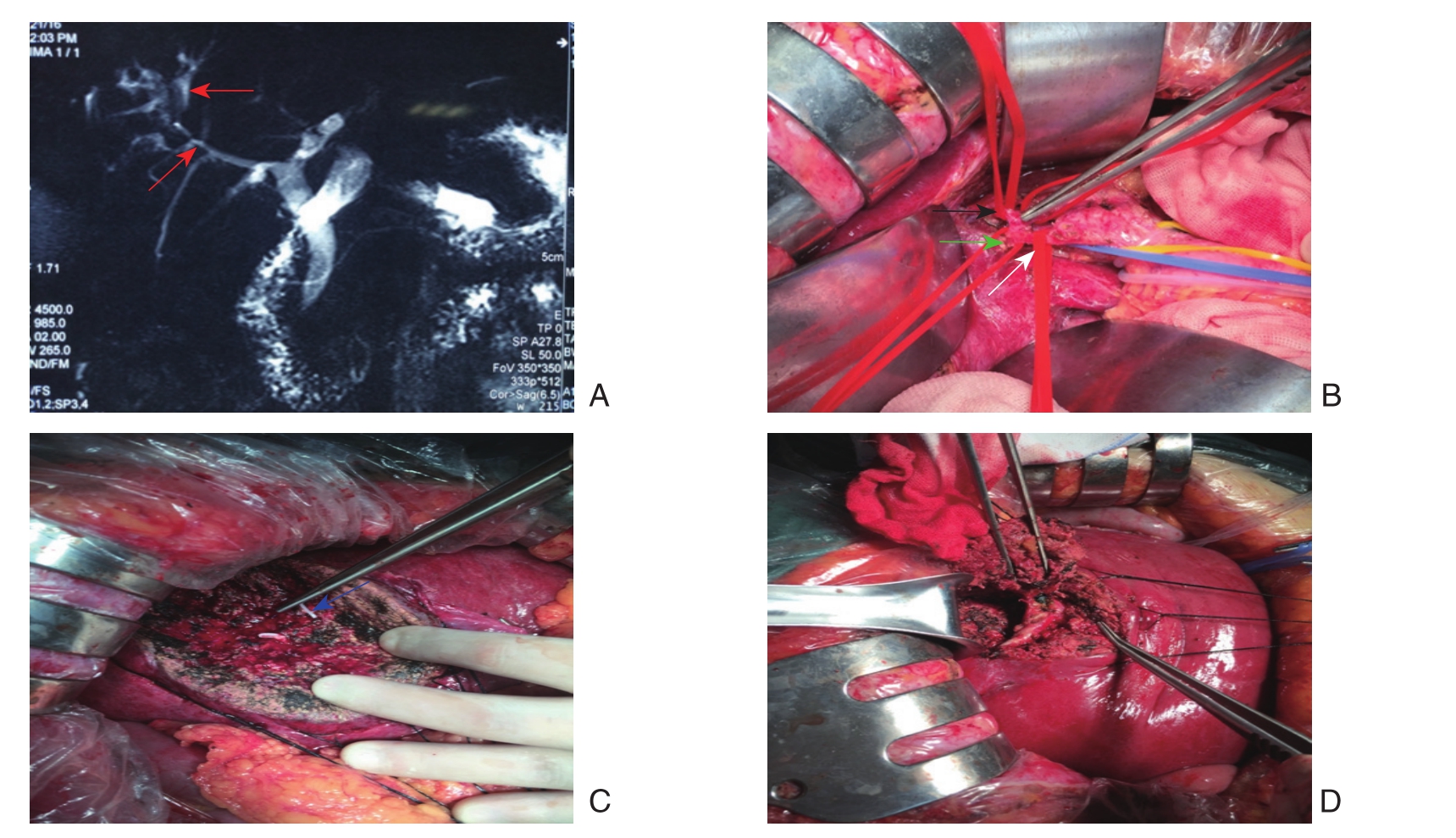
图2 右前叶血流阻断行肝VIII段肝内胆管结石手术切除
A:MRI+MRCP(红色箭头表示病变胆管区域);B-D:肝内胆管结石肝VIII段的手术切除(白色箭头表示肝右动脉;黑色箭头表示肝右动脉右前叶分支;绿色箭头表示肝右动脉右后叶分支;蓝色箭头表示肝中静脉)
Figure 2 Resection of intrahepatic stones in the VIII hepatic segment with vascular occlusion of the right anterior lobe
A: MRI+MRCP image (red arrow showing the diseased region); B–D: Resection of the VIII hepatic segment for intrahepatic stones (white arrow showing the right hepatic artery; black arrow showing the branch of the right hepatic artery for the right anterior lobe; green arrow showing the branch of the right hepatic artery for the right posterior lobe; blue arrow showing the middle hepatic vein)
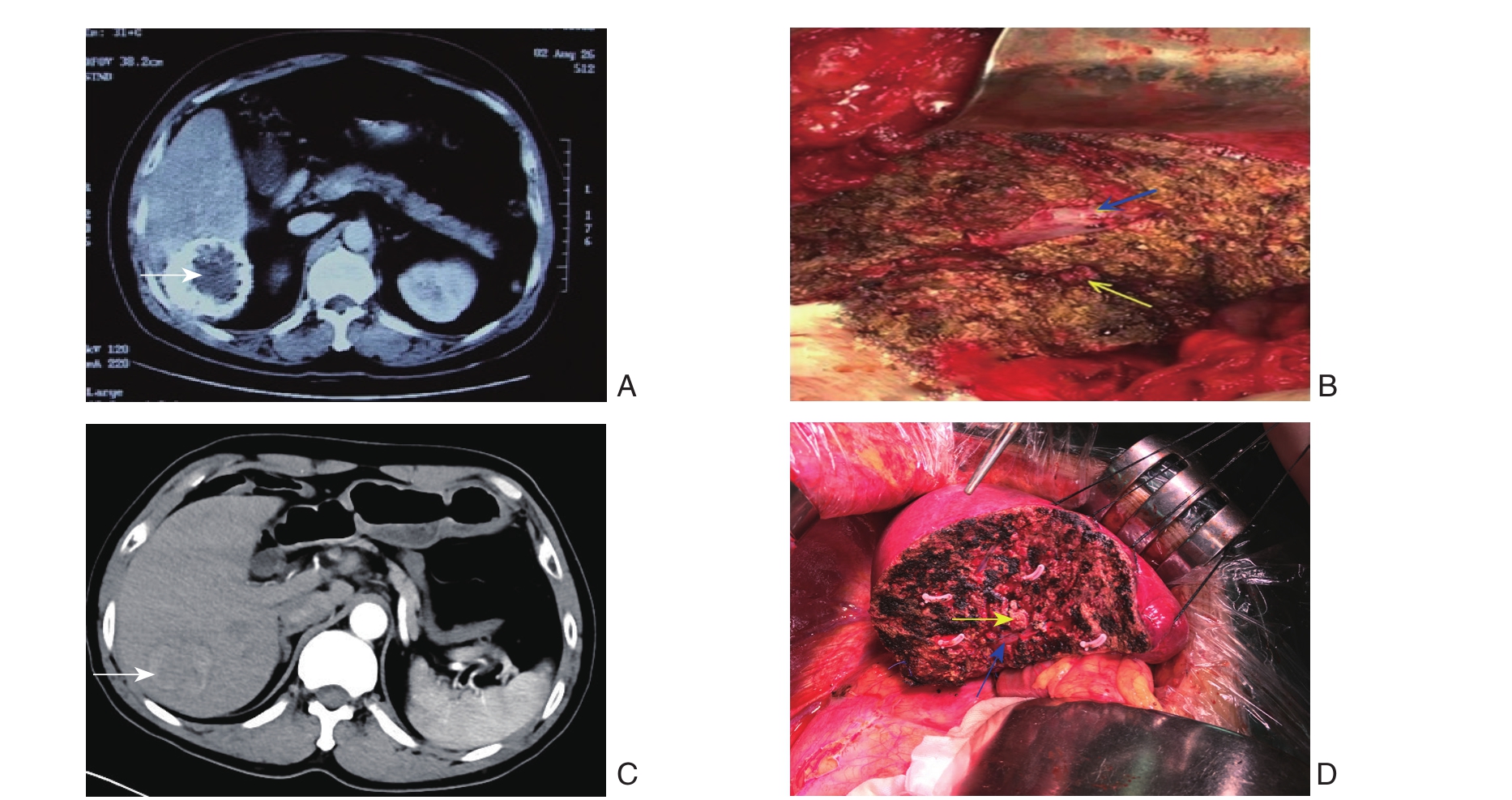
图3 右后叶血流阻断行肝VI段和肝VII段原发性肝癌切除
A:上腹部CT示肝VI段原发性肝癌(白色箭头表示肿瘤);B:肝VI段肝癌手术切除后(蓝色箭头表示肝右静脉;黄色箭头表示进入肝VI段肝蒂);C:上腹部CT示肝VII段原发性肝癌(白色箭头表示肿瘤);D:肝VII段肝癌手术切除后(蓝色箭头表示肝右静脉;黄色箭头表示进入肝VII段肝蒂)
Figure 3 Resection of the primary liver cancer in the VI or VII hepatic segment with vascular occlusion of the right posterior lobe of the liver
A: Upper abdominal CT showing liver tumor in the VI hepatic segment (whit arrow showing the tumor); B: View after resection of liver tumor in the VI hepatic segment (blue arrow showing the right hepatic vein; yellow arrow showing the hepatic pedicle entering into the VI hepatic segment); C: Upper abdominal CT showing liver tumor in the VII hepatic segment (whit arrow showing the tumor); D: View after resection of liver tumor in the VII hepatic segment (blue arrow showing the right hepatic vein; yellow arrow showing the hepatic pedicle entering into the VII hepatic segment)
2 结 果
2.1 肝切除范围
全组12例患者手术顺利完成,均成功施行肝叶血流阻断的右肝解剖性肝切除,肝内胆管结石患者术中均用胆道镜探查胆道。12例肝切除患者中,行肝V段切除1例,肝VII段切除2例,肝VIII段切除3例,右后叶切除4例,右前叶切除2例。
2.2 术中情况
所有患者术中除阻断病变肝叶入肝血流外,均未阻断其他肝叶的入肝血流、出肝血流。手术时间220~320 min不等,平均手术时间(263.33±27.99)min,个别患者手术时间的延长可能与第一肝门处的炎症水肿所致精细解剖时间延长相关;术中出血量300~600 mL,平均出血量(397.50±85.29)mL。
2.3 术后情况
患者术后第1、3、5天的总白蛋白(ALB)、血清胆红素(TBIL)、血清丙氨酸转氨酶(ALT)逐渐下降,术后第5天A L B、T B I L接近正常值(表1);术后并发胸腔积液1例,胆汁漏1例,经保守治疗后痊愈,所有患者均痊愈出院。
表1 12例患者术后的肝功能变化情况( ±s)
±s)
Table 1 Changes in postoperative liver function in the 12 patients (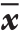 ±s)
±s)
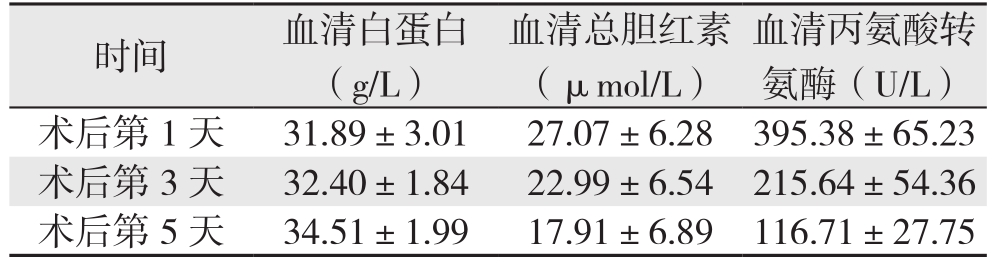
时间 血清白蛋白(g/L)血清丙氨酸转氨酶(U/L)术后第1天 31.89±3.01 27.07±6.28 395.38±65.23术后第3天 32.40±1.84 22.99±6.54 215.64±54.36术后第5天 34.51±1.99 17.91±6.89 116.71±27.75血清总胆红素(μmol/L)
3 讨 论
3.1 第一肝门阻断法的局限性
有效的肝脏血流控制技术能减少肝脏手术中的出血,减轻术中肝脏的缺血缺氧,保证手术的成功和减少术后并发症的发生。目前因操作简单、快速、有效,临床较多采用的是第一肝门阻断法(Pringle法),其是对入肝血流的全部阻断,在阻断手术区域肝脏血供的同时也阻断了正常肝脏组织的血供,易造成肝脏缺血一再灌注损伤,且术后肝损害大,恢复慢,尤其是在重度肝硬化患者中可导致严重的肝功能损害,甚至肝功能衰竭和死亡,严重影响预后[10-11]。同时由于门静脉的全部阻断影响着胃肠道静脉回流,导致胃肠道淤血、细菌移位和血液动力学的改变[12-13]。此外,Xia等[14]研究认为,肝缺血再灌注损伤是加速肿瘤生长的主要因素。
3.2 解剖性肝切除的重要性
有研究[15]统计了经外科治疗的1 450例原发性肝癌,其中86.8%合并肝炎、肝硬化,而肝炎、肝硬化患者肝功能储备差,且对术中缺血和失血的耐受性差,不能经受长时间的肝血流阻断和大出血。对于区域性肝内胆管结石患者,病变胆管是否完全切除是影响术后结石复发的关键因素[16]。肝脏每叶、段都拥有独立的血供及引流系统,对肝脏病变区域行解剖性切除能有效的减少术中出血、术后并发症的发生率[17-18]以及疾病的复发[19]。近年来,精准肝切理念在临床上不断的推广和应用,其旨在追求彻底清除目标病灶的同时,最大限度地确保剩余肝脏解剖结构完整和功能性体积的最大化,最大限度地控制手术出血和全身性创伤侵袭,最终使患者获得最佳康复效果[20-22]。而解剖性肝切除和肝叶血流阻断的有机结合,是对精准肝切较好的体现。
3.3 肝叶血流阻断与解剖性肝切除有机结合
本组12例患者均采用肝叶血流阻断行右肝病变区域肝叶或肝段的解剖性切除,对拟行手术区域肝叶的肝动脉及门静脉进行阻断,在有效控制手术区域血流的情况下最大限度的保留了正常肝组织的血供,减少了因缺血、缺氧、再灌注等对肝脏功能的影响。
3.4 肝叶血流阻断行右肝解剖性肝切除中需关注的问题
通过对术中操作、出血量、术后肝功能变化情况以及并发症的发生率的总结,笔者认为在肝叶血流阻断行右肝解剖性肝切除中值得关注的一些问题:⑴ 解剖第一肝门时可从切除后的胆囊三角处着手,并在第一肝门置预阻断带,以备骨骼化管道发生意外出血时能快速、有效的控制出血。骨骼化右肝蒂时可利用静脉拉钩、血管牵引带牵拉后进行精细解剖。⑵ 采用术中超声明确肝脏病变位置及数量,并仔细探查可能存在的术前影像学未发现的病灶,标记重要脉管走形,明确病灶和脉管之间的关系。⑶ 对病变存在的肝叶或肝段,采取先阻断再开放再阻断或切断的方法进行,第一次阻断时,观察缺血带的情况,并与术中超声观察到的病灶位置进行对比,标记拟离断部位,再对阻断的血流开放5 min后进行完全阻断或切断,能减少术中肝功能损伤及术后出血[23]。此外,沿缺血线离断肝实质,可减少术中出血[24]。⑷ 利用术中超声明确肝静脉位置及走行后,可先从肝脏下缘处着手,结合术中超声解剖离断肝脏至肝静脉边缘,并在术中超声的引导下从下至上沿肝静脉边缘向上离断肝脏,这也是寻找肝静脉及避免肝静脉损失的一种手段。⑸ 肝实质的离断根据脉管的走行及分布进行,外层的肝实质可对两侧进行缝扎牵拉离断,在有重要的脉管区域采用吸引器、能量平台、超声刀进行离断,并根据管道的粗细选择电凝或缝扎。⑹ 由于肝动脉、门静脉及胆管变异的发生率可高达46.7%[25-26],因此肝动脉、门静脉及胆管游离后宜先套带,临时予以结扎,待确定病灶位置与肝脏关系后,再作结扎、切断。
3.5 肝叶血流阻断行右肝解剖性肝切除的优点及不足之处
利用肝叶血流阻断行右肝解剖性肝切除存在的优点之处:⑴ 最大限度的减少了残肝的缺血再灌注损伤,减少了对肝脏功能的损害。本组12例患者只在术中阻断了需行手术肝脏区域的肝叶血流,保留了其余肝叶的血供,尤其是本组患者中还存在有左半肝切除史患者,术中可见左半肝缺如,如术中行半肝血流阻断,其相当于全部入肝血流的阻断,在肝体积较少的情况下再行全肝入肝血流的阻断,其对术后肝功能的恢复影响较大。⑵ 最大限度的保证的门静脉血流的回流,避免术后因肠道淤血和粘膜损伤带来的并发症的发生。⑶ 保证了术中操作时间的充足。在经典的Pringle法肝门阻断中,因其引起的缺血再灌注损伤及胃肠道淤血带来所带来的并发症导致切肝时间往往受到限制,尤其是伴有严重的肝硬化患者。而采取肝叶血流阻断行肝叶或肝段切除时,血流阻断区域仅有手术切除区域或附加的只有某一正常肝段在术中缺血,而余全部正常肝脏未有血流阻断。无需特别考虑肝血流阻断时间,其能让术者精细处理肝断面的血管、胆管,这对于减少术后并发症至关重要,且可减低结石的残留率及增加肝癌的根治率。本组12例患者中,术后并发1例胆汁漏,无出血,胆汁漏经保守治疗后痊愈。⑷ 利用缺血线和门静脉染色界限进行解剖性切除,避免了重要的管道损伤、严重出血和术后并发症的发生。⑸ 切除前对病变区域门静脉的阻断,能减少肿瘤细胞的转移[27]。对于此手术方式也存在一些不足之处:⑴ 需精细解剖第一肝门以及通往肝叶门静脉及肝动脉分支,在其上要花费精细解剖的时间。⑵ 精细解剖第一肝门时,可能会因为管道变异、炎症、粘连等因素,造成管道的损伤。⑶ 对手术医师资历及经验有较高要求,需熟悉肝脏的解剖及各管道可能存在的变异,并在术中能对各种管道变异做出准确判断及处理。
Pringle法因为简单、快捷、有效,但缺血再灌注损伤是其不容忽视的问题,尤其是严重的肝硬化患者。肝叶血流阻断完全保留了正常肝脏组织的血流,较好的减轻了肝脏缺血再灌注损伤等相关问题,在保证术中出血量的同时能最大程度的减轻肝脏的损伤。术前严格评估肝脏储备功能及影像学检查,明确肝脏管道可能存在的变异及周围情况,熟悉肝门解剖技巧及从容应对术中各种突发情况是手术成功的基础。具体选用何种血流阻断方法,应根据患者的身体状况、肝储备功能、肝硬化程度、肝脏病灶的位置、大小,术者的习惯、经验选择合理的肝血流阻断方法。
参考文献
[1] Minata M, Harada K H, Kudo M, et al. The prognostic value of vascular endothelial growth factor in hepatocellular carcinoma for predicting metastasis after curative resection[J]. Oncology, 2013,84(Suppl 1):75–81. doi: 10.1159/000345894.
[2] 李淳洋, 倪其泓, 王坚. 复杂肝内胆管结石60例诊治分析[J]. 中国实用外科杂志, 2016, 36(3):316–318.Li CY, Ni QH, Wang J. Diagnosis and treatment of complicated intrahepatic bile duct stone: An efficacy analysis of 60 cases[J].Chinese Journal of Practical Surgery, 2016, 36(3):316–318.
[3] 张贯启, 张志伟, 项帅, 等. 大肝癌手术切除术中不同肝血流阻断方法的临床研究[J]. 中国普通外科杂志, 2015, 24(1):18–22.doi:10.3978/j.issn.1005–6947.2015.01.004.Zhang GQ, Zhang ZW, Xiang S, et al. Comparison of different hepatic inflow occlusion methods in hepatectomy for large liver cancer[J]. Chinese Journal of General Surgery, 2015, 24(1):18–22.doi:10.3978/j.issn.1005–6947.2015.01.004.
[4] Boleslawski E, Decanter G, Truant S, et al. Right hepatectomy with extra-hepatic vascular division prior to transection: intentionto-treat analysis of a standardized policy[J]. HPB (Oxford), 2012,14(10):688–699. doi: 10.1111/j.1477–2574.2012.00519.x.
[5] Palavecino M, Wittekind C, Vauthey JN. Treatment of stage IVA hepatocellular carcinoma[J]. Arch Surg, 2008, 143(12):1235–1236.doi: 10.1001/archsurg.143.12.1235-c.
[6] Nuzzo G, Giuliante F, Ardito F, et al. Liver resection for primarily unresectable colorectal metastases downsized by chemotherapy[J].J Gastrointest Surg, 2007, 11(3):318–324.
[7] 黄兴华, 胡还章, 江艺. 半肝入肝血流阻断法与第一肝门血流阻断法在肝癌切除术中应用的比较[J]. 中华解剖与临床杂志, 2015,20(6):546–551. doi:10.3760/cma.j.issn.2095–7041.2015.06.014.Huang XH, Hu HZ, Jiang Y. Comparison of hemihepatic blood in fl ow occlusion without hepaticportal dissection with Pringle′ s occlusion in hepatectomy of hepatocellular carcinoma[J]. Chinese Journal of Anatomy and Clinics, 2015, 20(6):546–551. doi:10.3760/cma.j.issn.2095–7041.2015.06.014.
[8] 张奇, 王洪波, 彭晓晖, 等. 肝癌肝切除术中肝血流阻断方法的临床研究[J]. 中国普通外科杂志, 2013, 22(7):841–845. doi:10.7659/j.issn.1005–6947.2013.07.005.Zhang Q, Wang HB, Peng XH, et al. Selection of hepatic blood flow occlusion method during liver cancer resection[J]. Chinese Journal of General Surgery, 2013, 22(7):841–845. doi:10.7659/j.issn.1005–6947.2013.07.005.
[9] 李清汉, 甄作均, 陈应军, 等. 经肝门板半肝阻断在肝细胞肝癌切除术中的应用研究[J]. 中华肝脏外科手术学电子杂志, 2012,1(3):157–161. doi:10.3877/cma.j.issn.2095–3232.2012.03.003.Li QH, Zhen ZJ, Chen YJ, et al. Application of hemihepatic vascular occlusion through hilar plate in resection of hepatocellular carcinoma[J]. Chinese Journal of Hepatic Surgery, 2012, 1(3):157–161. doi:10.3877/cma.j.issn.2095–3232.2012.03.003.
[10] Dello SA, Reisinger KW, van Dam RM, et al. Total intermittent Pringle maneuver during liver resection can induce intestinal epithelial cell damage and endotoxemia[J]. PLoS One, 2012,7(1):e30539. doi: 10.1371/journal.pone.0030539.
[11] 吴健雄, 王黎明, 刘立国, 等. 肝区域血流选择性适时阻断在肝中央型大肿瘤切除中的应用[J]. 中华肿瘤杂志, 2012, 34(11):850–854. doi:10.3760/cma.j.issn.0253–3766.2012.11.012.Wu JX, Wang LM, Liu LG, et al. Application of selective and timely regional hepatic vascular occlusion for resection of large centrally located liver tumors: report of 133 cases[J]. Chinese Journal of Oncology, 2012, 34(11):850–854. doi:10.3760/cma.j.issn.0253–3766.2012.11.012.
[12] Dillner J, Meyer F, Lippert H, et al. Organ-invasive carcinoma of the pararenal gland involving the inferior vena cava: successful curative and interdisciplinary surgical management[J]. Dtsch Med Wochenschr, 2013, 138(6):260–265. doi: 10.1055/s-0032–1332842.
[13] 祝根飞, 林建宇, 毛谅, 等. 精准肝蒂解剖法肝段切除术的临床疗效分析[J]. 中华肝胆外科杂志, 2013, 19(5):343–348. doi:10.3760/cma.j.issn.1007–8118.2013.05.007.Zhu GF, Lin JY, Mao L, et al. Precise hepatic pedicle dissection in anatomical hepatic segmentectomy[J]. Chinese Journal of Hepatobiliary Surgery, 2013, 19(5):343–348. doi:10.3760/cma.j.issn.1007–8118.2013.05.007.
[14] Xia F, Lau W Y, Xu Y, et al. Does hepatic ischemia-reperfusion injury induced by hepatic pedicle clamping affect survival after partial hepatectomy for hepatocellular carcinoma?[J]. World J Surg,2013, 37(1):192–201. doi: 10.1007/s00268–012–1781-z.
[15] 黄志强. 黄志强肝脏外科手术学[M]. 北京: 人民军医出版社,1996.Huang ZQ. Huang zhiqiang operative surgery[M]. Beijing: People's Military Medical Publisher, 1996.
[16] 陈亚进. 肝胆管结石病多次手术原因及决策 [J]. 中国实用外科杂志, 2012, 32(1):57–59.Chen YJ. The cause of Hepatolithiasis reoperation and treatment decisions[J]. Chinese Journal of Practical Surgery, 2012, 32(1):57–59.
[17] 吴金术, 彭创, 尹新民, 等. Ⅰ、Ⅱ级肝门区域阻断肝叶(段)切除的初步体会[J]. 国际外科学杂志, 2009, 36(6):387–390.doi:10.3760/cma.j.issn.1673–4203.2009.06.011.Wu JS, Peng C, Yin XM, et al. Hepatic seginentectomy by regional vascular occlusion at hepatic hilum[J]. International Journal of Surgery, 2009, 36(6):387–390. doi:10.3760/cma.j.issn.1673–4203.2009.06.011.
[18] 肖卫星, 周君, 顾梦佳, 等. 精准肝切除在肝内胆管结石手术治疗中的应用[J]. 中国普通外科杂志, 2016, 25(2):191–196.doi:10.3978/j.issn.1005–6947.2016.02.006.Xiao WX, Zhou J, Gu MJ, et al. Application of precise hepatectomy techniques in treatment of intrahepatic stones[J]. Chinese Journal of General Surgery, 2016, 25(2):191–196. doi:10.3978/j.issn.1005–6947.2016.02.006.
[19] Tang YH, Wen TF, Chen X. Anatomic versus non-anatomic liver resection for hepatocellular carcinoma: a systematic review[J].Hepatogastroenterology, 2013, 60(128):2019–2025.
[20] 董家鸿, 唐茂盛, 张文智, 等. 精准肝脏外科理念和技术对大范围肝切除围手术期安全性的影响[J]. 中华消化外科杂志, 2013,12(5):344–351. doi:10.3760/cma.j.issn.1673–9752.2013.05.007.Dong JH, Tang MS, Zhang WZ, et al. Effects of concept and techniques of precision liver surgery on the perioperative safety of patients undergoing major hepatectomy[J]. Chinese Journal of Digestive Surgery, 2013, 12(5):344–351. doi:10.3760/cma.j.issn.1673–9752.2013.05.007.
[21] 董家鸿, 黄志强. 精准肝切除——21世纪肝脏外科新理念[J]. 中华外科杂志, 2009, 47(21):1601–1605. doi:10.3760/cma.j.issn.0529–5815.2009.21.001.Dong JH, Huang ZQ. Precise liver resection——new concept of liver surgery in 21st century[J]. Chinese Journal of Surgery, 2009,47(21):1601–1605. doi:10.3760/cma.j.issn.0529–5815.2009.21.001.
[22] 李建平, 杨军. 精准肝切除研究进展[J]. 中华肝胆外科杂志, 2011,17(5):434–436. doi:10.3760/cma.j.issn.1007–8118.2011.05.028.Li JP, Yang J. Progress on precise hepatectomy[J]. Chinese Journal of Hepatobiliary Surgery, 2011, 17(5):434–436. doi:10.3760/cma.j.issn.1007–8118.2011.05.028.
[23] 冯莉, 王黎明, 荣维淇, 等. 肝细胞癌切除术中区域血流预阻断与区域血流阻断的疗效对比初探[J]. 中华肿瘤杂志, 2015,37(3):186–189. doi:10.3760/cma.j.issn.0253–3766.2015.03.006.Feng L, Wang LM, Rong WQ, et al. Initial comparison of regional ischemic preconditioning and hemi-hepatic vascular inflow occlusion in resection of hepatocellular carcinoma[J]. Chinese Journal of Oncology, 2015, 37(3):186–189. doi:10.3760/cma.j.issn.0253–3766.2015.03.006.
[24] 赵明海, 朱少功, 赵会博, 等. 肝门部Glisson蒂右前支血流阻断行肝右后叶解剖性肝切除术[J]. 中国继续医学教育, 2015,7(19):71–72. doi:10.3969/j.issn.1674–9308.2015.19.053.Zhao MH, Zhu SG, Zhao HB, et al. The Dissection Hepatectomy of Porta Hepatis Glisson Pedicle Right Front Branch Blood Flow Interdict Liver Right Rear[J]. China Continuing Medical Education,2015, 7(19):71–72. doi:10.3969/j.issn.1674–9308.2015.19.053.
[25] van Gulik TM, de Graaf W, Dinant S, et al. Vascular occlusion techniques during liver resection[J]. Dig Surg, 2007, 24(4):274–281.
[26] Zhou W, Li A, Pan Z, et al. Selective hepatic vascular exclusion and Pringle maneuver: A comparative study in liver resection[J]. Eur J Surg Oncol, 2008, 34(1):49–54.
[27] DeMatteo RP, Fong Y, Jarnagin WR, et al. Recent advances in hepatic resection[J]. Semin Surg Oncol, 2000, 19(2):200–207.