肝细胞癌(HCC)是原发性肝癌的主要类型,约占70%~90%,在癌症相关致死原因中,肝癌位居前列。值得注意的是,全球大约有50%的HCC新发病例和死亡病例发生在中国[1],HCC已成为威胁我国人民健康的重大疾病。国外有文献[2]报道,HCC的5年生存率仅为11%。造成HCC预后差的最主要原因之一是缺乏有效的早期诊断手段,大多数患者一经发现就被诊断为无法行根治性手术的晚期阶段。因此,发现具有诊断价值的生物学指标对于HCC的早期诊断和预后是有必要的。近几年有研究[3-5]表明:TUSC3(tumor suppressor candidate 3,肿瘤抑制候选基因3)与卵巢癌、前列腺癌、小细胞肺癌等恶性肿瘤的发生发展有密切关系。TUSC3与HCC的关系目前研究较少,本研究检测TUSC3在HCC中的表达情况,并初步探讨TUSC3的表达与HCC患者相关临床病理特征之间的关系及其临床意义。
1 资料与方法
1.1 病例资料
收集2007年1月—2012年12月于安徽医科大学附属省立医院肝脏外科行根治性HCC切除术的92例HCC组织石蜡切片,其中年龄20~74岁,平均年龄51岁;有血管侵犯者(镜下癌栓或肉眼癌栓)58例,无血管侵犯者34例;肿瘤分级标准采用Edmondson分级法[6],I~II级者55例,III~IV级者37例;肿瘤TNM分期标准依据美国癌症联合会(AJCC)第八版标准[7],I~II期者62例,III~IV期者30例(表1)。另外收集2016—2017年于安徽医科大学附属省立医院肝脏外科行HCC切除术的新鲜冷冻HCC组织及其对应癌旁组织20对和TRIzol浸泡的HCC组织及其对应癌旁组织20对,行Western blot及qRT-PCR实验检测。其中男17例,女3例;年龄39~61岁,平均年龄53岁;有血管侵犯者(镜下或肉眼癌栓)9例,无血管侵犯者11例。所选患者术前均未行放疗、化疗、介入等抗肿瘤治疗。该研究资料获得患者及家属的书面同意及安徽医科大学附属省立医院临床试验伦理委员会批准(伦理批件号2017伦审第114号)。
1.2 主要试剂
兔抗人多克隆抗体TUSC3(LSBio公司);通用山羊抗鼠/兔二抗PV-6000(北京中杉金桥公司);DAB显色试剂盒(北京中杉金桥公司);苏木素染色剂(北京中杉金桥公司); RIPA蛋白裂解液(北京碧云天公司);MARK(美国Fermentas公司);TRIzol试剂、ECL 超敏发光试剂盒、逆转录试剂盒(美国Thermo公司),双色定时定量PCR仪(美国BIO-RAD MYIQ2);qRTPCR引物(英潍捷基上海贸易有限公司)。
1.3 实验方法
1.3.1 免疫组化 本研究选用链霉菌抗生物素蛋白-过氧化物酶连结法(SP法)对HCC及癌旁组织中TUSC3的表达情况进行检测,65 ℃烘烤石蜡切片,二甲苯及梯度乙醇脱蜡水化,柠檬酸高温修复抗原,过氧化氢室温孵育10 min,封闭过氧化物酶,加入兔抗人TUSC3多克隆抗体(1:200),4 ℃孵育过夜,37 ℃复温,PBS冲洗3遍,吐温1遍,二抗37 ℃孵育30 min,PBS冲洗3遍,吐温1遍,DAB显色,苏木素复染,自来水冲洗后蓝化,乙醇脱水,最后中性树胶封片。免疫组化实验结果判定标准:每张切片在400倍显微镜下随机选取5个不重复视野,根据着色细胞所占百分比评分:<10%细胞着色为0分;10%~30%细胞着色为1分;30%~50%细胞着色为2分;>50%细胞着色为3分。另外根据着色细胞强度评分:未显色或显色不清为0分;浅黄色为1分;棕黄色为2分;棕褐色为3分。切片最终分数=着色细胞所占百分比分数×着色细胞强度评分,分数≥5分定为高表达,得分<5分定位低表达。
1.3.2 Western blot法检测 取HCC及对应癌旁组织,加入RIPA蛋白裂解液提取总蛋白,BCA法蛋白定量测定,每对样本等量蛋白上样,聚丙烯酰胺凝胶电泳分离蛋白后转蛋白至PVDF膜上,Western 洗涤液漂洗蛋白膜5 min,脱脂奶粉室温摇床中封闭1 h,TUSC3一抗(1:500)4 ℃摇床中孵育过夜,TBST洗膜3次,二抗(1:1 0000)室温孵育2 h,TBST洗后用化学发光试剂盒显影,凝胶成像系统扫描,保存、导出图像,最后采用Quantity one图像分析软件进行灰度值分析。用鼠抗人β-actin作内参对照,方法同上。TUSC3条带灰度值与内参β-actin灰度值之比用于统计学分析。
1.3.3 qRT-PCR实验检测 提取HCC与癌旁组织总RNA,合成cDNA,采取三步法进行qRTPCR反应:94 ℃预变性30 s;94 ℃变性30 s;60 ℃退火30 s;72 ℃延伸30 s,共40个循环,每样本每基因设置3个重复。引物正向序列:5'-GAG TTC CAG ACG CTC AAT CTT C-3',反向序列:5'-GCC AGG AGT TCG CCA GTA TT-3'扩增产物长度:173 bp;内参18s引物正向序列:5'-CGG CGA CGA CCC ATT CGA AC-3',反向序列:5'-GAA TCG AAC CCT GAT TCC CCG TC-3',扩增产物长度为:180 bp;TUSC3mRNA的相对表达量用2-ΔΔCt进行计算。
1.4 统计学处理
使用SPSS 20.0及Graph Prism 5.0软件对数据进行统计学分析,本研究中所涉及定量资料均以均数±标准差(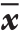 ±s)表示,采用t检验进行统计学分析,定性资料采用χ2检验。P<0.05为差异有统计学意义。
±s)表示,采用t检验进行统计学分析,定性资料采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 TUSC3在HCC组织中的表达下调
免疫组化结果显示,在92例组织切片中,有56例(60.9%)显示TUSC3在HCC组织细胞质中呈低表达,36例呈高表达;癌旁肝组织细胞质中呈低表达者33例(35.9%),呈高表达者59例,差异有统计学意义(P<0.001)(图1)。
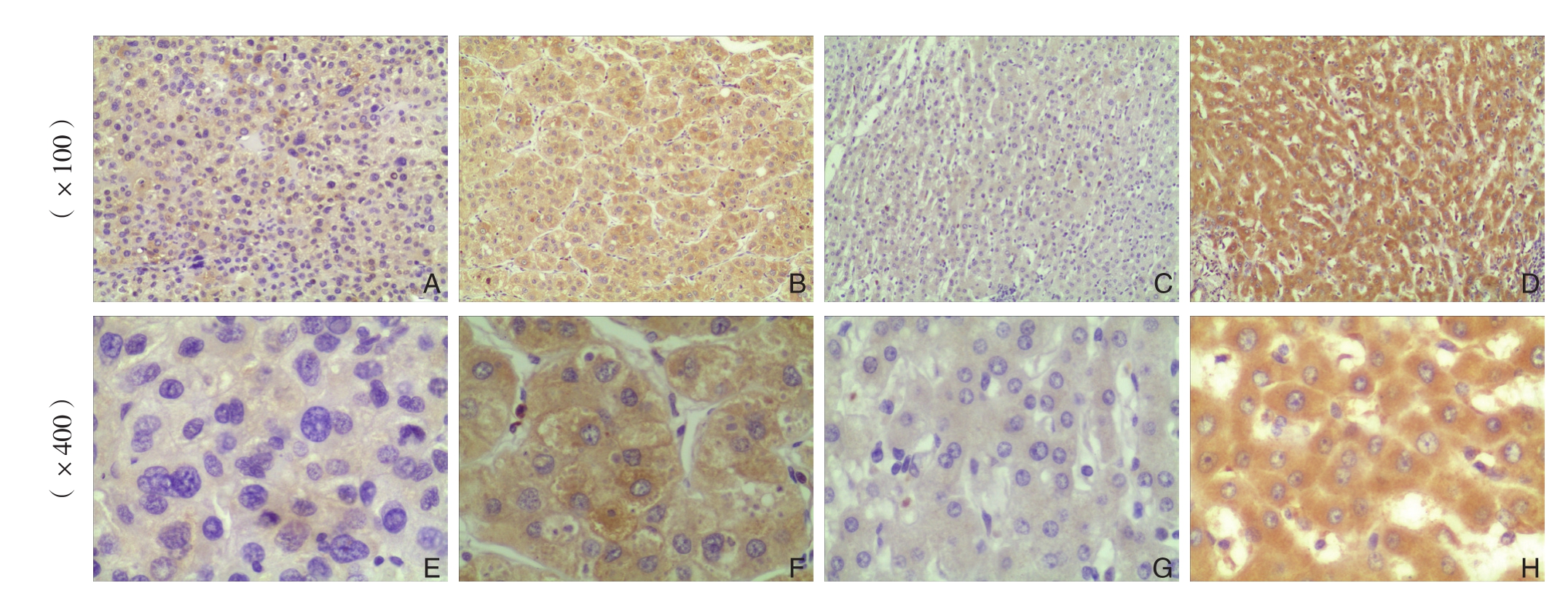
图1 免疫组化检测TUSC的表达
A,E:HCC组织中TUSC3的低表达;B,F:HCC组织中TUSC3的高表达;C,G:癌旁组织中TUSC3的低表达;D,H:癌旁组织中TUSC3的高表达
Figure 1 Immunohistochemical staining for TUSC expression
A, E: Low TUSC3 expression in HCC tissue; B, F: High TUSC3 expression in HCC tissue; C, G: Low TUSC3 expression in adjacent tissue; D, H: High TUSC3 expression in adjacent tissue
2.2 TUSC3在HCC组织中的表达与临床病理因素的关系
TUSC3在HCC组织中的低表达与肿瘤Edmondson分级、TNM分期、肿瘤直径有关(P=0.008,P=0.031,P=0.020);与年龄、性别、肿瘤包膜、血管侵犯、AFP、HBsAg、肝硬化、Child-Pugh分级、肿瘤数无关(均P>0.05)(表1)。
表1 TUSC3的表达与患者临床病理特征之间的关系[n(%)]
Table 1 Relations of TUSC3 expression with clinicopathologic features of the patients [n (%)]
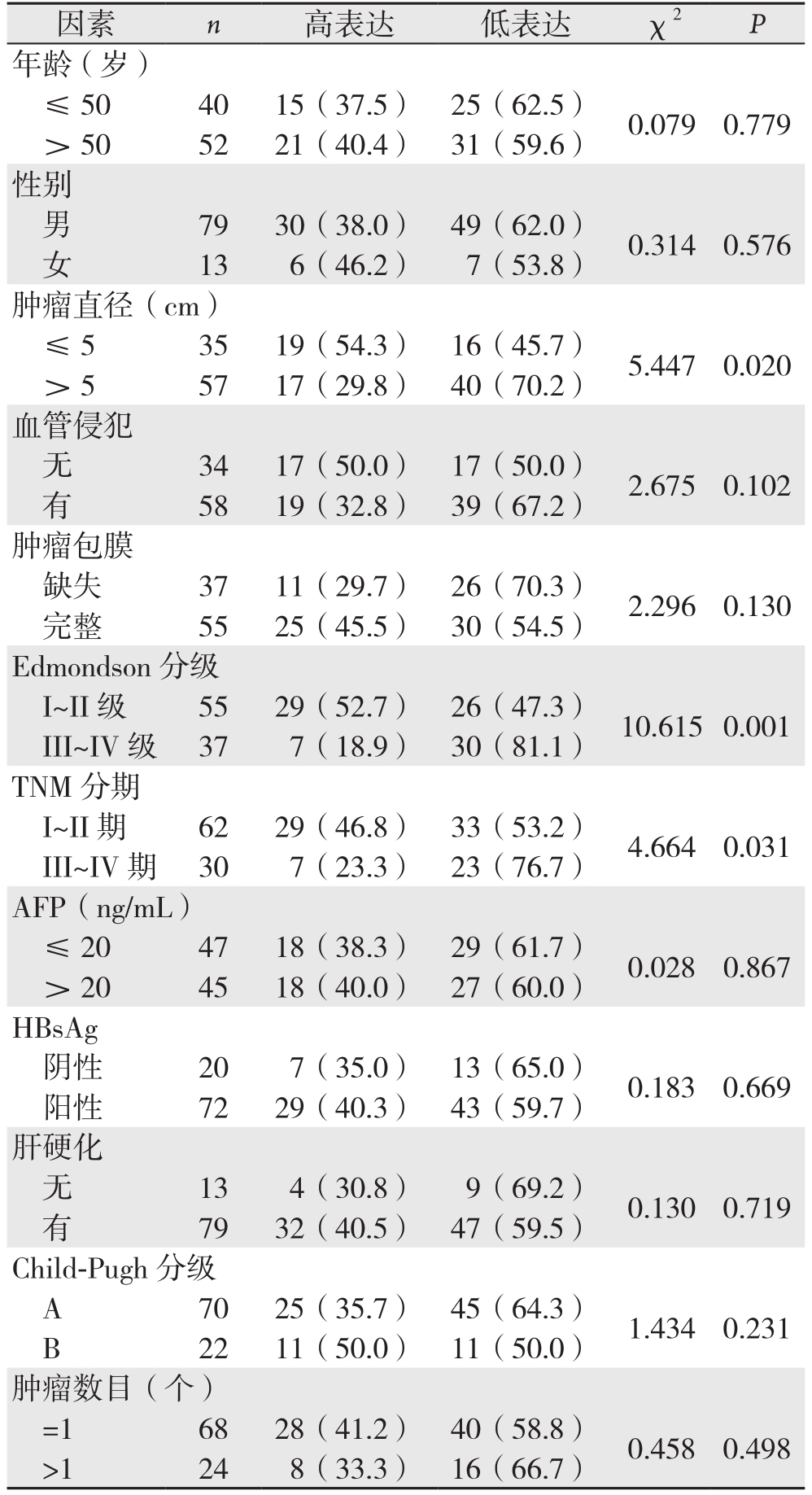
因素 n 高表达 低表达 χ2P年龄(岁)≤ 50 40 15(37.5) 25(62.5) 0.079 0.779> 50 52 21(40.4) 31(59.6)性别男79 30(38.0) 49(62.0) 0.314 0.576女13 6(46.2) 7(53.8)肿瘤直径(cm)≤ 5 35 19(54.3) 16(45.7) 5.447 0.020> 5 57 17(29.8) 40(70.2)血管侵犯无34 17(50.0) 17(50.0) 2.675 0.102有58 19(32.8) 39(67.2)肿瘤包膜缺失 37 11(29.7) 26(70.3) 2.296 0.130完整 55 25(45.5) 30(54.5)Edmondson分级I~II级 55 29(52.7) 26(47.3) 10.615 0.001 III~IV 级 37 7(18.9) 30(81.1)TNM分期I~II期 62 29(46.8) 33(53.2) 4.664 0.031 III~IV 期 30 7(23.3) 23(76.7)AFP(ng/mL)≤ 20 47 18(38.3) 29(61.7) 0.028 0.867> 20 45 18(40.0) 27(60.0)HBsAg阴性 20 7(35.0) 13(65.0) 0.183 0.669阳性 72 29(40.3) 43(59.7)肝硬化无13 4(30.8) 9(69.2) 0.130 0.719有79 32(40.5) 47(59.5)Child-Pugh分级A 70 25(35.7) 45(64.3) 1.434 0.231 B 22 11(50.0) 11(50.0)肿瘤数目(个)=1 68 28(41.2) 40(58.8) 0.458 0.498>1 24 8(33.3) 16(66.7)
2.3 qRT-PCR与Western blot检测结果
qRT-PCR检测结果显示,20对标本中17对(85%)TUSC3在癌组织中的mRNA表达低于对应癌旁组织。定量结果显示,20对标本中TUSC3在HCC组织及对应癌旁组织中的mRNA相对表达量分别为(0.99±1.46)和(1.96±2.18),差异有统计学意义(t=3.237,P<0.01)(图2)。Western blot检测结果显示,20对标本中16对(80%)TUSC3在癌组织中的蛋白表达低于对应癌旁组织。定量结果显示,20对标本中TUSC3在HCC组织及对应癌旁组织中的蛋白相对表达量分别为(0.49±0.35)和(1.04±0.43),差异有统计学意义(t=4.909,P<0.001)(图3)。
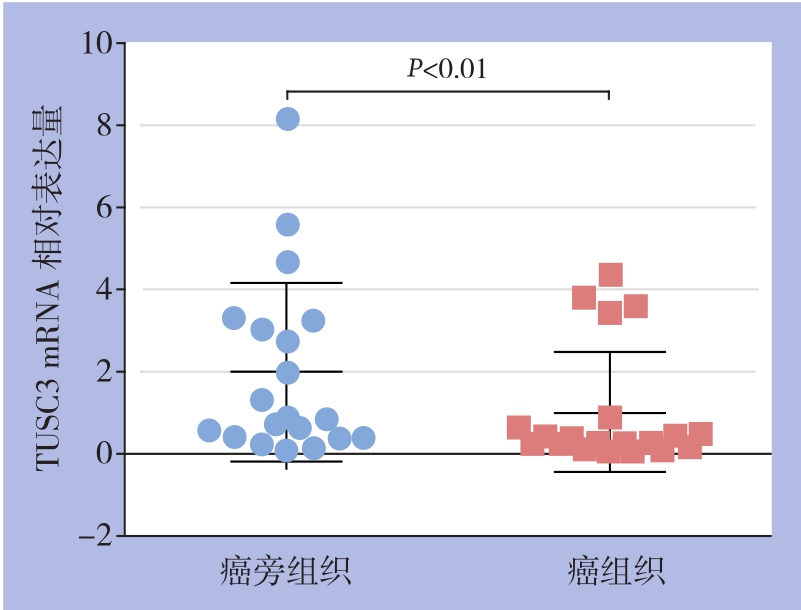
图2 TUSC3 mRNA在20对HCC及癌旁组织中的相对表达量
Figure 2 Relative TUSC3 mRNA expressions in the 20 paired HCC and adjacent tissues
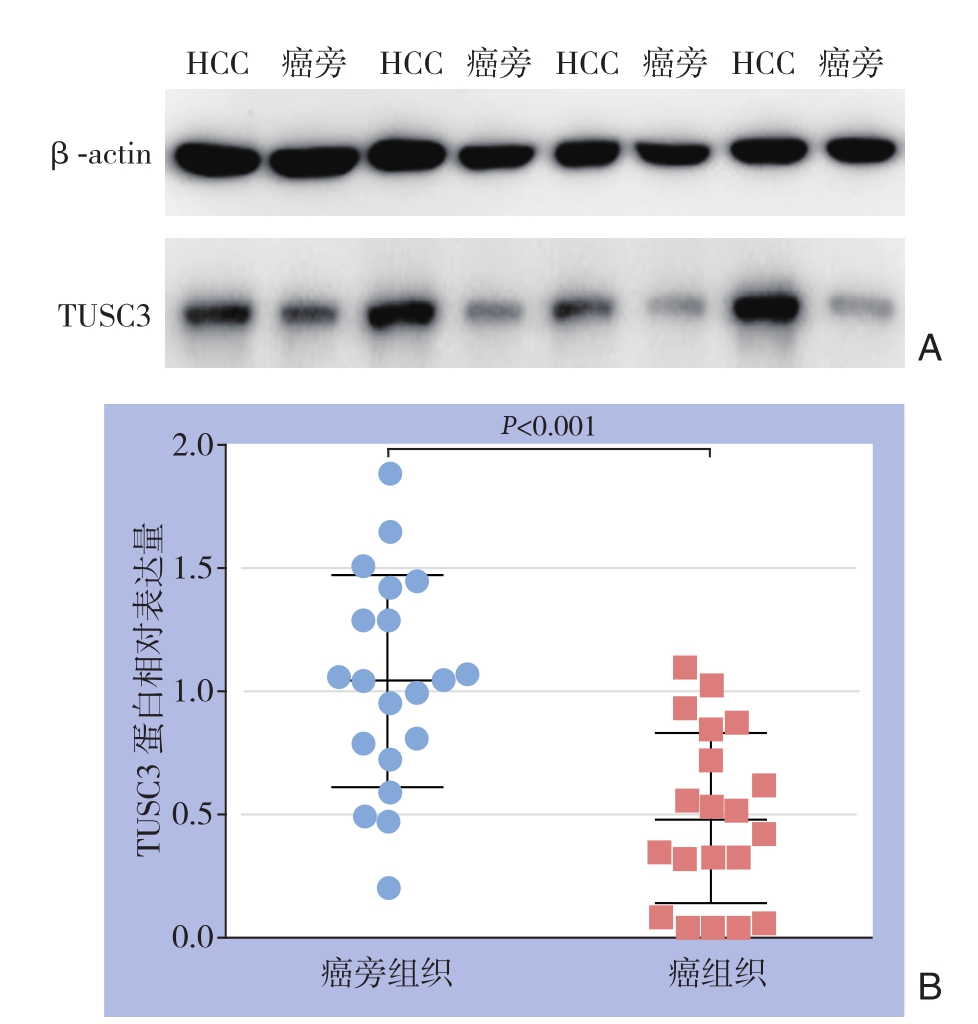
图3 Western blot检测TUSC的表达
A:TUSC3蛋白在4对代表性HCC及对应癌旁组织中的表达;B:TUSC3蛋白在20对HCC及对应癌旁组织中的相对表达量
Figure 3 Western blot analysis for TUSC expression
A: TUSC3 expressions in 4 representative paired HCC and adjacent tissues; B: Relative TUSC3 protein expressions in the 20 paired HCC and adjacent tissues
3 讨 论
TUSC3基因位于人类第8号染色体短臂8p22,又名N33[8],早期研究[9-11]表明TUSC3与常染色体隐性精神发育迟滞密切相关。目前研究[4,12-13]表明TUSC3在肿瘤中也扮演着重要的角色,TUSC3编码的蛋白质是寡糖基转移酶复合物中的亚基,参与蛋白质折叠过程中的N端糖基化反应。TUSC3的表达异常可改变N端糖基化的进程,而异常的N端糖基化与肿瘤的发生发展有着密切关系[14-16]。TUSC3的表达与恶性肿瘤的发生发展间的确切机制仍未明确,TUSC3与恶性肿瘤之间的研究正在陆续开展。
Pils等[17]通过对卵巢癌细胞系及肿瘤标本的研究显示由于TUSC3启动子区的过甲基化,TUSC3在卵巢癌中的表达明显下调,TUSC3的缺失可促进卵巢癌细胞的增殖与转移,并提出可能与异常的N端糖基化反应有关。TUSC3启动子甲基化状态与卵巢癌的无进展生存期及总体生存期有明显相关,TUSC3为卵巢癌预后的独立预测因子[3,17]。Kratochvílová等[18]的进一步研究提出TUSC3通过调节卵巢癌细胞内质网应激反应以及阻止其上皮间质转化发挥肿瘤抑制作用。Horak等[4]报道了在前列腺癌患者中TUSC3的表达下调与启动子区甲基化明显相关,并且在进展期肿瘤中下调明显,并提出在前列腺上皮细胞中TUSC3的缺失可能促进肿瘤的生成和进展,TUSC3在前列腺癌中扮演着抑癌基因的角色。有研究[5]显示TUSC3在小细胞肺癌中的表达下调,TUSC3的缺失与低分化肺癌相关,同时通过分析TUSC3的表达与淋巴结转移之间的相关性提出TUCS3可能成为肺癌患者淋巴结转移的预测指标。值得注意的是,研究[19]显示TUSC3在非小细胞肺癌中呈高表达,TUSC3高表达的非小细胞肺癌细胞表现出较高的增殖、侵袭及转移能力,TUSC3在非小细胞肺癌中表现出致癌作用,其作用机制可能与Hedgehog信号通路有关。研究[20-21]显示在多形性成胶质细胞瘤(GBM)中TUSC3的表达下调,TUSC3启动子区过度甲基化是其表达下调的原因,TUSC3通过抑制Akt信号通路的活性来调控GBM细胞的增殖和侵袭。研究[22-23]表明TUSC3在胰腺癌中的缺失,TUSC3的表达下调可促进胰腺癌细胞系的增殖、迁移和侵袭,且TUSC3的表达下调与胰腺癌患者的不良预后有关。另有研究[24]表明在结直肠癌肿瘤标本中TUSC3的表达上调,过表达的TUSC3诱导结直肠癌细胞的上皮间质转化,TUSC3过表达的结直肠癌细胞增殖、迁移和侵袭能力增加,TUSC3在结直肠癌中表现出致癌作用,其作用机制可能与调节MAPK、PI3K/Akt、和Wnt/β-catenin 信号通路有关。然而,又有一项对156例早期结直肠癌患者的研究[25]表明,TUSC3蛋白表达缺失与患者较差的总体生存率有关。基于前人的研究,TUSC3在不同恶性肿瘤中的作用及可能机制不尽相同。目前关于TUSC3与HCC之间的研究较少,TUSC3在HCC中的表达情况及其与HCC患者临床病理特征之间的关系未见报道。本项研究目的在于检测TUSC3在HCC中的表达情况,并分析TUSC3的表达与HCC患者相关临床病理特征之间的关系。本研究免疫组织化学实验、Western blot及qRT-PCR实验的结果均显示TUSC3在HCC中的表达下调。推测TUSC3在HCC中的表达下调很可能与TUSC3基因启动子区过甲基化有关,具体机制有待于更大样本更深入的研究。另外,临床资料分析显示TUSC3表达下调与肿瘤Edmondson分级、TNM分期、肿瘤直径有关(P=0.008,P=0.031,P=0.020);而与年龄、性别、肿瘤包膜、血管侵犯、AFP、HBsAg、肝硬化、Child-Pugh分级、肿瘤数目无关(P>0.05)。这提示TUSC3表达的下调可能进一步增加HCC的增殖能力、侵袭性及恶性程度,与患者肿瘤的恶性进展程度息息相关。本研究揭示了TUSC3在HCC中的表达情况以及TUSC3表达与临床病理资料之间的相关性,TUSC3可能会在HCC的早期诊断和预后预测中发挥作用。本研究未探究TUSC3在HCC细胞系中表达情况,未能具体阐述TUSC3在HCC发生发展中作用的具体机制,大样本更深入地研究TUSC3在HCC中的作用靶点及调控机制是很有必要的,TUSC3有可能成为HCC分子靶向治疗新的位点。
参考文献
[1] Torre LA, Siegel RL, Ward EM, et al. Global Cancer Incidence and Mortality Rates and Trends--An Update[J]. Cancer Epidemiol Biomarkers Prev, 2016, 25(1):16–27. doi: 10.1158/1055–9965.EPI-15–0578.
[2] Blechacz B, Mishra L. Hepatocellular carcinoma biology[J]. Recent Results Cancer Res, 2013, 190:1–20. doi: 10.1007/978–3–642–16037–0_1.
[3] Vaňhara P, Horak P, Pils D, et al. Loss of the oligosaccharyl transferase subunit TUSC3 promotes proliferation and migration of ovarian cancer cells [J]. Int J Oncol, 2013, 42(4):1383–1389. doi:10.3892/ijo.2013.1824.
[4] Horak P, Tomasich E, Vaňhara P, et al. TUSC3 loss alters the ER stress response and accelerates prostate cancer growth in vivo[J].Sci Rep, 2014, 4:3739. doi: 10.1038/srep03739.
[5] Yu X, Zhang K, Liu F, et al. Tumor suppressor candidate 3 as a novel predictor for lymph node metastasis in lung cancer patients[J].Oncol Lett, 2016, 12(6):5099–5105. doi: 10.3892/ol.2016.5333.
[6] Edmondson HA, Steiner PE. Primary carcinoma of the liver: a study of 100 cases among 48,900 necropsies[J]. Cancer, 1954, 7(3):462–503.
[7] Chun YS, Pawlik TM, Vauthey JN. 8th Edition of the AJCC Cancer Staging Manual: Pancreas and Hepatobiliary Cancers [J]. Ann Surg Oncol, 2017, doi: 10.1245/s10434–017–6025-x. [Epub ahead of print]
[8] MacGrogan D, Levy A, Bova GS, et al. Structure and methylationassociated silencing of a gene within a homozygously deleted region of human chromosome band 8p22[J]. Genomics, 1996,35(1):55–65. doi:10.1006/geno.1996.0322.
[9] Garshasbi M, Hadavi V, Habibi H, et al. A defect in the TUSC3 gene is associated with autosomal recessive mental retardation[J].Am J Hum Genet, 2008, 82(5):1158–1164. doi: 10.1016/j.ajhg.2008.03.018.
[10] Loddo S, Parisi V, Doccini V, et al. Homozygous deletion in TUSC3 causing syndromic intellectual disability: a new patient[J]. Am J Med Genet A, 2013, 161A(8):2084–2087. doi: 10.1002/ajmg.a.36028.
[11] Garshasbi M, Kahrizi K, Hosseini M, et al. A novel nonsense mutation in TUSC3 is responsible for non-syndromic autosomal recessive mental retardation in a consanguineous Iranian family[J].Am J Med Genet A, 2011, 155A(8):1976–1980. doi: 10.1002/ajmg.a.34077.
[12] Kelleher DJ, Gilmore R. An evolving view of the eukaryotic oligosaccharyltransferase[J]. Glycobiology, 2006, 16(4):47R-62R.
[13] Helenius A, Aebi M. Intracellular functions of N-linked glycans[J].Science, 2001, 291(5512):2364–2369.
[14] Oliveira-Ferrer L, Legler K, Milde-Langosch K. Role of protein glycosylation in cancer metastasis[J]. Semin Cancer Biol, 2017,44:141–152. doi: 10.1016/j.semcancer.2017.03.002.
[15] Balog CI, Stavenhagen K, Fung WL, et al. N-glycosylation of colorectal cancer tissues: a liquid chromatography and mass spectrometry-based investigation[J]. Mol Cell Proteomics, 2012,11(9):571–585. doi: 10.1074/mcp.M111.011601.
[16] Li JH, Huang W, Lin P, et al. N-linked glycosylation at Asn152 on CD147 affects protein folding and stability: promoting tumour metastasis in hepatocellular carcinoma[J]. Sci Rep, 2016, 6:35210.doi: 10.1038/srep35210.
[17] Pils D, Horak P, Vanhara P, et al. Methylation status of TUSC3 is a prognostic factor in ovarian cancer[J]. Cancer, 2013, 119(5):946–954. doi:10.1002/cncr.27850.
[18] Kratochvílová K, Horak P, Ešner M, et al. Tumor suppressor candidate 3 (TUSC3) prevents the epithelial-to-mesenchymal transition and inhibits tumor growth by modulating the endoplasmic reticulum stress response in ovarian cancer cells[J]. Int J Cancer,2015, 137(6):1330–1340. doi: 10.1002/ijc.29502.
[19] Gu Y, Pei X, Ren Y, et al. Oncogenic function of TUSC3 in nonsmall cell lung cancer is associated with Hedgehog signalling pathway[J]. Biochim Biophys Acta, 2017, 1863(7):1749–1760. doi:10.1016/j.bbadis.2017.05.005.
[20] Jiang Z, Guo M, Zhang X, et al. TUSC3 suppresses glioblastoma development by inhibiting Akt signaling[J]. Tumour Biol, 2016,37(9):12039–12047.
[21] Liang Q, Wang K, Wang B, et al. HCMV-encoded miR-UL112–3p promotes glioblastoma progression via tumour suppressor candidate 3[J]. Sci Rep, 2017, 7:44705. doi: 10.1038/srep44705.
[22] Birnbaum DJ, Adélaïde J, Mamessier E, et al. Genome pro fi ling of pancreatic adenocarcinoma[J]. Genes Chromosomes Cancer, 2011,50(6):456–465. doi: 10.1002/gcc.20870.
[23] Fan X, Zhang X, Shen J, et al. Decreased TUSC3 Promotes Pancreatic Cancer Proliferation, Invasion and Metastasis[J]. PLoS One, 2016, 11(2):e0149028. doi: 10.1371/journal.pone.0149028.
[24] Gu Y, Wang Q, Guo K, et al. TUSC3 promotes colorectal cancer progression and epithelial-mesenchymal transition (EMT)through WNT/β-catenin and MAPK signalling[J]. J Pathol, 2016,239(1):60–71. doi: 10.1002/path.4697.
[25] Burgermeister E, Höde P, Betge J, et al. Epigenetic silencing of tumor suppressor candidate 3 confers adverse prognosis in early colorectal cancer[J]. Oncotarget, 2017, 8(49):84714–84728. doi:10.18632/oncotarget.20950.