肝硬化或肝移植状态后容易发生腹外疝,其主要原因包括腹水导致腹腔内压力持续增高、营养状况差、移植术后口服免疫抑制剂影响切口愈合等因素[1-13]。目前国内外对肝硬化或肝移植术后进行疝修补术的治疗策略并未形成共识,尚需更多循证医学证据支持。因此,本研究回顾性分析2006年1月—2016年12月期间在中山大学附属第一医院进行疝修补术的肝硬化或肝移植术后合并腹外疝的35例患者病例资料,探讨这种特殊疾病状态下行腹外疝修补手术的安全性和有效性。
1 资料与方法
1.1 一般资料
本组患者35例,男27例,女8例;年龄为37~82岁,平均年龄(59.0±9.42)岁。腹股沟疝18例(51.4%),腹壁切口疝10例(28.6%),脐疝5例(14.3%),脐疝合并切口疝1例(2.9%),腹白线疝1例(2.9%)。 腹壁切口疝中,术前行同种异体肝移植术6例,肝右后叶切除1例,胆囊切除术1例,回肠部分切除+回肠双腔造瘘术1例,脾切除1例,升结肠癌根治术1例;切口疝病程为5~240个月。切口疝发生的位置:右上腹6例,腹部脐旁2例,左上腹1例,下腹部中线1例,腹部正中1例。切口疝缺损直径为5~20 cm,平均(8.6±4.2)cm。腹股沟疝中左侧6例,右侧8例,双侧4例;斜疝17例,直疝2例,骑跨疝2例,股疝1例;腹股沟疝改良Gilbert分型:I型1例,II型10例,III型6例,Ⅴ型2例,VI型2例,VII型1例; 此外3例为复发疝患者。 本组患者术前合并疾病包括:高血压病4例(11.4%),心脏病1例(2.9%),2型糖尿病3例(8.6%),慢性阻塞性肺疾病1例(2.9%),肝硬化状态26例(74.2%),合并有肝移植患者的9例(25.7%),肝移植并肝硬化患者1例(2.9%)。10例肝移植术后患者,既往行肝移植病因包括:4例乙肝肝硬化失代偿,3例乙肝肝硬化失代偿合并原发性肝癌,2例为丙肝肝硬化,1例胆源性肝硬化失代偿。本组患者中无合并肝性脑病患者。本组患者基线资料见表1。
表1 35例患者的基线资料
Table 1 The baseline data of the 35 patients
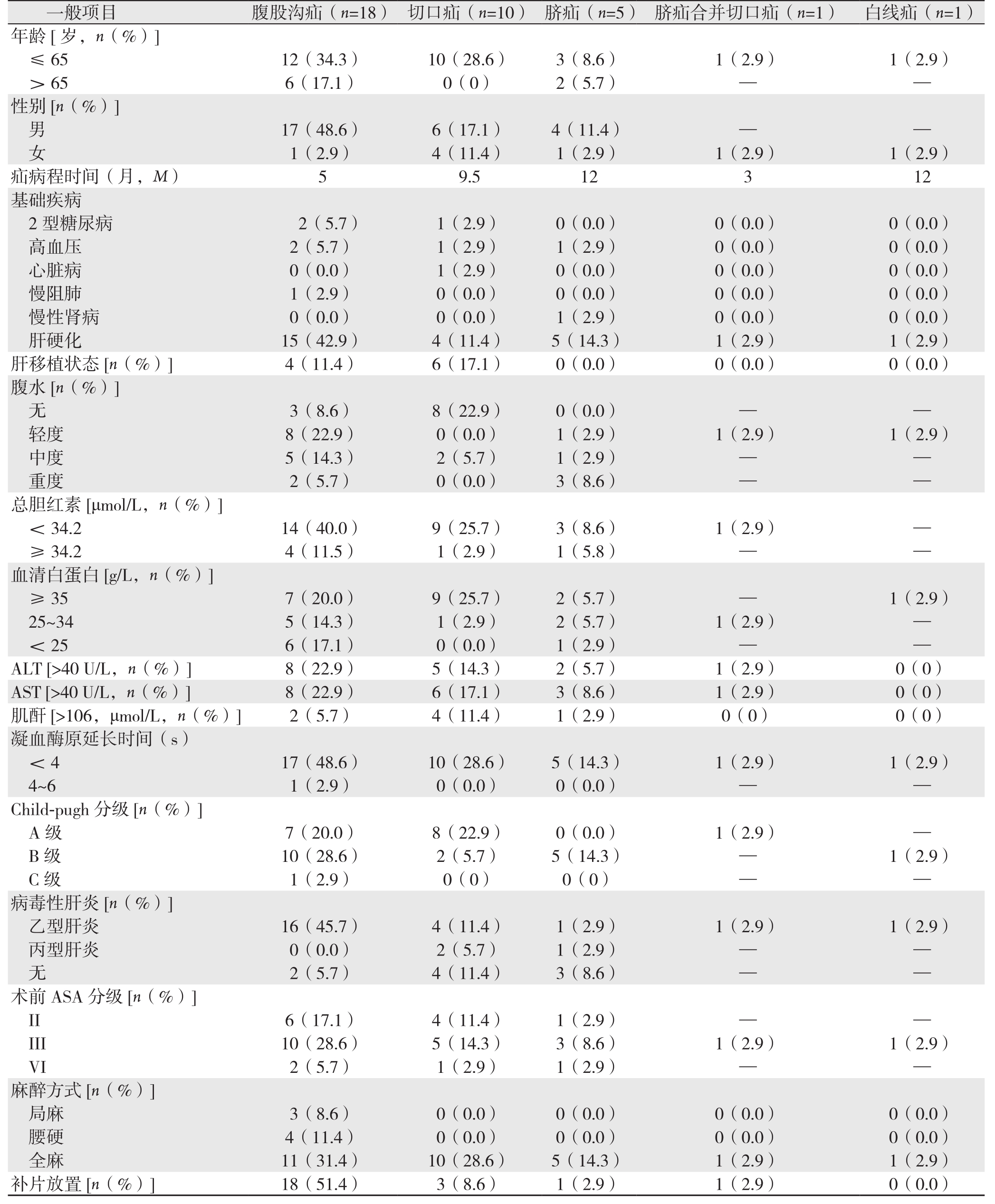
年龄[岁,n(%)]≤65 12(34.3) 10(28.6) 3(8.6) 1(2.9) 1(2.9)>65 6(17.1) 0(0) 2(5.7) — —性别[n(%)]男17(48.6) 6(17.1) 4(11.4) — —女1(2.9) 4(11.4) 1(2.9) 1(2.9) 1(2.9)疝病程时间(月,M) 5 9.5 12 3 12基础疾病2型糖尿病 2(5.7) 1(2.9) 0(0.0) 0(0.0) 0(0.0)高血压 2(5.7) 1(2.9) 1(2.9) 0(0.0) 0(0.0)心脏病 0(0.0) 1(2.9) 0(0.0) 0(0.0) 0(0.0)慢阻肺 1(2.9) 0(0.0) 0(0.0) 0(0.0) 0(0.0)慢性肾病 0(0.0) 0(0.0) 1(2.9) 0(0.0) 0(0.0)肝硬化 15(42.9) 4(11.4) 5(14.3) 1(2.9) 1(2.9)肝移植状态[n(%)] 4(11.4) 6(17.1) 0(0.0) 0(0.0) 0(0.0)腹水[n(%)]无3(8.6) 8(22.9) 0(0.0) — —轻度 8(22.9) 0(0.0) 1(2.9) 1(2.9) 1(2.9)中度 5(14.3) 2(5.7) 1(2.9) — —重度 2(5.7) 0(0.0) 3(8.6) — —总胆红素[μmol/L,n(%)]<34.2 14(40.0) 9(25.7) 3(8.6) 1(2.9) —≥34.2 4(11.5) 1(2.9) 1(5.8) — —血清白蛋白[g/L,n(%)]≥35 7(20.0) 9(25.7) 2(5.7) — 1(2.9)25~34 5(14.3) 1(2.9) 2(5.7) 1(2.9) —<25 6(17.1) 0(0.0) 1(2.9) — —ALT [>40 U/L,n(%)] 8(22.9) 5(14.3) 2(5.7) 1(2.9) 0(0)AST [>40 U/L,n(%)] 8(22.9) 6(17.1) 3(8.6) 1(2.9) 0(0)肌酐[>106,μmol/L,n(%)] 2(5.7) 4(11.4) 1(2.9) 0(0) 0(0)凝血酶原延长时间(s)<4 17(48.6) 10(28.6) 5(14.3) 1(2.9) 1(2.9)4~6 1(2.9) 0(0.0) 0(0.0) — —Child-pugh分级[n(%)]A级 7(20.0) 8(22.9) 0(0.0) 1(2.9) —B级 10(28.6) 2(5.7) 5(14.3) — 1(2.9)C级 1(2.9) 0(0) 0(0) — —病毒性肝炎[n(%)]乙型肝炎 16(45.7) 4(11.4) 1(2.9) 1(2.9) 1(2.9)丙型肝炎 0(0.0) 2(5.7) 1(2.9) — —无2(5.7) 4(11.4) 3(8.6) — —术前ASA分级[n(%)]II 6(17.1) 4(11.4) 1(2.9) — —III 10(28.6) 5(14.3) 3(8.6) 1(2.9) 1(2.9)VI 2(5.7) 1(2.9) 1(2.9) — —麻醉方式[n(%)]局麻 3(8.6) 0(0.0) 0(0.0) 0(0.0) 0(0.0)腰硬 4(11.4) 0(0.0) 0(0.0) 0(0.0) 0(0.0)全麻 11(31.4) 10(28.6) 5(14.3) 1(2.9) 1(2.9)补片放置[n(%)] 18(51.4) 3(8.6) 1(2.9) 1(2.9) 0(0.0)
1.2 手术方式
本组腹外疝患者中23例(65.7%)使用补片进行修补,其中聚丙烯补片19例,聚四氟乙烯补片1例,生物补片3例;12例(34.3%)行自体组织缝合修补术。具体术式如下:腹股沟疝17例患者均为Lichtenstein无张力疝修补术,1例双侧腹股沟疝患者在肝功能和凝血功能改善后行腹腔镜下疝修补术 ,其中聚丙烯补片16例,生物补片(猪小肠黏膜下层组织脱细胞基质补片)2例。切口疝患者中自体组织缝合修补术7例;2例采用开放Sublay技术 ,术中应用聚丙烯补片;1例采用开放Underlay技术,术中使用聚四氟乙烯补片将补片植入腹腔内。脐疝患者中4例为自体组织缝合修补术,1例使用开放sublay技术将聚丙烯补片放置于腹膜前。1例切口疝合并脐疝者,采用腹腔镜联合开腹的杂交技术切口疝修补术,术中使用生物补片(猪小肠黏膜下组织脱细胞基质补片)。1例腹白线疝患者采用自体组织缝合修补术。
1.3 围术期处理
术前完善脏器功能评估。转氨酶高者使用护肝降酶处理,提高手术耐受性,低蛋白血症者术前加强营养支持,并且输注白蛋白,控制腹水。调节凝血功能,常规补充维生素K1。维持水电解质及酸碱平衡,适当使用利尿药。对于切口疝的患者术前口服泻药行肠道准备。术中常规预防性使用抗生素治疗。术后处理:⑴ 术后常规监测肝功能并采取护肝治疗,每天监测腹围;⑵ 加强抗感染治疗,术后抗生素治疗3~5 d;⑶ 维持水电解质及酸碱平衡,使用利尿药,补充白蛋白,加强营养支持治疗。
1.4 观察指标
主要观察指标为术后疝复发率,次要观察指标为手术治疗的安全性和术后并发症发生情况。
1.5 数据记录与随访方法
由2名研究人员独立调阅病例并收集相应的临床数据,包括患者一般资料如性别、年龄、合并基础疾病以及腹前壁疝的基础资料,同时收集患者术后30 d内的并发症发生情况,由2名研究人员核对数据。术后慢性疼痛程度、术区不适感、异物感采用简单言语量表(simple verbal scale,SVS)评估 [5]。术后对所有患者进行随访,采用电话或门诊方式进行随访。随访开始时间为出院时间。随访时间截止时间为2018年3月31日,患者死亡或疝复发为随访终止事件。
1.6 统计学处理
计数资料采用例数(百分百)[n(%)]来描述。计量资料采用均数±标准差(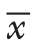 ±s)或中位数(M)描述。
±s)或中位数(M)描述。
2 结 果
2.1 患者围术期特点
本组患者术前16例(45.7%)凝血酶原时间延长[(2.30±1.29)s],16例(45.7%)低蛋白血症[(28.17±4.49)g/L],其中24例(68.5%)腹水(少量11例,中量8例,大量5例)。术前肝功能Child-Pugh A级16例(45.7%),B级18例(51.4%),C级1例(2.8%)。术前ASA分级:II级11例(31.4%),III级20例(57.1%),IV级4例(11.4%)。所有患者均顺利完成手术治疗,围术期无死亡者。腹股沟疝组平均手术时间(97.0±18.7)(70~130)min,术中出血量平均(30.0±5.0)mL。切口疝组平均时间(125±33.5)(75~180)min,术中出血量平均(100.5±23.5)mL。脐疝组平均手术时间为(106±45.1)(60~150)min,术中出血量平均(40.5±20.5)mL。本组患者术后中位住院时间8(1~63)d。
2.2 术后30 d内并发症发生情况
术后总体并发症发生率为22.8%,其中血清肿2例(5.7%);血肿4例(11.4%);切口感染1例(2.9%),手术部位感染2例(5.7%)。术后并发症具体情况如下:腹股沟疝组中总并发发生率为22.2%(4/18);血清肿1例(5.5%),血肿2例(11.1%),均经保守治疗治愈;1例(5.5%)出现膀胱瘘和腹股沟血肿,此例患者经局部穿刺置管引流和留置导尿管,使用抗生素治疗后治愈,未取出补片;未发生睾丸并发症。切口疝组1例(10%,1/10)补片修补患者术后出现血肿,经过保守治疗后治愈,1例(10%,1/10)直接缝合修补术后患者出现切口裂开并感染,经伤口清创二期缝合后痊愈。脐疝组术后出现血清肿1例(20%,1/5),另外1例(20%,1/5)出现腹腔感染、肺部感染。所有患者术后均无尿储留。
2.3 术后长期随访结果
23例患者获得长期随访(分别为12例腹股沟疝,8例切口疝,1例脐疝,1例脐疝合并切口疝和1例腹白线疝),随访率为65.7%。术后随访时间3~93个月,中位随访时间25个月。术后2例手术区域不适感(8.7%),无慢性疼痛病例,4例疝复发(17.4%)。腹股沟疝修补术后1例患者出现腹股沟区不适感或异物感(8.3%,1/12),无慢性疼痛病例,1例睾丸萎缩(8.3%,1/12),术后复发2例,占全部腹股沟疝患者的(16.7%,2/12)。切口疝组术后1例(12.5%,1/8)聚丙烯补片修补的切口疝患者术后出现术区异物感,无慢性疼痛病例,2例复发,占全部切口疝患者的25.0%(2/8)。本组患者术后死亡6例(26.1%),其中腹股沟疝组3例(13.0%),1例为术后6个月因肝硬化肝功能衰竭死亡,1例为出院后10 d因感染性休克死亡,1例为术后24个月因肝癌晚期死亡。切口疝1例(4.3%)在术后41个月因肝癌晚期死亡。脐疝1例(4.3%)在术后28个月因肝硬化肝功能衰竭死亡。腹白线疝1例(4.3%)在术后82个月因肝硬化门静脉高压上消化道大出血死亡。
3 讨 论
肝硬化和肝移植术后合并腹外疝临床上并不少见。肝硬化合并腹外疝患者术前常常并存血小板减少、凝血功能障碍、腹水、门静脉高压及肾功能衰竭等临床特点,而肝移植患者长期处于免疫抑制状态及移植肝功能不稳定等特点,这两类特殊状态患者对手术和麻醉的耐受性降低,可诱发肝功能衰竭,故手术并发症和病死率增高[3]。既往肝硬化合并腹外疝患者多采取观察等待治疗,手术仅限于嵌顿疝或疝囊破裂情况而进行急诊手术治疗,但此类患者急诊手术术后并发症和病死率较高[4-6, 13]。肝移植术后发生腹外疝的手术治疗时机及手术方式亦无定论。因此,肝硬化及肝移植术后合并腹外疝的最佳治疗策略仍有争议。
本研究中所有患者均为择期手术治疗,术前重视改善肝脏功能,输注白蛋白等控制腹水,同时使用维生素K1来纠正术前凝血功能障碍,所有患者麻醉和手术过程顺利。笔者认为加强围术期处理对于减少此类患者的术后并发症,减轻腹腔内压力,降低术后疝复发具有至关重要的作用。 围术期处理应积极改善患者肝肾功能和控制腹水,加强围手术期抗感染治疗和术后对症支持治疗,及时消除导致腹压增高的因素。本组患者术后30 d内总体并发症发生率为22.8%,其中血清肿2例(5.7%);血肿4例(11.4%);切口感染1例(2.9%),手术部位感染2例(5.7%)。1例(2.9%)腹股沟疝患者因腹腔感染,感染性休克在出院后10 d死亡。此类患者行疝修补术后并发症发生率较其他无肝硬化患者要高,其原因主要是术中低蛋白血症,腹水等因素导致组织液渗出较多,术后容易出现血清肿;同时因凝血功能障碍,止血不确切容易形成血肿。肝硬化和肝移植患者处于免疫抑制状态,容易发生手术部位感染,且病情进展快。围术期使用抗菌素可以减少此类患者手术部位感染,有效的腹水控制可减少术后并发症的发生,如切口感染、腹水渗漏、腹膜炎等[14-19]。近期有研究[14-17]表明此类患者手术疗效取决于腹水控制情况和肝功能分级,大多数腹水控制的理想的肝硬化合并腹外疝患者行择期腹壁疝修补术是安全有效的。
本组腹股沟疝患者采用是Lichtenstein无张力修补术,术后总并发发生率为22.2%,血清肿5.5%,血肿11.1%,均经保守治疗治愈;1例(5.5%)出现膀胱瘘和腹股沟血肿,经穿刺引流后治愈,无手术部位感染病例。术后随访腹股沟疝组2例患者复发(8.7%),占全部腹股沟疝患者的(16.7%),其中1例为术前已为复发性右侧腹股沟斜疝,术前有少量腹水,另外1例术前有在外院行右侧腹股沟斜疝无张力修补手术史,本次手术术前肝功能Child-Pugh分级B级、大量腹水。复发的2例均存在复发的高危因素。多项回顾性病例研究[7-8]表明Lichtenstein无张力修补术在肝硬化合并腹股沟疝治疗中是安全可行的,能够明显改善患者生活质量。本研究结果进一步论证了上述研究结论,此类患者术后疝复发率较高的主要原因是术后腹水没有得到良好的控制,肝硬化疾病进展导致。
本组切口疝患者直接缝合修补7例,2例行开放Sublay技术,术中应用聚丙烯补片;1例采用开放Underlay技术,术中使用聚四氟乙烯补片。术后总并发症发生率为20%(2/10),其中1例(10%,1/10)直接缝合修补术后患者出现血肿,经过保守治疗后治愈,1例(10%,1/10)直接缝合修补术后患者出现切口裂开并感染,经伤口清创二期缝合后痊愈。术后随访2例(25%)患者复发。文献[11-12]报道切口疝直接缝合修补术后疝复发率较高,故目前均推荐使用人工合成补片进行修补。Licari等[9]回顾性分析26例肝硬化合并切口疝患者资料,所有患者均进行切口疝修补术(onlay术式),术后5例死亡(18.5%),3例复发(11.0%),13例血清肿(50.0%),急诊手术组患者术后病死率、复发率及血清肿的发生率更高。本研究中1例切口疝合并脐疝患者使用生物补片进行杂交技术切口疝修补术,术后随访38个月未见复发。此类患者应首选聚丙烯补片进行修补,虽然也有研究报道生物补片可以应用于此类患者中,但尚缺乏足够的证据支持[5]。
肝硬化并发脐疝发生率约20%,若肝硬化同时合并顽固性腹水,并发脐疝发生率上升至40%左右[1-2]。本研究中脐疝术后出现血清肿1例(20.0%,1/5),另外1例(20.0%,1/5)出现腹腔感染、肺部感染,经过抗菌治疗后治愈。术后未见脐疝复发病例。Hew等[9]研究发现脐疝合并肝硬化行疝修补术后的并发症发生率高于无肝硬化组患者,但疝复发率和病死率并未增加。可见择期脐疝修补术是安全有效的,而急诊手术及肝功能Child-Pugh评分越高,术后并发症发生率更高[9-13]。
本研究中10例为肝移植术后患者,术前肝功能稳定,无Child-Pugh C级者。其中4例为肝移植术后合并腹股沟疝,肝移植术后时间为(40.0±23.1)个月,6例为肝移植术后合并切口疝,肝移植术后时间为(20.1±15.7)个月,均接受开放手术修补,8例获得长期随访,2例复发 (25.0%)均属于切口疝组,其中1例(12.5%)切口疝缺损最大直径为20 cm,术中采用Sublay技术(应用聚丙烯补片),另外1例(12.5%)复发者基础病为2型糖尿病,手术方式采取自体组织缝合修补术,术后出现切口裂开并感染。2例复发主要原因为切口疝缺损直径过大及术后切口感染。2例(25.0%)死亡病例均为腹股沟疝患者,死因分别为肝硬化肝功能衰竭和肝癌,与疝修补手术不相关。肝移植术后需长期服用免疫抑制药物,机体免疫功能受到抑制,这种免疫抑制特殊状态下的择期腹壁疝修补手术术后并发症和复发风险高,国内外报道文献很少,其最佳治疗策略仍待考究[20-23]。近年来,有学者[5]报道在腹腔镜修补或使用生物补片亦可取得满意效果。此类患者应重视评估术前肝功能、选择适当的手术策略、加强围手期肝功能监测及抗感染治疗 [24-25]。
综上所述,肝硬化或肝移植术后合并腹外疝患者,应在改善脏器功能,控制腹水的基础上早期行择期手术治疗,手术方式可选取开放手术或腹腔镜手术,保护正常组织结构,遵循微创操作及无菌原则,注意彻底止血。同时应加强围手术期管理,预防术后并发症的发生。
[1]Belghiti J, Durand F.Abdominal wall hernias in the setting of cirrhosis[J].Semin Liver Dis, 1997, 17(3):219–226.doi: 10.1055/s-2007–1007199.
[2]Carbonell AM, Wolfe LG, DeMaria EJ.Poor outcomes in cirrhosisassociated hernia repair: a nationwide cohort study of 32,033 patients[J].Hernia, 2005, 9(4):353–357.doi: 10.1007/s10029–005–0022-x.
[3]Silva FD, Andraus W, Pinheiro RS, et al.Abdominal and inguinal hernia in cirrhotic patients: what's the best approach[J].Arq Bras Cir Dig, 2012, 25(1):52–55.
[4]Marsman HA, Heisterkamp J, Halm JA, et al.Management in patients with liver cirrhosis and an umbilical hernia[J].Surgery,2007, 142(3):372–375.doi: 10.1016/j.surg.2007.05.006.
[5]Ansaloni L, Catena F, Coccolini F, et al.Inguinal hernia repair with porcine small intestine submucosa: 3-year follow-up results of a randomized controlled trial of Lichtenstein's repair with polypropylene mesh versus Surgisis Inguinal Hernia Matrix[J].Am J Surg, 2009, 198(3):303–312.doi: 10.1016/j.amjsurg.2008.09.021.
[6]Yu BC, Chung M, Lee G.The repair of umbilical hernia in cirrhotic patients: 18 consecutive case series in a single institute[J].Ann Surg Treat Res, 2015, 89(2):87–91.doi: 10.4174/astr.2015.89.2.87.
[7]Patti R, Almasio PL, Buscemi S, et al.Inguinal hernioplasty improves the quality of life in patients with cirrhosis[J].Am J Surg,2008, 196(3):373–378.doi: 10.1016/j.amjsurg.2008.02.007.
[8]罗文, 王勇, 段鑫, 等.肝硬化顽固性腹水合并腹股沟疝的临床治疗分析[J].中华疝和腹壁外科杂志:电子版, 2015, 9(2):125–127.doi:10.3877/cma.j.issn.1674–392X.2015.02.009.Luo W, Wang Y, Duan X, et al.The clinical efficiency of Iichtenstein tension-free hernioplasty in patients with inguinal hernia,liver cirrhosis and ascites[J].Chinese Journal of Hernia and Abdominal Wall Surgery: Electronic Version, 2015, 9(2):125–127.doi:10.3877/cma.j.issn.1674–392X.2015.02.009.
[9]Licari L, Salamone G, Ciolino G, et al.The abdominal wall incisional hernia repair in cirrhotic patients[J].G Chir, 2018,10(1):20–23.
[10]Hew S, Yu W, Robson S, et al.Safety and effectiveness of umbilical hernia repair in patients with cirrhosis[J].Hernia, 2018, 22(5):759–765.doi: 10.1007/s10029–018–1761–9.
[11]Andraus W, Pinheiro RS, Lai Q, et al.Abdominal wall hernia in cirrhotic patients: emergency surgery results in higher morbidity and mortality[J].BMC Surg, 2015, 15:65.doi: 10.1186/s12893–015–0052-y.
[12]McKay A, Dixon E, Bathe O, et al.Umbilical hernia repair in the presence of cirrhosis and ascites: results of a survey and review of the literature[J].Hernia, 2009, 13(5):461–468.doi: 10.1007/s10029–009–0535–9.
[13]Odom SR, Gupta A, Talmor D, et al.Emergency hernia repair in cirrhotic patients with ascites[J].J Trauma Acute Care Surg, 2013,75(3):404–409.doi: 10.1097/TA.0b013e31829e2313.
[14]Choi SB, Hong KD, Lee JS, et al.Management of umbilical hernia complicated with liver cirrhosis: an advocate of early and elective herniorrhaphy[J].Dig Liver Dis, 2011, 43(12):991–995.doi:10.1016/j.dld.2011.07.015.
[15]Cho SW, Bhayani N, Newell P, et al.Umbilical hernia repair in patients with signs of portal hypertension: surgical outcome and predictors of mortality[J].Arch Surg, 2012, 147(9):864–869.doi:10.1001/archsurg.2012.1663.
[16]Saleh F, Okrainec A, Cleary SP, et al.Management of umbilical hernias in patients with ascites: development of a nomogram to predict mortality[J].Am J Surg, 2015, 209(2):302–307.doi:10.1016/j.amjsurg.2014.04.013.
[17]Eker HH, van Ramshorst GH, de Goede B, et al.A prospective study on elective umbilical hernia repair in patients with liver cirrhosis and ascites[J].Surgery, 2011, 150(3):542–546.doi:10.1016/j.surg.2011.02.026.
[18]Slakey DP, Benz CC, Joshi S, et al.Umbilical hernia repair in cirrhotic patients: utility of temporary peritoneal dialysis catheter[J].Am Surg, 2005, 71(1):58–61.
[19]Gray SH, Vick CC, Graham LA, et al.Umbilical herniorrhapy in cirrhosis: improved outcomes with elective repair[J].J Gastrointest Surg, 2008, 12(4):675–681.doi: 10.1007/s11605–008–0496–9.
[20]Kuo SC, Lin CC, Elsarawy A, et al.Laparoscopic Repair of Incisional Hernia Following Liver Transplantation-Early Experience of a Single Institution in Taiwan[J].Transplant Proc, 2017,49(8):1870–1874.doi: 10.1016/j.transproceed.2017.04.019.
[21]Weiss S, Weissenbacher A1, Sucher R, et al.Outcome analysis of laparoscopic incisional hernia repair and risk factors for hernia recurrence in liver transplant patients[J].Clin Transplant, 2015,29(10):866–871.doi: 10.1111/ctr.12558.
[22]Hegab B, Abdelfattah MR, Azzam A, et al.The usefulness of laparoscopic hernia repair in the management of incisional hernia following liver transplantation[J].J Minim Access Surg, 2016,12(1):58–62.doi: 10.4103/0972–9941.152102.
[23]Schaffellner S, Sereinigg M, Wagner D, et al.Ventral incisional hernia (VIH) repair after liver transplantation (OLT) with a biological mesh: experience in 3 cases[J].Z Gastroenterol, 2016,54(5):421–425.doi: 10.1055/s-0042–103249.
[24]Ayvazoglu Soy EH, Kirnap M, Yildirim S, et al.Incisional Hernia After Liver Transplant[J].Exp Clin Transplant, 2017, 15(Suppl 1):185–189.doi: 10.6002/ect.mesot2016.P65.
[25]汤佳音, 罗蒙, 施志强, 等.腹股沟疝合并肝硬化的治疗分析: 附30例报告[J].中国普通外科杂志, 2011, 20(7):753–755.Tang JY, Luo M, Shi ZQ, et al.Treatment of inguinal hernia associated with liver cirrhosis: an analysis of 30 cases[J].Chinese Journal of General Surgery, 2011, 20(7):753–755.
