胃癌(gastric cancer)是中国最常见的恶性肿瘤之一,其发病率和病死率逐渐增加[1-2]。在中国甘肃省胃癌的发病率和病死率高于其他地区,每年新发胃癌病例14.24万例,胃癌死亡95 200例[3-4]。手术治疗一直是胃癌的主要手段,在过去几十年,手术技术取得了重大进展,其中最重要的是微创手术的出现和发展。
腹腔镜技术最早、最常见的应用于胃癌的治疗。传统腹腔镜手术属于二维手术视野,操作活动度有限,具有生理震颤和手术操作疲劳等技术上的局限性和缺点[5-6]。然而,达芬奇机器人手术系统(Da Vinci Robotic Surgery System)提供了三维高清晰度、10倍放大的手术视野并帮助外科医生克服传统腹腔镜手术的局限性[7],尤为在胃癌精准清扫淋巴结时更重要。2002年,Hashizume团队首次报道了机器人辅助胃切除术(robotic assisted gastrectomy,RAG)。此后,RAG的临床研究陆续报道。尽管这些研究为RAG的安全性和可行性提供了依据,但RAG仍处于探索阶段,其短期和长期疗效仍有待进一步证实。
1 资料与方法
1.1 一般资料
所有患者选自2017年1月31日—2018年2月1日于解放军兰州总医院普通外科行RAG和腹腔镜辅助胃切除术(laparoscopy-assisted gastrectomy,LAG)治疗的患者。纳入标准如下:⑴ 所有胃癌患者均通过病理活检确诊。⑵ 所有患者在术前腹部超声、CT或核磁中均未发现远处转移。⑶ 所有的胃癌根治术根据最新版日本胃癌治疗指南[8]标准进行。排除标准:胃良性肿瘤、胃间质瘤或合并其他器官恶性肿瘤以及残胃癌等患者。纳入研究RAG组患者100例(男79例,女21例)和LAG组患者135例(男101例,女34例)。在本研究中,病理分期根据美国胃癌TNM分期系统第8版进行分类[9-10]。
1.2 手术方式
除了套管和手术器械的位置外,两种微创手术操作相似。LAG手术过程已有详细描述[11]。机器人手术过程与之前报道的类似[12-13]。根据日本胃癌研究学会的标准完成胃癌根治术和周围淋巴结清扫[14-15],采用区域淋巴结清扫方式,术中手术人员对淋巴结进行分组并计数,实际清扫淋巴结数目以病理医师镜检结果为准。在本研究中,大多数消化道重建在达芬奇手术系统辅助下在腹腔内进行,体外手辅助加固缝合。全胃切除消化道重建采用Roux-en-Y食管空肠吻合术,Billroth II胃空肠吻合术+布朗氏吻合术应用于远端胃切除术。
1.3 围手术期管理
按照相同的方案对两组进行术前后护理、建立饮食和出院。患者术后第1日拔除胃管,可饮少量水,第1次肛门排气后饮水次数增多,术后第3天或第4天给予流质饮食,术后第5~7天软饮食。软饮食耐受2~3 d,术后无并发症的患者,办理出院。所有出院患者在胃切除术后6个月内随访。
1.4 统计学处理
统计分析使用SPSS 22.0分析。连续变量采用平均值均数±标准差(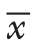 ±s)、中位数和四分位间距[M(Q1~Q3)]表示。连续变量分析使用t检验或U检验,分类变量使用χ2检验或F检验。统计检验为双侧检验,P<0.05为差异有统计学意义。
±s)、中位数和四分位间距[M(Q1~Q3)]表示。连续变量分析使用t检验或U检验,分类变量使用χ2检验或F检验。统计检验为双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 患者临床病理特征
RAG组患者与LAG组患者的性别、年龄、体质量指数(BMI)、肿瘤部位、肿瘤大小、既往腹部手术史、T分期、N分期和肿瘤TNM分期等临床病理特征均无统计学差异(均P>0.05)(表1)。
表1 RAG组与LAG组患者一般资料和病理特征比较
Table 1 Comparison of the general data and pathologic features between RAG and LAG group
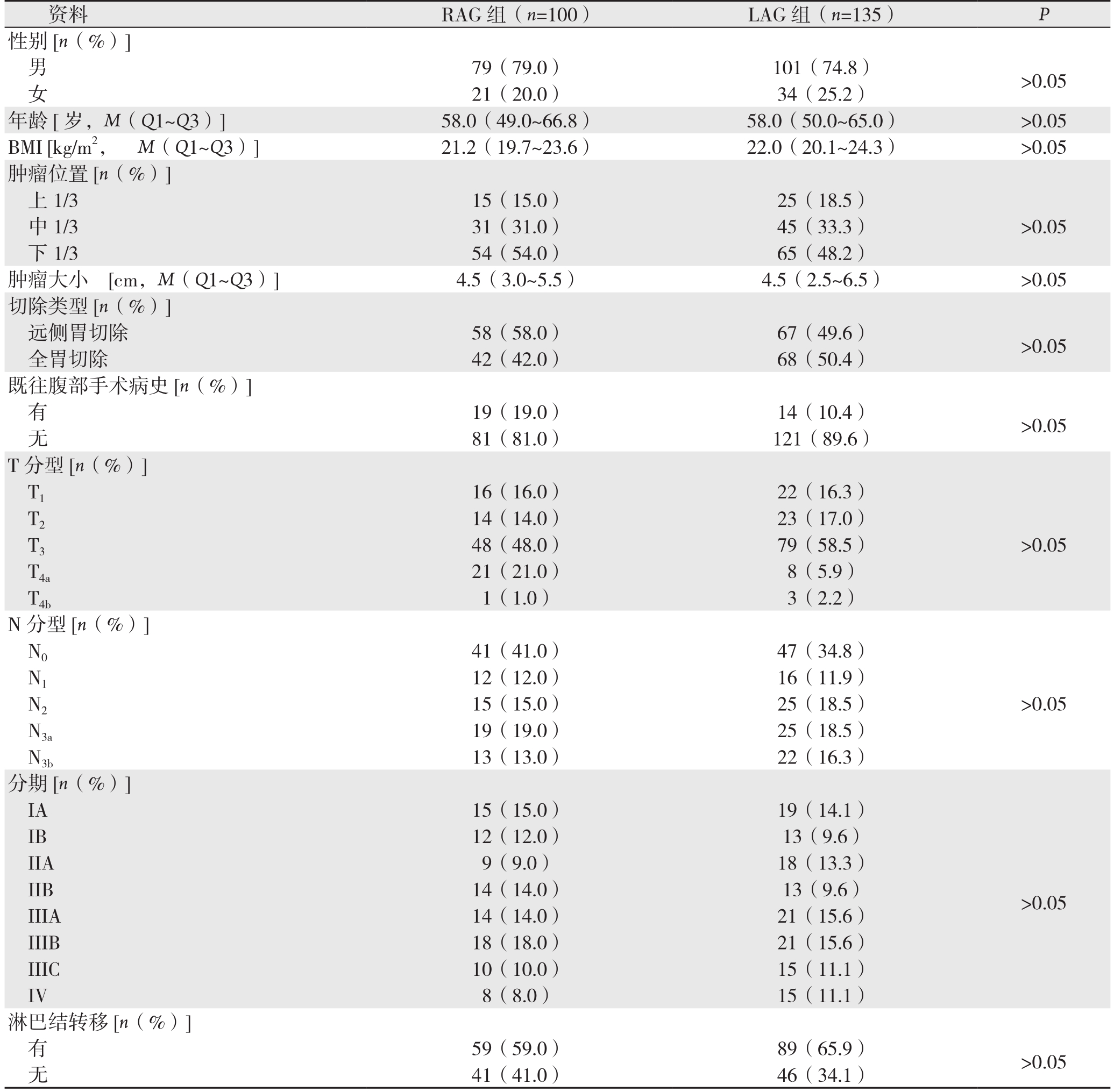
资料 RAG组(n=100) LAG组(n=135) P性别[n(%)]男79(79.0) 101(74.8) >0.05女21(20.0) 34(25.2)年龄[岁,M(Q1~Q3)] 58.0(49.0~66.8) 58.0(50.0~65.0) >0.05 BMI [kg/m2, M(Q1~Q3)] 21.2(19.7~23.6) 22.0(20.1~24.3) >0.05肿瘤位置[n(%)]上1/3 15(15.0) 25(18.5)中1/3 31(31.0) 45(33.3) >0.05下 1/3 54(54.0) 65(48.2)肿瘤大小 [cm,M(Q1~Q3)] 4.5(3.0~5.5) 4.5(2.5~6.5) >0.05切除类型[n(%)]远侧胃切除 58(58.0) 67(49.6) >0.05全胃切除 42(42.0) 68(50.4)既往腹部手术病史[n(%)]有19(19.0) 14(10.4) >0.05无81(81.0) 121(89.6)T分型[n(%)]T1 16(16.0) 22(16.3)T2 14(14.0) 23(17.0)T3 48(48.0) 79(58.5) >0.05 T4a 21(21.0) 8(5.9)T4b 1(1.0) 3(2.2)N分型[n(%)]N0 41(41.0) 47(34.8)N1 12(12.0) 16(11.9)N2 15(15.0) 25(18.5) >0.05 N3a 19(19.0) 25(18.5)N3b 13(13.0) 22(16.3)分期[n(%)]IA 15(15.0) 19(14.1)>0.05 IB 12(12.0) 13(9.6)IIA 9(9.0) 18(13.3)IIB 14(14.0) 13(9.6)IIIA 14(14.0) 21(15.6)IIIB 18(18.0) 21(15.6)IIIC 10(10.0) 15(11.1)IV 8(8.0) 15(11.1)淋巴结转移[n(%)]有59(59.0) 89(65.9) >0.05无41(41.0) 46(34.1)
2.2 手术情况表现和术后并发症
RAG组术后住院时间较LAG组短[11(9~13)d vs.12(10~14)d,P<0.0001],第1次肛门排气时间较LAG组短[2(2~3)d vs.3(2.3~3)d,P<0.0001](表2)。两组的手术时间、手术出血量和进流食时间无统计学差异(均P>0.05)。RAG组术后有5例(5%)发生并发症,LAG组术后有9例(6.7%)发生并发症,两组并发症发生率无统计学差异(P>0.05)。
表2 RAG组与LAG组手术指标以及术后并发症的比较
Table 2 Comparison of the surgical variables and postoperative complications between RAG and LAG group
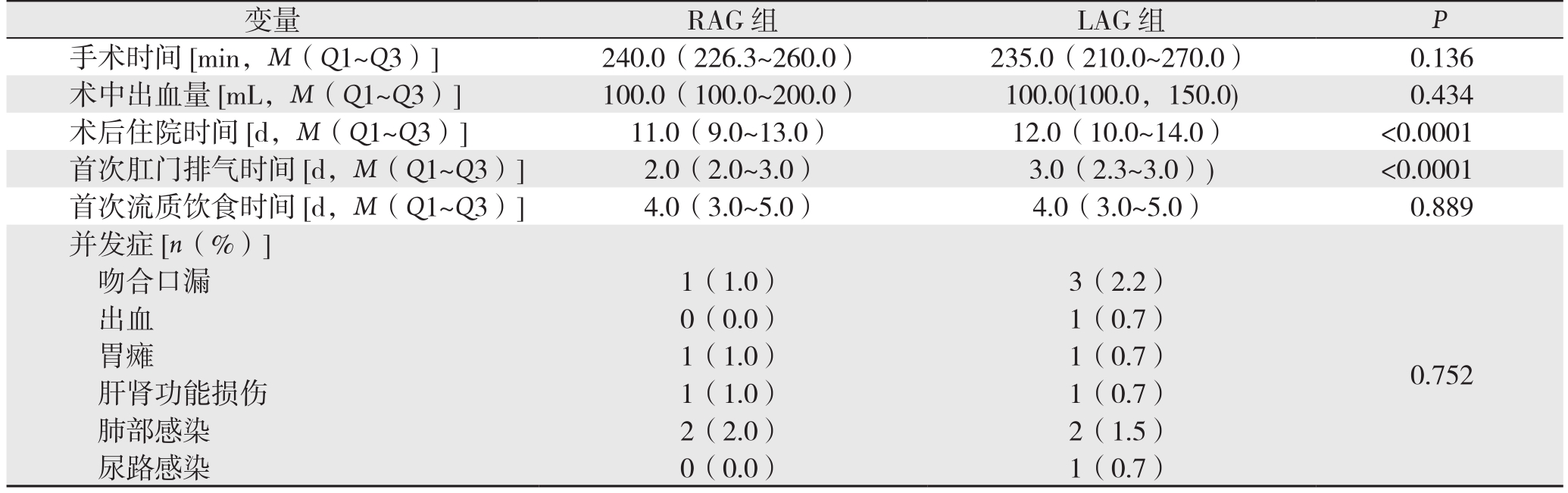
变量 RAG组 LAG组 P手术时间[min,M(Q1~Q3)] 240.0(226.3~260.0) 235.0(210.0~270.0) 0.136术中出血量 [mL,M(Q1~Q3)] 100.0(100.0~200.0) 100.0(100.0,150.0) 0.434术后住院时间[d,M(Q1~Q3)] 11.0(9.0~13.0) 12.0(10.0~14.0) <0.0001首次肛门排气时间[d,M(Q1~Q3)] 2.0(2.0~3.0) 3.0(2.3~3.0)) <0.0001首次流质饮食时间[d,M(Q1~Q3)] 4.0(3.0~5.0) 4.0(3.0~5.0) 0.889并发症[n(%)]吻合口漏 1(1.0) 3(2.2)0.752出血 0(0.0) 1(0.7)胃瘫 1(1.0) 1(0.7)肝肾功能损伤 1(1.0) 1(0.7)肺部感染 2(2.0) 2(1.5)尿路感染 0(0.0) 1(0.7)
2.3 淋巴结清扫数目
RAG组清扫淋巴结平均数为40.9枚,而LAG组平均数为35.4枚(P=0.004)。然而,两组间第1站清扫淋巴结平均数目无统计学差异[(23.2±8.3)枚 vs.(21.3±9.6)枚,P=0.115],但RAG组第2、3站清扫淋巴结数目明显大于LAG组[(14.6±6.3)枚vs.(11.9±7.1)枚,P=0.004;(3.2±3.1)枚vs.(2.1±2.7)枚,P=0.006](图1)。
为了详细评估机器人淋巴结清扫的技术可行性,进一步比较各组间清扫淋巴结数目。在全胃切除组中,RAG组清扫淋巴结数目多于LAG组[(43.9±12.7)枚vs.(37.7±16.2)枚,P=0.037];两组间胃周淋巴结(第1~6组)清扫数目并无差异[(25.9±8.0)枚vs.(23.6±9.7)枚,P=0.202];在胃周以外淋巴结(第7~14v)以及7~12a、10+11组清扫淋巴结数目RAG组明显大于LAG组[(17.9±7.3)枚vs.(14.1±8.7)枚,P=0.018;(16.3±6.4)枚vs.(13.1±7.6)枚,P=0.025;(3.6±1.9)枚vs.(2.0±2.7)枚,P=0.006],此外,RAG组第6、7、10、11p、14v组的淋巴结清扫数目明显大于LAG组[(5.9±3.4)枚vs.(3.9±2.9)枚,P=0.002;(4.3±2.6)枚vs.(3.2±2.3)枚,P=0.032;(2.5±2.3)枚vs.(1.4±1.5)枚,P=0.025;(1.1±1.2)枚vs.(0.5±0.4)枚,P=0.036;(1.1±2.1)枚vs.(0.5±1.6)枚,P=0.038]。在远端胃切除组中,也观察到类似的结果(图2)。
2.4 手术方面亚组比较
在BMI、切除类型和年龄进行亚组分析。在BMI<30 kg/m2与BMI≥30 kg/m2、远端胃切除组和全胃切除组以及不同年龄分组中,RAG组患者术后住院时间短、第1次肛门排气早、淋巴结清扫数目多(均P<0.05)(表3-5)。
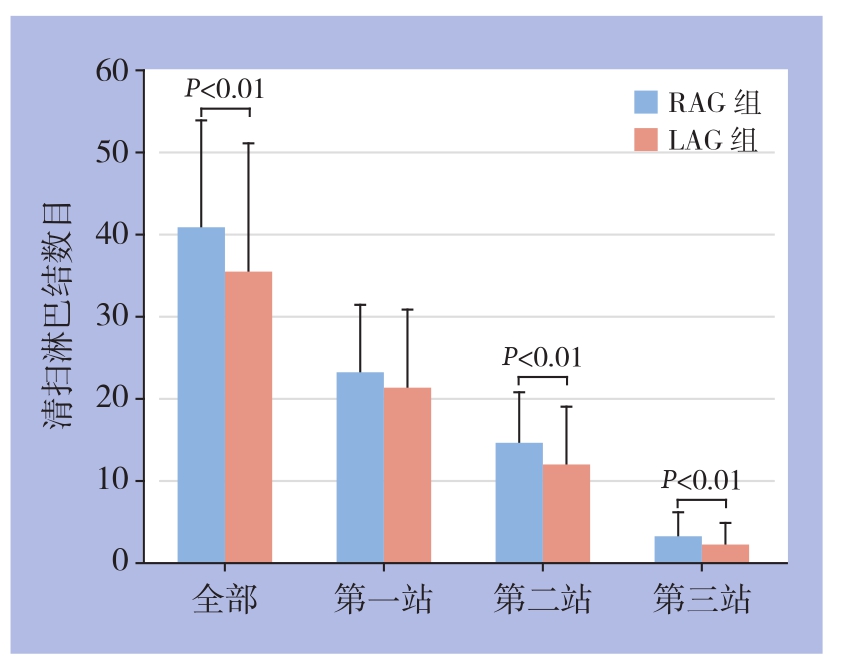
图1 RAG组与LAG组总淋巴结各站清扫淋巴结平均数目比较
Figure 1 Comparison of the total number and numbers of each station of lymph nodes between RAG and LAG group
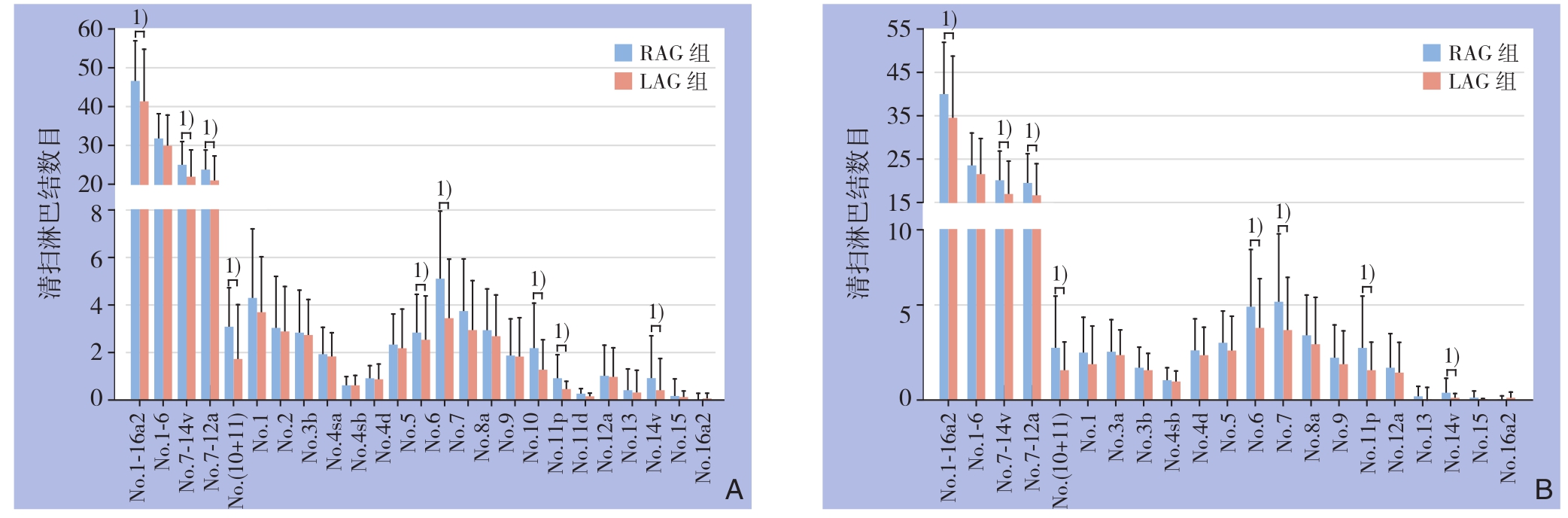
图2 每组淋巴结之间清扫淋巴结平均数目比较 A:全胃切除术;B:远端胃切除术 1) P<0.05
Figure 2 Comparison of the average number in each group of lymph nodes A: Total gastrectomy; B: Distal gastrectomy 1) P<0.05
表3 不同BMI亚组分析
Table 3 Analysis of different BMI subgroups
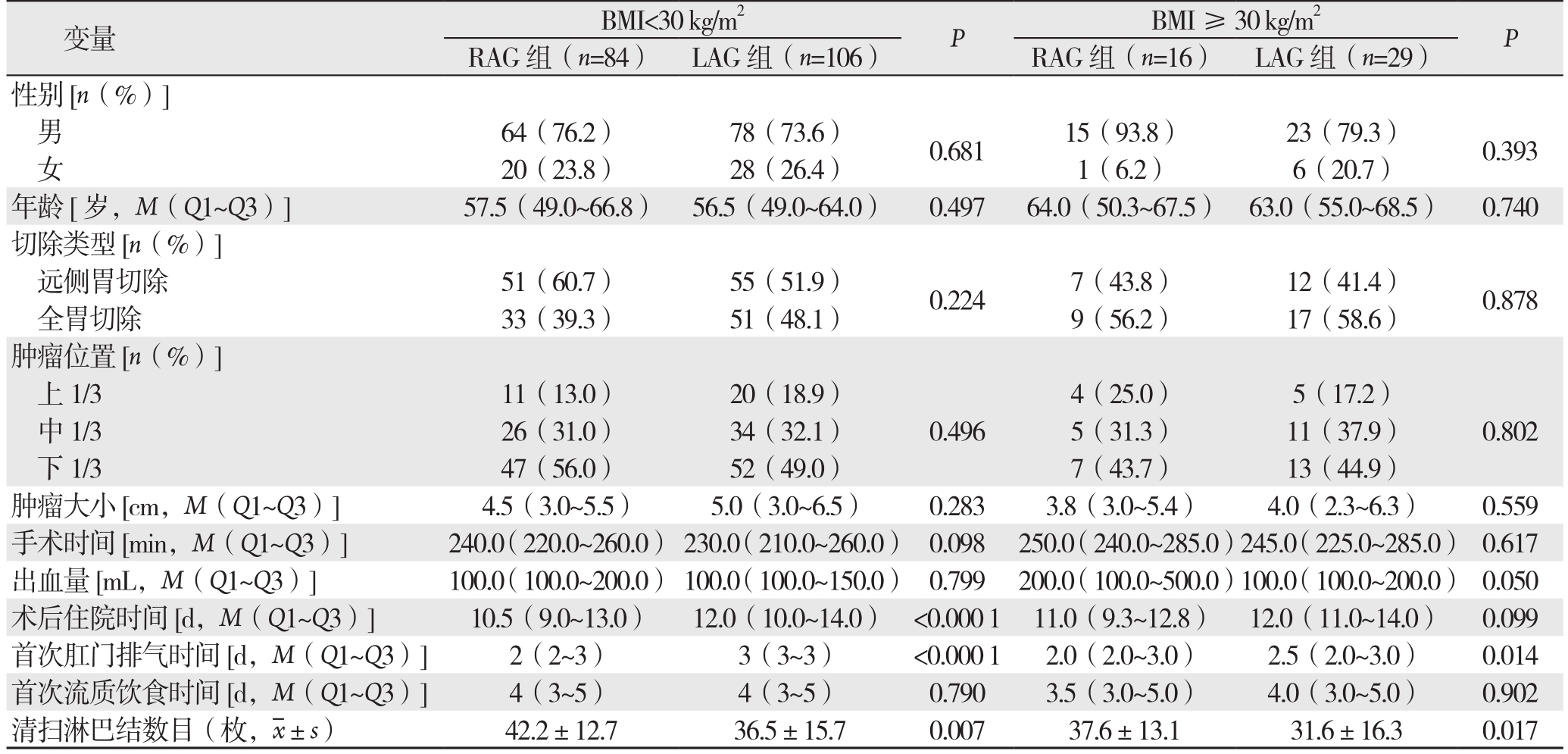
变量 BMI<30 kg/m2 P BMI≥30 kg/m2 P RAG组(n=84) LAG组(n=106) RAG组(n=16) LAG组(n=29)性别[n(%)]男64(76.2) 78(73.6) 0.681 15(93.8) 23(79.3) 0.393女20(23.8) 28(26.4) 1(6.2) 6(20.7)年龄[岁,M(Q1~Q3)] 57.5(49.0~66.8) 56.5(49.0~64.0) 0.497 64.0(50.3~67.5) 63.0(55.0~68.5) 0.740切除类型[n(%)]远侧胃切除 51(60.7) 55(51.9) 0.224 7(43.8) 12(41.4) 0.878全胃切除 33(39.3) 51(48.1) 9(56.2) 17(58.6)肿瘤位置[n(%)]上 1/3 11(13.0) 20(18.9)0.496 4(25.0) 5(17.2)0.802中1/3 26(31.0) 34(32.1) 5(31.3) 11(37.9)下1/3 47(56.0) 52(49.0) 7(43.7) 13(44.9)肿瘤大小[cm,M(Q1~Q3)] 4.5(3.0~5.5) 5.0(3.0~6.5) 0.283 3.8(3.0~5.4) 4.0(2.3~6.3) 0.559手术时间 [min,M(Q1~Q3)] 240.0(220.0~260.0) 230.0(210.0~260.0) 0.098 250.0(240.0~285.0)245.0(225.0~285.0) 0.617出血量 [mL,M(Q1~Q3)] 100.0(100.0~200.0) 100.0(100.0~150.0) 0.799 200.0(100.0~500.0)100.0(100.0~200.0) 0.050术后住院时间[d,M(Q1~Q3)] 10.5(9.0~13.0) 12.0(10.0~14.0) <0.000 1 11.0(9.3~12.8) 12.0(11.0~14.0) 0.099首次肛门排气时间[d,M(Q1~Q3)] 2(2~3) 3(3~3) <0.000 1 2.0(2.0~3.0) 2.5(2.0~3.0) 0.014首次流质饮食时间[d,M(Q1~Q3)] 4(3~5) 4(3~5) 0.790 3.5(3.0~5.0) 4.0(3.0~5.0) 0.902清扫淋巴结数目(枚,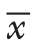 ±s) 42.2±12.7 36.5±15.7 0.007 37.6±13.1 31.6±16.3 0.017
±s) 42.2±12.7 36.5±15.7 0.007 37.6±13.1 31.6±16.3 0.017
表4 不同切除范围亚组分析
Table 4 Analysis of different resection scopes
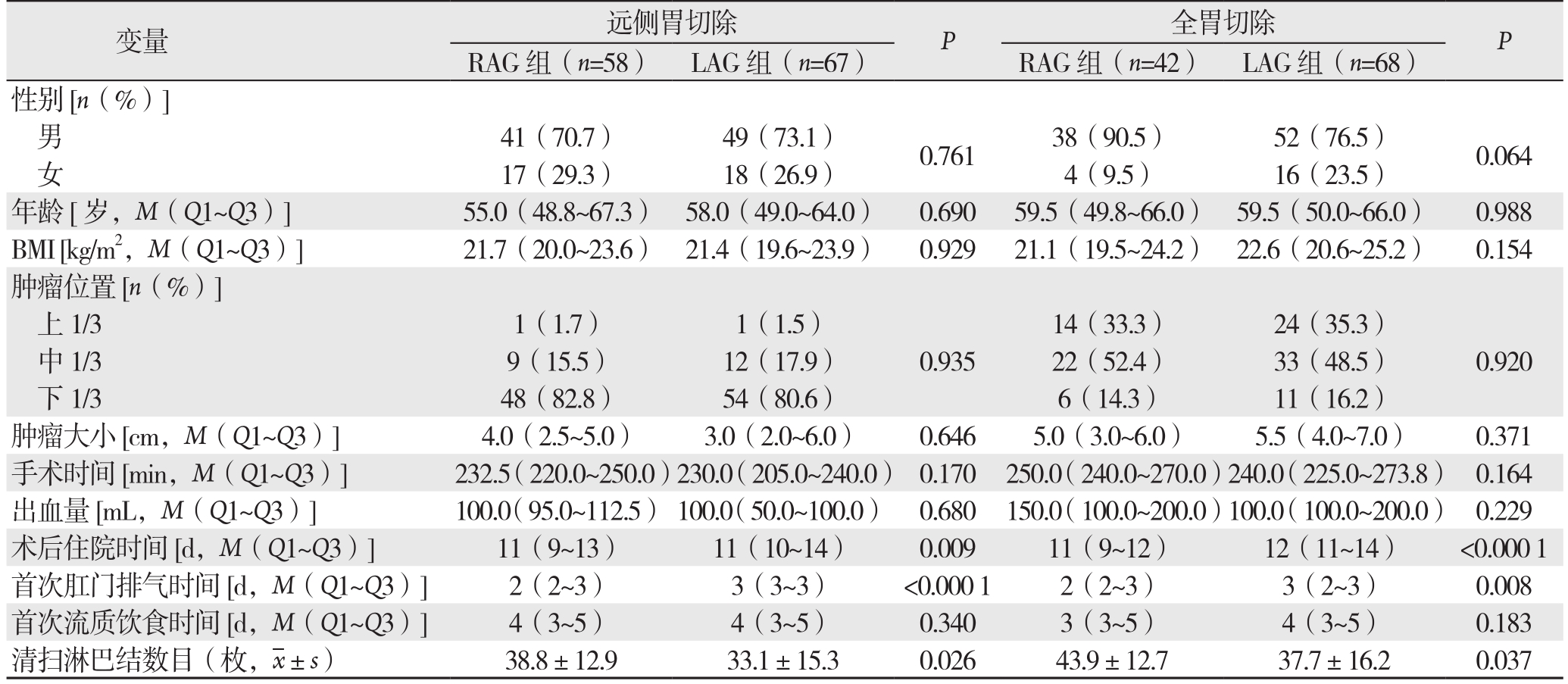
变量 远侧胃切除 P 全胃切除 P RAG组(n=58) LAG组(n=67) RAG组(n=42) LAG组(n=68)性别[n(%)]男41(70.7) 49(73.1) 0.761 38(90.5) 52(76.5) 0.064女17(29.3) 18(26.9) 4(9.5) 16(23.5)年龄[岁,M(Q1~Q3)] 55.0(48.8~67.3) 58.0(49.0~64.0) 0.690 59.5(49.8~66.0) 59.5(50.0~66.0) 0.988 BMI [kg/m2,M(Q1~Q3)] 21.7(20.0~23.6) 21.4(19.6~23.9) 0.929 21.1(19.5~24.2) 22.6(20.6~25.2) 0.154肿瘤位置[n(%)]上1/3 1(1.7) 1(1.5) 14(33.3) 24(35.3)中1/3 9(15.5) 12(17.9) 0.935 22(52.4) 33(48.5) 0.920下1/3 48(82.8) 54(80.6) 6(14.3) 11(16.2)肿瘤大小[cm,M(Q1~Q3)] 4.0(2.5~5.0) 3.0(2.0~6.0) 0.646 5.0(3.0~6.0) 5.5(4.0~7.0) 0.371手术时间 [min,M(Q1~Q3)] 232.5(220.0~250.0)230.0(205.0~240.0) 0.170 250.0(240.0~270.0)240.0(225.0~273.8) 0.164出血量 [mL,M(Q1~Q3)] 100.0(95.0~112.5) 100.0(50.0~100.0) 0.680 150.0(100.0~200.0)100.0(100.0~200.0) 0.229术后住院时间[d,M(Q1~Q3)] 11(9~13) 11(10~14) 0.009 11(9~12) 12(11~14) <0.000 1首次肛门排气时间[d,M(Q1~Q3)] 2(2~3) 3(3~3) <0.000 1 2(2~3) 3(2~3) 0.008首次流质饮食时间[d,M(Q1~Q3)] 4(3~5) 4(3~5) 0.340 3(3~5) 4(3~5) 0.183清扫淋巴结数目(枚,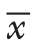 ±s) 38.8±12.9 33.1±15.3 0.026 43.9±12.7 37.7±16.2 0.037
±s) 38.8±12.9 33.1±15.3 0.026 43.9±12.7 37.7±16.2 0.037
表5 不同年龄亚组分析
Table 5 Analysis of different age subgroups
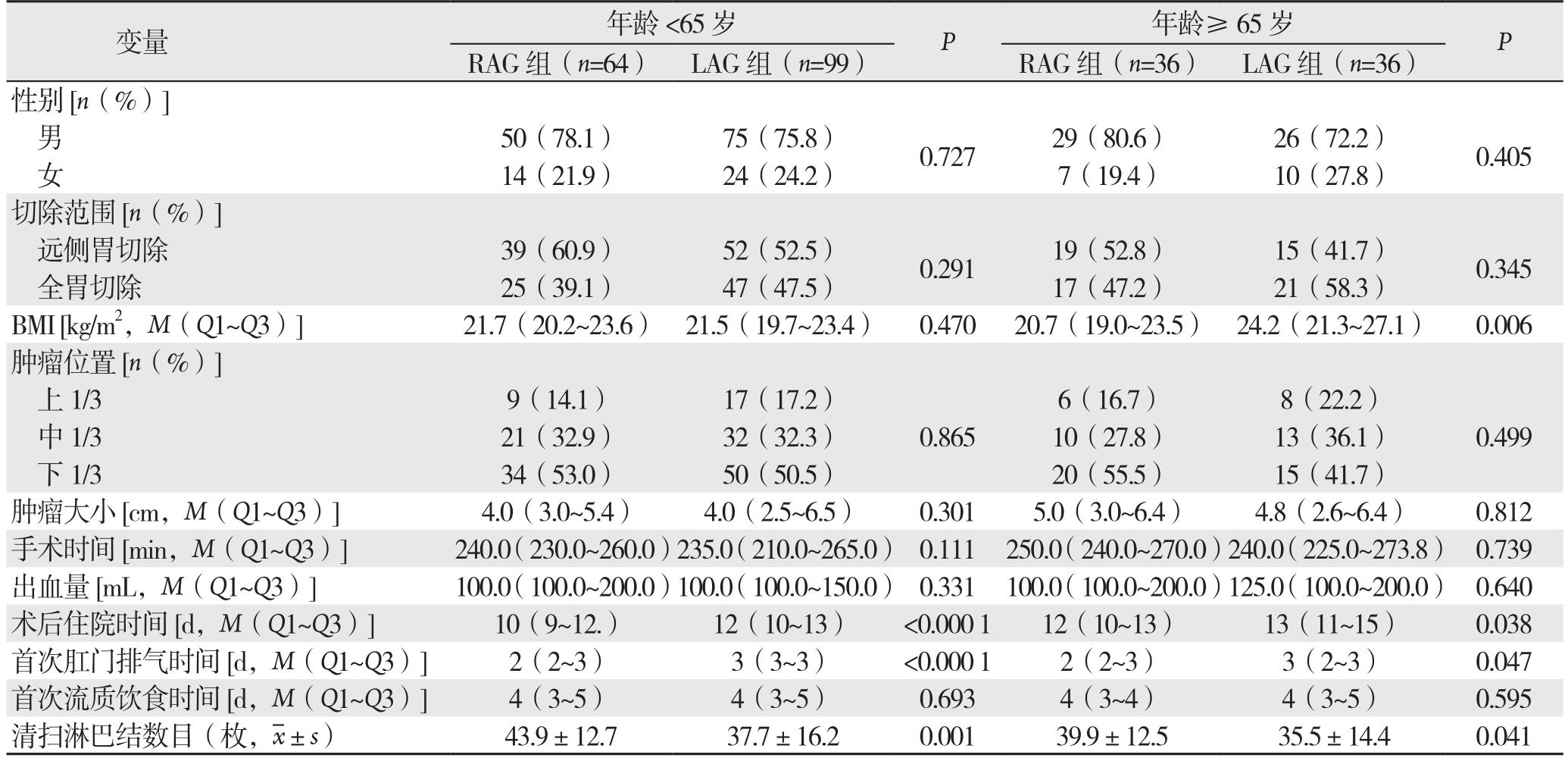
变量 年龄<65岁 P 年龄≥65岁 P RAG组(n=64) LAG组(n=99) RAG组(n=36) LAG组(n=36)性别[n(%)]男50(78.1) 75(75.8) 0.727 29(80.6) 26(72.2) 0.405女14(21.9) 24(24.2) 7(19.4) 10(27.8)切除范围[n(%)]远侧胃切除 39(60.9) 52(52.5) 0.291 19(52.8) 15(41.7) 0.345全胃切除 25(39.1) 47(47.5) 17(47.2) 21(58.3)BMI [kg/m2,M(Q1~Q3)] 21.7(20.2~23.6) 21.5(19.7~23.4) 0.470 20.7(19.0~23.5) 24.2(21.3~27.1) 0.006肿瘤位置[n(%)]上 1/3 9(14.1) 17(17.2)0.865 6(16.7) 8(22.2)0.499中1/3 21(32.9) 32(32.3) 10(27.8) 13(36.1)下1/3 34(53.0) 50(50.5) 20(55.5) 15(41.7)肿瘤大小[cm,M(Q1~Q3)] 4.0(3.0~5.4) 4.0(2.5~6.5) 0.301 5.0(3.0~6.4) 4.8(2.6~6.4) 0.812手术时间 [min,M(Q1~Q3)] 240.0(230.0~260.0)235.0(210.0~265.0) 0.111 250.0(240.0~270.0)240.0(225.0~273.8) 0.739出血量 [mL,M(Q1~Q3)] 100.0(100.0~200.0)100.0(100.0~150.0) 0.331 100.0(100.0~200.0)125.0(100.0~200.0) 0.640术后住院时间[d,M(Q1~Q3)] 10(9~12.) 12(10~13) <0.000 1 12(10~13) 13(11~15) 0.038首次肛门排气时间[d,M(Q1~Q3)] 2(2~3) 3(3~3) <0.000 1 2(2~3) 3(2~3) 0.047首次流质饮食时间[d,M(Q1~Q3)] 4(3~5) 4(3~5) 0.693 4(3~4) 4(3~5) 0.595清扫淋巴结数目(枚,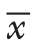 ±s) 43.9±12.7 37.7±16.2 0.001 39.9±12.5 35.5±14.4 0.041
±s) 43.9±12.7 37.7±16.2 0.001 39.9±12.5 35.5±14.4 0.041
3 讨 论
近年来,达芬奇机器人手术系统的出现在微创手术中实现了质的飞跃[16]。然而,与传统腹腔镜手术相比,达芬奇机器人手术系统尚未广泛普及运用、标准化[17]。本研究通过有经验的外科医生在RAG组和LAG组中进行比较。
本研究结果表明,RAG组术后第1次肛门排气较早,术后住院时间较短。两组手术时间、术中出血量及进食时间均无统计学差异。学者[18]认为,手术中牵拉器官是手术后引起炎症反应的重要因素。RAG的器械可能比LAG的器械诱发更少的炎症。因此,RAG组的术后肠道恢复时间可能较短,这与本研究结果一致。Kim等[6]报道RAG组的患者比LAG的患者出院早。本研究发现,RAG组术后住院时间短于LAG组。这可能是因为RAG组的术后肠道恢复时间较短,从流质饮食转换为软饮食所需的时间较短。本研究在患者饮食方面实施:第1次肛门排气后给予一小口水,术后第3天或第4天给予流质饮食,术后第5~7天给予软饮食。一旦软饮食耐受3~4 d,无并发症发生,办理出院。在本研究中,RAG组术后住院天数中位数为11 d,LAG组为12 d。今后可以尽量早日摄入流质饮食,以尽量减少术后住院时间。
有研究[19]报道RAG组和LAG组在手术出血量没有差异,这与本研究的结果一致。而其他研究也发现由有经验的外科医生进行的RAG失血较少[20-22]。一些外科医生认为LAG具有手术自由度和二维手术视野的局限性,特别是在清扫6、7、8a、9和14v的淋巴结时,手术区域更容易出血[6]。此外,两组术后并发症发生率无差异。然而,一些研究报道RAG相比LAG并发症较少[23-24],手术过程中未发生机器人手术特异性并发症,如器官损伤和腹壁严重创伤。
BMI、切除类型和年龄可能是影响手术结果的相关因素[21, 25]。因此,进一步根据这些变量进行亚组分析。在这项研究中,分别选择BMI(30 kg/m2)和年龄(65岁)为临界值。亚组分析结果显示:RAG组在第1次肛门排气时间较早、术后住院时间较短、淋巴结清扫数目较多。
在目前的研究中,RAG组的淋巴结清扫数目更多[26-27]。此外,RAG组中清扫第7~14v组淋巴结平均数显著大于LAG组。进一步比较了各组之间每站清扫淋巴结数目,发现第6、7、10、11和14a组淋巴结在统计学上有显著差异(均P<0.05)。一些研究[6, 28]认为,由于传统腹腔镜操作自由度限制,二维手术视野和生理震颤,在清扫第7、8a、9、11p和14v组淋巴结时受限较大。然而,达芬奇机器人手术系统具有三维视野、手术视野十倍放大视图以及防抖动等优势,可帮助外科医生精确解剖淋巴结并避免血管损伤。
达芬奇机器人手术系统可以在狭窄、复杂的条件中进行精细手术,并且比腹腔镜手术更容易、更精确地进行血管分离、松解与腹壁粘连,辨别清扫更多淋巴结[25]。本研究发现机器人手术系统更有助于外科医生清扫胰腺背部、门静脉和脾血管周围淋巴结。目前的腹腔镜器械和二维成像系统很难达到完全清扫这些区域淋巴结。此外还发现,三维立体视觉和防抖动功能有助于沿着血管鞘较安全地进行解剖,帮助外科医生完全切除淋巴组织,避免损伤脾动脉、肝动脉和门静脉等血管。曾研究表明:D2淋巴结清扫对于晚期胃癌的治疗具有更多益处[29-30]。同时,有学者[31]认为,RAG在经济学获益方面不如LAG。
该研究具有一定的局限性。首先,本研究属于回顾性研究,非随机双盲对照,可能存在选择偏倚。其次,由于随访时间太短,没能比较分析长期、病理特征和生活质量等亚组之间关系,需要进一步评估研究这些问题。最后,由于本研究样本量不够大,没有根据肿瘤部位、肿瘤大小、病理分期、吻合方式和术后并发症进行亚组分析。虽然该研究具有局限性,但本研究的发现为RAG治疗胃癌提供了有关证据。需进一步研究并获得更多有关这些方面的信息。
总之,本研究结果表明RAG是一种安全、可行的手术方法。达芬奇手术系统有助于胃癌患者术后快速康复,准确的临床效果评价需进一步多中心、大样本量和高质量配对随机研究来阐明。
[1]Torre LA, Bray F, Siegel RL, et al.Global cancer statistics, 2012[J].CA Cancer J Clin, 2015, 65(2):87–108.doi: 10.3322/caac.21262.
[2]Chen W, Zheng R, Baade PD, et al.Cancer statistics in China,2015[J].CA Cancer J Clin, 2016, 66(2):115–132.doi: 10.3322/caac.21338.
[3]Liu Y, Zhang X, Chen L, et al.Cancer incidence and mortality in Gansu province, 2012[J].Chin J Cancer Res, 2016, 28(3):301–310.doi: 10.21147/j.issn.1000–9604.2016.03.04.
[4]王宝华, 王宁, 冯雅靖, 等.1990年与2013年中国人群胃癌疾病负担分析[J].中华流行病学杂志, 2016, 37(6):763–767.doi:10.3760/cma.j.issn.0254–6450.2016.06.004.Wang BH, Wang N, Feng YJ, et al.Disease burden of stomach cancer in the Chinese population, in 1990 and 2013[J].Chinese Journal of Epidemiology, 2016, 37(6):763–767.doi:10.3760/cma.j.issn.0254–6450.2016.06.004.
[5]Baik SH, Kwon HY, Kim JS, et al.Robotic versus laparoscopic low anterior resection of rectal cancer: short-term outcome of a prospective comparative study[J].Ann Surg Oncol, 2009,16(6):1480–1487.doi: 10.1245/s10434–009–0435–3.
[6]Kim MC, Heo GU, Jung GJ.Robotic gastrectomy for gastric cancer: surgical techniques and clinical merits[J].Surg Endosc,2010, 24(3):610–615.doi: 10.1007/s00464–009–0618–9.
[7]Gutt CN, Oniu T, Mehrabi A, et al.Robot-assisted abdominal surgery[J].Br J Surg, 2004, 91(11):1390–1397.doi: 10.1002/bjs.4700.
[8]Japanese Gastric Cancer Association.Japanese gastric cancer treatment guidelines 2014 (ver.4)[J].Gastric Cancer, 2017, 20(1):1–19.doi: 10.1007/s10120–016–0622–4.
[9]In H, Solsky I, Palis B, et al.Validation of the 8th Edition of the AJCC TNM Staging System for Gastric Cancer using the National Cancer Database[J].Ann Surg Oncol, 2017, 24(12):3683–3691.doi:10.1245/s10434–017–6078-x.
[10]Lu J, Zheng CH, Cao LL, et al.The effectiveness of the 8th American Joint Committee on Cancer TNM classification in the prognosis evaluation of gastric cancer patients: A comparative study between the 7th and 8th editions[J].Eur J Surg Oncol, 2017,43(12):2349–2356.doi: 10.1016/j.ejso.2017.09.001.
[11]Li HT, Han XP, Su L, et al.Short-term efficacy of laparoscopyassisted vs open radical gastrectomy in gastric cancer[J].World J Gastrointest Surg, 2014, 6(4):59–64.doi: 10.4240/wjgs.v6.i4.59.
[12]Eom BW, Yoon HM, Ryu KW, et al.Comparison of surgical performance and short-term clinical outcomes between laparoscopic and robotic surgery in distal gastric cancer[J].Eur J Surg Oncol,2012, 38(1):57–63.doi: 10.1016/j.ejso.2011.09.006.
[13]Uyama I, Kanaya S, Ishida Y, et al.Novel integrated robotic approach for suprapancreatic D2 nodal dissection for treating gastric cancer: technique and initial experience[J].World J Surg,2012, 36(2):331–337.doi: 10.1007/s00268–011–1352–8.
[14]Japanese Gastric Cancer Association.Japanese classification of gastric carcinoma: 3rd English edition[J].Gastric Cancer, 2011,14(2):101–112.doi: 10.1007/s10120–011–0041–5.
[15]Japanese Gastric Cancer Association.Japanese gastric cancer treatment guidelines 2010 (ver.3)[J].Gastric Cancer, 2011,14(2):113–123.doi: 10.1007/s10120–011–0042–4.
[16]Wang S, Ling T, Zhao E, et al.The surgical treatment of gastric cancer in the era of minimally invasive surgery[J].Minerva Chir,2017 ,72(4):334–346.doi: 10.23736/S0026–4733.17.07347–3.
[17]Suda K, Nakauchi M, Inaba K, et al.Robotic surgery for upper gastrointestinal cancer: Current status and future perspectives[J].Dig Endosc, 2016, 28(7):701–713.doi: 10.1111/den.12697.
[18]Kim MC, Kim KH, Kim HH, et al.Comparison of laparoscopyassisted by conventional open distal gastrectomy and extraperigastric lymph node dissection in early gastric cancer[J].J Surg Oncol, 2005, 91(1):90–94.doi: 10.1002/jso.20271.
[19]Park JM, Kim HI, Han SU, et al.Who may benefit from robotic gastrectomy?: A subgroup analysis of multicenter prospective comparative study data on robotic versus laparoscopic gastrectomy[J].Eur J Surg Oncol, 2016 ,42(12):1944–1949.doi:10.1016/j.ejso.2016.07.012.
[20]deSouza AL, Prasad LM, Park JJ, et al.Robotic assistance in right hemicolectomy: is there a role?[J].Dis Colon Rectum, 2010,53(7):1000–1006.doi: 10.1007/DCR.0b013e3181d32096.
[21]Lee J, Kim YM, Woo Y, et al.Robotic distal subtotal gastrectomy with D2 lymphadenectomy for gastric cancer patients with high body mass index: comparison with conventional laparoscopic distal subtotal gastrectomy with D2 lymphadenectomy[J].Surg Endosc,2015, 29(11):3251–3260.doi: 10.1007/s00464–015–4069–1.
[22]Kostakis ID, Alexandrou A, Armeni E, et al.Comparison Between Minimally Invasive and Open Gastrectomy for Gastric Cancer in Europe: A Systematic Review and Meta-analysis[J].Scand J Surg,2017, 106(1):3–20.doi: 10.1177/1457496916630654.
[23]Stefanidis D, Bailey SB, Kuwada T, et al.Robotic gastric bypass may lead to fewer complications compared with laparoscopy[J].Surg Endosc, 2018, 32(2):610–616.doi: 10.1007/s00464–017–5710-y.
[24]Yang SY, Roh KH, Kim YN, et al.Surgical Outcomes After Open,Laparoscopic, and Robotic Gastrectomy for Gastric Cancer[J].Ann Surg Oncol, 2017 ,24(7):1770–1777.doi: 10.1245/s10434–017–5851–1.
[25]Junfeng Z, Yan S, Bo T, et al.Robotic gastrectomy versus laparoscopic gastrectomy for gastric cancer: comparison of surgical performance and short-term outcomes[J].Surg Endosc, 2014,28(6):1779–1787.doi: 10.1007/s00464–013–3385–6.
[26]吉国锋, 陶有茂, 张涛, 等.机器人与腹腔镜手术治疗胃癌的近期疗效对比Meta分析[J].中国普通外科杂志, 2015, 24(4):538–546.doi:10.3978/j.issn.1005–6947.2015.04.015.Ji GF, Tao YM, Zhang T, et al.Robotic versus laparoscopic gastrectomy for gastric cancer:a Meta-analysis of short-term results[J].Chinese Journal of General Surgery, 2015, 24(4):538–546.doi:10.3978/j.issn.1005–6947.2015.04.015.
[27]王沛云, 熊兵红, 曾玉剑, 等.达芬奇机器人与腹腔镜手术治疗胃癌疗效比较的Meta分析[J].中国普通外科杂志, 2017, 26(4):412–424.doi:10.3978/j.issn.1005–6947.2017.04.003.Wang PY, Xiong BH, Zeng YJ, et al.Meta-analysis of da Vinci robotic versus laparoscopic gastrectomy for gastric cancer[J].Chinese Journal of General Surgery, 2017, 26(4):412–424.doi:10.3978/j.issn.1005–6947.2017.04.003.
[28]Son T, Lee JH, Kim YM, et al.Robotic spleen-preserving total gastrectomy for gastric cancer: comparison with conventional laparoscopic procedure[J].Surg Endosc, 2014, 28(9):2606–2615.doi: 10.1007/s00464–014–3511–0.
[29]Galizia G, Lieto E, De Vita F, et al.Modified versus standard D2 lymphadenectomy in total gastrectomy for nonjunctional gastric carcinoma with lymph node metastasis[J].Surgery, 2015,157(2):285–296.doi: 10.1016/j.surg.2014.09.012.
[30]El-Sedfy A, Dixon M, Seevaratnam R, et al.Personalized Surgery for Gastric Adenocarcinoma: A Meta-analysis of D1 versus D2 Lymphadenectomy[J].Ann Surg Oncol, 2015, 22(6):1820–1827.doi: 10.1245/s10434–014–4168–6.
[31]Lu J, Zheng HL, Li P, et al.A Propensity Score-Matched Comparison of Robotic Versus Laparoscopic Gastrectomy for Gastric Cancer: Oncological, Cost, and Surgical Stress Analysis [J].J Gastrointest Surg, 2018.doi: 10.1007/s11605–018–3785-y.[Epub ahead of print]
