甲状腺髓样癌(medullary thyroid carcinoma,MTC)是一种起源于甲状腺滤泡旁细胞(C细胞)的恶性肿瘤,又称C细胞癌,约占所有甲状腺癌的1%~2%,但却占甲状腺癌总体病死率的8.6%[1-4]。MTC临床表现各异,其预后介于未分化型甲状腺癌与分化型甲状腺癌之间[5]。目前,关于MTC预后的相关因素报道较少,本文通过对中国医科大学附属盛京医院2001年1月—2017年12月收治的MTC患者的临床转归情况进行单因素及多因素回归分析,探讨影响MTC预后的相关因素。
1 资料与方法
1.1 一般资料
本组MTC患者共78例,其中散发型76例,家族型2例;男30例,女48例,男:女=1:1.6;年龄9~76岁,其中<55岁47例,≥55岁31例,中位年龄51.5岁;病程2 d至240个月,平均18.6个月;原发肿瘤最大径0.1~6.0 cm,其中<2 cm 42例,2~<4 cm 30例,≥4 cm 6例。78例患者中,诊断时I、II、III、IVA、IVB期患者分别为63、11、2、1、1例。78例中75例因发现颈部或甲状腺肿物就诊,1例因双眼眼睑肿胀就诊,1例因慢性咳嗽咳痰入住呼吸内科化验CEA增高,行胸部计算机断层扫描检查提示甲状腺病变而转科治疗,1例因头颈部胀痛就诊。所有患者中有3例就诊时即伴有腹泻症状,其中1例自幼频繁腹泻,约6~7次/d,术后腹泻症状稍缓解,术后2年颈部再次出现包块,未就诊,术后5年半因腹泻加重导致脱水于大连儿童医院行颈部彩超检查提示肿瘤复发。伴呼吸困难或压气感3例;伴吞咽困难1例。发生远处转移8例(均为影像学诊断),其中初治即有转移者2例(其中1例初治时即有纵隔淋巴结及肺转移,另1例初治时即有枢椎转移),随访过程中发现远处转移6例,其中纵隔及肺转移1例,单纯肺转移3例,单纯骨转移1例,肝和肺转移1例。
1.2 治疗情况
78例均行手术治疗,其手术方式如下:患侧腺叶切除术5例,患侧腺叶次全切加峡部切除术2例,患侧腺叶切除加峡部切除术5例,双侧腺叶次全切除术10例,患侧腺叶切除加对侧腺叶大部切除术37例,甲状腺全切术19例。本组MTC患者中,行中央区淋巴结清扫27例,中央区及侧颈区淋巴结清扫40例,未行淋巴结清扫11例(其中2010年以前5例,2010年以后6例)。未行颈部淋巴结清扫的11例患者中,1例因肺部多发结节及纵隔淋巴结肿大,考虑远处转移而仅行颈部淋巴结活检术,5例因术中快速病理诊断为良性而未做颈部淋巴结清扫,5例术中病理未能确诊为恶性而未行颈部淋巴结清扫。
1.3 术后随访
以电话、短信以及查阅患者复查资料的方式进行随访,截止2018年4月4日。生存时间计算从首次手术至死亡或至最终随访日期。
1.4 研究指标
以患者就诊时的年龄、性别、原发肿瘤大小、原发肿瘤累及范围、肿瘤是否存在腺外侵犯、首次甲状腺手术方式、颈部淋巴结清扫范围、颈部淋巴结转移情况、确诊时肿瘤临床分期(cTNM分期)[6]、肿瘤数量、是否复发、家族史、病理类型(单纯甲状腺髓样癌、髓样癌伴乳头状癌、髓样癌伴结节性甲状腺肿)、有无远处转移为研究指标。
1.5 统计学处理
统计软件为SPSS 23.0,采用Kaplan-Meier法进行生存率统计,采用Log-rank检验进行差异性分析,采用Cox回归模型进行单因素及多因素分析,将单因素分析中有统计学意义的因素(P<0.05)纳入多因素模型,其中多因素分析选用逐步回归法,P<0.05为差异有统计学意义。
2 结 果
2.1 生存率
2.1.1 随访结果 MTC78例患者中4例失访,失访率为5.13%,因失访者均无生存时间,未将其纳入统计分析,其余74例经过3~189个月的随访,中位随访时间57.5个月。10例死于疾病,其余患者均存活。所有78例手术的MTC患者,34例首次就诊于我院即有淋巴结转移,12例患者存在甲状腺腺外侵犯。
2.1.2 总体生存率 本组获得随访的74例MTC患者的总体生存曲线如图1A所示,其中1、3、5、10、15年生存率分别为98.6%、93.5%、88.4%、73.2%、73.2%。
2.1.3 性别与生存率 获得生存时间的74例MTC患者中,男27例,女47例。男性3、5、10、15年生存率分别为90.9%、77.9%、38.7%、38.7%, 女 性 3、5、10、15年 生 存 率 分 别 为94.8%、94.8%、94.8%、94.8%,差异有统计学意义(P=0.002)(图1B)。
2.1.4 颈部淋巴结转移与生存率 74例MTC患者中,术后病理证实存在颈部淋巴结转移33例,无淋巴结转移31例,其余10例因未行颈部淋巴结手术而不知其是否存在淋巴结转移。颈部淋巴结转移的MTC患者的3、5、10、15年生存率分别为84.8%、73.5%、59.4%、59.4%,无颈部淋巴结转移的MTC患者的3、5、10年生存率分别为100%、100%、87.5%,差异有统计学意义(P=0.018)(图1C)。
2.1.5 远处转移与生存率 74例患者中,发生远处转移8例(骨转移者2例,纵隔淋巴结及肺转移者2例,单纯肺转移3例,肝和肺转移1例)。无远处转移66例。远处转移患者的3、5、10、15年 生 存 率 分 别 为 55.0%、25.0%、0、0, 无远处转移患者的3、5、10、15年生存率分别为100%、100%、91.0%、91.0%,其差异有统计学意义(P<0.001)(图1D)。
2.1.6 病理类型与生存率 74例患者中,单纯髓样癌41例,髓样癌合并乳头状癌5例,髓样癌合并结节性甲状腺肿28例。单纯甲状腺髓样癌的3、5、10、15年生存率分别为94.1%、90.1%、70.7%、70.7%,甲状腺髓样癌合并乳头状癌的3年、5年均为100%,髓样癌合并结节性甲状腺肿的3、5、10、15年生存率分别为91.8%、83.4%、71.5%、71.5%,差异无统计学意义(P=0.668)(图1E)。
2.1.7 甲状腺手术方式与生存率 获得随访资料的74例MTC患者中,其甲状腺的手术方式如下:患侧腺叶切除术5例,患侧腺叶次全切加峡部切除术2例,患侧腺叶切除加峡部切除术5例,双侧腺叶次全切除术10例,患侧腺叶切除加对侧腺叶大部切除术36例,甲状腺全切术16例。双侧腺叶次全切除术患者的3、5、10、15年生存率分别为100%、100%、66.7%、66.7%;患侧腺叶次全切加峡部切除患者的1年生存率为100%,患侧腺叶切除加峡部切除患者的3、5、10、15年生存率分别为100%、100%、33.3%、33.3%;患侧腺叶切除加对侧腺叶大部切除术患者的3、5、10、15年生存率分别为94.1%、86.9%、81.4%、81.4%,甲状腺全切术患者的1、3、5年的生存率分别为93.8%、83.3%、83.3,患侧腺叶切除的1年生存率为100%,差异无统计学意义(P=0.652)(图1F)。
2.1.8 颈部淋巴结清扫范围与生存率 74例患者中,未行颈部淋巴结清扫11例,仅行中央区淋巴结清扫26例,中央区及侧颈区淋巴结清扫37例。未行颈部淋巴结清扫的MTC患者3、5、10、15年生存率分别为100%、100%、66.7%、66.7%,仅行中央区淋巴结清扫的MTC患者3、5、10年生存率分别为90.7%、83.7%、64.6%,行中央区及侧颈区淋巴结清扫的MTC患者3、5、10、15年生存率分别为93.5%、88.3%、88.3%、88.3%,其差异无统计学意义(P=0.613)(图1G)。
2.1.9 肿瘤cTNM分期与生存率 74例患者中,诊 断 时 I、II、III、IVA、IVB期 患 者 分 别 为 59、11、2、1、1例。Ⅰ期患者的3、5、10、15年的生存 率 分 别 为 100%、96.7%、80.3%、80.3%,II期患者的3、5、10、15年的生存率分别为87.5%、70%、52.5%、52.5%,III期 患 者 的 1、3、5年 生存率均为50%,ⅣA、ⅣB期的1、3年生存率分别为100%、0,其差异有统计学意义(P<0.001)(图1H)。
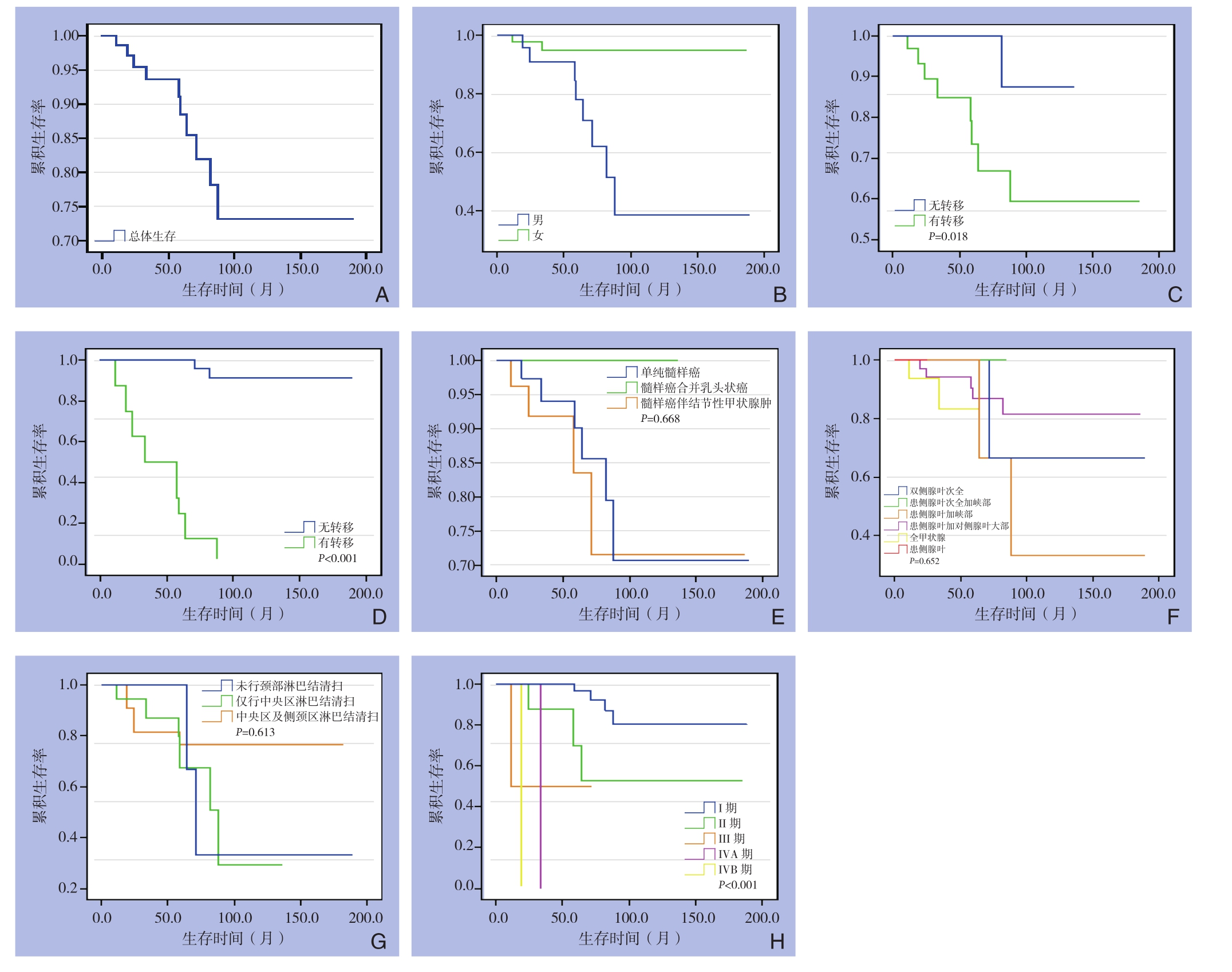
图1 MTC患者生存曲线 A:总生存曲线;B:不同性别患者的生存情况比较;C:不同淋巴结状态患者的生存情况比较;D:有远处转移与无远处转移患者的生存情况比较;E:不同病理类型患者的生存情况比较;F:不同手术方式患者的生存情况比较;G:不同淋巴结清扫范围患者的生存情况比较;H:不同cTNM分期患者的生存情况比较
Figure1 Survival curves of the MTC patients A: Overall survival cure; B: Comparison of the survivals between patients of different sexes; C: Comparison of the survivals between patients with different lymph node statuses; D: Comparison of the survivals between patients with or without distant metastases; E: Comparison of the survivals among patients with different pathological classifications;F: Comparison of the survivals among patients undergoing different surgical procedures; G: Comparison of the survivals among patients with different scopes of lymph node dissection; H: Comparison of the survivals among patients with different cTNM stages
2.2 影响MTC患者预后的单变量分析
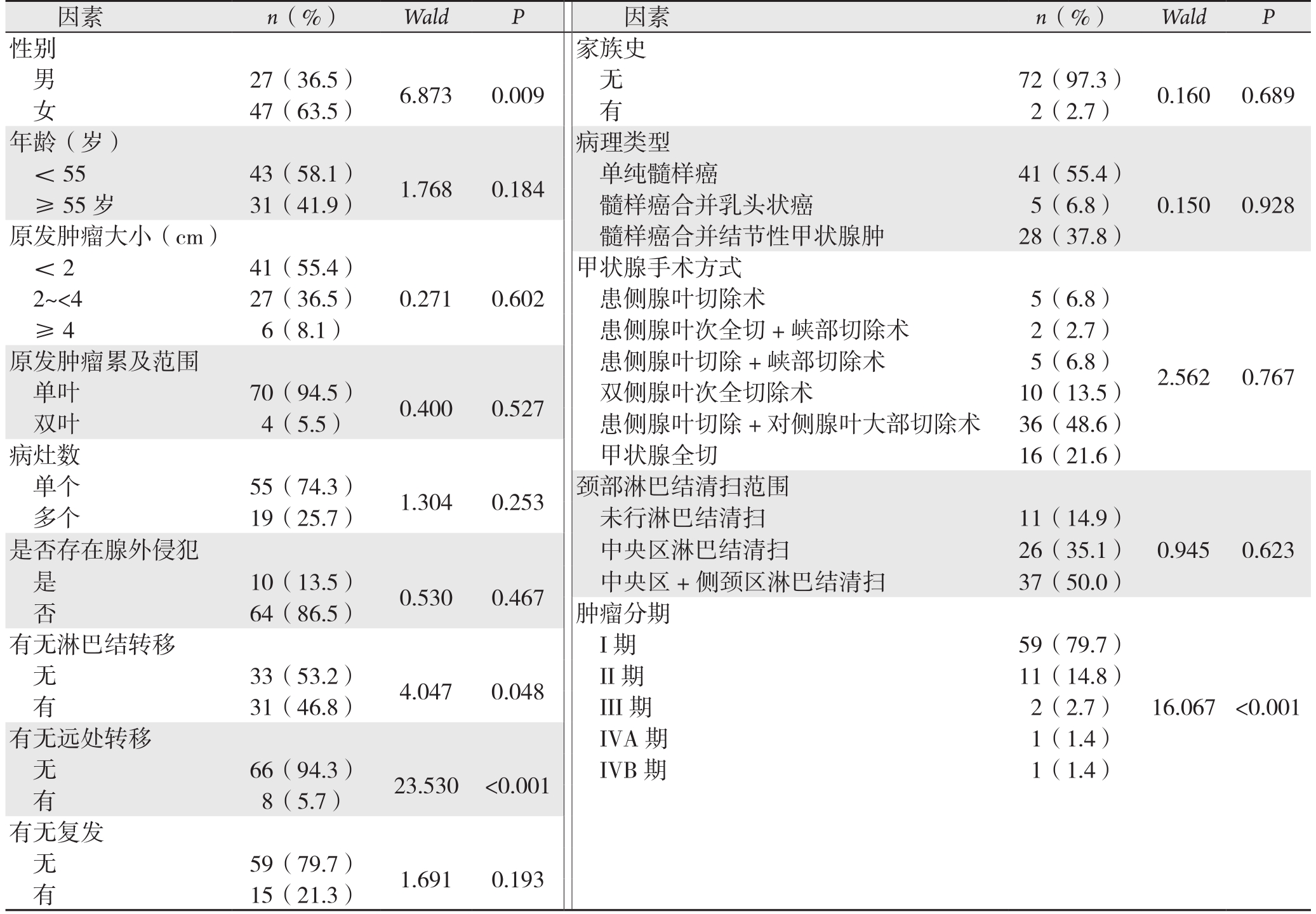
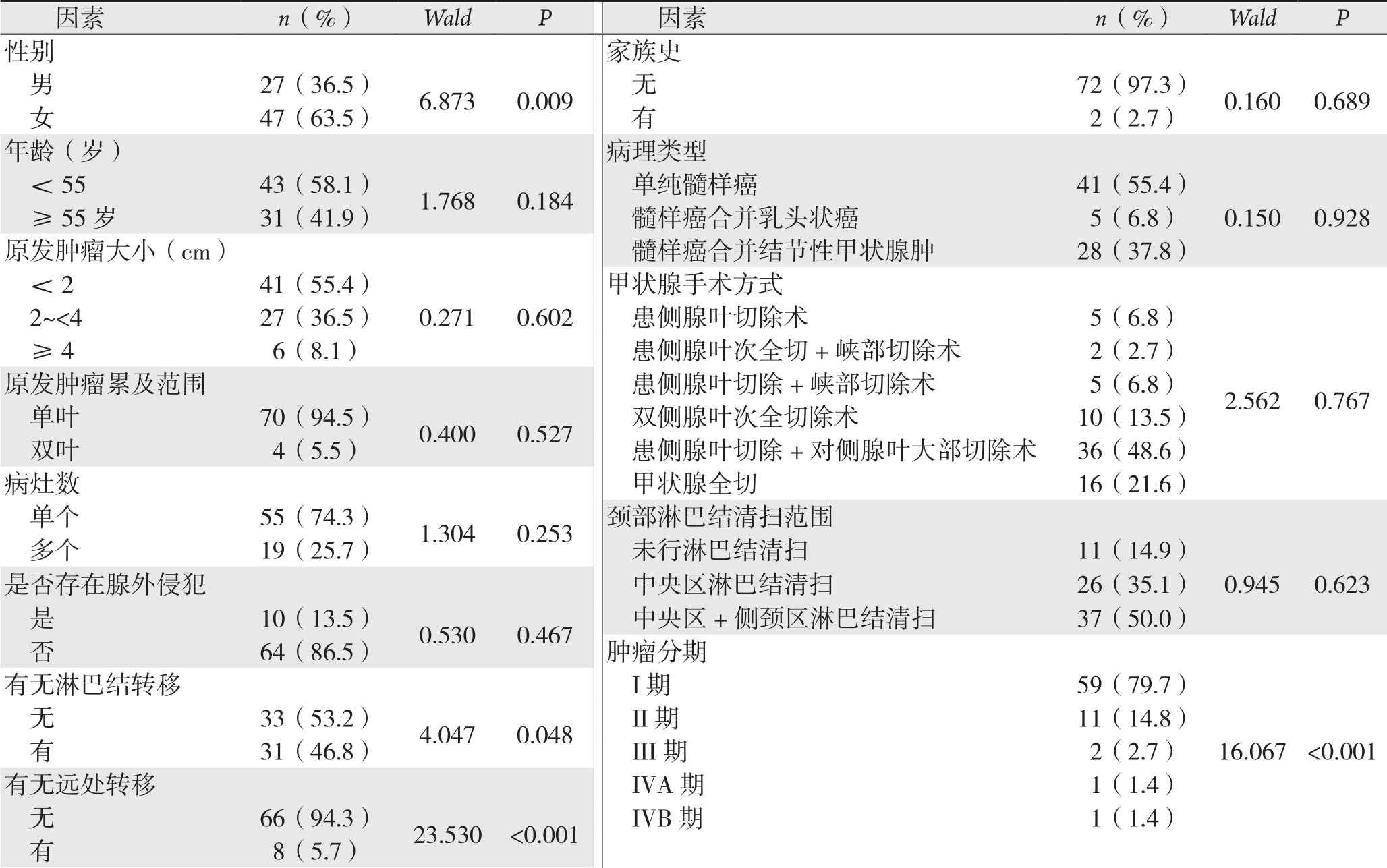
采用Cox回归行单变量分析显示性别、远处转移、确诊时颈部淋巴结转移及肿瘤临床分期(cTNM分期)影响患者预后(P<0.05),而诊断时年龄、原发肿瘤大小、原发肿瘤累及范围、肿瘤是否存在甲状腺腺外侵犯、甲状腺手术方式、颈部淋巴结清扫范围、肿瘤数量、是否复发、病理类型、家族史等均对患者预后无影响(P>0.05)(表1)。
2.3 影响MTC患者预后的多变量分析
采用Cox回归行多变量分析显示,仅肿瘤的cTNM分期及存在远处转移是影响MTC患者生存的独立预后因素(P<0.05),患者存在远处转移及诊断时肿瘤为III~IV期的患者预后差。而性别、颈部淋巴结转移情况不是影响MTC患者生存的独立预后因素(表2)。
表1 MTC患者预后因素的单变量分析
Table1 Univariate analysis of the prognostic factors for MTC patients
 有无复发无59(79.7) 1.691 0.193有15(21.3)
有无复发无59(79.7) 1.691 0.193有15(21.3)
表2 MTC患者预后相关因素的多变量分析
Table2 Multivariate analysis of the prognostic factors for MTC patients

因素 β SE Wald P HR(95% CI)有无远处转移 4.007 1.102 13.224 <0.001 54.956(6.341~476.257)肿瘤 cTNM 分期 0.795 0.375 4.485 0.034 2.214(1.061~4.619)
3 讨 论
MTC是起源于C细胞的神经内分泌肿瘤,其恶性程度位于分化型甲状腺癌与未分化型甲状腺癌之间,发病率约占所有甲状腺癌的1%~2%,但却占甲状腺癌总体病死率的8.6%[1-4]。甲状腺髓样癌具有神经内分泌肿瘤(如胰岛细胞瘤和类癌)的特征,可分泌降钙素(calcitonin,CT)、癌胚抗原(carcinoembryonic antigen,CEA)、嗜铬粒蛋白、前列腺素、5-羟色胺等物质[7],因此术前血清CT及CEA水平的升高有助于MTC的早期诊断[8-11]。MTC与其他类型的甲状腺癌相比具有独特的生物学特征,对碘治疗及放化疗均不敏感,且复发率及早期转移率均较高[12]。目前关于MTC的生存率及影响其预后的相关因素报道不尽相同,各文献报道也不尽一致。相关研究表明其5年生存率为63.03%~94%[13-17],10年生存率约为72%~89%[15-20],早期诊断、规范处理的甲状腺髓样癌10年生存率>90%[21],甚至有文献[22]报道伴有结节性甲状腺肿的MTC患者15年生存率接近100%。本组5年与10年生存率分别为88.4%与73.2%,同相关文献报道基本相符。笔者将本组患者中单纯髓样癌、髓样癌伴乳头状癌及髓样癌伴结节性甲状腺肿的生存率进行比较,差异无统计学意义(P>0.05),其中髓样癌合并结节性甲状腺肿的3、5、10、15年生存率分别为91.8%、83.4%、71.5%、71.5%,与Xu等[22]报道的15年生存率约为100%不符,可能是因为本组病例数与Xu等[22]报道的病例数不同,且髓样癌伴结节性甲状腺肿的预后报道较少,尚有待于进一步研究。研究发现伴有分化型甲状腺癌的MTC患者比单纯的MTC患者更早被诊断,有更好的预后趋势[19]。本组患者中伴有甲状腺乳头状癌的MTC患者的3、5年的疾病相关生存率均为100%,但因该类患者较少,且随访时间较短,与单纯MTC患者或单纯甲状腺乳头状癌患者的生存比较有待于进一步研究。
MTC分为遗传型MTC(hereditary medullary thyroid carcinoma,HMTC)与散发型MTC(sporadic medullary thyroid carcinoma,SMTC),HMTC是一种常染色体显性遗传性疾病[23],约98%的HMTC是由RET基因种系突变引起[3],国外报道其约占所有MTC的20%~30%,而SMTC发病率较高,约占所有MTC的70%~80%[24-25]。有文献[25-26]报道HMTC的发病年龄明显早于SMTC,且比SMTC更多累及双侧甲状腺。笔者根据有无髓样癌家族史,将MTC分为SMTC及HMTC,其中HMTC2例,SMTC76例,与相关报道[24-26]不符。由于RET基因检测价格昂贵,国内患者收入水平差异较大,因此在国内尚未能广泛应用,本组患者均未行RET基因检测。对本组患者行单因素分析显示家族史对MTC患者的预后无统计学意义(P>0.05),但因存在家族史的患者较少,尚有待进一步研究。
诊断时年龄是否影响MTC患者的预后,各家报道不一。国内外多篇文献[15,17]报道年龄>45岁是MTC患者不良预后的重要影响因素,甚至有文献[18,20,27]报道年龄是影响MTC预后的独立因素。而高云飞等[16]对118例MTC患者进行Logistic回归分析表明年龄>45岁并不影响MTC患者预后。本研究以55岁为年龄分段标准(参考AJCC第8版分化型甲状腺癌分期系统)[6]进行Cox回归分析显示年龄并不影响MTC患者预后,与高云飞等[16]的报道相符。
相关文献[15-16,25,28]表明,性别与MTC预后无关。笔者对本组病例行单因素分析显示性别是影响MTC患者预后的重要因素(P<0.05),而多因素分析表明其不是影响MTC预后的独立因素(P>0.05),与文献[3,8,27]报道相符。
高云飞等[16]对118例MTC患者行单因素分析显示原发肿瘤大小、肿瘤被膜外侵犯是影响MTC预后的重要因素,而并非影响预后的独立因素。而杨传盛等[17]对102例MTC患者行单因素及多因素分析表明肿瘤外侵甲状腺被膜是影响MTC预后的重要因素,而原发肿瘤>4 cm才是影响其预后的独立因素。笔者对本组患者行单因素与多因素回归分析均表明原发肿瘤大小以及是否存在腺外侵犯与MTC患者的预后无关,与相关报道不符,可能由于本组将肿瘤大小分为<2 cm,2~<4 cm,≥4 cm,与文献[16-17]将肿瘤大小分为<4 cm及≥4 cm的分组方法不同,且本组患者诊断时肿瘤多较小,发生腺外侵犯的机会相对较少。
根据文献资料,手术后6个月内及最后1次随访时的疾病状况均分为:⑴ 肿瘤无残留/复发,即血清降钙素水平<10 pg/mL,并且颈部超声或其他影像学检查未见结构性疾病;⑵ 仅生化残留/复发,即血清降钙素水平≥10 pg/mL,并且术后随访期间无结构性疾病的证据;⑶ 结构残留/复发,即术后随访过程中,通过颈部超声及其他影像学检查可见结构性疾病[29-30]。MTC属于侵袭性肿瘤,常发生颈部淋巴结转移,当有可扪及的甲状腺结节被考虑为髓样癌时,约70%的患者已经存在颈部淋巴结转移[31]。另有研究[32]表明:从1981年—2016年期间,行颈部淋巴结清扫术检出淋巴结转移的比例从88.9%降至65.0%。Oh等[33]对27例存在侧颈区淋巴结转移的MTC患者及47例无颈部淋巴结转移或残留的MTC患者进行分析后表明:术前CT水平高(>65 pg/mL)、直径较大(>1.5 cm)、形态不规则、毛刺状边缘的MTC发生侧颈区淋巴结转移的风险较高。Fan等[34]对65例SMTC患者进行χ2检验及多元Logistic回归分析表明,仅甲状腺包膜浸润是中心区和侧颈区淋巴结转移的独立预测因素,另外术前CEA>30 ng/mL时,中心区淋巴结转移的可能性明显增高。而颈部淋巴结转移是否影响MTC患者预后,各文献报道不一。杨传盛等[17]对102例MTC患者行Logistic回归分析表明,颈部淋巴结转移对预后无影响。而国外相关研究表明,颈部淋巴结转移是肿瘤复发的重要预测因素[28],甚至是影响生存的独立预测因素[20]。本组患者中,肿瘤复发15例,均为结构性复发,其中包括肿瘤残留5例。本研究行Cox回归模型的单因素分析表明颈部淋巴结转移是影响MTC预后的重要因素(P<0.05),但肿瘤复发并不影响患者的生存(P>0.05)。在多因素分析中颈部淋巴结转移并不是影响预后的独立因素(P>0.05),与文献[28]报道相符。
肿瘤cTNM分期是否影响MTC患者的生存,目前为止仍存在争议。杨传盛等[17]对102例MTC患者行单因素分析表明cTNM分期并不影响患者预后。Simões-Pereira等[15]对单中心的140例MTC患者的临床资料进行回顾性分析表明,确诊时晚期和无生化治愈(术后血清降钙素水平高于正常值上限)在单因素分析中是预后较差的预测因素,但在多因素分析中,仅无生化治愈是影响预后的唯一因素。而Torresan等[20]对单中心的MTC患者术后远期疗效进行分析表明,肿瘤分期是影响患者生存的独立预后因素。本研究以AJCC第8版分化型甲状腺癌分期系统进行分期,对74例MTC患者行Cox回归的单因素及多因素分析均表明,cTNM分期是MTC预后的独立预测因子,诊断为III~IV期的患者预后较差,与Torresan等[20]的报道相符。
MTC远处转移部位常发生在肝、肺及骨[35],相关文献[18,36]表明肿瘤远处转移是影响MTC生存的重要的预后因素,甚至有文献[16-17,25,37]报道其是影响MTC患者生存的独立预测因素。本研究进行Cox回归行单因素及多因素回归分析表明肿瘤远处转移情况是影响MTC患者生存的重要且独立的预测因素,与相关文献报道相符。
随着对MTC研究的深入,靶向药物如Cabozantinib、Vandetanib、Apatinib等可以延缓晚期MTC患者的疾病进展,是治疗晚期MTC的有效药物[38-41],但由于价格昂贵,在国内尚未广泛应用。目前合理手术方式仍是治愈MTC的唯一方式。对所有MTC而言,无论是SMTC还是HMTC,相关文献一致推荐行全部甲状腺切除术而不残留任何甲状腺组织[2,42-44]。本组获得随访资料的74例MTC患者中,行甲状腺全切术仅16例,经Cox单因素回归分析表明甲状腺床的手术方式与患者生存时间无关(P>0.05)。由于MTC的术前诊断较难,大部分患者均为术后病理确诊,且本组患者的手术由不同科室、不同水平的外科医师进行,导致本组行甲状腺全切术的患者所占比例较小,可能对研究结果产生一定影响。并且本研究未分析甲状腺床的手术方式与患者无瘤生存时间的关系,存在一定缺陷。
对MTC患者常规行中央区颈部淋巴结清扫术已达成共识,而对于存在颈中央区淋巴结转移的患者是否应该进行预防性双侧侧颈区淋巴结清扫,目前仍无定论[42]。有报道[45]称存在中央区淋巴结转移的患者中,约35%会发生对侧侧颈区淋巴结转移,对基础降钙素水平<1000 pg/mL的患者行双侧侧颈区淋巴结清扫,将会使大约50%的患者获得生化治愈(术后血清降钙素水平低于正常值上限)[46]。然而,当多于10个淋巴结转移或者超过2个区域的淋巴结受累时,生化治愈率将降低。总之,预防性双侧侧颈区淋巴结清扫能够降低血清降钙素及减少肿瘤复发的风险,但对于生存的影响尚不明确。
Vlad等[47]对1992年至2012确诊的所有19例MTC患者进行回顾性分析后认为对所有MTC患者不需要进行改良根治性颈部清扫。而2014版英国甲状腺协会指南[42]推荐:在缺乏临床或影像学证据表明中央区及同侧侧颈区淋巴结转移时,不推荐行对侧侧颈区淋巴结清扫;在没有直接侵犯的情况下,胸锁乳突肌、颈内静脉、副神经应被保留,若没有明显的或是可疑的I、IIb和Va区淋巴结转移,不需要常规清扫该区域的淋巴组织;当强烈怀疑或有明显证据表明头臂静脉以下纵隔淋巴结受累,而没有远处转移证据时,应该考虑行进一步手术,建议行胸骨劈开淋巴结清扫术;对于存在远处转移的患者,为了防止气管、食管及喉神经继发性损伤,应行相应侧颈区的淋巴结清扫术。而2015版美国甲状腺指南[2]推荐:累及颈部及中央组淋巴结的MTC患者应该行中央区淋巴结加受累的颈外侧淋巴结(II~V区)清扫;影像学检查提示同侧颈外侧淋巴结阳性而对侧颈外侧淋巴结阴性,如果基础血清降钙素>200 pg/mL,应考虑清扫对侧颈外侧淋巴结(推荐C级)。本组获得随访的74例患者中,仅行中央区淋巴结清扫26例,中央区及侧颈区淋巴结清扫37例,而11例未行淋巴结清扫(其中2010年以前5例,2010年以后6例),经单因素回归分析表明颈部淋巴结清扫范围不影响MTC患者预后(P<0.05),但颈部淋巴结转移与肿瘤临床分期是影响MTC预后的重要因素,本研究与高云飞等[16]的报道相符。
降钙素是由甲状腺滤泡旁细胞分泌的生物活性物质,是MTC公认的特异性及敏感性极高的肿瘤标志物。相关研究表明降钙素值的测量在MTC的早期诊断、淋巴结清扫范围的选择、评价手术疗效、判断有无病灶残留、转移和复发及预后随访中具有举足轻重的作用[16,33,46,48-52]。有研究[52]表明术后降钙素<29 pg/mL预测结构疾病时,其敏感度为100%,特异度为90.5%,阴性预测值为100%。另有研究报道称甲状腺结节患者的血清降钙素诊断MTC的截断值为258.5 pg/mL,特异性为96.99%,敏感性为90.91%[8]。由于检出的甲状腺结节中,其确诊为恶性结节仅占5%~15%[53],其余大部分为良性甲状腺结节,并且MTC仅占甲状腺恶性肿瘤的1%~2%[2],考虑到对所有甲状腺结节患者行降钙素检测会增加大部分患者的经济负担,故本组患者均未行降钙素检测,而对于手术后病理学确诊为MTC的患者,在随访过程中患者仍缺乏降钙素数值,存在一定缺陷,有待于进一步积累临床资料以指导术后随访工作。
在胃肠道癌中,CEA一直以来都是应用最广泛的肿瘤标志物。刚开始,CEA被当做是结直肠癌的特异性标志物,但后来研究证明其实际属于非特异性标志物。在乳腺癌、肺癌和肝癌等癌症中,CEA水平可能会升高,包括髓状甲状腺癌[54]。Turkdogan等[11]对33例术前血清CEA的MTC患者回顾性分析,经多因素分析表明,术前CEA水平升高与肿瘤大小、分期、远处转移、生化治愈降低、病死率显著相关;CEA水平异常是晚期疾病较好的指标;CEA水平>271 ng/mL对晚期肿瘤大小和分期、转移到中央区淋巴结和降低生化治愈的机会有显著影响。CEA水平>500 ng/mL与显著的患者病死率相关。本组患者中1例因术前CEA增高,行胸部计算机断层扫描检查提示甲状腺病变而进行手术治疗。由于随访难度较大,故本组未常规统计术后CEA水平,其对患者生存的影响,尚需进一步积累临床资料进行大样本研究。
本组患者有较为准确的生存时间,保证了生存分析的可靠性。但本研究为回顾性研究,且随访资料主要通过电话、短信以及查阅患者复查资料等方式获得,对未在本院复查的部分患者,其准确的复发时间获取较难,故未绘制无瘤生存曲线。由于RET基因检测价格昂贵,国内患者收入水平差距较大,在国内尚未能广泛应用,本组患者未常规进行RET基因检测,尤其对于Ⅳ期患者,未能进行RET基因检测,不能进一步选择有效的治疗手段,而仅随访观察,存在一定不足。
[1] Aschebrook-Kilfoy B, Ward MH, Sabra MM, et al. Thyroid cancer incidence patterns in the United States by histologic type, 1992–2006[J]. Thyroid, 2011, 21(2):125–134. doi: 10.1089/thy.2010.0021.
[2] Wells SA Jr, Asa SL, Dralle H, et al. Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma [J]. Thyroid, 2015, 25(6):567–610. doi: 10.1089/thy.2014.0335.
[3] Mohammadi M, Hedayati M. A Brief Review on The Molecular Basis of Medullary Thyroid Carcinoma [J]. Cell J, 2017, 18(4):485–492.
[4] Veiga LH, Neta G, Aschebrook-Kilfoy B, et al. Thyroid cancer incidence patterns in Sao Paulo, Brazil, and the U.S. SEER program, 1997–2008[J]. Thyroid, 2013, 23(6):748–757. doi:10.1089/thy.2012.0532.
[5] 李新营, 王志明, 黄云, 等. 甲状腺癌的外科治疗:附487例报告[J].中国普通外科杂志, 2010, 19(5):459–462.Li XY, Wang ZM, Huang Y, et al. Surgical treatement of thyroid carcinoma: a report of 487 cases[J]. Chinese Journal of General Surgery, 2010, 19(5):459–462.
[6] 孙威, 贺亮, 张浩. 美国癌症联合委员会甲状腺癌分期系统(第8版)更新解读[J]. 中国实用外科杂志, 2017, 37(3):255–258.Sun W, He L, Zhang H. Interpretations on the updates of American Joint Committee on cancer staging system (8th edition) for thyroid cancer[J]. Chinese Journal of Practical Surgery, 2017,37(3):255–258.
[7] Abe K, Adachi I, Miyakawa S, et al. Production of calcitonin,adrenocorticotropic hormone, and beta-melanocyte-stimulating hormone in tumors derived from amine precursor uptake and decarboxylation cells[J]. Cancer Res, 1977, 37(11):4190–4194.
[8] 殷德涛, 张高朋, 李红强, 等. 甲状腺结节患者常规行血清降钙素检查对早期发现甲状腺髓样癌的临床价值[J]. 中国普通外科杂志, 2018, 27(5):541–546. doi:10.3978/j.issn.1005–6947.2018.05.003.Yin DT, Zhang GP, Li HQ, et al. Clinical value of routine serum calcitonin measurement for early detection of medullary thyroid carcinoma in patients with thyroid nodules[J]. Chinese Journal of General Surgery, 2018, 27(5):541–546. doi:10.3978/j.issn.1005–6947.2018.05.003.
[9] Allelein S, Ehlers M, Morneau C, et al. Measurement of Basal Serum Calcitonin for the Diagnosis of Medullary Thyroid Cancer [J].Horm Metab Res, 2018, 50(1):23–28. doi: 10.1055/s-0043–122237.
[10] 陈伟才. 降钙素和癌胚抗原联合检测应用于甲状腺髓样癌诊治的价值[J]. 深圳中西医结合杂志, 2018, 28(7):19–21.doi:10.16458/j.cnki.1007–0893.2018.07.008.Chen WC. Diagnostic value of combined detection calcitonin and carcino-embryonic antigen for medullary thyroid carcinoma[J]. Shenzhen Journal of Integrated Traditional Chinese and Western Medicine, 2018, 28(7):19–21. doi:10.16458/j.cnki.1007–0893.2018.07.008.
[11] Turkdogan S, Forest VI, Hier MP, et al. Carcinoembryonic antigen levels correlated with advanced disease in medullary thyroid cancer[J]. J Otolaryngol Head Neck Surg, 2018, 47(1):55. doi:10.1186/s40463–018–0303-x.
[12] Griebeler ML, Gharib H, Thompson GB. Medullary thyroid carcinoma[J]. Endocr Pract, 2013, 19(4):703–711. doi: 10.4158/EP12430.RA.
[13] 胡朝理, 靳红义, 邱新光, 等. 甲状腺髓样癌预后因素分析[J]. 中国普通外科杂志, 2008, 17(11):1061–1064.Hu CL, Jin HY, Qiu XG, et al. Analysis on prognostic factors of medullary thyroid carcinoma[J]. Chinese Journal of General Surgery, 2008, 17(11):1061–1064.
[14] Momin S, Chute D, Burkey B, et al. Prognostic variables affecting primary treatment outcome for medullary thyroid cancer[J]. Endocr Pract, 2017, 23(9):1053–1058. doi: 10.4158/EP161684.OR.
[15] Simões-Pereira J, Bugalho MJ, Limbert E, et al. Retrospective analysis of 140 cases of medullary thyroid carcinoma followed-up in a single institution[J]. Oncol Lett, 2016, 11(6):3870–3874. doi:10.3892/ol.2016.4482.
[16] 高云飞, 邓维叶, 陈艳峰, 等. 甲状腺髓样癌预后相关因素分析(附118例报告)[J]. 中国实用外科杂志, 2015, 35(9): 996–1000.Gao YF, Deng WY, Chen YF, et al. Prognostic factors of medullary thyroid carcinoma: an analysis of 118 patients[J]. Chinese Journal of Practical Surgery, 2015, 35(9): 996–1000.
[17] 杨传盛, 黄湛, 张诠, 等. 102例甲状腺髓样癌的预后因素分析[J]. 中国肿瘤外科杂志, 2012, 4(3):155–158. doi:10.3969/j.issn.1674–4136.2012.03.009.Yang CS, Huang Z, Zhang Q, et al. The prognostic factors of 102 cases of medullary thyroid carcinoma[J]. Chinese Journal of Surgical Oncology, 2012, 4(3):155–158. doi:10.3969/j.issn.1674–4136.2012.03.009.
[18] Pelizzo MR, Boschin IM, Bernante P, et al. Natural history,diagnosis, treatment and outcome of medullary thyroid cancer:37 years experience on 157 patients[J]. Eur J Surg Oncol, 2007,33(4):493–497. doi: 10.1016/j.ejso.2006.10.021.
[19] Wong RL, Kazaure HS, Roman SA, et al. Simultaneous medullary and differentiated thyroid cancer: a population‐level analysis of an increasingly common entity[J]. Ann Surg Oncol, 2012, 19(8):2635–2642. doi: 10.1245/s10434–012–2357–8.
[20] Torresan F, Cavedon E, Mian C, et al. Long-Term Outcome After Surgery for Medullary Thyroid Carcinoma: A Single-Center Experience[J]. World J Surg, 2018, 42(2):367–375. doi: 10.1007/s00268–017–4321-z.
[21] Ogilvie JB, Kebebew E. Indication and timing of thyroid surgery for patients with hereditary medullary thyroid cancer syndromes[J].J Natl Compr Canc Netw, 2006, 4(2):139–147.
[22] Xu L, Wang WB, Zhao YP, et al. Medullary thyroid carcinoma with nodular goiter carries an excellent prognosis[J]. J Surg Oncol, 2012,106(2):169–173. doi: 10.1002/jso.23070.
[23] Mulligan LM, Kwok JB, Healey CS, et al. Germ-line mutations of the RET proto-oncogene in multiple endocrine neoplasia type 2A[J]. Nature, 1993, 363(6428):458–460. doi: 10.1038/363458a0
[24] Schlumberger M, Pacini F. Thyroid Tumors[M]. Paris: Editions Nucleon, 2006:313–340.
[25] Lee CR, Lee S, Song H, et al. Medullary thyroid carcinoma: a 30-year experience at one institution in Korea[J]. Ann Surg Treat Res,2016, 91(6):278–287. doi: 10.4174/astr.2016.91.6.278.
[26] 马海洋, 李卫红. 32例甲状腺髓样癌的相关数据分析[J]. 中国病案, 2016, 17(5):82–84.Ma HY, Li WH. Related Data Analysis on 32 Cases of Medullary Thyroid Carcinoma[J]. Chinese Medical Record, 2016, 17(5):82–84.
[27] 王俊男, 闫枫尚, 徐拯, 等. 基于SEER数据库的甲状腺髓样癌预后因素分析[J]. 中国普通外科杂志, 2018, 27(5):547–552.doi:10.3978/j.issn.1005–6947.2018.05.004.Wang JN, Yan FS, Xu Z, et al. Analysis of prognostic factors for medullary thyroid carcinoma based on SEER database[J]. Chinese Journal of General Surgery, 2018, 27(5):547–552. doi:10.3978/j.issn.1005–6947.2018.05.004.
[28] Verbeek HH, Meijer JA, Zandee WT, et al. Fewer cancer reoperations for medullary thyroid cancer after initial surgery according to ATA guidelines[J]. Ann Surg Oncol, 2015, 22(4):1207–1213. doi: 10.1245/s10434–014–4115–6.
[29] Lindsey SC, Ganly I, Palmer F, et al. Response to initial therapy predicts clinical outcomes in medullary thyroid cancer[J]. Thyroid,2015, 25(2):242–249. doi: 10.1089/thy.2014.0277.
[30] Jung KY, Kim SM, Yoo WS, et al. Postoperative biochemical remission of serum calcitonin is the best predictive factor for recurrence-free survival of medullary thyroid cancer: a large-scale retrospective analysis over 30 years[J]. Clin Endocrinol (Oxf),2016, 84(4):587–597. doi: 10.1111/cen.12852.
[31] Moley JF. Medullary thyroid carcinoma: management of lymph node metastases[J]. J Natl Compr Canc Netw, 2010, 8(5):549–556.
[32] Hirsch D, Twito O, Levy S, et al. Temporal Trends in the Presentation, Treatment, and Outcome of Medullary Thyroid Carcinoma: An Israeli Multicenter Study[J]. Thyroid, 2018,28(3):369–376. doi: 10.1089/thy.2017.0371.
[33] Oh HS, Kwon H, Song E, et al. Preoperative Clinical and Sonographic Predictors for Lateral Cervical Lymph Node Metastases in Sporadic Medullary Thyroid Carcinoma[J]. Thyroid,2018, 28(3):362–368. doi: 10.1089/thy.2017.0514.
[34] Fan W, Xiao C, Wu F. Analysis of risk factors for cervical lymph node metastases in patients with sporadic medullary thyroid carcinoma[J]. J Int Med Res, 2018, 46(5):1982–1989. doi:10.1177/0300060518762684.
[35] Jiménez C, Hu MI, Gagel RF. Management of medullary thyroid carcinoma[J]. Endocrinol Metab Clin North Am, 2008, 37(2):481–496. doi: 10.1016/j.ecl.2008.03.001.
[36] Kebebew E, Ituarte PH, Siperstein AE, et al. Medullary thyroid carcinoma: clinical characteristics, treatment, prognostic factors,and a comparison of staging systems[J]. Cancer, 2000, 88(5):1139–1148.
[37] Jayakody S, Reagh J, Bullock M, et al. Medullary Thyroid Carcinoma: Survival Analysis and Evaluation of Mutation‐Specific Immunohistochemistry in Detection of Sporadic Disease[J]. World J Surg, 2018, 42(5):1432–1439. doi: 10.1007/s00268–018–4551–8.
[38] Trimboli P, Castellana M, Virili C, et al. Efficacy of Vandetanib in Treating Locally Advanced or Metastatic Medullary Thyroid Carcinoma According to RECIST Criteria: A Systematic Review and Meta-Analysis[J]. Front Endocrinol (Lausanne), 2018, 9:224.doi: 10.3389/fendo.2018.00224.
[39] Kraft IL, Akshintala S, Zhu Y, et al. Outcomes of Children and Adolescents with Advanced Hereditary Medullary Thyroid Carcinoma Treated with Vandetanib[J]. Clin Cancer Res, 2018,24(4):753–765. doi: 10.1158/1078–0432.CCR-17–2101.
[40] Schlumberger M, Elisei R, Mueller S, et al. Overall survival analysis of EXAM, a phase III trial of cabozantinib in patients with radiographically progressive medullary thyroid carcinoma[J]. Ann Oncol, 2017, 28(11):2813–2819. doi: 10.1093/annonc/mdx479.
[41] Cai S, Deng H, Chen Y, et al. Treatment of medullary thyroid carcinoma with apatinib A case report and literature review[J].Medicine (Baltimore), 2017, 96(50):e8704. doi: 10.1097/MD.0000000000008704.
[42] Perros P, Boelaert K, Colley S, et al. Guidelines for the management of thyroid cancer[J]. Clin Endocrinol (Oxf), 2014, 81(Suppl 1):1–122. doi: 10.1111/cen.12515.
[43] Pulgar BD, Jans BJ, Petric GM, et al. Medullary thyroid cancer.Review of 28 patients[J]. Rev Med Chil, 2013, 141(11):1395–1401.doi: 10.4067/S0034–98872013001100005.
[44] Elisei R, Romei C, Renzini G, et al. The timing of total thyroidectomy in RET gene mutation carriers could be personalized and safely planned on the basis of serum calcitonin: 18 years experience at one single center[J]. J Clin Endocrinol Metab, 2012,97(2):426–435. doi: 10.1210/jc.2011–2046.
[45] Machens A, Hauptmann S, Dralle H. Prediction of lateral lymph node metastases in medullary thyroid cancer [J]. Br J Surg, 2008,95(5):586–591. doi: 10.1002/bjs.6075.
[46] Machens A, Dralle H. Biomarker-based risk stratification for previously untreated medullary thyroid cancer[J]. J Clin Endocrinol Metab, 2010, 95(6):2655–2663. doi: 10.1210/jc.2009–2368.
[47] Vlad M, Zosin I, Timar B, et al. Results of Surgical Therapy in Patients with Medullary Thyroid Carcinoma[J]. Indian J Surg, 2016,78(4):309–314. doi: 10.1007/s12262–015–1386–5.
[48] Maia AL, Siqueira DR, Kulcsar MaV, et al. Diagnosis, treatment,and follow-up of medullary thyroid carcinoma: recommendations by the Thyroid Department of the Brazilian Society of Endocrinology and Metabolism[J]. Arq Bras Endocrinol Metabol, 2014, 58(7):667–700.
[49] Machens A, Schneyer U, Holzhausen HJ, et al. Prospects of remission in medullary thyroid carcinoma according to basal calcitonin level[J]. J Clin Endocrinol Metab, 2005, 90(4):2029–2034. doi: 10.1210/jc.2004–1836.
[50] Kwon H, Kim WG, Choi YM, et al. A cut-off value of basal serum calcitonin for detecting macroscopic medullary thyroid carcinoma[J]. Clin Endocrinol (Oxf), 2015, 82(4):598–603. doi:10.1111/cen.12562.
[51] Dottorini ME, Assi A, Sironi M, et al. Multivariate analysis of patients with medullary thyroid carcinoma. Prognostic significance and impact on treatment of clinical and pathologic variables[J].Cancer, 1996, 77(8):1556–1565.
[52] Cho YY, Jang HW, Jang JY, et al. Clinical outcomes of patients with hypercalcitoninemia after initial treatment for medullary thyroid cancer and postoperative serum calcitonin cutoffs for predicting structural recurrence[J]. Head Neck, 2016, 38(10):1501–1508. doi:10.1002/hed.24469.
[53] Wartofsky L. Highlights of the American Thyroid Association Guidelines for patients with thyroid nodules or differentiated thyroid carcinoma: the 2009 revision[J]. Thyroid, 2009, 19(11):1139–1143.doi: 10.1089/thy.2009.1599.
[54] Martins A, Goncalves A, Almeida T, et al. Persistent elevation of carcinoembryonic antigen as first presentation of a medullary thyroid carcinoma[J]. BMJ Case Rep, 2018. pii: bcr-2017–223233.doi: 10.1136/bcr-2017–223233.
