颈动脉体瘤(carotid body tumor,CBT)是一种少见的发生于颈动脉体的神经内分泌肿瘤[1],肿瘤位于颈动脉分叉处,随着其不断增大,常部分或全部包绕颈动脉及周围颅神经,最终将压迫气管、血管或压迫神经引起相应症状。据文献[2]报道,该肿瘤手术颅神经损伤的发生率直接与肿瘤的体积相关。另外,CBT的恶性比例约占2.6%~10.0%,而对于CBT恶性与否的判断只能通过其生物学行为,因此有文献[3]表示所有的CBT都应被看作有恶性潜能。因此,CBT一则确诊,尽早手术治疗、完整切除是目前首选治疗方案。由于该肿瘤血供丰富且与颈动脉关系紧密[4-5],术前准确分析预测为术中颈动脉重建方式提供方案,是否需要行转流,以及在颈动脉破裂后修复重建过程中评估阻断颈动脉侧大脑能否耐受缺血及所耐受的缺血时间很重要[6]。对于目前转流管的应用是否必要及是否会带来不必要的风险仍存在争议,本文通过对比分析转流管在复杂CBT中的应用,对此提出相应见解。自2002年1月—2018年3月,我中心共诊治CBT 113例(其中12例为双侧CBT),完成CBT切除术119例(对6例双侧行分期手术切除两侧CBT),119例中,33例复杂的Shamblin II型及III型中应用到颈动脉转流管,所有的颈内动脉均予以保留。本研究将临床资料进行整理并筛选,进行分组并对比分析常规将应用颈动脉转流管作为复杂CBT的手术操作是否具有可行性,现报告如下。
1 资料与方法
1.1 一般资料
2002年1月—2018年3月,我中心共诊治CBT患者113例(其中12例为双侧CBT),完成CBT切除术119例(对6例双侧行分期手术切除两侧CBT),119例中,32例为Shamblin I型,均完整切除,无短期及长期神经损伤,无脑梗等缺血并发症,87例为Shamblin II型及III型CBT,其中33例因手术复杂或术中出血难以控制应用转流管,另54例未应用颈动脉转流管。未应用转流管的手术中有2例(Shamblin II、III型各1例)因肿瘤包裹严重,术前行供瘤血管栓塞,在本次研究中筛除。因此本研究将北京大学人民医院2002年以来52例未应用术前血管栓塞的Shamblin II型或III型非应用转流管CBT切除手术,及33例应用转流管的CBT切除术共85例作为样本对比研究。瘤体最大径均取自术前CT测量结果,瘤体体积计算方式采用4/3 πabc(瘤体近似椭圆体,a、b、c分别为瘤体三边半径)[7]。
1.2 手术方式
患者全麻下取平卧位,头部偏向健侧,颈背部垫高,使颈部伸展。取患侧胸锁乳头肌前缘切口,先分离并控制颈总动脉,沿颈动脉分叉部向上游离显露瘤体近心端颈内动脉、颈外动脉,同时尽量控制瘤体远端颈内、颈外动脉。未应用转流管的病例中仔细分离瘤体,同时如分叉部视野不清 可 行颈外动脉近端结扎,注意保护颈内动脉 。
当术中发现肿瘤与颈动脉分叉或颈内动脉界限不清或呈包裹状,且同时伴有颈动脉外膜浸润,血管壁菲薄,颈内动脉无法完整保护时,术中根据分离的困难程度适时行颈总动脉至颈内动脉段转流。静脉注射普通肝素(0.5~0.8 mg/kg)约5 min后阻断血流,将转流管两侧分别置于动脉近远端,肝素盐水注入近、远端球囊行腔内转流,开放血流。随后顺转流管走形将粘连血管及神经与瘤体游离,将难以分离或因受侵犯无法分离的血管、神经和瘤体一并切除,并应用自体大隐静脉补片修补。操作过程中尤其注意分叉部和颈外动脉至瘤体供血动脉,适时行颈外动脉近端结扎或缝扎,之后再行颈内动脉重建。对于无法修补的颈内动脉破损通过自体大隐静脉或直径6 mm ePTFE人工血管行颈总-颈内动脉端-端吻合。吻合基本完成后取出转流管,排气并观察返血良好后收紧吻合口,缝线打结,转流管放置和取出均耗时少于120 s。
1.3 术后随访
患者术后如有不适可随时电话及门诊咨询,并于2018年8月行统一电话随访。随访项目:(1)临床指标:长期神经损伤症状如声嘶、伸舌偏斜;动脉通畅率,有无间断头晕、黑矇、认知下降。(2)影像学指标:患者于术后6个月及术后每年行彩超判断有无复发及颈动脉狭窄。
1.4 统计学处理
采用SPSS 24.0软件进行统计学分析,计量资料以均数±标准差(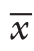 ±s)表示,两种手术方式术中出血、手术时间、术后神经损伤及动脉狭窄的比较采用配对t检验;计数资料采用频数与百分数[n(%)]表示,不同手术方式比较采用χ2检验。P<0.05认为差异具有统计学意义。
±s)表示,两种手术方式术中出血、手术时间、术后神经损伤及动脉狭窄的比较采用配对t检验;计数资料采用频数与百分数[n(%)]表示,不同手术方式比较采用χ2检验。P<0.05认为差异具有统计学意义。
2 结 果
2.1 患者一般临床资料比较
非转流管组患者年龄分布26~68岁,转流管组21~71岁。非转流管组、转流管组患者的性别、年龄、肿瘤位置(侧)、瘤体最大径、体积、术前喉镜及入院时是否合并吞咽困难、声嘶或者头晕的症状比较,差异无统计学差异(均P>0.05);Shamblin分型在两组手术患者中具有明显统计学差异(P<0.05)。部分一般资料及术前检查见表1。
表1 非转流管组与转流管组患者一般临床资料比较
Table 1 Comparison of general characteristics between shunt tube group and non-shunt tube group
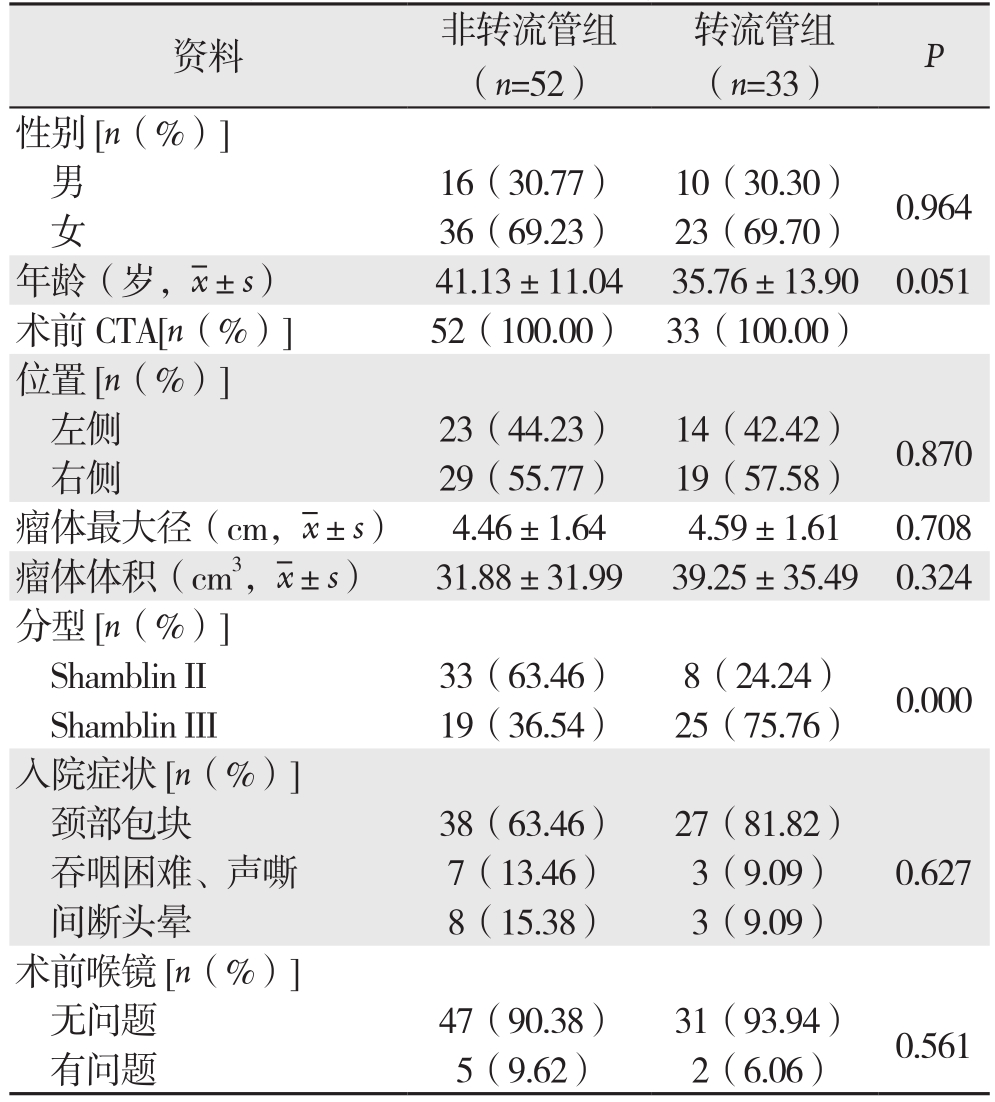
资料 非转流管组(n=52)转流管组(n=33)P性别[n(%)]男16(30.77)10(30.30)0.964女36(69.23)23(69.70)年龄(岁,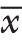 ±s)41.13±11.0435.76±13.900.051术前CTA[n(%)] 52(100.00)33(100.00)位置[n(%)]左侧 23(44.23)14(42.42)0.870右侧 29(55.77)19(57.58)瘤体最大径(cm,
±s)41.13±11.0435.76±13.900.051术前CTA[n(%)] 52(100.00)33(100.00)位置[n(%)]左侧 23(44.23)14(42.42)0.870右侧 29(55.77)19(57.58)瘤体最大径(cm,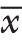 ±s)4.46±1.644.59±1.610.708瘤体体积(cm3,
±s)4.46±1.644.59±1.610.708瘤体体积(cm3,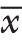 ±s)31.88±31.9939.25±35.490.324分型[n(%)]Shamblin II 33(63.46)8(24.24)0.000 Shamblin III 19(36.54)25(75.76)入院症状[n(%)]颈部包块 38(63.46)27(81.82)0.627吞咽困难、声嘶 7(13.46)3(9.09)间断头晕 8(15.38)3(9.09)术前喉镜[n(%)]无问题 47(90.38)31(93.94)0.561有问题 5(9.62)2(6.06)
±s)31.88±31.9939.25±35.490.324分型[n(%)]Shamblin II 33(63.46)8(24.24)0.000 Shamblin III 19(36.54)25(75.76)入院症状[n(%)]颈部包块 38(63.46)27(81.82)0.627吞咽困难、声嘶 7(13.46)3(9.09)间断头晕 8(15.38)3(9.09)术前喉镜[n(%)]无问题 47(90.38)31(93.94)0.561有问题 5(9.62)2(6.06)
2.2 手术资料
非转流管组的手术时间及术中出血均明显低于转流管组(均P<0.05)(表2)。非转流管组中有2例因颈内动脉破损行大隐静脉补片修补,同时行颈外动脉结扎,另有14例行单纯颈外动脉结扎,6例行颈外动脉重建,均保留颈内动脉。转流管组中因颈内动脉术中破损均行重建,术中应用大隐静脉补片修补9例,因破裂严重行端端吻合重建共24例,其中17例行自体大隐静脉重建,另7例应用人工血管。转流管组中,有2例保留了颈外动脉,4例行颈外动脉重建(均为颈内动脉分叉远心端破损),另27例行颈外动脉结扎。非转流管组中1例患者出现术中心跳停跳30 s,4例因肿瘤延伸至颈动脉孔部分入颅,粘连严重,无法完整切除,残留部分高位瘤体。非转流管组中,1例术中出现一过性血压、心率下降,且与周围神经包裹严重,未行完整切除。余样本术中无明显血流动力学异常,术后病理证实CBT均完整切除。术后病理两组无明显统计学差异(P>0.05),其中非转流管组病理提示恶性2例,包膜侵犯4例,其中1例术后病理提示包膜侵犯患者因肿瘤深达颅底有少量残留,该患者术后随访中表示偶有头晕、复查肿瘤未见明显增大。转流管组无恶性CBT,病理提示包膜侵犯5例,均完整切除。具体手术资料见表2。
2.3 随访结果
针对应用转流管患者及术中行颈内动脉或颈外动脉修补、重建的患者,术后均应用低分子肝素4000 U/12 h抗凝1周,后逐渐覆盖改为阿司匹林100 mg/d单抗半年,其中1例未用转流管患者围手术期出现脑梗(脑梗患者术中未损伤颈外及颈内动脉),余患者围手术期无脑血管并发症。围手术期3例非转流管组患者出现血肿,转流管组1例(P=0.561)。85例手术术后均获得随访,时间6~182个月,平均随访时间(86.58±45.79)个月,经彩超或CT检查,除术中未完全切除的5例缓慢增长外,无术后复发及转移。
术后短期内颅神经并发症原因包括神经牵拉、水肿及损伤。转流管组出现短期神经损伤症状共21例(63.6%),包括声嘶9例,呛咳4例,伸舌患侧偏2例(纤维喉镜示水肿相关的声带活动度下降),患侧味觉消失、声嘶、呛咳1例(纤维喉镜示左侧完全型声带麻痹),吞咽困难5例。非转流管组短期神经损伤共22例。发现神经损伤症状后,临床予神经营养药物及消肿药物治疗,大部分神经症状均在1~6个月内恢复正常。
非转流管组发生长期神经损伤8例(其中1例为双侧患者的1侧损伤)及转流管组3例(均为非双侧CBT患者),主要表现为声嘶及伸舌患侧偏,余神经损伤及水肿均在1个月至1年中恢复至正常。两组长期神经损伤无统计学差异(P>0.05)(表3)。
3 讨 论
3.1 CBT手术中及术后保持颈动脉血流的重要性
手术完整切除是CBT的首选治疗方式[8-9],但肿瘤血供丰富,且复杂CBT可包绕并侵蚀颈动脉,亦会侵犯邻近神经,术中由于各种原因引起的颈动脉损伤甚至破裂无法完全避免,颈内动脉破损时盲目结扎可导致偏瘫、昏迷甚至死亡等严重并发症[10-11]。Zhang等[12-13]报道了1949年—2011年的7例行颈动脉结扎或切除的案例中,2例于术后1周内出现偏瘫,1例术后1个月因中风出现失语,另外12例颈动脉重建案例中没有脑梗塞案例发生。李平栋等[14]表示术前的球囊阻断血管造影检查等充分的术前评估是更好的选择,但即使通过球囊阻塞实验的患者仍有25%的迟发性中风发生率。Chazono等[15]的研究报道中,术前均通过Matas试验、球囊阻断试验(BOT试验)及PET脑血流显像证实脑侧枝循环良好能耐受手术而结扎颈动脉的患者,术后有2例出现了脑梗塞。另外学者[16]2011年的研究中亦在51例行脑血流相关试验的Shamblin III型术中出现3例脑梗病例。因此,即使术前辅助检查评估脑灌注能够由对侧颈动脉代偿,我中心亦坚持常规重建患侧颈内动脉[17],同时严格把控术中颈动脉阻断时间以避免缺血性脑卒中。除2例因颈内动脉破损较小易于修补未应用转流管外,另33例均为破裂较大导致出血难以控制时应用转流管,保证脑循环缺血时间可控制在120 s以内。另外,在本研究中,使用转流管必行颈动脉修补或重建,重建率较高,与非转流管组有明显差异,但实际术中脑梗、围术期血肿发生率及术后的长期神经损伤则与是否应用转流管无明显关系。综上所述,我中心考虑,颈动脉转流管操作安全性能够保证,在进行复杂的CBT手术中尽量保护并保留颈动脉血供是可行的,可以为之后随年龄增长发生颈动脉粥样硬化等疾病导致颈动脉缺血提供一定帮助。
表2 两组患者手术资料比较
Table 2 Comparison of surgical variables between shunt tube group and non-shunt tube group

手术时间(min,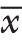 ±s)组别 n 术中出血(mL,
±s)组别 n 术中出血(mL,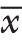 ±s)术后残留[n(%)]病理恶性或包膜侵袭性[n(%)]非转流管组 52161.9±80.5538.3±565.94(7.69)6(11.54)转流管组 33240.6±64.31150.0±1147.11(3.03)5(15.15)P 0.0000.020.3730.886
±s)术后残留[n(%)]病理恶性或包膜侵袭性[n(%)]非转流管组 52161.9±80.5538.3±565.94(7.69)6(11.54)转流管组 33240.6±64.31150.0±1147.11(3.03)5(15.15)P 0.0000.020.3730.886
表3 两组患者术后随访信息比较
Table 3 Comparison of follow-up data between shunt tube group and non-shunt tube group
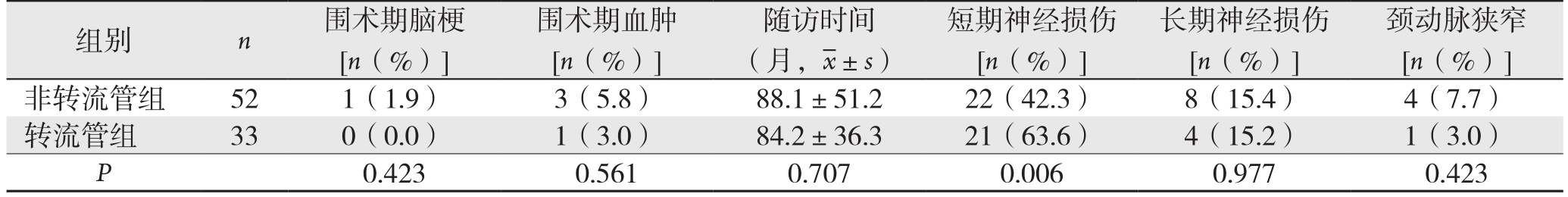
围术期血肿[n(%)]组别 n 围术期脑梗[n(%)]随访时间(月, ±s)短期神经损伤[n(%)]长期神经损伤[n(%)]颈动脉狭窄[n(%)]非转流管组 521(1.9)3(5.8)88.1±51.222(42.3)8(15.4)4(7.7)转流管组 330(0.0)1(3.0)84.2±36.321(63.6)4(15.2)1(3.0)P 0.4230.5610.7070.0060.9770.423
±s)短期神经损伤[n(%)]长期神经损伤[n(%)]颈动脉狭窄[n(%)]非转流管组 521(1.9)3(5.8)88.1±51.222(42.3)8(15.4)4(7.7)转流管组 330(0.0)1(3.0)84.2±36.321(63.6)4(15.2)1(3.0)P 0.4230.5610.7070.0060.9770.423
3.2 颈动脉转流管的应用方式
根据研究结果,Shamblin Ⅲ型CBT术中有明显应用转流管的趋势(P<0.01),说明目前颈动脉转流管更多应用在复杂的CBT手术中。复杂II型CBT中,部分颈动脉与肿瘤粘连紧密甚至颈动脉外膜受到肿瘤侵犯,分离过程中极易出现动脉壁破损,而外膜缺失后动脉管壁失去弹力纤维层,直接缝合修补十分困难并且破裂风险大大增加。因此,术中首先找寻并控制颈内外动脉远心端,如分离瘤体期间出现动脉破裂、出血难以控制,则在此时及时、迅速的从颈内动脉破损处插入转流管,颅内血流灌注得以维持,即可在从容切除CBT后再行修补颈动脉。
对于完全包裹颈动脉的III型CBT,瘤体包裹中的局部解剖结构复杂,往往无法清晰分辨颈内动脉走行方向或无法分离显露出颈内动脉远心端,以及对于深入颅内无法控制颈内动脉远心端的CBT,直接行肿瘤切除风险巨大。此时可以从巨大的动脉体瘤中间剖开找寻颈动脉,若分离期间出现破口,迅速从破口置入转流管并行转流,转流管在动脉腔内可起到一定的支撑作用,利于术者沿转流管上行、下行找寻并清晰游离血管,对CBT的完整剥除起到了明显的帮助及指示,切除肿瘤后再从容重建颈内动脉。
应用转流管对颈动脉破损处行球囊阻断,此时颈动脉破损部位不再出血,视野干净,而同时由于转流后瘤体供血动脉部分被阻断,瘤体体积缩小,分离瘤体时出血亦相应减少,为手术提供了便利。同时由于术野清晰,舌下神经、喉上神经、迷走神经等常可得到恰当的保护。另外,因转流管提供了良好的颈内动脉支撑,远端残余瘤体即可从容沿颈内动脉仔细分离切除,相对缩短了手术时间[18-19]。颈动脉转流管应用组较非转流管应用组手术时间及手术出血明显增加(P<0.01),需要考虑到应用转流管的时机经常为术中出血较多后的补救操作,同时CBT的位置及与周边组织的包裹程度也更加复杂。同时,短期的神经损伤发生率增加与手术中的出血增大及时间延长明显有关,因此把握适当的应用时机以尽量减少不必要的手术时间及尽快控制术中出血,是转流管高效应用的关键。
3.3 颈动脉转流管的并发症
颈动脉转流管的应用经验多来自于颈动脉内膜剥脱术[19],在颈动脉硬化狭窄严重的病例中,置入转流管可将粥样斑块推向远端造成急性脑栓塞;转流管对内膜组织的损伤有诱发血栓形成、引起夹层的风险[20]。但在Zeng等[21]的研究中,在复杂CBT应用转流管时均无脑梗、血栓形成、颈动脉夹层及术后死亡的案例报道。本研究应用转流管的案例中,术后1周内规律予低分子肝素,术后半年内口服单抗阿司匹林,随访过程中颈动脉狭窄发生率与非转流管组无明显统计学差异(P=0.423),而可能与年龄增长有相似的趋势(P=0.054),考虑因术中均为端端吻合,同时补片修补对于管腔直径影响不大,因此并不是转流管应用的主要并发症。笔者考虑原因为CBT患者因多为青年及中年,合并严重颈动脉粥样硬化斑块病变少见,因此在动脉内膜组织较为完好的前提下,转流管的安全性也较高。
但是,应用转流管与短期神经损伤的发生率增加明显相关(P<0.01),是应用转流管明确的短期并发症。然而,在长期神经损伤中颈动脉转流管并不是绝对的危险因素,与非转流管应用的手术相比并无统计学差异(P=0.977)。笔者考虑可能是因为应用转流管的手术均为较复杂的分型,手术难度较大,术中出血及手术时间也相应增加,因此组织水肿及神经牵拉发生率大,但因无绝对神经损伤,应用药物后即会有明显好转。这表明转流管的应用是相对安全的。
因此总体看来,在周围组织粘连侵蚀严重、颈动脉壁菲薄不易分离的复杂CBT中,颈动脉转流管的应用是安全有效,但严格把控其应用指征仍应作为重点[22]。
3.4 展望与局限
经过围手术期周密的准备和管理,尽早手术切除CBT是目前首选的治疗措施。CBT所在解剖位置复杂精细,颈动脉转流管的应用不会增加手术带来的动脉狭窄及缺血的并发症风险,是部分复杂CBT术中安全有效的措施。如出现颈动脉破裂可以尽快应用转流管维持颅内血流,可能有助于减少相对的出血及手术时间,同时减少短期神经损伤的发生。
但是,目前应用颈动脉转流管的案例多为复杂CBT,缺少对照研究可以为转流管是否在减少神经损伤、减少脑灌注不足的并发症上起到显著作用提供支持。同时,结合其他参考文献及证据,大多数中心选择在术前CTA或DSA证明Willis环完整性的前提下,对于复杂CBT的手术倾向选择单侧颈内动脉结扎,这一操作的安全性已被证实。但因CBT发病多为中青年,目前尚无更加长期的大数据随访,不能完全明确结扎一侧颈内动脉血供不会影响到远期合并其他改变的脑部血供。除此之外,目前术前行供瘤动脉栓塞作为一成熟的技术,对于提高手术安全性有优势[23-24],但是亦有文章表示术前栓塞对降低术后神经并发症无明显效果[25]。是否供瘤动脉栓塞可以在复杂CBT中起到等同或者较转流管应用更佳的效果亦有待对比验证。
因此,在不违背伦理的前提下收集更多的数据及前瞻性研究仍然是工作的重点。
[1] 高金辉,蔡铭智,林小雷,等.颈动脉体瘤的外科治疗:附24例报告[J].中国普通外科杂志,2015,24(6):843-846.doi:10.3978/j.issn.1005-6947.2015.06.015.Gao JH,Cai MZ,Lin XL,et al.Surgical treatment of carotid body tumor:a report of 24 cases[J].Chinese Journal of General Surgery,2015,24(6):843-846.doi:10.3978/j.issn.1005-6947.2015.06.015.
[2] Wieneke JA,Smith A.Paraganglioma:carotid body tumor[J].Head Neck Pathol,2009,3(4):303-306.doi:10.1007/s12105-009-0130-5.
[3] Sajid MS,Hamilton G,Baker DM,et al.A multicenter review of carotid body tumor management[J].Eur J Vasc Endovasc Surg,2007,34(2):127-130.doi:10.1016/j.ejvs.2007.01.015.
[4] Makeieff M,Raingeard I,Alric P,et al.Surgical management of carotid body tumors[J].Ann Surg Oncol,2008,15(8):2180-2186.doi:10.1245/s10434-008-9977-z.
[5] van der Bogt KE,Vrancken Peeters MP,van Baalen JM,et al.Resection of carotid body tumors:results of an evolving surgical technique[J].Ann Surg,2008,247(5):877-884.doi:10.1097/SLA.0b013e3181656cc0.
[6] Paridaans MP,van der Bogt KE,Jansen JC,et al.Results from craniocaudal carotid body tumor resection:should it be the standard surgical approach?[J].Eur J Vasc Endovasc Surg,2013,46(6):624-629.doi:10.1016/j.ejvs.2013.08.010.
[7] Zeng G,Zhao J,Ma Y,et al.Resection of carotid body tumors and the additional choice of intraoperative shunt in complicated tumors[J].Ann Vasc Surg,2012,26(4):511-515.doi:10.1016/j.avsg.2011.11.025.
[8] Cobb AN,Barkat A,Daungjaiboon W,et al.Carotid Body Tumor Resection:Just as Safe without Preoperative Embolization[J].Ann Vasc Surg,2018,46:54-59.doi:10.1016/j.avsg.2017.06.149.
[9] Vogel TR,Mousa AY,Dombrovskiy VY,et al.Carotid body tumor surgery:management and outcomes in the nation[J].Vasc Endovascular Surg,2009,43(5):457-461.doi:10.1177/1538574409335274.
[10] 陈飞,邹剑,王力红,等.颈动脉体瘤的个体化序贯治疗应用评价[J].中国耳鼻喉颅底外科杂志,2012,18(4):264-269.Chen F,Zou J,Wang LH,et al.Application of individualized sequential treatment to carotid body tumor[J].Chinese Journal of Otorhinolaryngology-skull Base Surgery,2012,18(4):264-269.
[11] 陈智勇,何明长,杨爱国,等.颈动脉体瘤的手术治疗及围手术期处理[J].中国普通外科杂志,2010,19(6):638-641.Chen ZY,He MC,Yang AG,et al.Surgical treatment and perioperative management of carotid body tumors[J].Chinese Journal of General Surgery,2010,19(6):638-641.
[12] Zhang TH,Jiang WL,Li YL,et al.Perioperative approach in the surgical management of carotid body tumors[J].Ann Vasc Surg,2012,26(6):775-782.doi:10.1016/j.avsg.2012.01.020.
[13] Zheng YH,Liu B,Li YJ,et al.Analysis of effect and complication on surgical treatment of carotid body tumor in 46 cases[J].Chin Med Sci J,2003,18(3):172-174.
[14] 李平栋,于振坤,房居高,等.颈动脉体瘤诊断与处理-单中心经验[J].首都医科大学学报,2012,33(6):757-761.doi:10.3969/j.issn.1006-7795.2012.06.010.Li PD,Yu ZK,Fang JG,et al.Diagnosis and surgical treatment of carotid body tumor:A single clinical center experience[J].Journal of Capital Medical University,2012,33(6):757-761.doi:10.3969/j.issn.1006-7795.2012.06.010.
[15] Chazono H,Okamoto Y,Matsuzaki Z,et al.Carotid artery resection:preoperative temporary occlusion is not always an accurate predictor of collateral blood flow[J].Acta Otolaryngol,2005,125(2):196-200.
[16] Li-shan L,Chang-wei L,Heng G,et al.Efficacy of surgical therapy for carotid body tumors[J].Chin Med Sci J,2011,26(4):241-245.
[17] 张小明,张学民,李伟,等.颈动脉体瘤的外科治疗[J].中华普通外科杂志,2009,24(8):621-624.doi:10.3760/cma.j.issn.1007-631X.2009.08.006.Zhang XM,Zhang XM,Li W,et al.Surgical treatment of carotid body tumors[J].Zhong Hua Pu Tong Wai Ke Za Zhi,2009,24(8):621-624.doi:10.3760/cma.j.issn.1007-631X.2009.08.006.
[18] 张小明,李伟,张学民,等.颈动脉转流管在颅外段血管手术中的应用[J].中华普通外科杂志,2002,17(11):657-659.doi:10.3760/j.issn:1007-631X.2002.11.006.Zhang XM,Li W,Zhang XM,et al.Application of carotid shunt in extra-cranial vascular surgery:report of 23 cases[J].Zhong Hua Pu Tong Wai Ke Za Zhi,2002,17(11):657-659.doi:10.3760/j.issn:1007-631X.2002.11.006.
[19] 赵纪春,马玉奎,黄斌,等.术中颈内动脉转流在颈动脉体瘤切除中的应用[J].中华普通外科杂志,2010,25(7):533-535.doi:10.3760/cma.j.issn.1007-631X.2010.07.007.Zhao JC,Ma YK,Huang B,et al.Intraoperative internal carotid artery shunt in the resection of carotid body tumors(CBT)[J].Zhong Hua Pu Tong Wai Ke Za Zhi,2010,25(7):533-535.doi:10.3760/cma.j.issn.1007-631X.2010.07.007.
[20] Tamaki T,Yoji N,Saito N.Distal cervical carotid artery dissection after carotid endarterectomy:a complication of indwelling shunt [J].Int J Vasc Med,2010,2010:816937.doi:10.1155/2010/816937.
[21] Zeng G,Zhao J,Ma Y,et al.Use of an intraoperative shunt for easy resection of complicated carotid body tumors[J].Head Neck,2013,35(1):61-64.doi:10.1002/hed.22915.
[22] Kim GY,Lawrence PF,Moridzadeh RS,et al.New predictors of complications in carotid body tumor resection[J].J Vasc Surg,2017,65(6):1673-1679.doi:10.1016/j.jvs.2016.12.124.
[23] 张建彬,徐荣伟,陈洁,等.超选择动脉栓塞后手术切除颈动脉体瘤的疗效分析[J].中国普通外科杂志,2016,25(6):859-863.doi:10.3978/j.issn.1005-6947.2016.06.014.Zhang JB,Xu RW,Chen J,et al.Efficacy analysis of superselective embolization followed by surgical resection for carotid body tumors[J].Chinese Journal of General Surgery,2016,25(6):859-863.doi:10.3978/j.issn.1005-6947.2016.06.014.
[24] Power AH,Bower TC,Kasperbauer J,et al.Impact of preoperative embolization on outcomes of carotid body tumor resections [J].J Vasc Surg,2012,56(4):979-989.doi:10.1016/j.jvs.2012.03.037.
[25] 李勇辉,王劲松,姚陈,等.颈动脉体瘤切除术中颈内动脉破裂的高危因素分析[J].中华医学杂志,2017,97(22):1724-1728.doi:10.3760/cma.j.issn.0376-2491.2017.22.010.Li YH,Wang JS,Yao C,et al.Risk factors of rupture of internal carotid artery during surgical resection of carotid body tumor[J].National Medical Journal of China,2017,97(22):1724-1728.doi:10.3760/cma.j.issn.0376-2491.2017.22.010.
