乳腺浸润性导管癌是乳腺癌中最常见的病理类型,特别是在具有乳腺BRCA遗传易感基因携带的患者中,乳腺浸润性导管癌的发生率可进一步的增加[1]。临床上乳腺恶性肿瘤的发生,能够增加患者的致残率,导致无瘤生存时间的显著下降[2]。在探讨乳腺浸润性导管癌的发病机制的过程中发现,P53蛋白能够通过影响到癌细胞的周期调控,导致上皮细胞的持续性增殖,提高了癌细胞对于导管基底部的浸润作用[3];表皮生长因子受体(epidermal growth factor receptor,EGFR)家族成员c-erbB-2的表达,能够通过提高癌细胞DNA的扩增速度,并促进局部病灶组织的新生血管的形成,从而为恶性肿瘤的早期发生及中晚期转移提供前提和基础[4]; B淋巴细胞瘤2基因(B-cell lymphoma-2,bcl-2)是重要的凋亡因子,其表达浓度的维持能够促进癌细胞的凋亡,抑制癌细胞的过度增殖[5]。为了揭示P53、bcl-2及c-erbB-2蛋白在乳腺浸润性导管癌患者组织内表达水平变化意义,笔者收集相关乳腺浸润性导管癌患者临床资料,分析探讨P53、bcl-2及c-erbB-2蛋白的异常表达情况及其与乳腺癌患者临床病理特征的关系。
1 资料与方法
1.1 研究对象
选取2016年12月—2017年10月在我院接受治疗的乳腺浸润性导管癌患者为研究对象。纳入标准:(1)年龄≥18周岁;(2)经术中病理检查确诊为乳腺浸润性导管癌患者;(3)无其他部位原发肿瘤者。排除标准:(1)不愿参与本项研究者;(2)合并其他系统严重疾病者。根据纳入排除标准共纳入研究对象150例,年龄32~62岁,平均(48.92±10.05)岁;高分化者85例,中低分化者65例;绝经者105例,淋巴结转移者60例;浸润深度T1+T2者88例,T3+T4者62例;TNM分期I+I I期者110例,I I I+I V期40例。对照组150例为乳腺良性肿瘤患者,年龄30~64岁,平均(49.04±9.85)岁。两组患者的年龄等一般资料方面无统计学差异(P>0.05),具有可比性。本项研究经医院伦理委员会评审通过,且所有患者均知情同意。
1.2 检测方法
所有组织标本经石蜡包埋后作连续切片,厚度约为4 mm,采用免疫组化链霉卵白素一生物素复合体法(strep avidin—biotin complex,SABC法)染色,二氨基联苯胺(diamionben zidene,DAB)显色。P53、bcl-2及c-erbB-2蛋白通用型二抗以及SP试剂盒和DAB显色盒均购自北京中杉金桥生物技术开发公司。以阳性片及PBS代替一抗分别作为阳性及阴性对照,高倍显微镜下观察P53、bcl-2及c-erbB-2蛋白的表达情况,具体染色步骤严格按照SP试剂盒说明书进行操作。
1.3 评价指标
观察两组P53、bcl-2及c-erbB-2阳性表达率的差异,分析P53、bcl-2及c-erbB-2的关系,比较不同临床病理特征的乳腺癌患者P53、bcl-2及c-erbB-2表达阳性率的差异。阳性评价标准:在高倍镜下随机观察5个视野,以整张切片阳性细胞≥25%为阳性,<25%为阴性。P53、bcl-2及c-erbB-2阳性表达结果见图1。
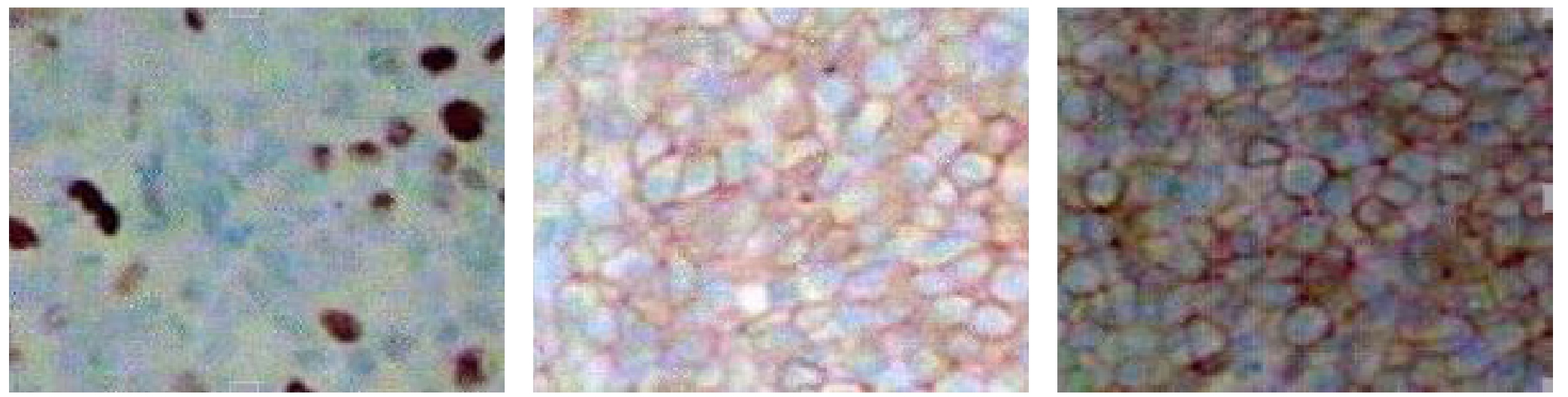
图1 P53、bcl-2及c-erbB-2阳性表达结果
1.4 统计学处理
所有数据经双人录入后,采用SPSS 11.5统计软件进行统计学分析。计数资料采用例或百分率表示,计量资料采用均数±标准差(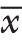 ±s)表示。两组和不同临床病理特征患者P53、bcl-2及c-erbB-2阳性表达率的比较采用χ2检验进行处理,采用回归分析法分析影响乳腺癌患者P53、bcl-2及c-erbB-2表达的因素。P<0.05记为差异具有统计学意义。
±s)表示。两组和不同临床病理特征患者P53、bcl-2及c-erbB-2阳性表达率的比较采用χ2检验进行处理,采用回归分析法分析影响乳腺癌患者P53、bcl-2及c-erbB-2表达的因素。P<0.05记为差异具有统计学意义。
2 结 果
2.1 两组患者P53、bcl-2及c-erbB-2阳性表达率的比较
乳腺癌组患者P53、c-erbB-2阳性表达率高于对照组,bcl-2阳性表达率低于对照组,差异具有统计学意义(P<0.05)(表1)。
表1 两组患者P53、bcl-2及c-erbB-2阳性表达率的比较[n=150,n(%)]
组别 P53 bcl-2 c-erbB-2乳腺癌组 80(53.3)25(16.7)85(56.7)对照组 20(13.3)75(50.0)22(14.7)χ2 54.00037.50057.658 P<0.001 <0.001 <0.001
2.2 不同临床特征的乳腺癌患者P53、bcl-2及c-erbB-2阳性表达率的比较
分化程度低、有淋巴结转移、浸润深度T3+T4、TNM分期Ⅲ+Ⅳ期的乳腺癌患者P53、c-e r bB-2阳性表达率较高,b c l-2阳性表达率较低。P53、c-erbB-2及bcl-2的表达与分化程度、有无淋巴结转移、浸润深度、TNM分期有关(P<0.05);与患者年龄无关(P>0.05)(表2)。
表2 不同临床病理特征的乳腺癌患者P53、bcl-2及c-erbB-2阳性表达率的比较[n(%)]
项目 n P53阳性 χ2 P bcl-2阳性 χ2 P c-erbB-2阳性 χ2 P年龄≥508245(30.0)0.1730.67716(10.7)1.0550.30450(33.3)1.3680.242<506835(23.3)9(6.0)35(23.3)分化程度高分化 8530(20.0)25.646 <0.00120(13.3)6.6520.01033(22.0)25.433 <0.001中、低分化 6550(33.3)5(3.3)52(34.7)淋巴结转移有6055(36.7)59.040 <0.0015(3.3)5.0000.02555(36.6)49.887 <0.001无9025(16.7)20(13.3)30(20.0)浸润深度T1+T2 8822(14.7)68.671 <0.00121(14.0)61.533 <0.00125(16.7)69.231 <0.001 T3+T4 6258(38.7)4(2.6)60(40.0)TNM分期I+II期 11045(30.0)25.583 <0.00123(15.3)5.3450.02147(31.3)32.641 <0.001 III+IV期 4035(23.3)2(1.3)38(25.3)
2.3 影响乳腺癌患者P53、bcl-2及c-erbB-2阳性表达率的因素
将单因素分析有意义的因素作为自变量,将乳腺癌患者P53、bcl-2及c-erbB-2阳性表达情况作为因变量进行回归分析,结果显示分化程度和TNM分期是影响P53、bcl-2及c-erbB-2阳性表达的因素(表3)。
表3 影响乳腺癌患者P53、bcl-2及c-erbB-2阳性表达率的因素
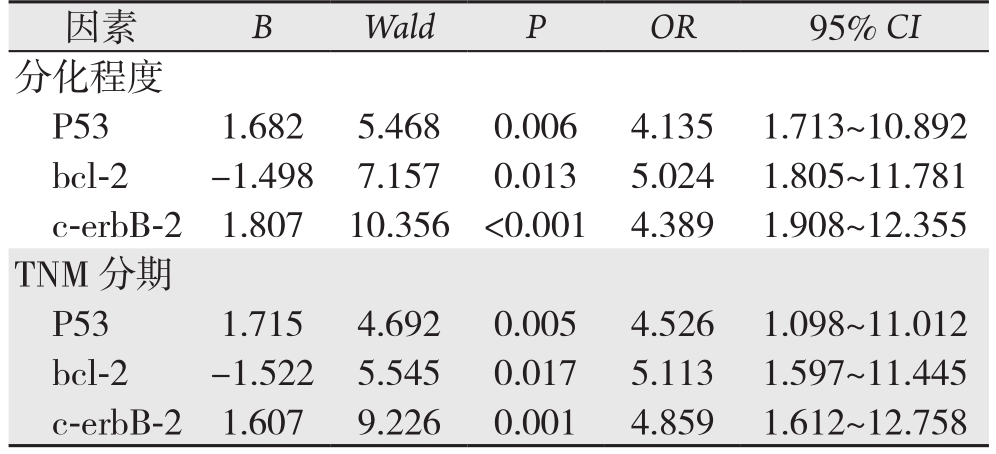
因素 B Wald P OR 95% CI分化程度P531.6825.4680.0064.1351.713~10.892 bcl-2 -1.4987.1570.0135.0241.805~11.781 c-erbB-21.80710.356 <0.0014.3891.908~12.355 TNM分期P531.7154.6920.0054.5261.098~11.012 bcl-2 -1.5225.5450.0175.1131.597~11.445 c-erbB-21.6079.2260.0014.8591.612~12.758
3 讨 论
乳腺浸润性导管癌的发生主要考虑与性激素水平的紊乱及基因调控异常有关,不同的生物学因素的改变,能够通过影响到肿瘤相关信号通路的激活,导致早期细胞异常病变的发生[6]。现阶段临床上乳腺浸润性导管癌患者的早期诊断的水平仍然较为局限,影像学筛查虽然能够提高乳腺浸润性导管癌的筛查水平,但漏诊率或者误诊率水平仍然较高[7];临床上通过手术及综合性的放疗方式辅助治疗乳腺浸润性导管癌,但其治疗后的乳腺浸润性导管癌患者的生存时间的改善并不理想,治疗后的3年生存率并无明显的提高[8]。本次研究对于乳腺浸润性导管癌患者病灶组织中的免疫组化相关蛋白水平的相关研究,具有下列两个方面的价值:(1)能够为临床上乳腺浸润性导管癌患者的早期筛查提供理论基础;(2)能够为免疫靶向治疗提供作用靶点,从而提高乳腺浸润性导管癌患者的生存预后水平。
P53的表达能够影响到导管上皮细胞的增殖活性,提高上皮细胞核DNA的异常增殖的风险,P53的表达阳性率的提升还能够诱导癌细胞的早期分化调控障碍,促进癌细胞的低分化及中低分化的发生风险[9];c-erbB-2作用PI3K/AKT信号通路的下游因子,其表达浓度的上调能够提高乳腺导管细胞的核转录水平,抑制柱状上皮细胞的凋亡。基础领域的研究[4]还认为,c-erbB-2的表达能够提高乳腺浸润性导管癌细胞的侵袭能力,提高癌细胞对于临近正常乳腺组织的浸润风险;bcl-2是重要的凋亡相关因子,其能够影响到导管上皮细胞的凋亡过程,促进乳腺癌细胞的程序性凋亡过程[10-11]。
本次研究通过免疫组化的相关分析研究发现,在浸润性导管癌患者病灶组织中,P53、c-erbB-2的表达阳性率显著的上升,高于正常对照乳腺组织,差异较为明显,提示了P53、c-erbB-2均可能影响到了乳腺癌发生,通过荟萃相关研究[12-13],笔者认为P53、c-erbB-2对于乳腺浸润性导管癌的病情影响可能与下列几个方面的因素有关:(1)P53的上升能够提高导管上皮细胞内的MAPK信号通路的激活,促进了癌细胞转录活性的增强;(2)c-erbB-2不仅能够促进乳腺上皮细胞的异常增殖过程,同时还能够促进新生微血管的形成,提高肿瘤病灶组织的血流灌注水平。赖静等[14]也认为,在乳腺癌患者病灶组织中,P53的表达阳性率可平均上升30%以上,同时在临床分期较晚或者远期病死率较高的导管癌患者中,P53的表达阳性率可进一步的上升。bcl-2在乳腺癌病灶组织中的表达阳性率显著的下降,提示了bcl-2在乳腺癌的发生过程中可能具有一定的保护性作用,这主要由于bcl-2的表达能够维持乳腺上皮细胞的增殖,抑制癌细胞的过度增殖和浸润过程,并促进癌细胞的凋亡过程。在分化程度低、有淋巴结转移、浸润深度较深或者临床分期较晚的乳腺癌患者中,P53、c-erbB-2的表达浓度可进一步的上升,同时bcl-2的表达浓度可进一步的下降,提示不同的指标与乳腺癌患者的临床病理特征密切相关,这主要由于P53、c-erbB-2的表达能够改变癌细胞的生物学活性,影响到癌细胞对于淋巴结的黏附过程[15]。而bcl-2的表达浓度的下降失去了其对于癌细胞的细胞周期的稳定作用。但部分研究者认为bcl-2等指标的改变与淋巴结的转移并无关系,存在不同的结论可能与免疫组化相关指标的检测灵敏度的差异等有关。回归分析也可见,分化程度和TNM分期是影响P53、bcl-2及c-erbB-2阳性表达的因素,进一步提示了P53、c-erbB-2等与乳腺癌的病情关系。
综上所述,乳腺浸润性导管癌患者组织内P53、c-erbB-2蛋白阳性表达率较高,bcl-2阳性表达率较低,分化程度和TNM分期是其表达的影响因素。
[1] Wang T,Ma Y,Wang L,et al.Strong adverse effect of epidermal growth factor receptor 2 overexpression on prognosis of patients with invasive lobular breast cancer:a comparative study with invasive ductal breast cancer in Chinese population[J].Tumor Biology,2015,36(8):6113-6124.doi:10.1007/s13277-015-3293-6.
[2] Liu Y,Huang X,Bi R,et al.Similar prognoses for invasive micropapillary breast carcinoma and pure invasive ductal carcinoma:a retrospectively matched cohort study in China[J].PLoS One,2014,9(9):e106564.doi:10.1371/journal.pone.0106564.
[3] 陶曙,邱志远,雷珍,等.P53、CerbB-2、ER、PR和Ki67在乳腺浸润性小叶癌的表达及临床意义[J].江苏医药,2016,42(3):266-268.Tao S,Qiu ZY,Lei Z,et al.Expressions and clinical signi ficance of P53,CerbB-2,ER,PR and Ki67 in breast invasive lobular carcinoma[J].Jiangsu Medical Journal,2016,42(3):266-268.
[4] 史春颖,刘源,李睿,等.乳腺导管原位癌的发病危险因素及生物学指标ER、PR、C-erbB-2表达的研究[J].哈尔滨医科大学学报,2015,49(1):52-54.Shi CY,Liu Y,Li R,et al.Incidence risk factors of breast ductal carcinoma in situ and the expression of ER,PR,and C-erbB-2[J].Journal of Harbin Medical University,2015,49(1):52-54.
[5] 张延勇.乳腺癌Bcl-2 mRNA和Ki-67 mRNA的表达与临床病理意义[J].中国妇幼保健,2014,29(19):3158-3159.doi:10.7620/zgfybj.j.issn.1001-4411.2014.19.46.Zhang YY.Expression of Bcl-2mRNA and Ki-67 in breast cancer and the clinicopathologic signi ficance[J].Maternal & Child Health Care of China,2014,29(19):3158-3159.doi:10.7620/zgfybj.j.issn.1001-4411.2014.19.46.
[6] 马继斌,曾理,张保荣,等.特殊类型乳腺恶性病变与常见浸润性导管癌超声声像图的对比分析[J].癌症进展,2017,15(7):790-793.doi:10.11877/j.issn.1672-1535.2017.15.07.19.Ma JB,Zeng L,Zhang BR,et al.Comparative analysis of ultrasonographic features of rare malignant breast lesions and common invasive ductal carcinoma[J].Oncology Progress,2017,15(7):790-793.doi:10.11877/j.issn.1672-1535.2017.15.07.19.
[7] Shi W,Yang L,Hu X,et al.Clinico-pathological features and prognosis of invasive micropapillary carcinoma compared to invasive ductal carcinoma:a population-based study from China[J].PLoS One,2014,9(6):e101390.doi:10.1371/journal.pone.0101390.
[8] Paul Wright G,Davis AT,Koehler TJ,et al.Hormone receptor status does not affect prognosis in metaplastic breast cancer:a population-based analysis with comparison to in filtrating ductal and lobular carcinomas[J].Ann Surg Oncol,2014,21(11):3497-3503.doi:10.1245/s10434-014-3782-7.
[9] 霍莉莉,李慧,魏枫,等.乳腺癌中P53的表达与上皮-间质转化的相关性及其临床意义[J].中国肿瘤临床,2014,41(12):776-780.doi:10.3969/j.issn.1000-8179.20140603.Huo LL,Li H,Wei F,et al.Correlation and clinical signi ficance of P53 expression with epithelial-mesenchymal transition in breast cancer[J].Chinese Journal of Clinical Oncology,2014,41(12):776-780.doi:10.3969/j.issn.1000-8179.20140603.
[10] 黄信,张清,吕荣钊,等.乳腺癌组织中蛋白 Bcl-2的表达及意义[J].暨南大学学报:自然科学与医学版,2015,36(5):421-424.doi:10.11778/j.jdxb.2015.05.012.Huang X,Zhang Q,Lu RZ,et al.Expressions and signi ficance of Bcl-2 protein in breast cancer tissue[J].Journal of Jinan University:Natural Science & Medicine Edition,2015,36(5):421-424.doi:10.11778/j.jdxb.2015.05.012.
[11] 刘赛,陈少芬,李文林,等.乳腺癌微环境成纤维细胞对乳腺癌细胞表达TIGAR和Bcl-2的影响[J].中国免疫学杂志,2018,34(2):177-182.doi:10.3969/j.issn.1000-484X.2018.02.004.Liu S,Chen SF,Li WL,et al.Effect of fibroblasts in breast cancer microenvironment on expression of TIGAR and Bcl-2 of breast cancer cells[J].Chinese Journal of Immunology,2018,34(2):177-182.doi:10.3969/j.issn.1000-484X.2018.02.004.
[12] 柴森,牛玉军.乳腺浸润性导管癌X线征象与Ki-67、P53表达的关系及临床意义[J].解放军医学院学报,2016,37(4):360-363.doi:10.3969/j.issn.2095-5227.2016.04.017.Cai S,Niu YJ.Relationship between mammographic appearances of breast infiltrating ductal carcinoma and expression of Ki-67 and P53 and its clinical significance[J].Academic Journal of Chinese Pla Medical School,2016,37(4):360-363.doi:10.3969/j.issn.2095-5227.2016.04.017.
[13] 赵倩,迪力夏提·金斯汗,吐鲁洪·沙列尔.新疆维吾尔族乳腺癌C-erbB-2和Caspase3蛋白的表达及其意义[J].新疆医科大学学报,2016,39(5):551-554.doi:10.3969/j.issn.1009-5551.2016.05.007.Zhao Q,Dilixiati·JSH,Tuluhong·SLE.The expression of C-erbB-2 and Caspase3 in breast cancer in Xinj iang Uygur[J].Journal of Xinjiang Medical University,2016,39(5):551-554.doi:10.3969/j.issn.1009-5551.2016.05.007.
[14] 赖静,顾军,许晶,等.P53在乳腺癌中的表达意义及5-氮杂脱氧胞苷对 P53的调控作用[J].医学研究生学报,2014,(6):573-576.Nai J,Gu J,Xu J,et al.Expression of P53 in breast cancer and regulatory effects of 5-aza-2′-deoxycytidine on P53[J].Journal of Medical Postgraduates,2014,(6):573-576.
[15] 李志华,雷秋模,熊建萍.乳腺癌组织P53表达与新辅助化疗疗效相关性Meta分析[J].中华肿瘤防治杂志,2015,22(3):221-226.Li ZH,Lei QM,Xiong JP.Correlation between P53 expression in breast cancer and clinical response to neoadjuvant chemotherapy:a Meta-analysis[J].Chinese Journal of Cancer Prevention and Treatment,2015,22(3):221-226.
