瘦素(leptin)是脂肪细胞分泌的激素,它的作用最初认为是通过降低能量摄入、增加能量消耗来维持机体的能量平衡[1],然而事实并非如此,瘦素的受体广泛表达于身体各处,包括中枢神经系统,也有瘦素受体的表达,瘦素通过血脑屏障作用于这些受体,起着调节中枢神经内分泌功能、调节摄食行为和调节能量消耗的作用[2-3],同时瘦素作为一种激素也参与机体脂肪代谢的调节[4]。胆固醇主要在肝细胞代谢,经胆道排出,80%的胆固醇结石位于胆囊内,胆汁在胆囊内浓缩,使胆固醇易于析出、结晶、沉淀。目前国内外关于瘦素与胆囊结石的研究很少,而且这些研究多集中于胆囊动力学和脂肪代谢方面[5-7],关于瘦素及其受体对人体胆固醇代谢及胆囊内胆汁成分的影响及其在胆囊结石形成中的所起的作用,目前国内外尚缺乏研究。本研究采用病例对照研究的方法,研究胆囊胆固醇结石患者瘦素及其受体对胆固醇代谢及胆囊内胆汁成分的调节在胆囊胆固醇结石形成中的作用。
1 资料与方法
1.1 一般资料
研究对象:随机选择2015年10月—2016年10月河北省人民医院肝胆外科住院患者中因胆囊胆固醇结石接受腹腔镜胆囊切除术的患者30例(结石组),其中男12例,女18例,平均48.1岁;选取同期因胆囊息肉行腹腔镜胆囊切除术的患者22例(息肉组),其中男8例,女14例,平均46.4岁。两组间年龄、性别差异无统计学意义(均P>0.05)。两组患者全部排除心、脑、肝、肾及内分泌系统疾病。近1个月未服用降低胆固醇药物和胆酸、非甾体抗炎药及生长素等影响胆囊排空药物,3月内无包括胆系感染在内的急性炎症病史。两组患者均签署知情同意书。
1.2 方法
1.2.1 标本收集 ⑴ 血液标本的采集:所有胆囊胆固醇结石及胆囊息肉样病变患者于入院次日清晨7时左右空腹平卧静脉采血,取血清。⑵ 胆囊标本采集:胆囊均是患胆囊结石和胆囊息肉样病变择期手术的腹腔镜胆囊切除患者。术中在腹腔镜指引下经皮肤行胆囊穿刺术抽取胆汁(白胆汁病例不列入研究范围),抽取胆汁时尽量抽空胆囊以避免因胆汁分层造成的误差。所得胆汁置于无菌试管中,放入-20 ℃冰箱保存。胆囊切除后,无菌条件下取胆囊壁颈部和体部部分全层组织,大小约0.5 cm×0.5 cm,置于无菌管内,迅速放入液氮中冷冻,随后置于-80 ℃冰箱内保存供检测用。以上所取标本3个月内行各项指标检测。
1.2.2 胆囊结石化学定性分类法 将术中取出的胆囊结石用生理盐水反复冲洗干净、晾干后研磨成粉末状,取少量胆石粉置于白色陶瓷杯中先加入醋酸酐5~6滴,再加入浓硫酸1滴,观察显色反映。如胆石粉末立即呈现翠绿色并由中心向四周放射表明为胆固醇结石,如见到呈红色,则表明为胆色素类结石。
1.2.3 血脂的测定 用酶法检测总血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)。应用的仪器为美国BEKMAN公司的全自动生化LX20分析仪。
1.2.4 胆汁中脂质成分的测定 将-20 ℃冰箱内保存的胆囊胆汁2 mL,在-4 ℃下解冻后以0.9%的生理盐水1:5稀释后,5 000 r/min离心10 min除胆汁中的固体颗粒成分。取1 mL胆汁标本置于无菌透明试管中,在4 ℃条件下使用20 w白色日光灯连续照12 h,降解胆汁中的胆红素等胆色素成分。应用美国BEKMAN公司的全自动生化LX20分析仪对上述过程处理完毕的胆汁中的TC、总胆汁酸(TBA)进行测定。
1.2.5 瘦素的测定 瘦素的测定采用双抗体夹心ELISA法(瘦素试剂盒晶美生物工程有限公司提供,该试剂盒板内、板间变异系数<10%,最小可测值为15 pg/mL)。
1.2.6 瘦素受体mRNA的测定 采用半定量RTPCR方法,将胆囊组织从-80 ℃超低温冰箱中取出,快速称重组织100 mg左右,提取总RNA,取总RNA 2 µg,加入RT反应体系(含AMV Buffer,dNTPs,Oligo dT Primer,AMV,Rnase Inhibitor等)管中,并用DEPC处理水补足到50 µL反应液体积,震荡混匀后短暂离心,加少许矿物油于PCR仪,42 ℃ 30 min(cDNA合成),99 ℃ 5 min(逆转录酶失活),5 ℃ 5 min。Human GAPDH扩增片段为228 bp,上游引物:5'-CGA CCA CTT TGT CAA GCT CA-3',下游引物:5'-AGG GGT CTA CAT GGC AAC TG-3';Human瘦素受体扩增片段为344 bp,上游引物:5'-CAG AAG CCA GAA ACG TTT GAG-3', 下游引物:5'-AGC CCT TGT TCT TCA CCA GT-3'。取每个标本的扩增产物6 µL于1%的含GV核酸染料的琼脂糖凝胶电泳,以DNA Marker(DL2000)作为标准片段标记,电泳后于紫外透射仪观察,并用数码相机照相,输入微机应用Quantity One凝胶图象分析软件对目的电泳条带进行分析,以相应的内参电泳条带作为参照,结果以两者之积分吸光度的比值表示。
1.3 统计学处理
数据用均数±标准差(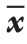 ±s)表示,SPSS 14.0统计软件进行分析。两组间数据的比较,先进性方差齐性检验,方差齐的采用独立样本的t检验,不齐的采用秩和检验。Spearman相关系数分析观测指标间的相关性。P<0.05为差异有统计学意义。
±s)表示,SPSS 14.0统计软件进行分析。两组间数据的比较,先进性方差齐性检验,方差齐的采用独立样本的t检验,不齐的采用秩和检验。Spearman相关系数分析观测指标间的相关性。P<0.05为差异有统计学意义。
2 结 果
2.1 两组间血脂指标的比较
与息肉组比较,结石组血清TC[(5.64±1.08)mmol/L vs.(4.32±0.87)mmol/L]、TG [(1.96±1.17)mmol/L vs. (1.34±0.79)mmol/L]、LDL [(2.76±0.71) mmol/L vs.(2.33±0.56)mmol/L]均明显升高,而血清HDL明显降低[(1.17±0.27)mmol/L vs. (1.41±0.31)mmol/L],差异均有统计学意义(P=0.047、P=0.031、P=0.025、P=0.005)(表1)。
表1 两组血脂指标比较(mmol/L,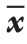 ±s)
±s)
Table 1 Comparison of the blood lipids between the two groups(mmol/L, 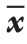 ±s)
±s)
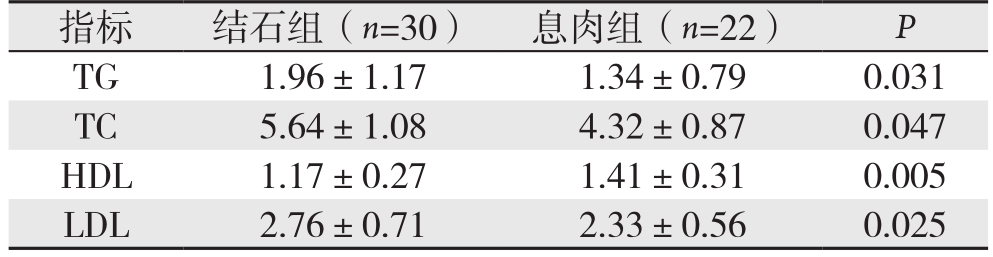
指标 结石组(n=30) 息肉组(n=22) P TG 1.96±1.17 1.34±0.79 0.031 TC 5.64±1.08 4.32±0.87 0.047 HDL 1.17±0.27 1.41±0.31 0.005 LDL 2.76±0.71 2.33±0.56 0.025
2.2 两组胆囊内胆汁成分的特点
结石组胆囊内胆汁TC水平与息肉组无统计学差异[(13.44±2.68)mmol/L vs.(11.26±1.37)mmol/L,P=0.291],结石组胆囊内胆汁TBA含量与息肉组的差异亦无统计学意义[122.76±29.33)mmol/L vs.(137.63±47.01)mmol/L,P=0.145],但结石组胆囊内胆汁TC/TBA含量比率明显高于息肉组[(11.21±7.13)% vs. (8.01±3.04)%],差异有统计学意义(P=0.017)(表2)。
表2 两组胆囊胆汁成分比较(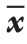 ±s)
±s)
Table 2 Comparison of the gallbladder bile components between the two groups( 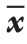 ±s)
±s)

指标 结石组(n=30) 息肉组(n=22) P TC(mmol/L) 13.44±2.68 11.26±1.37 0.291 TBA(mmol/L) 122.76±29.33 137.63±47.01 0.145 TC/TBA 11.21±7.13% 8.01±3.04% 0.017
2.3 两组血清瘦素的比较
检测结果显示,结石组血清瘦素水平明显高于息肉组[(8.27±5.98)ng/mL vs.(5.15±4.23)ng/mL],差异有统计学意义(P=0.041)。
2.4 两组血清瘦素与血脂及胆汁成分的相关性
结石组中血清瘦素水平与TG、TC均呈明显正相关(r=0.633,P=0.002;r=0.224,P=0.025),与HDL呈明显负相关(r=-0.205,P=0.014);瘦素与LDL无相关性(r=0.199,P=0.301)。息肉组中血清瘦素与TG、TC、HDL、LDL无明显相关性(r=-0.125,P=0.845;r=-0.289,P=0.354;r=0.317,P=0.445;r=-0.329,P=0.279)。结石组中瘦素与胆汁TC呈正相关(r=0.384,P=0.000)、与TBA呈负相关(r=-0.548,P=0.024)。息肉组血脂与胆汁中的成分未发现相关关系(r=0.492,P=0.563;r=-0.466,P=0.137)(表3)。
表3 两组血清瘦素与血脂及胆囊胆汁成分的相关性分析
Table 3 Correlation analysis of leptin with blood lipids and gallbladder bile components
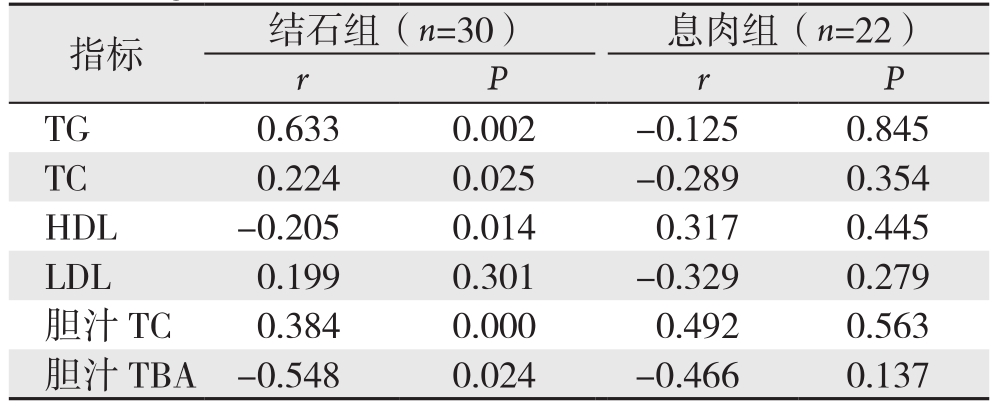
指标 结石组(n=30) 息肉组(n=22)rPrP TG 0.633 0.002 -0.125 0.845 TC 0.224 0.025 -0.289 0.354 HDL -0.205 0.014 0.317 0.445 LDL 0.199 0.301 -0.329 0.279胆汁TC 0.384 0.000 0.492 0.563胆汁TBA -0.548 0.024 -0.466 0.137
2.5 两组胆囊组织瘦素受体mRNA表达的比较
RT-PCR结果显示,结石组患者胆囊组织瘦素受体mRNA相对表达水平明显高于胆囊息肉样变组(0.34±0.06 vs. 0.13±0.04),差异有统计学意义(P=0.012)(图1)。

图1 RT-PCR检测瘦素受体mRNA表达 M:分子量标记;1-4:结石组;5-8:息肉组
Figure 1 Leptin receptor mRNA expressions by RT-PCR M: Markers; 1–4: Gallstone group; 5–8: Polyp group
3 讨 论
在我国及经济发达国家,胆囊胆固醇结石是一种常见的消化道疾病,据统计,在美国,12%的成年人患有胆囊结石[8-9]。关于胆囊胆固醇结石形成病理生理学机制在于:胆囊内胆汁过饱和、成核及胆固醇结晶水合物不断沉着、胆囊动力学异常[10],但是其中最关键的环节是胆固醇结晶沉淀,胆囊胆汁中的胆固醇能以微胶粒和胆固醇磷脂泡的方式保持溶解状态,一旦胆汁中的胆固醇超出这些大泡的最大承载能力,它们将会析出、结晶、沉淀,胆汁中胆固醇的溶解度取决于胆固醇与胆汁酸(盐)、磷脂的相对浓度比[11]。本研究显示与息肉组相比,虽然结石组胆囊内胆汁TC水平高,而胆汁TBA含量低,但差异无统计学意义;而结石组胆囊内胆汁的TC/TBA含量比率明显高于息肉组,差异有统计学意义,表明结石组胆囊内胆汁的胆固醇更容易析出、结晶、沉淀,有明显形成结石的倾向。
瘦素最初发现于机体的脂肪细胞,是脂肪细胞分泌的一种激素,其受体广泛表达于全身各个组织脏器[12]。目前已发现瘦素有多种生物学活性,实验研究发现瘦素及其受体与犬类的胆囊黏液囊肿有关[13-14],进一步研究[15]发现瘦素及其受体与狗的胆囊结石形成有关。我国学者[16]严格设计的配对研究发现人类血清瘦素水平与胆囊胆固醇结石密切相关。
本研究发现,结石组血清TC、TG、LDL明显高于息肉组,而血清HDL显著低于息肉组,同时结石组血清瘦素水平显著高于息肉组,并且相关性分析显示,结石组血清TC、TG、HDL水平与血清瘦素水平相关,这与Saraç等[6]的结果相一致,瘦素本身参与脂代谢[17],而且胆囊结石与高脂血症有关[18],因此,瘦素与胆囊结石的形成有关[19-21]。
并且本研究还发现,与息肉组比较,结石组胆囊壁瘦素受体高表达,表明结石组较息肉组有明显的瘦素抵抗现象[22],并且与肥胖与胰岛素抵抗的关系相似[23];而息肉组血清瘦素水平与血清TG、TC、HDL水平无相关性。本研究发现TG与血清瘦素水平呈正相关,笔者前期研究胰岛素抵抗组TG明显升高,并且与体质指数相一致[23],研究[19,24]发现瘦素抵抗与胰岛素抵抗存在内在联系,并且与血清游离脂肪酸增高有关[6],这与笔者前期研究发现相一致[23]。
研究[5,10,25]发现,有瘦素抵抗现象的大鼠,空腹胆囊体积大,收缩力下降,而且在瘦素基因缺失的大鼠上也发现了同样的现象,临床研究也发现慢性胆囊炎患者血清瘦素水平及可溶性瘦素受体水平也异常[26]。本组研究发现结石组胆囊壁瘦素受体高表达,同时血清瘦素水平也较息肉组高,存在瘦素抵抗现象。并且本组研究还发现结石组血清TC、LDL明显高于息肉组,显示结石组血清高胆固醇,这必然导致过多的胆固醇排泄到胆汁,而且本研究结果也证实了结石组胆囊内胆汁中TC水平高于息肉组,但增高幅度没有统计学差异;本研究发现结石组血清HDL显著低于息肉组,并且结石组胆囊内胆汁TBA含量也低于息肉组,尽管后者差异无统计学意义,显示胆固醇代谢、转化功能低下,本研究结果还证实结石组胆囊内胆汁TBA含量低于息肉组,虽然减低程度没有统计学差异,但综合分析却发现结石组胆囊内胆汁的TC/TBA含量比率明显高于息肉组;相关性分析显示,上述这些改变都与血清瘦素水平相关。由于瘦素抵抗,胆固醇转化代谢功能低下,导致血清胆固醇增高,过多的胆固醇进入胆汁,而且肝脏胆固醇代谢能力降低,胆汁酸(盐)生成减少,导致胆囊内胆汁中TC/TBA的比例升高,由于瘦素抵抗同时造成胆囊排空能力下降,胆汁在胆囊淤积,胆固醇更容易析出、结晶、沉淀,形成胆固醇结石。
综上所述,本研究显示胆囊胆固醇结石患者,血清瘦素水平升高,血清高胆固醇,低HDL,胆囊胆汁中TC/TBA的比例升高,胆囊壁瘦素受体高表达,提示瘦素与胆囊胆固醇结石形成有关。
参考文献
[1] Farr OM, Gavrieli A, Mantzoros CS. Leptin applications in 2015:what have we learned about leptin and obesity?[J]. Curr Opin Endocrinol Diabetes Obes, 2015, 22(5):353–359. doi: 10.1097/MED.0000000000000184.
[2] Kelesidis T, Kelesidis I, Chou S, et al. Narrative review: the role of leptin in human physiology: emerging clinical applications[J]. Ann Intern Med, 2010, 152(2):93–100. doi: 10.7326/0003–4819–152–2–201001190–00008.
[3] 金希彪, 杨永志, 杨水仙, 等. 不同消化道重建术式对胃癌合并2型糖尿病患者术后糖代谢的影响[J]. 中国普通外科杂志, 2016,25(1):151–154. doi:10.3978/j.issn.1005–6947.2016.01.024.Jin XB, Yang YZ, Yang SX, et al. Influence of different digestive reconstruction methods on glycometabolism in patients with type 2 diabetes[J]. Chinese Journal of General Surgery, 2016, 25(1):151–154. doi:10.3978/j.issn.1005–6947.2016.01.024.
[4] Farooqi IS, O'Rahilly S. 20 years of leptin: human disorders of leptin action[J]. J Endocrinol, 2014, 223(1):T63–70. doi: 10.1530/JOE-14–0480.
[5] Graewin SJ, Kiely JM, Lu D, et al. Leptin regulates gallbladder genes related to gallstone pathogenesis in leptin-deficient mice[J]. J Am Coll Surg, 2008, 206(3):503–510. doi: 10.1016/j.jamcollsurg.2007.09.015.
[6] Saraç S, Atamer A, Atamer Y, et al. Leptin levels and lipoprotein profiles in patients with cholelithiasis[J]. J Int Med Res, 2015,43(3):385–392. doi: 10.1177/0300060514561134.
[7] Kwak MS, Kim D, Chung GE, et al. Cholecystectomy is independently associated with nonalcoholic fatty liver disease in an Asian population[J]. World J Gastroenterol, 2015, 21(20):6287–6295. doi: 10.3748/wjg.v21.i20.6287.
[8] Flegul KM, Cunoll MD, Ogden CL, et al. Prevalence and trends in obesity among US adults 1999–2000[J]. JAMA, 2002,288(14):1728–1732.
[9] Mokdad AH, Ford ES, Bowman BA, et al. Prevalence of obesity,diabetes and obesity-related health risk factors, 2001[J]. JAMA,2003, 289(1):76–79.
[10] Swartz-Basile DA, Goldblatt MI, Choi SH, et al. Biliary lipids and cholesterol crystal formation in leptin-deficient obese mice[J]. HPB(Oxford), 2006, 8(5):386–392. doi: 10.1080/13651820600641233.
[11] Dikkers A, Tietge UJ. Biliary cholesterol secretion: more than a simple ABC[J]. World J Gastroenterol, 2010, 16(47):5936–5945.
[12] D'souza AM, Neumann UH, Glavas MM, et al. The glucoregulatory actions of leptin[J]. Mol Metab, 2017, 6(9):1052–1065. doi:10.1016/j.molmet.2017.04.011.
[13] Mizutani S, Torisu S, Kaneko Y, et al. Retrospective analysis of canine gallbladder contents in biliary sludge and gallbladder mucoceles[J]. J Vet Med Sci, 2017, 79(2):366–374. doi: 10.1292/jvms.16–0562.
[14] Lee S, Kweon OK, Kim WH. Increased Leptin and Leptin Receptor Expression in Dogs With Gallbladder Mucocele[J]. J Vet Intern Med, 2017, 31(1):36–42. doi: 10.1111/jvim.14612.
[15] Lee S, Kweon OK, Kim WH. Associations between serum leptin levels, hyperlipidemia, and cholelithiasis in dogs[J]. PLoS One,2017, 12(10):e0187315. doi: 10.1371/journal.pone.0187315.
[16] 陈静, 何洁, 陈江慧, 等. 瘦素基因G2548A多态性及环境因素与胆囊胆固醇结石关联性研究[J]. 四川大学学报: 医学版, 2017,48(3):410–417.Chen J, He J, Chen JH, et al. Relationship Between LEP G2548A Polymorphism and Cholesterol Gallstone[J]. Journal of Sichuan University: Medical Science Edition, 2017, 48(3):410–417.
[17] Mantzoros CS, Magkos F, Brinkoetter M, et al. Leptin in human physiology and pathophysiology[J]. Am J Physiol Endocrinol Metab, 2011, 301(4):E567–584. doi: 10.1152/ajpendo.00315.2011.
[18] Zhu L, Aili A, Zhang C, et al. Prevalence of and risk factors for gallstones in Uighur and Han Chinese[J]. World J Gastroenterol, 2014, 20(40):1494214949. doi: 10.3748/wjg.v20.i40.14942.
[19] Xie Y, Fung HY, Newberry EP, et al. Hepatic Mttp deletion reverses gallstone susceptibility in L-Fabp knockout mice[J]. J Lipid Res,2014, 55(3):540–548. doi: 10.1194/jlr.M046342.
[20] Huang W, Bansode RR, Xie Y, et al. Disruption of the murine protein kinase Cbeta gene promotes gallstone formation and alters biliary lipid and hepatic cholesterol metabolism[J]. J Biol Chem,2011, 286(26): 22795–22805. doi: 10.1074/jbc.M111.250282.
[21] Tsai CH, Wu JS, Chang YF, et al. The number of metabolic abnormalities associated with the risk of gallstones in a non-diabetic population[J]. PLoS One, 2014, 9(3):e90310. doi: 10.1371/journal.pone.0090310.
[22] Crujeiras AB, Carreira MC, Cabia B, et al. Leptin resistance in obesity: An epigenetic landscape[J]. Life Sci, 2015, 140:57–63. doi:10.1016/j.lfs.2015.05.003.
[23] 郭怀斌, 唐勇, 王兰辉, 等. 内脏脂肪堆积与内脏脂肪酶活性及胰岛素抵抗的关系[J]. 山东医药, 2011, 51(25):56–57. doi:10.3969/j.issn.1002–266X.2011.25.036.Guo HB, Tang Y, Wang LH, et al. Relations of visceral fat accumulation with visceral lipase ctivity andinsulin resistance[J].Shandong Medical Journal, 2011, 51(25):56–57. doi:10.3969/j.issn.1002–266X.2011.25.036.
[24] Koch CE, Lowe C, Pretz D, et al. High-fat diet induces leptin resistance in leptin-deficient mice[J]. J Neuroendocrinol, 2014,26(2):58–67. doi: 10.1111/jne.12131.
[25] Graewin SJ, Tran KQ, Naggert JK, et al. Diminished gallbladder motility in Rotund leptin-resistant obese mice[J]. HPB (Oxford),2005, 7(2):139–143. doi: 10.1080/13651820510028800.
[26] 高蓉, 蒲文静, 马春梅, 等. 慢性胆囊炎患者血清瘦素及可溶性瘦素受体与血脂水平的变化及关系[J]. 中国普通外科杂志, 2015,24(8):1112–1115. doi:10.3978/j.issn.1005–6947.2015.08.011.Gao R, Pu WJ, Ma CM, et al. Alteration of leptin, soluble leptin receptor and blood lipid levels and their relations in patients with chronic cholecystitis[J]. Chinese Journal of General Surgery, 2015,24(8):1112–1115. doi:10.3978/j.issn.1005–6947.2015.08.011.
