胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors,pNET)是起源于胰腺神经内分泌某种细胞而形成的一类罕见肿瘤,按照有无临床症状,可分为无功能性与功能性,有功能性是因产生某种激素而具有一系列相应临床症状,按照激素分泌的类型可分为胰岛素瘤、胰高血糖素瘤、胃泌素瘤、血管活性肠肽瘤、生长抑素瘤等[1];无功能性是可能并不产生内分泌物质且不导致明确临床症状的肿瘤,称为无功能胰腺神经内分泌肿瘤。该肿瘤具有显著异质性,近年来该病的发病率呈逐年上升趋势[2]。为加深对该病的认识,提高诊疗水平,现回顾性分析内蒙古医科大学附属医院肝胆外科经手术及病理证实的8例pNET患者的临床资料,总结如下。
1 资料与方法
1.1 一般资料
回顾性分析2008年1月—2017年1月我院经手术及病理证实的8例pNET患者的临床资料。其中男2例,女6例;年龄36~72岁,中位年龄54岁。其中功能性肿瘤3例(3/8),无功能性肿瘤5例(5/8)。
1.2 研究方法
采用WHO2010版消化系统肿瘤病理分类的诊断标准[3]和2013年中国胃肠胰神经内分泌肿瘤病理诊断共识[4]对pNET临床病理回顾性分析,并对其进行分类、命名和分级。疾病分级标准:G1,核分裂数<2/10高倍视野(HPF)和(或)Ki67指数为≤2%;G2,核分裂数<(2~20)/10高倍视野(HPF)和(或)Ki指数为3%~20%;G3,核分裂数>20/10 HPF和(或)Ki67指数为>20%[5]。采用2010年美国癌症研究联合会(AJCC)[6] pNET TNM分期标准来确定肿瘤分期。回顾性分析本组pNET患者的首发临床症状、发生部位、肿瘤标志物检测、影像学特征、手术方式、病理特点等,结合文献,总结pNET的临床特点及病理特征,分析诊治pNET的关键因素。
1.3 随访方式
采用电话和门诊的方式进行随访。随访时间截至2017年1月1号。
2 结 果
2.1 临床表现
8例pNET患者中,其中无功能性肿瘤占5例(5/8),主要表现为腹痛腹胀、腹部肿块、食欲不振、消瘦等;3例(3/8)为功能性肿瘤,以低血糖反应或高血糖为主要表现。
2.2 影像学检查
5例患者接受腹部B超检查,其中4例(4/5)发现胰腺内实性或囊性肿物,回声欠均匀,但均未能明确性质。8例接受增强CT检查,其中7例(7/8)明确发现病灶,多表现为平扫时等密度或低密度病灶,增强后强化不均匀,结合临床表现,明确诊断。7例行MRI检查,明确发现病灶7例(7/7),都表现为T1W1呈低信号,T2W1呈高信号,增强扫描实性成分呈不均匀片状强化,其内低信号无强化。
2.3 治疗情况
8例患者中,均行手术治疗,其中1例行肿瘤局部切除术,2例行胰体尾切除术,4例行胰十二指肠切除术,1例行胰体尾+脾切除术+胰腺空肠吻合术。本组无手术死亡,术后发生消化道出血1例(1/8),经输血、抑酸、等保守治疗1周后好转。
2.4 病理检查
肿瘤直径0.6~5.0 cm,其中肿瘤<2.0 cm 2例、2.0~4.0 cm 5例、>4.0 cm 1例。肿瘤位于胰头3例(3/8),胰体1例(1/8),胰尾4例(4/8)。pNET包括神经内分泌瘤和神经内分泌癌,本组8例患者中,G1级3例、G2级4例、G3级1例。TNM分期I期2例、II期5例、III期1例,其中侵犯血管1例、淋巴结转移1例。免疫组化结果:CgA阳性率为62.5%(5/8),Syn阳性率为87.5%(7/8),NSE阳性率为75.0%(6/8)。
2.5 随访结果
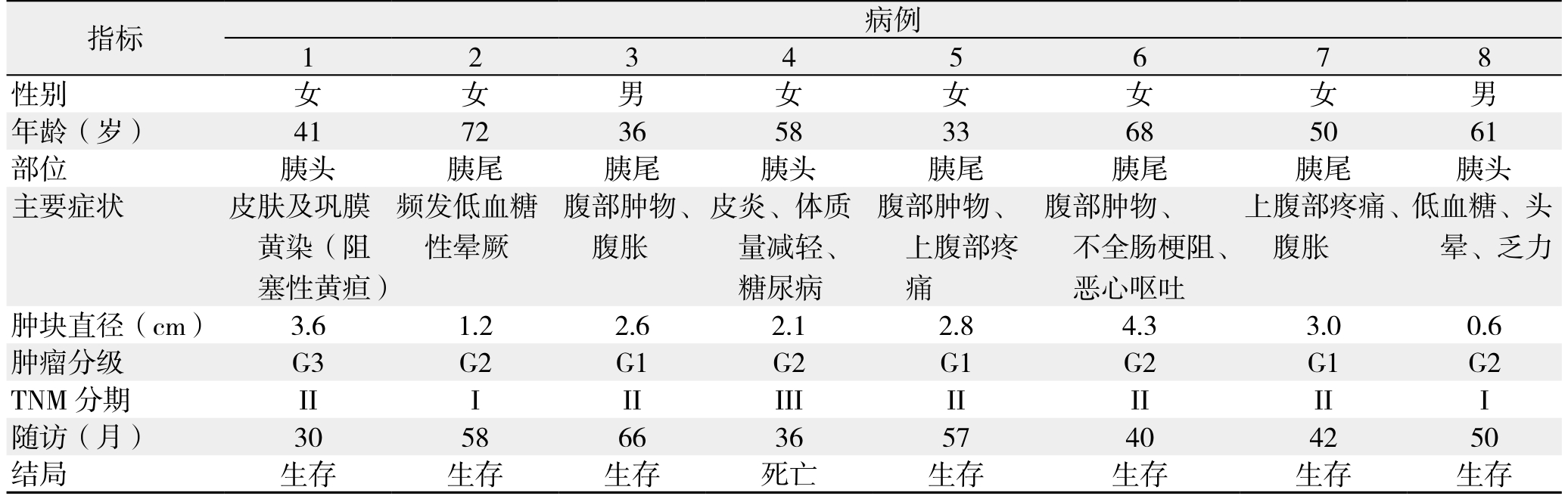
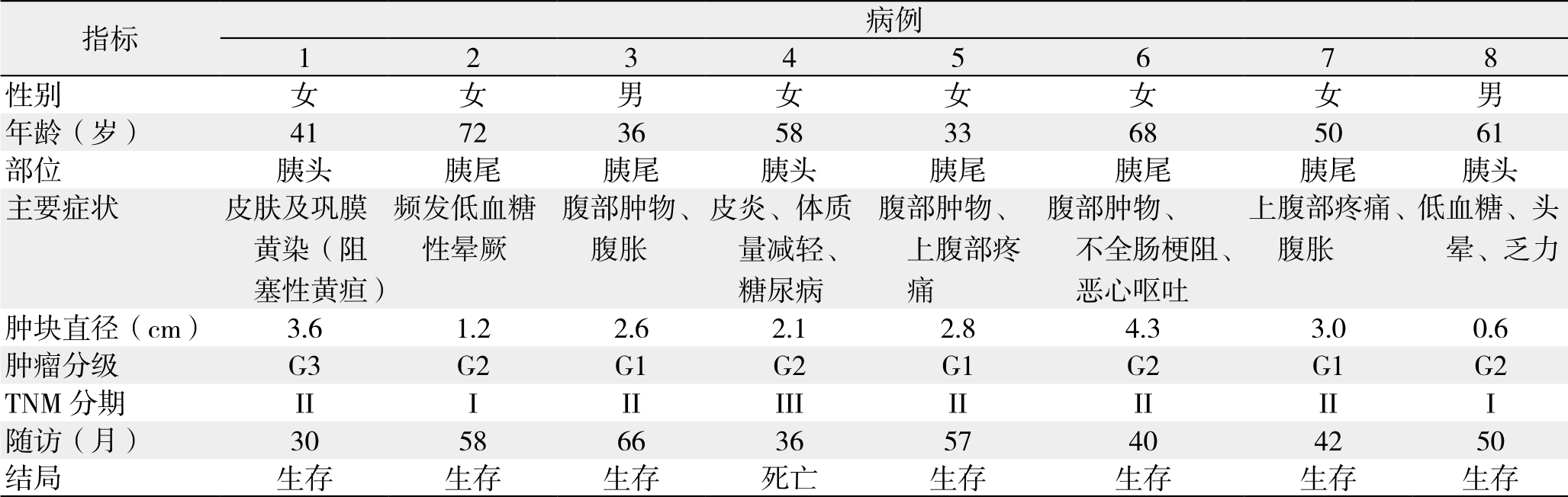
8例患者全部进行随访,随访日期截止到2017年1月1日。随访时间为30~66个月,平均随访时间是47个月。随访8例,正常生存有7例,1例行胰体尾切除术后9个月发生肝转移后行肝左叶切除,术后多次给予射频消融等治疗,随访36个月后死亡。患者临床资料及随访资料详见表1。
表1 8例患者的临床资料与随访情况
Table 1 Clinical and follow-up data of the 8 patients
3 讨 论
神经内分泌肿瘤(NET)是一类起源于多能神经内分泌干细胞的肿瘤,可发生于全身许多器官和组织,其中pNET临床少见,症状复杂多样,病程缓慢,易误诊和漏诊,甚至出现严重的不可逆的损害。近年来该病的发病率有着明显上升。由于临床医生对本病认识与研究不够,进一步分析pNET的资料将有望提高本病的诊疗水平和预后。
pNET按照有无临床症状,可分为无功能性与功能性[7]。回顾性分析本组pNET患者的临床资料发现,无功能性pNET为主(5/8),与国外的大宗病例报道[8]情况相符合。由于无早期特征性的临床症状,无功能性pNET主要表现为腹痛腹胀、腹部肿块、食欲不振、消瘦等,常被误诊为消化性疾病而耽误了本病的最佳治疗时间[9]。因此对这类症状需要提高意识,详细询问病史,进一步检查。
影像学检查是诊断pNET主要手段,由于它具有高密度分辨率和可重复检查,且不受腹内气体的影响,给以临床医生对肿瘤诊断、定位带来了重大的帮助。B超检查灵敏度稍低,对肿瘤直径小的会易出现误诊漏诊,而且未能明确性质,但比较经济,可作为普通患者的筛查和体检。增强CT和MRI对于肿瘤病灶检查具有较高诊断率[10],通过回顾性研究增强CT和MRI检查肿瘤的诊断率要高于B超,进一步分析B超漏诊的病例,肿瘤直径均≤2 cm。目前越来越多的报道普遍认为正电子发射计算机断层扫描(PET)/CT对于pNET有着非常重要的诊断应用价值。Sharma等[11]对141例pNET病例进行回顾性研究发现,PET/CT对于pNET再分期的诊断准确性(98.8%)明显高于常规影像学(B超、CT、MRI)检查,尤其对非胰岛素瘤的高诊断准确率。但另外文献[12]表明PET/CT联合MRI T1T2序列、MRI DWI序列将提高诊断准确率。因此需要影像学检查相结合来综合探讨,才能明确诊断[13],制定合理可行的治疗方案。
目前,手术切除是pNET患者最有效治疗方法[14-15]。手术方式选择应根据肿瘤部位、大小、性质、有无周围组织侵犯、有无转移等因素[16]。本组pNET患者的手术方式包括肿瘤局部切除术、胰体尾切除术、胰十二指肠切除术、胰体尾+脾+胰腺空肠吻合术。其中1例pNET伴淋巴结转移应尽可能切除肿瘤原发灶和转移灶以及清扫淋巴结,降低肿瘤负荷,提高存活率[17]和生活质量。大量回顾性分析[18]均认为淋巴结转移与预后有相关。对于功能性pNET:除胰岛素瘤外,均需常规行淋巴结清扫,尤其着重胃泌素瘤[19]由于术中多需要进行十二指肠切开探查,且淋巴结转移多见。此外可考虑联合放化疗、介入治疗、靶向治疗等方法进行治疗。
本组pNET患者的随访发现有1例死亡,该患者的肿瘤TNM(III期)和分级(G2)并且伴有淋巴结转移可能与预后有相关。国外文献[20]报道,肿瘤分期是影响pNET患者预后的因素。淋巴结转移和远处转移一般见于恶性程度较高的pNET,但G1级和G2级也可能出现淋巴结转移和远处转移。周延等[21]研究分析,分化越差、分级越高的肿瘤血供可能越差。由于本组临床资料样本量较小,统计效能较低,因此未做预后因子的分析。
综上所述,pNET是一种发病隐匿、病程较长的疾病,肿瘤分级、分期、淋巴结转移、远处转移是影响pNET预后的重要因素。因此,临床上对该病应早期发现、明确诊断,结合多学科制定个体化的综合治疗方案,对提高pNET的临床治愈率、改善患者预后及提高生活质量将具有重要的意义。
参考文献
[1]Dumlu EG, Karakoç D, Özdemir A. Nonfunctional pancreatic neuroendocrine tumors: advances in diagnosis, management, and controversies[J]. Int Surg, 2015, 100(6):1089–1097. doi: 10.9738/INTSURG-D-14–00204.1.
[2]Ellison TA, Wolfgang CL, Shi C, et al. A single institution's 26-year experience with nonfunctional pancreatic neuroendocrine tumors:a validation of current staging systems and a new prognostic nomogram[J]. Ann Surg, 2014, 259(2):204–212. doi: 10.1097/SLA.0b013e31828f3174.
[3]Morin E, Cheng S, Mete O, et al. Hormone profiling, WHO 2010 grading, and AJCC/UICC staging in pancreatic neuroendocrine tumor behavior[J]. Cancer Med, 2013, 2(5):701–711. doi: 10.1002/cam4.96.
[4]2013年中国胃肠胰神经内分泌肿瘤病理诊断共识专家组. 中国胃肠胰神经内分泌肿瘤病理诊断共识(2013版)[J]. 中华病理学杂志, 2013, 42(10):691–694. doi:10.3760/cma.j.issn.0529–5807.2013.10.011.Chinese Pathologic Consensus Group for Gastrointestinal and Pancreatic Neuroendocrine Neoplasms 2013. Chinese consensus on pathologic diagnosis of gastrointestinal and pancreatic neuroendocrine neoplasms (2013 edition)[J]. Chinese Journal of Pathology, 2013, 42(10):691–694. doi:10.3760/cma.j.issn.0529–5807.2013.10.011.
[5]Garcia-Carbonero R, Sorbye H, Baudin E, et al. ENETS Consensus Guidelines for High-Grade Gastroenteropancreatic Neuroendocrine Tumors and Neuroendocrine Carcinomas[J]. Neuroendocrinology,2016, 103(2):186–194. doi: 10.1159/000443172.
[6]Ye BX, Heng D, Jiang LQ, et al. Application of AJCC/UICC and WHO-2010 classifications for GEP-NEN in Chinese patients[J]. J Dig Dis, 2015, 16(5):264–271. doi: 10.1111/1751–2980.12239.
[7]Romashchenko PN, Priadko AS, Lysaniuk MV. Adequacy of surgical approach in insulinoma of the pancreas[J]. Vestn Khir Im I I Grek, 2013, 172(2):60–62.
[8]Zerbi A, Falconi M, Rindi G, et al. Clinicopathological features of pancreatic endocrine tumors: a prospective multicenter study in Italy of 297 sporadic cases[J]. Am J Gastroenterol, 2010,105(6):1421–1429. doi: 10.1038/ajg.2009.747.
[9]孟兴凯, 张俊晶, 任建军, 等. 胰腺内分泌肿瘤诊疗研究进展[J].中华内分泌外科杂志, 2010, 4(4):258–261. doi:10.3760/cma.j.issn.1674–6090.2010.04.015.Meng XK, Zhang JJ, Ren JJ, et al. Progress in the diagnosis and treatment of pancreatic endocrine tumors[J]. Journal of Endocrine Surgery, 2010, 4(4):258–261. doi:10.3760/cma.j.issn.1674–6090.2010.04.015.
[10]Manta R, Nardi E, Pagano N, et al. Pre-operative diagnosis of pancreatic neuroendocrine tumors with endoscopic ultrasonography and computed tomography in a large series[J]. J Gastrointestin Liver Dis, 2016, 25(3):317–321. doi: 10.15403/jgld.2014.1121.253.ned.
[11]Sharma P, Arora S, Dhull VS, et al. Evaluation of 68 Ga—DOTANOC PET /CT imaging in a large exclusive population of pancreatic neuroendocrine tumors[J]. Abdom Imaging, 2015,40(2):299–309. doi: 10.1007/s00261–014–0219–5.
[12]Farchione A, Rufini V, Brizi MG, et al. Evaluation of the Added Value of Diffusion-Weighted Imaging to Conventional Magnetic Resonance Imaging in Pancreatic Neuroendocrine Tumors and Comparison With 68Ga-DOTANOC Positron Emission Tomography/Computed Tomography[J]. Pancreas, 2016, 45(3):345–354. doi: 10.1097/MPA.0000000000000461.
[13]张宇, 孟兴凯, 张俊晶. 胰腺神经内分泌肿瘤的诊断和治疗进展[J]. 肝胆胰外科杂志, 2017, 29(4):345–348. doi:10.11952/j.issn.1007–1954.2017.04.021.Zhang Y, Meng XK, Zhang JJ. Progress of diagnosis and treatment for pancreatic neuroendocrine neoplasm[J]. Journal of Hepatopancreatobiliary Surgery, 2017, 29(4):345–348.doi:10.11952/j.issn.1007–1954.2017.04.021.
[14]Sun J. Pancreatic neuroendorine tumors[J]. Intractable Rare Dis Res, 2017, 6(1):21–28. doi: 10.5582/irdr.2017.01007.
[15]柯牧京, 李宜雄. 胰腺神经内分泌肿瘤诊断和治疗进展[J]. 中国普通外科杂志, 2014, 23(9):1258–1263. doi:10.7659/j.issn.1005–6947.2014.09.019.Ke MJ, Li YX. Diagnosis and treatment of pancreatic neuroendocrine tumors:recent advances[J]. Chinese Journal of General Surgery, 2014, 23(9):1258–1263. doi:10.7659/j.issn.1005–6947.2014.09.019.
[16]Frilling A, Modlin I M, Kidd M, et al. Recommendations for management of patients with neuroendocrine liver metastases[J].Lancet Oncol, 2014, 15(1):e8–21. doi: 10.1016/S1470–2045(13)70362–0..
[17]Falconi M, Bartsch DK, Eriksson B, et al. ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms of the digestive system: well-differentiated pancreatic non-functioning tumors[J]. Neuroendocrinology, 2012, 95(2):120–134. doi:10.1159/000335587.
[18]Hashim YM, Trinkaus KM, Linehan DC, et al. Reginoal lymphadenectomy is indicated in the surgical treatment of pancreatic neuroendocrine tumors (PNETs)[J]. Ann Surg, 2014,259(2):197–203. doi: 10.1097/SLA.0000000000000348.
[19]Kim BS, Park YS, Yook JH, et al. Comparison of the prognostic values of the 2010 WHO classification, AJCC 7th edition, and ENETS classification of gastric neuroendocrine tumors [J].Medicine (Baltimore), 2016, 95(30):e3977. doi: 10.1097/MD.0000000000003977.
[20]Strosberg JR, Cheema A, Weber J, et al. Prognostic validity of a novel american joint committee on cancer staging classification for pancreatic neuroendocrine tumors[J]. J Clin Onco1, 2011,29(22):3044–3049. doi: 10.1200/JCO.2011.35.1817.
[21]周延, 刘剑羽, 朱翔. 胰腺神经内分泌肿瘤多层螺旋CT双期增强扫描特征[J]. 中华放射学杂志, 2013, 47(3):225–230. doi:10.3760/cma.j.issn.1005–1201.2013.03.007.Zhou Y, Liu JY, Zhu X. Dual-phase contrast enhancement multislice CT in grading pancreatic neuroendocrine tumors[J]. Chinese Journal of Radiology, 2013, 47(3):225–230. doi:10.3760/cma.j.issn.1005–1201.2013.03.007.