胃癌是常见的恶性肿瘤之一,仅在2012年,胃癌新发病例就估计有95万左右,其中死亡人数72万,在不同的国家和地区,胃癌的发病率有很大差异[1]。在我国,胃癌发病率及病死率位列第二[2]。目前,胃癌主要的治疗手段包括手术及放化疗,但是由于多数患者在确诊时已进入进展期,导致胃癌患者预后较差[1]。因此,寻找可靠的生物标志物作为临床早期诊疗的靶点具有重要意义。
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度超过200 nt的RNA,在基因转录、转录后调控及表观遗传等多个水平调控基因表达,在多种疾病中也有重要的作用[3-4]。lncRNA CCAT2最早在2013年被发现并鉴定出来,其序列定位于8q24高度保守区域[5]。CCAT2在结直肠癌[5]、非小细胞肺癌[6]、食管鳞癌[7]、前列腺癌[8]等肿瘤中异常高表达,发挥类似于原癌基因的功能。本研究旨在体外研究CCAT2在胃癌细胞系中的表达及敲低其表达对胃癌细胞生长和侵袭的作用及可能机制。
1 材料与方法
1.1 材料
胃癌细胞系AGS、Hs746T、BSG823及正常胃黏膜上皮细胞系GES-1均购自美国ATCC细胞库,P53、caspase-8、Bcl-2及Bax一抗均购自美国cell signaling technology公司,二抗购自美国BD公司,RPMI 1640培养基购自上海经科化学科技有限公司,LncRNA CCAT2 siRNA套装购自广州锐博生物科技有限公司,LipofectamineTM2000转染试剂购自美国BD公司。RT-PCR仪购自美国BD公司,HBS-1096B酶标仪购自南京德铁实验设备有限公司,蛋白免疫印迹电泳设备购自美国Bio-Rad公司。
1.2 实验方法
1.2.1 细胞培养、转染及分组 胃癌细胞系AGS、Hs746T、BSG823及正常胃黏膜上皮细胞系GES-1均种植于RPMI 1640培养基,并培养于37 ℃、5%CO2培养箱中,于48 h后消化传代,实验所用的细胞均为对数生长期细胞。
取胃癌细胞系AGS分成3组,si-CCAT2组、阴性对照组及空白对照组,并制备终浓度为80 nmol/L的LncRNA CCAT2 siRNA脂质体复合物,将AGS细胞系以每孔2×105个接种于6孔板上,待细胞生长至融合后,si-CCAT2组和阴性对照组经LipofectamineTM 2000分别转染CCAT2 siRNA序列和阴性对照siRNA序列,空白对照组以PBST为空白对照。CCAT2 siRNA序列正义链:5'-AGG UGU AGC CAG AGU UAA UTT-3',反义链:5'-AUU AAC UCU GGC UAC ACC UTT-3';阴性对照siRNA序列正义链:5'-UUC UCC GAA CGU GUC ACG UTT-3',反义链:5'-ACG UGA CAC GUU CGG AGA ATT-3'。
1.2.2 RNA提取及实时荧光定量PCR(qRTPCR) RNA的提取:收集待测细胞系和3组细胞,每孔不少于1×106个细胞,用All-in-One miRNA抽提试剂盒提取总RNA,取5 μg总RNA行反转录合成cDNA, 以cDNA为模板,GAPDH为内参,LncRNA CCAT2引物序列正向:5'-CCC TGG TCA AAT TGC TTA ACC T-3',反向:5'-TTA TTC GTC CCT CTG TTT TAT GG AT-3';GAPDH引物序列正 向:5'-GCT CTC TGC TCC TCC TGT TC-3',反 向:5'-ACG ACC AAA TCC GTT GAC TC-3'。行qRT-PCR反应。反应条件:95 ℃ 变性30 s,95℃ 5 s,60℃ 20 s,共40个循环,使用BIORAD real-time PCR仪自带软件分析样本的循环阈值(cycle threshold,CT),采用 2−ΔΔCt方法定量,计算LncRNA CCAT2的相对表达量。
1.2.3 细胞增殖能力测定 CCK-8法测定si-CCAT2组、阴性对照组及空白对照组3组细胞增殖能力,将si-CCAT2组、阴性对照组及空白对照组细胞消化成单细胞悬液后,以2×103个/孔将3组细胞种植于96孔板上,每个孔按200 µL的体积上样,经0、24、48、72、96 h培养后,20 µL CCK-8溶液加入于每孔中去,继续培养1 h后,在450 nm波长下,用酶标仪测定各孔吸光值,以时间为横坐标,吸光值为纵坐标绘制细胞增殖曲线。
1.2.4 细胞凋亡测定 采用流式细胞术测定si-CCAT2组、阴性对照组两组细胞凋亡率,染色采用Annexin V/PI,将si-CCAT2组、阴性对照组两组细胞消化后,结合缓冲液重悬混匀后,加入Annexin V抗体,避光染色10 min后加入适量PBS溶液及PI染料,流式细胞仪检测Annexin V阳性细胞比例来确定细胞凋亡率。
1.2.5 细胞迁移能力测定 采用细胞划痕实验,将si-CCAT2组、阴性对照组及空白对照组细胞培养于12孔板中,待细胞长满融合后,用20 µL无菌Tips枪头画直线,在0 h和48 h在显微镜下观察修复情况,划痕愈合率的计算按照公式,即划痕愈合率=(划痕后即刻的划痕面积-划痕后48 h的划痕面积)/划痕后即刻的划痕面积×100%。实验在同一情况及条件下重复测量3次。迁移能力与划痕愈合率成正比。
1.2.6 细胞侵袭能力测定 采用Transwell实验将si-CCAT2组、阴性对照组及空白对照组3组细胞,每组取3×104个细胞后接种于Transwell小室表面,于37 ℃条件下培养24 h,24h后,将小室膜下面的细胞用甲醛固定,并采用0.2%结晶紫溶液染色10 min,显微镜下随机10个200×视野,计算膜下细胞数,在同一条件下实验重复3次。侵袭细胞数越多表示侵袭能力越强。
1.2.7 Western blot检测 将si-CCAT2组、阴性对照组两组细胞裂解、变性后,上样量为每孔30 μg蛋白,浓缩胶条件为50 min 80 V,分离胶条件为100 min 100 V,常规转膜,加入P53、caspase-8、Bcl-2及Bax一抗,浓度为1:200,4℃孵育过夜,二抗(1:1000)经37 ℃孵育4 h后,PBST漂洗3次,在ECL发光液下显影,Quantity One 1-D分析目标蛋白灰度值,目标蛋白相对表达量=目标蛋白灰度值/GAPDH灰度值,实验重复3次,取平均值。
1.3 统计学处理
采用SPSS 20.0统计软件行数据分析,计量资料以均数±标准差(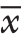 ±s)表示,两组间的比较采用t检验,3组比较先用方差分析,有意义时,两两比较再用LSD-t检验,P<0.05为差异有统计学意义。
±s)表示,两组间的比较采用t检验,3组比较先用方差分析,有意义时,两两比较再用LSD-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 CCAT2在胃癌细胞系与正常胃黏膜上皮细胞中的表达
qRT-PCR示,正常胃黏膜上皮细胞系GES-1中LncRNA CCAT2相对表达量为1.0±0.03,在胃癌细胞系AGS、Hs746T及BSG823中相对表达量分别为8.52±0.43、5.67±0.31及3.49±0.18,胃癌细胞系AGS、Hs746T及BSG823中LncRNA CCAT2相对表达量均明显高于正常胃黏膜上皮细胞系GES-1(均P<0.05)(图1)。

图1 CCAT2在胃癌及正常胃黏膜上皮细胞系中的表达
Figure 1 Expressions of CCAT2 in different gastric cancer cell lines and normal gastric cell line

图2 敲低CCAT2表达抑制胃癌细胞的影响 A:CCAT2相对表达量;B:细胞增殖曲线
Figure 2 Effect of knockdown of CCAT2 expression on gastric cancer cells A: Relative CCAT2 expression levels; B: Cell proliferation curves
2.2 敲低CCAT2表达对胃癌细胞增殖的影响
胃癌细胞系A G S转染2 4 h后,q R T-P C R示,si-CCAT2组LncRNA CCAT2相对表达量为0.25±0.021,阴性对照组相对表达量为1.0±0.04,空白对照组为1.06±0.07,si-CCAT2组LncRNA CCAT2相对表达量低于阴性对照组和空白对照组(均P<0.05),提示转染成功(图2A)。
转染0、2 4,4 8 h后,C C K-8实验示,si-CCAT2组、阴性对照组及空白对照组间OD450 nm值差异无统计学意义(P>0.05);转染后72、96 h,si-CCAT2组OD450 nm值低于阴性对照组及空白对照组(均P<0.05),阴性对照组与空白对照组间各时间点OD450 nm值差异均无统计学意义(均P>0.05)(图2B)。
2.3 敲低CCAT2表达对胃癌细胞凋亡的影响
流式细胞术检测结果示,si-CCAT2组细胞凋亡率为(15.7±1.1)%,阴性对照组凋亡率为(4.5±0.63)%,si-CCAT2组细胞凋亡率高于阴性对照组(均P<0.05)(图3)。

图3 流式细胞术检测胃癌细胞凋亡
Figure 3 Apoptosis of the gastric cancer cells detected by fl ow cytometry
2.4 敲低CCAT2表达对胃癌细胞迁移和侵袭的影响
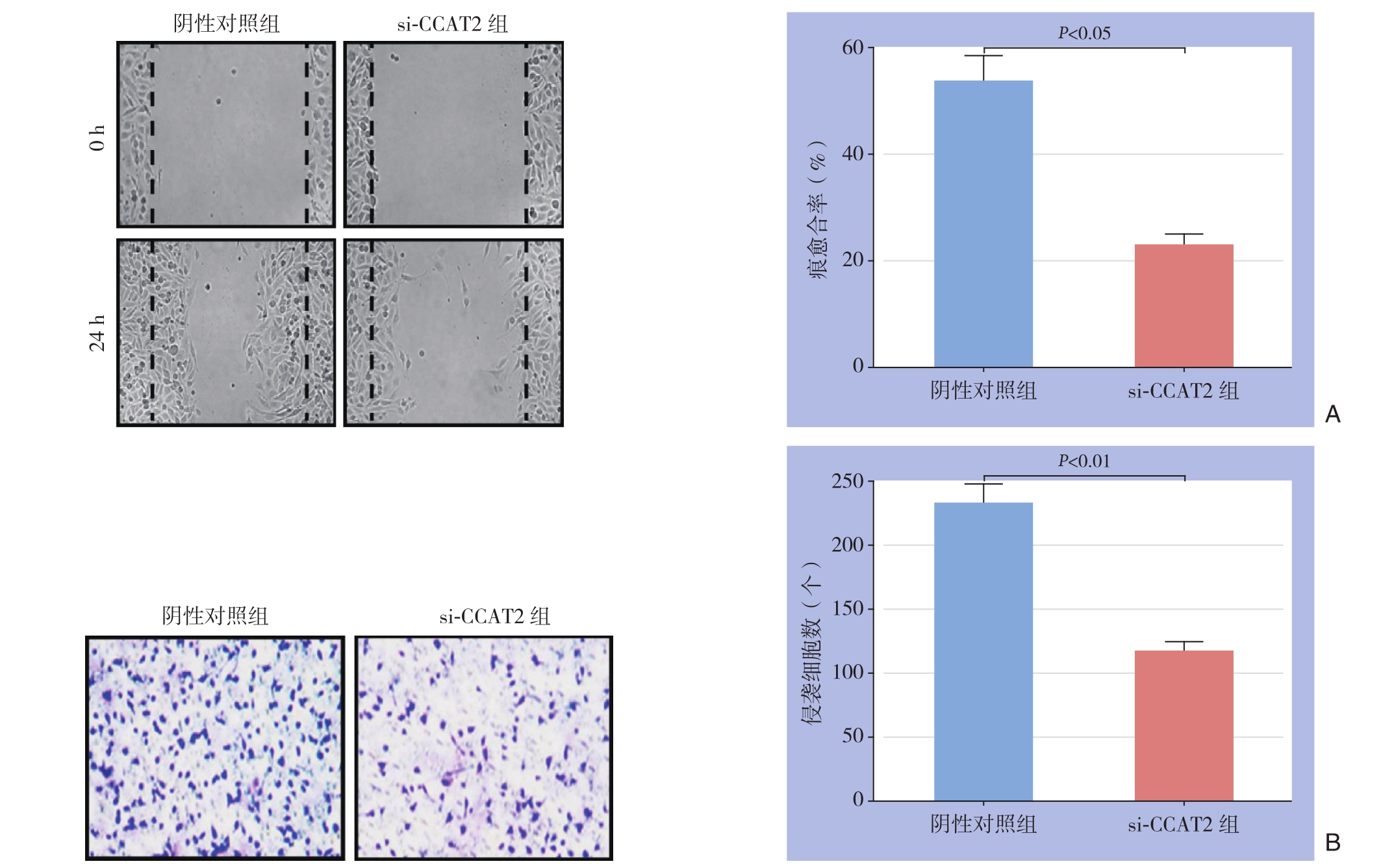
图4 迁移和侵袭能力检测结果 A:细胞划痕实验;B:Transwell实验
Figure 4 Migration and invasion ability analyses A: Cell scratch assay; B: Transwell assay
细胞划痕实验示,s i-C C A T 2组划痕愈合率为(2 2.9 1±2.1 6)%,阴性对照组为(5 3.5 7±4.8 1)%,s i-C C A T 2组划痕愈合率低于阴性对照组(P<0.0 5)(图4 A);Transwell实验示,200倍视野下,si-CCAT2组侵袭细胞数为(116.9±7.5)个,阴性对照组为(231.6±15.8)个,si-CCAT2组侵袭细胞数少于阴性对照组(P<0.01)(图4B)。
2.5 敲低CCAT2表达对胃癌细胞P53、caspase-8和Bcl-2蛋白表达的影响
Western blot示,si-CCAT2组与阴性对照组P53、caspase-8、Bcl-2及Bax蛋白相对表达量分别为(3.42±0.21)vs.(1.0±0.04)、(2.74±0.17)vs.(1.0±0.03)、(0.46±0.03)vs.(1.0±0.0 3)及(2.2 8±0.1 4)v s.(1.0±0.0 3);与阴性对照组比较,P 5 3、si-CCAT2组caspase-8、Bax蛋白表达上调,Bcl-2表达下调(均P<0.05)(图5)。

图5 Western blot检测凋亡相关蛋白的表达
Figure 5 Western blot analyses of the expressions of the apoptosis-associated proteins
3 讨 论
在我国,胃癌发病率和病死率在恶性肿瘤中排名第二[2]。目前,胃癌的治疗包括手术和放化疗,但大多数患者在确诊时已是进展期,预后较差,5年生存率低于30%[9-11]。
lncRNA广泛存在于基因组中,其没有开放阅读框,能调控基因转录、基因组印记和染色体修饰等生物学过程,对生物体发育、机体代谢和多种疾病有密切的关系[12]。lncRNA CCAT2在结直肠癌组织中高表达,且其高表达会影响到癌基因myc表达,且可促进肿瘤的生长和转移,研究[5]认为这可能是通过影响TCF7L2介导的转录调控促进了myc、miR-17-5p和miR-20a的表达来发挥作用,同时也发现CCAT2能够影响到Wnt信号通路。在非小细胞肺癌中,CCAT2表达上调,且其表达上调与远处转移有关,下调CCAT2表达后,可显著抑制癌细胞的增殖和侵袭能力[6]。在食管鳞癌中,CCAT2高表达与患者吸烟史相关[7]。本研究发现CCAT2在3种胃癌细胞系中高表达,这提示其在胃癌中具有类似于原癌基因的功能。本研究通过敲低CCAT2来检测其对胃癌细胞增殖和迁移能力的影响,发现敲低CCAT2可显著抑制胃癌细胞的增殖和侵袭能力,同时诱导胃癌细胞凋亡。在胆囊癌[13]中,CCAT2高表达,且其高表达与肿瘤大小、淋巴结侵犯、TNM分级及术后复发相关,敲低CCAT2表达可抑制增殖、迁移和侵袭,并诱导凋亡逆转上皮间质转化过程。胰腺导管腺癌[14]中, CCAT2在胰腺癌组织及细胞中高表达,且与预后差相关,敲低其表达可抑制细胞增殖和侵袭。在神经胶质瘤[15]中,CCAT2在神经胶质瘤组织及细胞中高表达,且与肿瘤大小及分级相关,高表达CCAT2的神经胶质瘤患者预后较低表达者差,沉默其表达可抑制神经胶质瘤生长、迁移和侵袭,并诱导早期凋亡,CCAT2可调节上皮间质转化相关基因表达。在前列腺癌中,敲低CCAT2表达可抑制细胞生长、迁移和侵袭,且是影响前列腺癌预后的独立影响因子[8]。在卵巢癌[16]中,沉默CCAT2表达可抑制卵巢癌细胞系HeLa增殖,并诱导凋亡。在肝细胞癌[17]中,CCAT2起着癌基因的功能,调节着细胞增殖、迁移和凋亡过程。
在细胞凋亡过程中,P53是著名的抑癌基因,可通过接收到细胞内的各种损伤和凋亡信号,诱导细胞进入凋亡通路;而下游的caspase-8是执行细胞凋亡的关键酶之一,是控制细胞凋亡进程的核心酶,通过接收上游凋亡信号,caspase-8能对多个蛋白裂解,阻滞细胞周期,诱导细胞凋亡,其通常是细胞凋亡水平的指标之一。Bcl-2能通过改变线粒体中的氧化还原水平和线粒体膜通透性来抑制细胞的凋亡,bax是Bcl-2家族最广泛的促凋亡蛋白,这些蛋白都是细胞凋亡过程中重要的标志物[18-24]。本研究对下游的凋亡标志性基因进行检测,发现P53、caspase-8和bax显著上调,而Bcl-2表达显著下调,这提示敲除CCAT2能激活凋亡信号通路,诱导癌细胞发生凋亡。
由于是体外研究,本研究尚存在一定的不足,比如:CCAT2在胃癌组织中的表达如何,与预后的关系如何,在动物体内实验如何,都值得进一步的研究,这也是后续的研究方向。
综上,本研究发现,CCAT2在胃癌细胞系中表达上调,敲低CCAT2的表达可抑制胃癌细胞增殖、迁移和侵袭,并诱导胃癌细胞凋亡,其机制可能与P53、caspase-8和bax上调及Bcl-2下调表达有关,这为更深一步的阐明胃癌的发生发展机制提供了新的视野。
参考文献
[1]Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J].CA Cancer J Clin, 2015, 65(2):87–108. doi: 10.3322/caac.21262.
[2]Chen W, Zheng R, Baade PD, et al. Cancer statistics in China,2015[J]. CA Cancer J Clin, 2016, 66(2):115–132. doi: 10.3322/caac.21338.
[3]Esteller M. Non-coding RNAs in human disease[J]. Nat Rev Genet,2011, 12(12):861–874. doi: 10.1038/nrg3074. Review.
[4]Gutschner T, Diederichs S. The hallmarks of cancer: a long noncoding RNA point of view[J]. RNA biology, 2012, 9(6):703–719.doi: 10.4161/rna.20481.
[5]Ling H, Spizzo R, Atlasi Y, et al. CCAT2, a novel noncoding RNA mapping to 8q24, underlies metastatic progression and chromosomal instability in colon cancer[J]. Genome Res, 2013,23(9):1446–1461. doi: 10.1101/gr.152942.112.
[6]Qiu M, Xu Y, Yang X, et al. CCAT2 is a lung adenocarcinomaspecif i c long non-coding RNA and promotes invasion of non-small cell lung cancer[J]. Tumour Biol, 2014, 35(6):5375–5380. doi:10.1007/s13277–014–1700-z.
[7]Wang J, Qiu M, Xu Y, et al. Long noncoding RNA CCAT2 correlates with smoking in esophageal squamous cell carcinoma[J].Tumour Biol, 2015, 36(7):5523–5528. doi: 10.1007/s13277–015–3220–x.
[8]Zheng J, Zhao S, He X, et al. The up-regulation of long noncoding RNA CCAT2 indicates a poor prognosis for prostate cancer and promotes metastasis by affecting epithelial-mesenchymal transition[J]. Biochem Biophys Res Commun, 2016, 480(4):508–514. doi: 10.1016/j.bbrc.2016.08.120.
[9]Brenner H, Rothenbacher D, Arndt V. Epidemiology of stomach cancer[J]. Methods Mol Biol, 2009, 472:467–477. doi:10.1007/978–1–60327–492–0_23.
[10]常敏, 张久聪, 周琴, 等. 胃癌流行病学研究进展[J]. 胃肠病学和肝病学杂志, 2017, 26(9):966–969. doi:10.3969/j.issn.1006–5709.2017.09.002.Chang M, Zhang JC, Zhou Q, et al. Research progress of clinical epidemiology of gastric cancer[J]. Chinese Journal of Gastroenterology and Hepatology, 2017, 26(9):966–969.doi:10.3969/j.issn.1006–5709.2017.09.002.
[11]Jiang YX. 多学科方法综合治疗胃癌[J]. 中国普通外科杂志, 2015, 24(10):1354–1355. doi:10.3978/j.issn.1005–6947.2015.10.002.Jiang YX. Multidisciplinary approach for the treatment of gastric cancer[J]. Chinese Journal of General Surgery, 2015, 24(10):1354–1355. doi:10.3978/j.issn.1005–6947.2015.10.002.
[12]Mercer TR, Dinger ME, Mattick JS. Long non-coding RNAs:insights into functions[J]. Nat Rev Genet, 2009, 10(3):155–159. doi:10.1038/nrg2521.
[13]Xu Y, Yao Y, Qin W, et al. Long non-coding RNA CCAT2 promotes cholangiocarcinoma cells migration and invasion by induction of epithelial-to-mesenchymal transition[J]. Biomed Pharmacother,2018, 99:121–127. doi: 10.1016/j.biopha.2018.01.061.
[14]Cai Y, Li X, Shen P, et al. CCAT2 is an oncogenic long non-coding RNA in pancreatic ductal adenocarcinoma[J]. Biol Res, 2018,51(1):1. doi: 10.1186/s40659–017–0149–0.
[15]Zeng J, Du T, Song Y, et al. Knockdown of Long Noncoding RNA CCAT2 Inhibits Cellular Proliferation, Invasion, and Epithelial-Mesenchymal Transition in Glioma Cells[J]. Oncol Res, 2017,25(6):913–921. doi: 10.3727/096504016X14792098307036.
[16]Wu L, Jin L, Zhang W, et al. Roles of Long Non-Coding RNA CCAT2 in Cervical Cancer Cell Growth and Apoptosis [J]. Med Sci Monit, 2016, 22:875–879.
[17]Zhou N, Si Z, Li T, et al. Long non-coding RNA CCAT2 functions as an oncogene in hepatocellular carcinoma, regulating cellular proliferation, migration and apoptosis[J]. Oncol Lett, 2016,12(1):132–138.
[18]Sheikh BY, Sarker MMR, Kamarudin MNA, et al. Antiproliferative and apoptosis inducing effects of citral via p53 and ROS-induced mitochondrial-mediated apoptosis in human colorectal HCT116 and HT29 cell lines[J]. Biomed Pharmacother, 2017, 96:834–846. doi:10.1016/j.biopha.2017.10.038.
[19]Zhang P, Huang C, Wang W, et al. Harmine Hydrochloride Triggers G2 Phase Arrest and Apoptosis in MGC-803 Cells and SMMC-7721 Cells by Upregulating p21, Activating Caspase-8/Bid, and Downregulating ERK/Bad Pathway[J]. Phytother Res, 2016,30(1):31–40. doi: 10.1002/ptr.5497.
[20]Wang L, Yang JK, Kabaleeswaran V, et al. The Fas-FADD death domain complex structure reveals the basis of DISC assembly and disease mutations[J]. Nat Struct Mol Biol, 2010, 17(11):1324–1329.doi: 10.1038/nsmb.1920.
[21]Tait SW, Green DR. Mitochondrial regulation of cell death[J]. Cold Spring Harb Perspect Biol, 2013, 5(9):pii: a008706. doi: 10.1101/cshperspect.a008706.
[22]McIlwain DR, Berger T, Mak TW. Caspase functions in cell death and disease[J]. Cold Spring Harb Perspect Biol, 2013, 5(4):a008656.doi: 10.1101/cshperspect.a008656.
[23]Raghav PK, Verma YK, Gangenahalli GU. Molecular dynamics simulations of the Bcl-2 protein to predict the structure of its unordered fl exible loop domain[J]. J Mol Model, 2012, 18(5):1885–1906. doi: 10.1007/s00894–011–1201–6.
[24]Czabotar PE, Westphal D, Dewson G, et al. Bax crystal structures reveal how BH3 domains activate Bax and nucleate its oligomerization to induce apoptosis[J]. Cell, 2013, 152(3):519–531.doi: 10.1016/j.cell.2012.12.031.
