深静脉血栓(deep venous thrombosis,DVT)通常指下肢或骨盆深静脉系统发生的血栓,不但导致下肢血液循环障碍,还可因血栓脱落随血流循环进入肺动脉及其分支导致肺血栓栓塞症(pulmonary thromboembolism,PTE),是PTE的主要血栓来源[1],两者统称为静脉血栓栓塞症(venous thromboembolism,VTE),往往导致严重临床事件。VTE的30 d全因病死率为9%~11%,3个月全因病死率为8.6%~17%[2-3]。恶性肿瘤本身即为VTE的高危因素,癌症患者VTE发生风险是非癌症患者的4~6.5倍[4-5]。发生VTE的肿瘤相关危险因素包括诊断时间、肿瘤部位、组织学分级和病理分期/转移等[6]。
腹膜癌(peritoneal carcinomatosis,PC)是指在腹膜上发生和/或发展的一类恶性肿瘤,包括原发性和继发性两种,前者的典型代表是原发性腹膜癌和腹膜恶性间皮瘤,后者的典型代表是各种肿瘤所形成的腹膜癌转移癌,如来自胃肠道肿瘤和妇科肿瘤的腹膜转移癌,现在观点认为腹膜癌属于区域性转移[7],并发展了以肿瘤细胞减灭术(cytoreductive surgery,CRS)加腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)为主的综合治疗策略。腹膜癌患者具有较高VTE风险,为提高围手术期安全性,避免致死性PTE的发生,需特别注意DVT的风险评估、筛查与防治。
临床上已广泛开展Wells评分及D-二聚体(D-dimer,D-D)预测下肢DVT[8-9],主要是利用其排除诊断价值。但在癌症患者中其安全性及有效性均受到怀疑[10]。本研究通过对241例腹膜癌患者进行回顾性分析,探讨D-D联合凝血酶时间(thrombin time,TT)对腹膜癌患者下肢DVT的排除诊断价值,并比较不同Wells风险分层中的有效性,旨在确立更为客观、安全、有效、经济的癌症患者DVT预测方法。
1 资料与方法
1.1 临床资料
研究对象为2015年5月—2017年5月首都医科大学附属北京世纪坛医院腹膜肿瘤外科收治的腹膜癌患者。主要纳入标准为病理确诊为腹膜癌、接受CRS+HIPEC手术治疗者,主要排除标准为入院前已确诊为DVT并接受药物抗凝治疗或临床病理资料不完整者,共241例入选。患者均签署知情同意,研究方案经医院伦理委员会批准。
1.2 手术相关检查
患者均接受术前常规检查,包括血液学检查、心肺功能检查、胸部高分辨CT、全腹增强CT+三维重建、全消化道碘水造影、全身骨显像,经评估所有患者均可耐受手术,并排除肝肺骨等远处转移。
1.3 血栓相关事件检查
患者入院后进行Wells评分、凝血四项、纤维蛋白(原)降解产物(fibrin/fibrinogen degradation products,FDP)、血D-D检测,并进行下肢多普勒静脉超声检查。
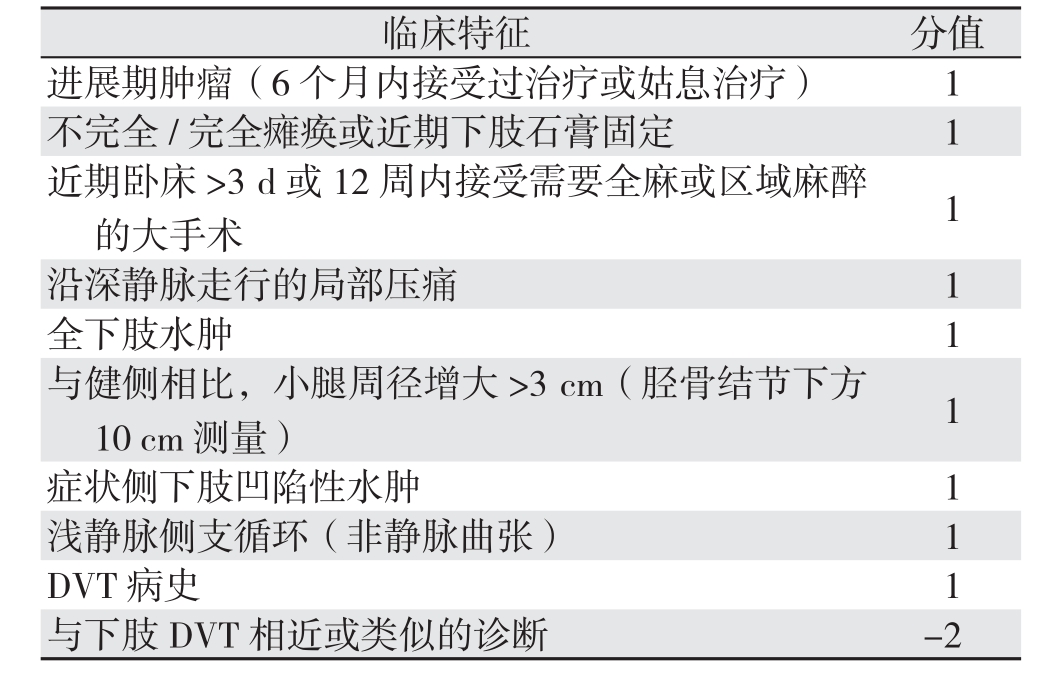
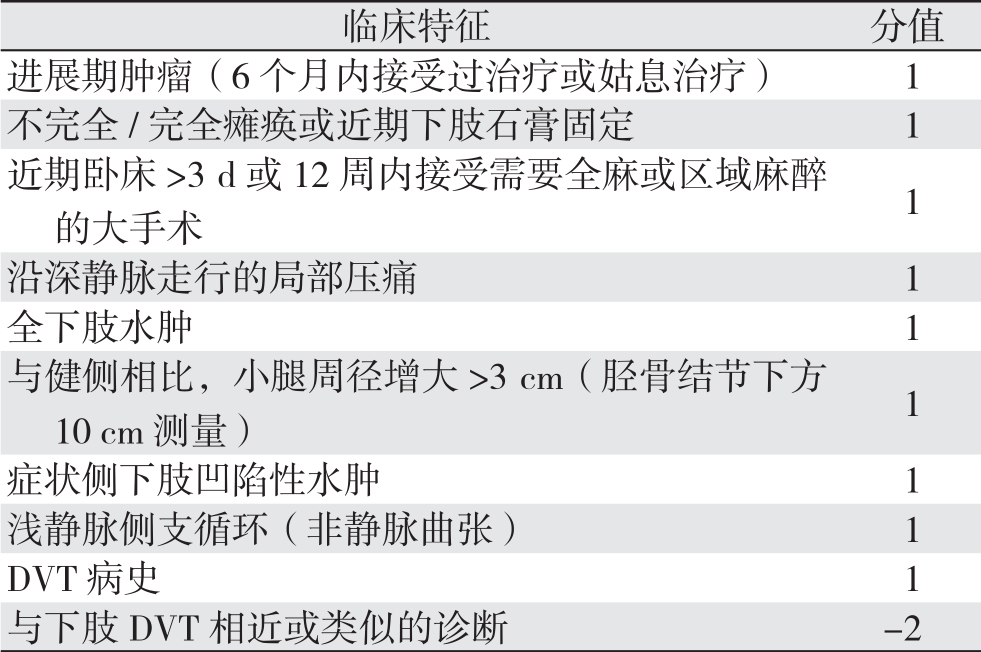
1.3.1 Wells评分[11] 入院当天由主治医师根据Wells评分标准对患者进行DVT诊断可能性评估,>1分为高度可能,≤1分为低度可能(表1)。
表1 Wells评分标准
Table 1 Wells creteria
1.3.2 凝血指标检测 患者入院后用3.2%枸橼酸钠抗凝管采集空腹静脉血2.7 mL,采用TOP全自动凝血分析仪(ACL-TOP,IL,美国国家仪器实验室公司)以及配套试剂测定凝血四项、FDP(参考值:0~5 μg/mL)及血D-D水平(定量检测,免疫比浊法,参考值<243 ng/mL DDU)。凝血四项包括:凝血酶原时间(prothrombin time,PT-s,参考值 8.8~11.8 s)、凝血酶原活动度(prothrombin activity,PT%,参考值 80%~130%)、部分凝血 活 酶 时 间(activated partial thromboplastin time,APTT,参考值 24~37 s)、国际标准化比值(international normalized ratio,INR,参考值0.8~1.2)、TT(参考值 11~17.8 s)、纤维蛋白原(fibrinogen,FIB,参考值 2~4.5 g/L)。
1.3.3 下肢多普勒静脉超声 目前临床上多采用无创的下肢静脉超声替代有创的静脉造影诊断DVT,对下肢近端静脉血栓的诊断灵敏度为90%,特异度为95%,阳性预测值为97%,阴性预测值为98%[12]。因此,本研究采用下肢静脉超声诊断临床DVT,所用设备为Philips iE 33彩色多普勒超声诊断系统,采用L11-3高频探头,主要监测指标包括:双股静脉、腘静脉、胫前静脉、胫后静脉、腓静脉及小腿肌间静脉的压缩性、静脉腔宽度、腔内回声情况、CDFI血流充盈情况。
1.4 CRS+HIPEC主要过程
CRS+HIPEC由腹膜癌治疗专科团队实施。在腹腔探查后,根据标准化评估及记录系统,评估腹膜癌指数(peritoneal carcinomatosis index,PCI)[13],依照Sugarbaker制定的CRS手术程序[14]切除肿瘤侵犯的腹膜、原发肿瘤及临近受侵组织、淋巴结清扫,进行肿瘤细胞减灭程度(completeness of cytoreduction,CC)评分[15]。CRS完成后进行开放式HIPEC,每种药物加入3 L生理盐水中,加热至(43±0.5)℃ ,以400 mL/min的流速持续灌注,每种药物持续30 min。HIPEC药物方案包括:多西他赛120 mg+顺铂120 mg,或丝裂霉素30 mg+顺铂120 mg,或多西他赛120 mg+丝裂霉素30 mg,或单药丝裂霉素30 mg、多西他赛120 mg。
1.5 围手术期预防DVT措施
对术前经超声排除DVT患者,术中术后常规采用主被动肢体活动+机械措施预防DVT发生[16]。对术前确诊DVT患者,根据出血风险,采用皮下注射低分子肝素治疗。
1.6 随访
所有患者均随访至手术后3个月,记录症状性VTE事件。
1.7 诊断试验评价
诊断试验评价指标:阳性预测值、阴性预测值及漏诊率。
1.8 统计学处理
采用SPSS 23.0软件进行统计学分析,计量资料用平均值±标准差(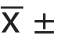 s)表示,计数资料用例数(百分数)表示。对各变量进行正态性检验,对符合正态分布的变量平均值比较采用两独立样本t检验,不符合正态分布的变量平均值比较采用秩和检验。率比较采用交叉表χ2检验。P<0.05为差异有统计学意义。最佳临界值根据ROC曲线(receiver operating characteristic curve)选择Youden指数最大的诊断值确定。
s)表示,计数资料用例数(百分数)表示。对各变量进行正态性检验,对符合正态分布的变量平均值比较采用两独立样本t检验,不符合正态分布的变量平均值比较采用秩和检验。率比较采用交叉表χ2检验。P<0.05为差异有统计学意义。最佳临界值根据ROC曲线(receiver operating characteristic curve)选择Youden指数最大的诊断值确定。
2 结 果
2.1 患者的主要临床病理特征
241例腹膜癌患者,男105例(43.6%)、女136例(56.4%);年龄21~81岁,中位年龄54岁;原发性腹膜癌6例(2.5%)、恶性间皮瘤21例(8.7%),继发性腹膜癌依次为:腹膜假黏液瘤75例(31.1%)、结直肠癌来源71例(29.5%)、卵巢癌来源38例(15.8%)、胃癌来源17例(7.0%)、其他消化系统肿瘤来源6例(2.5%)、其他女性生殖系统肿瘤来源5例(2.1%)、脐尿管癌来源2例(0.8%)。PCI评分可用238例,范围1~39分,中位22分,其中≤20分113例(47.5%),>20分125例(52.5%)。术后CC评分0~1分共143例(60.1%),2~3分共95例(39.9%)。17例(7.1%)患者既往有动脉或静脉血栓病史(表2)。
表2 241例患者主要临床病理特征
Table 2 The general clinicopathologic features of the 241 patients
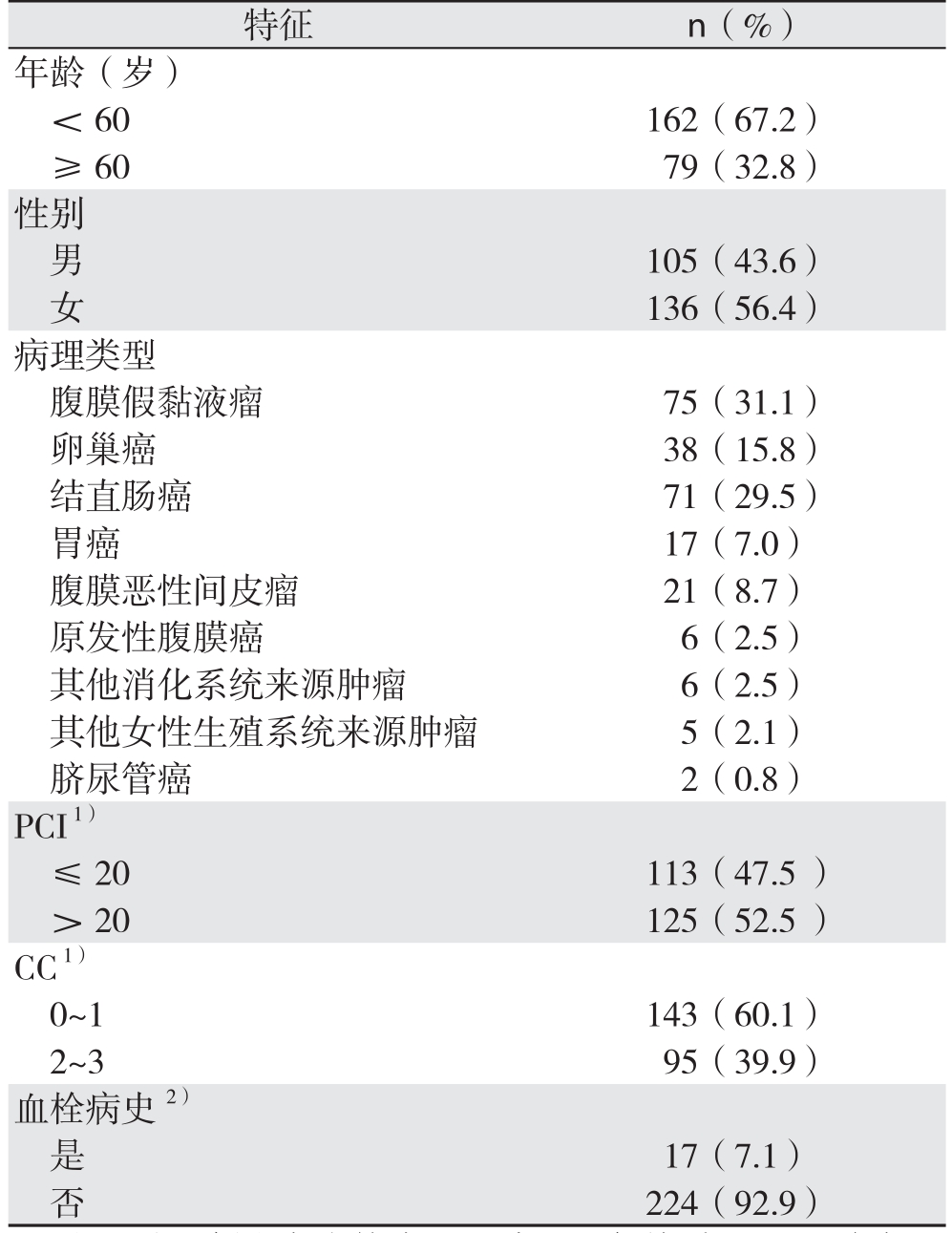
注:1)3例患者为外院CRS术后,仅接受HIPEC治疗,无法评估PCI及CC;2)包括动脉及静脉血栓病史
Note: 1) PCI and CC cannot be evaluated in 3 patients who underwent CRS in other hospital only received HIPEC; 2) Including history of arterial and venous thrombus
特征 n(%)年龄(岁)< 60 162(67.2)≥ 60 79(32.8)性别男105(43.6)女136(56.4)病理类型腹膜假黏液瘤 75(31.1)卵巢癌 38(15.8)结直肠癌 71(29.5)胃癌 17(7.0)腹膜恶性间皮瘤 21(8.7)原发性腹膜癌 6(2.5)其他消化系统来源肿瘤 6(2.5)其他女性生殖系统来源肿瘤 5(2.1)脐尿管癌 2(0.8)PCI 1)≤ 20 113(47.5 )> 20 125(52.5 )CC 1)0~1 143(60.1)2~3 95(39.9)血栓病史2)是17(7.1)否224(92.9)
2.2 诊断流程及患者预后
2.2.1 患者VTE发生情况 241例患者中经下肢静脉超声确诊DVT共21例,发生率为8.7%。其中股总静脉血栓形成1例,腓静脉血栓形成3例,胫后静脉血栓形成2例,小腿肌间静脉血栓形成12例,腘静脉合并肌间静脉血栓形成2例,胫后静脉合并肌间静脉血栓形成1例。所有患者术后均恢复良好顺利出院。随防至术后3个月,均未出现症状性VTE事件。随访率100%。
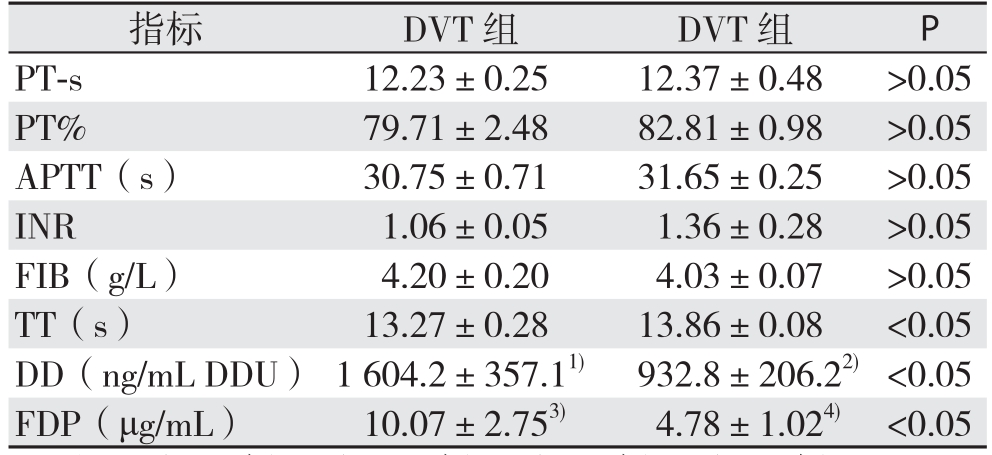
2.2.2 DVT组与非DVT组间凝血指标差异 241例患者凝血四项结果可用241例。21例DVT患者中D-D结果可用19例,FDP结果可用14例。220例非DVT患者中D-D结果可用161例,FDP结果可 用 98例。DVT组 与 非 DVT组 比 较,PT-s、PT%、APTT、INR、FIB差异均无统计学意义(均P>0.05);TT、FDP、D-D差异均有统计学意义(均P<0.05)(表 3)。
表3 DVT组与非DVT组凝血指标的比较( ±s)
±s)
Table 3 Comparison of the coagulation variables between DVT group and non-DVT group ( ±s)
±s)
注:1)19例;2)161例;3)14例;4)98例
Note: 1) 19 cases; 2) 161 cases; 3) 14 cases; 4) 98 cases
指标 DVT组 DVT组 P PT-s 12.23±0.25 12.37±0.48 >0.05 PT% 79.71±2.48 82.81±0.98 >0.05 APTT(s) 30.75±0.71 31.65±0.25 >0.05 INR 1.06±0.05 1.36±0.28 >0.05 FIB(g/L) 4.20±0.20 4.03±0.07 >0.05 TT(s) 13.27±0.28 13.86±0.08 <0.05 DD(ng/mL DDU) 1 604.2±357.11) 932.8±206.22) <0.05 FDP(μg/mL) 10.07±2.753) 4.78±1.024) <0.05
2.2.3 Wells评估结果 Wells评分高度可能共29例,其中下肢DVT 12例;低度可能共212例,其中下肢DVT 9例。Wells高度可能组中下肢DVT发生率明显高于低度可能组(41.4% vs. 4.2%,P<0.01)。Wells评分诊断下肢DVT的阳性预测值为41.4%,阴性预测值为95.8%,漏诊率为42.9%。
2.2.4 D-D排除下肢DVT的诊断效能 241例腹膜癌患者中D-D结果可用共180例。D-D阳性共124例,其中下肢DVT共18例;D-D阴性共56例,其中下肢DVT共1例。D-D诊断下肢DVT的阳性预测值为14.5%,阴性预测值为98.2%,漏诊率为5.3%(P=0.01)。
2.2.5 ROC曲线确定TT最佳临界值 以排除下肢DVT为诊断目的,根据241例腹膜癌TT检测结果及下肢静脉超声结果绘制ROC曲线(图1)。曲线下面积(area under the ROC curve,AUC)为0.642,确定Youden指数最大(0.235)时的TT临界值为13.55 s,即≤ 13.55 s为阳性,阳性预测值为10.6%,阴性预测值为87.2%,漏诊率33.3%。
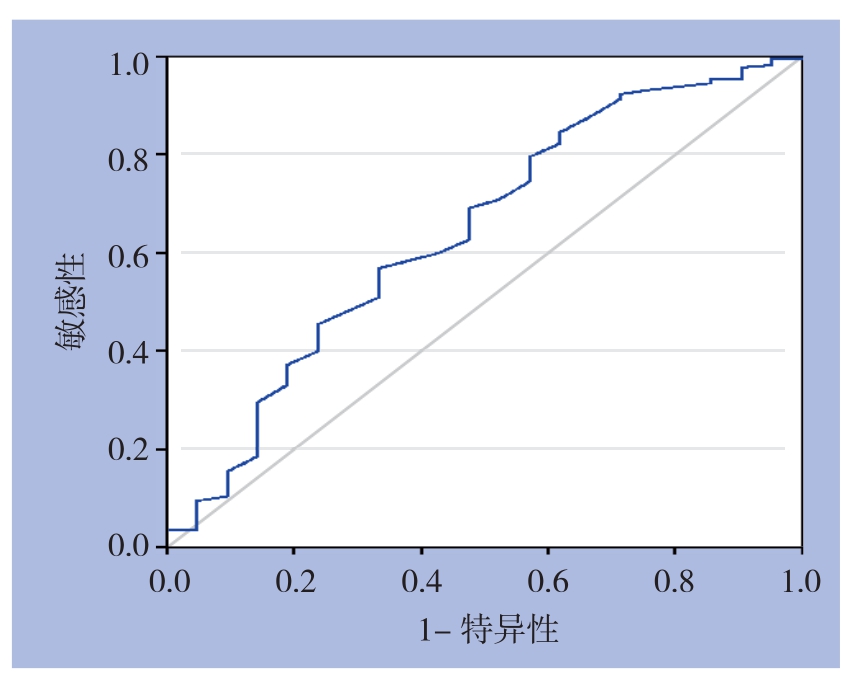
图1 腹膜癌患者TT的ROC曲线
Figure 1 ROC curve of TT in patients with peritoneal carcinomatosis
2.2.6 D-D联合TT排除下肢DVT的诊断效能 根据临界值,设定TT≤13.55 s为阳性,D-D≥243 ng/mL为阳性。在D-D联合TT诊断中,D-D及TT均为阳性则认定为联合试验强阳性(++),D-D及TT任一项为阳性则认定为联合试验弱阳性(+),两者均为阴性则认定为联合试验阴性(-)。180例腹膜癌患者中,联合试验强阳性共65例,其中下肢DVT 13例;弱阳性76例,其中下肢DVT 6例;阴性39例,其中下肢DVT 0例。D-D联合TT诊断下肢DVT的阳性预测值为13.5%,阴性预测值为100%,漏诊率为0(P=0.015)(表4)。
表4 D-D联合TT排除下肢DVT的诊断效能
Table 4 Diagnostic eき ciency of the combined detection of D-D and TT for exclusion of DVT of the lower limbs
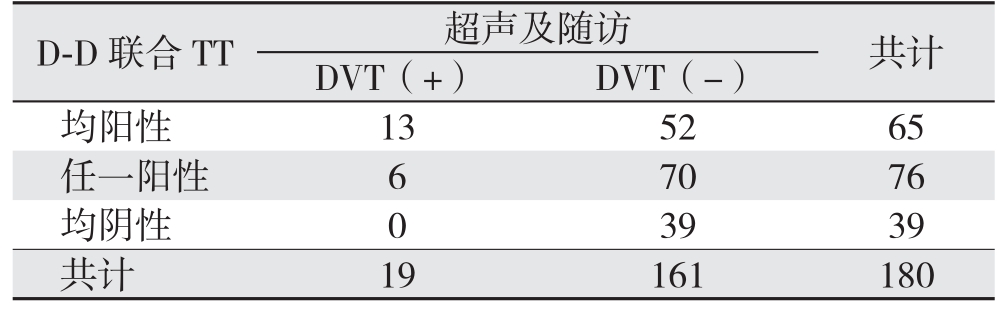
D-D联合TT 超声及随访 共计DVT(+) DVT(-)均阳性 13 52 65任一阳性 6 70 76均阴性 0 39 39共计 19 161 180
180例腹膜癌患者中,Wells评分高度可能24例,其中D-D联合TT强阳性11例,下肢DVT 7例;弱阳性12例,下肢DVT 3例;阴性1例,下肢DVT 0例。Wells评分低度可能156例,其中联合试验强阳性54例,下肢DVT 6例;弱阳性64例,下肢DVT 3例;阴性38例,下肢DVT 0例。D-D联合TT在Wells评分高度可能组中阳性预测值为43.5%,低度可能组中阳性预测值为7.6%,在两组中阴性预测值均为100%,漏诊率为0。
3 讨 论
VTE是恶性肿瘤患者常见的并发症之一,是仅次于肿瘤进展的第2位直接死因[17]。肿瘤患者VTE发生率为1.6%[18],并以每年4.0%速度增长[19]。腹膜癌患者DVT发生率为0.9%~11.1%,PTE发生率为0.5%~12.8% [16]。Virchow经典理论中的3大因素(即静脉淤滞,高凝状态和血管壁损伤)[20]在癌症相关VTE的发生过程中都发挥作用,包括活动减少、化疗、手术介导的内皮损伤和癌症诱发的高凝状态。直接凝血途径激活、诱导炎症反应,抑制纤维蛋白溶解活性均可导致癌症患者的高凝状态[6]。
在DVT形成过程中高凝状态理论上会反映为PT、APTT、INR、TT缩短,继发性纤溶状态则会反映为FIB、FDP及D-D升高[21]。但对于DVT早期诊断,常规检测的凝血四项通常被认为并不敏感。本研究中发现,腹膜癌患者中伴有下肢DVT者较无DVT者PT、APTT、INR、TT缩短,FIB、FDP及D-D升高,符合理论预期,但仅TT、FDP及D-D具有统计学差异(均P<0.05)。通过反映高凝状态的TT及继发性纤溶状态的D-D来诊断腹膜癌患者DVT具有理论基础。
因腹膜癌患者伴或不伴DVT检测TT均值均在正常参考值范围内,故进一步通过ROC曲线确定腹膜癌患者中TT诊断DVT的最佳临界值为13.55 s,对DVT诊断的阴性预测值为87.2%,漏诊率33.3%。显然,在腹膜癌患者中单纯应用TT排除下肢DVT诊断效能仍欠佳。
在纤溶指标中D-D由于其只发生于继发性纤溶中[22],是继发性纤溶亢进的敏感和特异指标,临床上用于DVT的诊断。但D-D在临床上受多种影响因素,如肿瘤、炎症、出血、创伤、外科手术等都会使D-D升高,故其阳性预测价值低,主要用来进行排除PTE及DVT诊断[1]。在肿瘤患者中,D-D升高与肿瘤分期相关,原因可能为肿瘤的局部侵袭和远处转移主要依赖于新生血管形成,此过程中纤维蛋白交联增加然后再降解导致D-D增加[23]。本研究中也观察到无下肢DVT腹膜癌患者血D-D水平升高现象,平均水平为(932.8±206.2)ng/mL DDU,这符合腹膜癌作为区域性转移的肿瘤学特点。D-D在腹膜癌患者中的阳性预测值14.5%,阴性预测值98.2%。与文献报道相似,D-D对腹膜癌患者下肢DVT的阴性预测价值均远远大于阳性预测价值,漏诊率为5.3%。
在本研究中,采用反映继发纤溶状态的D-D联合反映高凝状态的TT诊断腹膜癌患者的DVT,设定判断标准:D-D及TT均为阳性为联合试验强阳性(++),D-D及TT任一项为阳性为联合试验弱阳性(+),强阳性及弱阳性均为阳性;D-D及TT均为阴性为联合试验阴性(-)。联合试验阴性检出率为21.7%,其中DVT发生率为0。联合试验的阳性预测值为13.5%,阴性预测值为100%,漏诊率为0。D-D联合TT检测对腹膜癌患者DVT诊断具有很高的阴性排除价值,漏诊率低,安全性高。
目前临床上广泛采用Wells评分联合D-D来排除下肢DVT[24]。Wells评分常采用以下两种分级方法:三层分级(≤0分,低度;1~2分,中度;≥3分,高度),二层分级(≤1分,低度可能;>1分,高度可能)[11]。Wells评分低于2分,且D-D阴性时(SimpliRED test阴性或者IL-test<200 μg/L),仅0.9%(95% CI=0.1%~3.3%)患者发生DVT,两者联合应用可安全排除DVT,而无需进一步行超声检查[25]。但在癌症患者中,D-D联合Wells评分的安全性及有效性却受到怀疑。Geersing等[10]对13个研究(n=10 002)进行Meta分析,结果显示在癌症患者中,Wells评分≤1+D-D阴性(<500 μg/L FEU)检出率仅为9.1%,但其中DVT的发生率却达2.2%。D-D单位可通过下述公式进行转换:FEU=2×DDU[26]。
通过对腹膜癌患者Wells评分进行DVT诊断可能性分层后,采用D-D联合TT进行DVT诊断,在高度可能组中联合试验的阳性预测值为43.5%,低度可能组中为7.6%,而阴性预测值在两组中均为100%,漏诊率为0。以上结果表明,D-D联合TT检测具有很强的排除下肢DVT诊断价值,安全性及有效性均较高,不依赖于Wells评分,相较目前广泛采用的Wells评分联合D-D诊断DVT方法,具有更客观的优点。
综上所述,腹膜癌患者就诊时DVT的发生率可达8.7%,D-D联合TT检测对腹膜癌患者排除DVT诊断有很强的阴性预测价值,且不依赖于Wells评分,更为客观,联合试验阴性(D-D<243 ng/mL DDU且TT>13.55 s)者可不接受下肢血管超声检查而安全排除下肢DVT,可减少此类患者的医疗花费。由于本研究为回顾性单中心研究,该结论有待于更大样本量的前瞻性研究进一步证实。
参考文献
[1] 中华医学会心血管病学分会肺血管病学组. 急性肺栓塞诊断与治疗中国专家共识(2015)[J]. 中华心血管病杂志, 2016, 44(3):197–211. doi:10.3760/cma.j.issn.0253–3758.2016.03.005.Pulmonary Circulation and Right Ventricular Function Assembly of Chinese Society of Cardiology of Chinese Medical Association. Chinese expert consensus on the diagnosis and management of acute pulmonary embolism (2015)[J]. Chinese Journal of Cardiology, 2016, 44(3): 197–211. doi:10.3760/cma.j.issn.0253–3758.2016.03.005.
[2] Laporte S1, Mismetti P, Décousus H, et al. Clinical predictors for fatal pulmonary embolism in 15,520 patients with venous thromboembolism: findings from the Registro Informatizado de la Enfermedad TromboEmbolica venosa (RIETE) Registry[J].Circulation, 2008, 117(13): 1711–1716. doi: 10.1161/CIRCULATIONAHA.107.726232.
[3] Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism:clinical outcomes in the International Cooperative Pulmonary Embolism Registry(ICOPER)[J]. Lancet. 1999, 353(9162):1386–1389.
[4] Walker AJ, Card TR, West J, et al. Incidence of venous thromboembolism in patients with cancer - a cohort study using linked United Kingdom databases[J]. Eur J Cancer, 2013, 49(6):1404–1413. doi: 10.1016/j.ejca.2012.10.021.
[5] Heit JA, Silverstein MD, Mohr DN, et al. Risk factors for deep vein thrombosis and pulmonary embolism: a population-based casecontrol study[J]. Arch Intern Med, 2000, 160(6): 809–815.
[6] Ay C, Pabinger I, Cohen AT. Cancer-associated venous thromboembolism: Burden, mechanisms, and management[J].Thromb Haemost, 2017, 117(2): 219–230. doi: 10.1160/TH16–08–0615.
[7] 李雁. 腹膜癌研究之我见[J]. 中国肿瘤临床, 2012, 39(22): 1685–1686. doi:10.3969/j.issn.1000–8179.2012.22.001.Li Y. My view on studies of peritoneal carcinomatosis[J].Chinese Journal of Clinical Oncology 2012, 39(22): 1685–1686.doi:10.3969/j.issn.1000–8179.2012.22.001.
[8] Wells PS, Anderson DR, Bormanis J, et al. Value of assessment of pretest probability of deep-vein thrombosis in clinical management[J]. Lancet, 1997, 350(9094): 1795–1798. doi: 10.1016/S0140–6736(97)08140–3.
[9] Di Nisio M, Squizzato A, Rutjes AW, et al. Diagnostic accuracy of D-dimer test for exclusion of venous thromboembolism: a systematic review[J]. J Thromb Haemost, 2007, 5(2): 296–304. doi:10.1111/j.1538–7836.2007.02328.x
[10] Geersing GJ, Zuithoff NP, Kearon C, et al. Exclusion of deep vein thrombosis using the Wells rule in clinically important subgroups:individual patient data meta-analysis[J]. BMJ, 2014, 348:g1340.doi: 10.1136/bmj.g1340.
[11] Wells PS. The role of qualitative D-dimer assays, clinical probability, and noninvasive imaging tests for the diagnosis of deep vein thrombosis and pulmonary embolism[J]. Semin Vasc Med,2005, 5(4): 340–350. doi: 10.1055/s-2005–922479.
[12] Kearon C, Ginsberg JS, Hirsh J. The role of venous ultrasonography in the diagnosis of suspected deep venous thrombosis and pulmonary embolism[J]. Ann Intern Med, 1998, 129(12): 1044–1049.
[13] Jacquet P, Sugarbaker PH. Clinical research methodologies in diagnosis and staging of patients with peritoneal carcinomatosis[J].Cancer Treat Res, 1996, 82:359–374.
[14] Sugarbaker PH. Peritonectomy procedures[J]. Cancer Treat Res,2007, 134:247–264.
[15] Sugarbaker PH. Cytoreductive surgery and peri-operative intraperitoneal chemotherapy as a curative approach to pseudomyxoma peritonei syndrome[J]. Eur J Surg Oncol, 2001,27(3): 239–243. doi: 10.1053/ejso.2000.1038.
[16] 彭开文, 张倩, 刘九洋, 等. 肿瘤细胞减灭加腹腔热灌注化疗术后静脉血栓栓塞症的预防[J]. 中国肿瘤临床, 2017, 44(8): 384–389.doi:10.3969/j.issn.1000–8179.2017.08.421.Peng KW, Zhang Q, Liu JY, et al. Venous thromboembolism prevention for peritoneal carcinomatosis patients treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy[J]. Chinese Journal of Clinical Oncology, 2017,44(8): 384–389. doi:10.3969/j.issn.1000–8179.2017.08.421.
[17] Khorana AA, Francis CW, Culakova E, et al. Thromboembolism is a leading cause of death in cancer patients receiving outpatient chemotherapy[J]. J Thromb Haemost, 2007, 5(3): 632–634. doi:10.1111/j.1538–7836.2007.02374.x.
[18] Blom JW, Doggen CJ, Osanto S, et al. Malignancies, prothrombotic mutations, and the risk of venous thrombosis[J]. JAMA, 2005,293(6): 715–722. doi: 10.1001/jama.293.6.715.
[19] Trinh VQ, Karakiewicz PI, Sammon J, et al. Venous thromboembolism after major cancer surgery: temporal trends and patterns of care[J]. JAMA Surg, 2014, 149(1):43–49. doi:10.1001/jamasurg.2013.3172.
[20] Kyrle PA, Eichinger S. Is Virchow's triad complete?[J]. Blood,2009, 114(6):1138–1139. doi: 10.1182/blood-2009–05–223511.
[21] 高阳, 芦琳, 张甦颖. 深静脉血栓形成患者凝血、抗凝、纤溶系统功能改变及临床意义[J]. 中国交通医学杂志, 2006, 20(2):184–185. doi:10.3969/j.issn.1006–2440.2006.02.032.Gao Y, Lu L, Zhang SY. The Study on the Coagulant, Anticoagulant and Fibrinolytic Function change in Patients with Deep Venous Thrombosis[J]. Medical Journal of Communications, 2006, 20(2):184–185. doi:10.3969/j.issn.1006–2440.2006.02.032.
[22] 董怀平, 李庆敏. D-二聚体的研究进展[J]. 国际检验医学杂志, 2006, 27(12):1134–1135. doi:10.3969/j.issn.1673–4130.2006.12.032.Dong HP, Li QM. Research progress of D-dimer[J]. International Journal of Laboratory Medicine 2006, 27(12): 1134–1135.doi:10.3969/j.issn.1673–4130.2006.12.032.
[23] Tekeşin K, Bayrak S, Esatoğlu V, et al. D-Dimer and carcinoembryonic antigen levels: useful indicators for predicting the tumor stage and postoperative survival[J]. Gastroenterol Res Pract,2016, 2016:4295029. doi: 10.1155/2016/4295029.
[24] Bates SM, Jaeschke R, Stevens SM, et al. Diagnosis of DVT:antithrombotic therapy and prevention of thrombosis, 9th ed:American college of chest physicians evidence-based clinical practice guidelines[J]. Chest, 2012, 141(2 Suppl):e351S-418S.doi: 10.1378/chest.11–2299.
[25] Wells PS, Anderson DR, Rodger M, et al. Evaluation of D-dimer in the diagnosis of suspected deep-vein thrombosis[J]. N Engl J Med,2003, 349(13): 1227–1235. doi: 10.1056/NEJMoa023153.
[26] Kassim NA, Farid TM, Pessar SA, et al. Performance Evaluation of Different d-Dimer Cutoffs in Bedridden Hospitalized Elderly Patients[J]. Clin Appl Thromb Hemost, 2017, 23(8): 998–1004. doi:10.1177/1076029616665165.