原发性肝癌(primary liver cancer,PLC,以下简称肝癌)是发生于肝实质细胞或肝内胆管上皮细胞的恶性肿瘤,具有高度恶性、隐匿发病、浸润性强、预后不良等特点[1]。根据2015年中国癌症统计数据提示,肝癌的发病率和病死率分别位于恶性肿瘤第4位和第3位[2]。近年来,随着数字化技术的发展,与医学影像技术的相互融合,肝癌的早期诊断和治疗有明显进步[3]。三维重建(3D reconstruction)是对三维物体建立适合计算机表示和处理的数学模型,在计算机环境下对其进行处理、操作和分析其性质的基础,也是在计算机中建立表达客观世界的虚拟现实的关键技术[4]。肝癌治疗理念和思维模式日益更新,治疗领域的特点是多个学科、多种方法共存,手术治疗是提高肝癌远期生存率最重要的手段,利用计算机进行三维重建获得虚拟的肝脏三维影像指导肝癌精准肝切除术是目前治疗肝癌的一种新型技术体系[5-6]。
与常规CT检查相比,Myrian肝脏三维重建软件能更形象、直观、多角度地显示肝脏的解剖、脉管系统的走行、肿瘤的位置及其与周围血管的相互关系[7];通过术前行肝脏三维重建、肝脏体积的测量及肝切除术的模拟,能给术者提供准确的手术切除范围,避免切除过多肝组织,确保剩余肝脏解剖的完整和功能性肝体积的最大化[8-9],防止术中误伤肝脏管道,缩短手术时间,减少术中出血量,进而优化手术方案,降低术后肝衰竭、胆汁漏及其他并发症[10]。笔者对21例肝癌进行术前评估,应用肝脏三维重建软件Myrian系统对肿瘤重新定位,分析肿瘤与周围血管关系,虚拟切割肿瘤,计算出全肝体积(TLV)、肿瘤体积(TuV)、拟切除肝体积(vRLV)、拟切除标本体积(vRSV)、标准肝体积(SLV)、功能性肝体积(FLV)及残肝体积(RLV),进而对手术方案的设计及术中策略进行了指导和优化,治疗效果满意,报告如下。
1 资料与方法
1.1 研究对象
本研究选自2015年10月—2017年10月吉林大学中日联谊医院肝胆外科21例直径>5 cm原发性肝癌。统计患者年龄、性别、身高、体质量等一般资料,并计算出体表面积(BSA)和标准肝体积(SLV),其中计算公式:BSA(m2)=身高(cm)×0.0061+体质量(kg)×0.0124-0.0099,SLV(cm3)=706.2×体表面积+2.4[11-12]。
研究对象纳入标准:⑴ 无肝脏手术史,腹部无外伤史;⑵ 术前行吲哚氰绿试验15 min滞留率(ICG15%)[13]均在10%以下;⑶ 肝内单发病灶>5 cm或多发病灶局限于单侧可行手术切除者;⑷ 成功行手术治疗。研究对象排除标准:⑴ 有严重心、脑、肺、肾等器官疾病;⑵ 全肝多发病灶或者肝外转移,无法行手术治疗;⑶ 有严重肝硬化;⑷ 常规CT效果差,无法重建者;⑸ 妊娠及哺乳期妇女。
1.2 三维重建方法
术前均采用多层螺旋CT机行肝脏CT平扫加增强检查,1.25 mm全层薄扫,盘以医学数据化图像格式(Digital Imaging and Communications in Medicine,DICOM)存储,刻保留数据,并导入Myrian肝脏三维重建系统进行图像处理,对肝脏、肝动脉系统、门静脉系统、肝静脉系统、肿瘤进行三维重建,并且在3D平面上虚拟手术切除。
1.2.1 肝组织提取与图像分析 将CT数据导入Myrian肝脏三维重建系统后,在二维CT层面(即轴状位)上采用半自动法[12]获得感兴趣区域(regions of interest,ROI)面积,自动提取肝脏及肿瘤组织,除去相似密度的非肝脏组织(如膈肌、下腔静脉、胆囊及肝门血管等),从肝脏膈顶部逐层至下极,在矢状位、冠状位手工调整,勾勒肝脏范围,延肝脏边缘及肿瘤边缘逐层提取,最后启动拉伸,系统自动计算获得所勾勒的各ROI体积,用分割法在3D平面上对肿瘤虚拟切割,形成预测体积,包括全肝体积(total liver volume,TLV;TLV=TuV+FLV)、肿瘤体积(tumor volume,TuV)、功能性肝体积(functional liver volume,FLV)、拟切除肝体积(virtual resection liver volume,vRLV)、拟切除标本体积(virtual resection specimen volume,vRSV;vRSV=TuV+vRLV)及残肝体积(residual liver volume,RLV;RLV=TLV-vRLV)。对肝动脉系统、门静脉系统、肝静脉系统从一次单击分段到手动路径逐渐提取,形成虚拟肝脏Glisson系统及肝静脉系统,最后计算出血管引流区域。
1.2.2 残肝分数的计算 残肝分数的计算对评估肝脏肿瘤的可切除性、降低术后并发症具有重大意义[14]。残肝分数:%RLV=RLV/FLV×100%。
1.2.3 数据分析与手术方案的制定 根据三维重建系统测得的体积评估手术切除率以及术后肝衰竭可能性,结合残肝分数和肿瘤与血管的侵犯关系优化手术方案,尽可能在切除肿瘤病灶的基础上,保留正常肝脏组织,避免切除过多肝脏组织。
1.3 术中离体标本重量及体积测定
手术中切除的离体肝脏及肿瘤标本,放置于电子称重仪上称重,记录标本重量,继续用排水法测量标本体积,得到术中实际标本重量(actual resection specimen weight,aRSW)、实际标本体积(actual resection specimen volume,aRSV)。
1.4 观察指标
统计术前三维重建计算的肝脏相关体积,选择合适的手术方案,与术中实际采用的手术方案对比,统计术中出血量、平均手术时间、术后并发症、及围手术期病死率,将三维重建软件计算的vRSV与aRSV比较,将aRSV与vRSV、aRSW与vRSV、aRSW与aRSV做相关性分析。
1.5 统计学处理
所有资料采用Excel软件建立数据库后,应用Graphpad prism 7.0进行统计学分析。计量资料采用均数±标准差(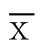 ±s)表示,组间数据比较采用配对t检验,相关性分析采用Pearson检验,P<0.05为差异有统计学意义。
±s)表示,组间数据比较采用配对t检验,相关性分析采用Pearson检验,P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
21例患者,男17例(81%),女4例(19%);年龄29~71岁,平均年龄(56.4±13.3)岁;身高157~180 cm,平均身高(167.6±6.1)cm;体质量55~82 kg,平均(67.9±7.8)kg;术前Child-Pugh分级,其中A级16例(76%),B级5例(24%),C级未纳入本研究。甲胎蛋白1.6~2 000 µg/L。肿瘤位于肝右叶8例,中肝叶3例,左叶6例,其他位于肝段或者不规则肿瘤4例。
2.2 肝脏三维重建软件对管道系统重建结果分析
21例术前应用Myrian肝脏三维重建软件进行肝脏及内部脉管结构进行重建。重建后的三维图像形态逼真,立体感强,能从轴位、冠状位及矢状位多角度显示肝脏各血管间复杂的解剖关系,血管与肿瘤的毗邻关系形成鲜明的对比。在对21例进行肝外动脉重建时,其中2例变异左肝动脉(replaced left hepatic artery,rLHA)来自于胃左动脉(left gastric artery,LGA),4例变异右肝动脉(replaced right hepatic artery,rRHA)起自肠系膜上动脉(superior mesenteric artery,SMA),分别属于Michels分型的II型和III型。门静脉系统和肝静脉系统与肿瘤的空间位置关系均能直观、清晰的辨识,特别是对于存在肿瘤侵犯脉管结构的情况。肝脏三维重建可以给术者构造立体画像,避免术中误伤血管[15],减少术后出现肝脏缺血及其他严重并发症。
2.3 病例介绍
患者1 男,54岁。诊断为原发性肝癌,在用Myrian肝脏三维重建软件对肝内门静脉系统、肝静脉系统、肝外动脉重建,分割定位肿瘤,对肿瘤虚拟切除。重建后的图像显示该患者rRHA来自于SMA,二维CT不能很好的辨识出来,三维重建的影像显示清晰、直观(图1)。
患者2 女,60岁。诊断为原发性肝癌,在用Myrian肝脏三维重建软件重建,分割定位肿瘤,肿瘤位于右半肝,肿瘤最大直径约11.9 cm,三维重建结果显示,门静脉左右支毗邻肿瘤,并且存在一定程度的挤压、变形,甚至侵犯门静脉。巨大肝癌(肿瘤直径>10 cm)往往对肝脏脉管结构造成不同程度的挤压和侵犯,在精准肝切除时,精确的肝脏体积及残留肝体积的计算尤为重要(图2)。
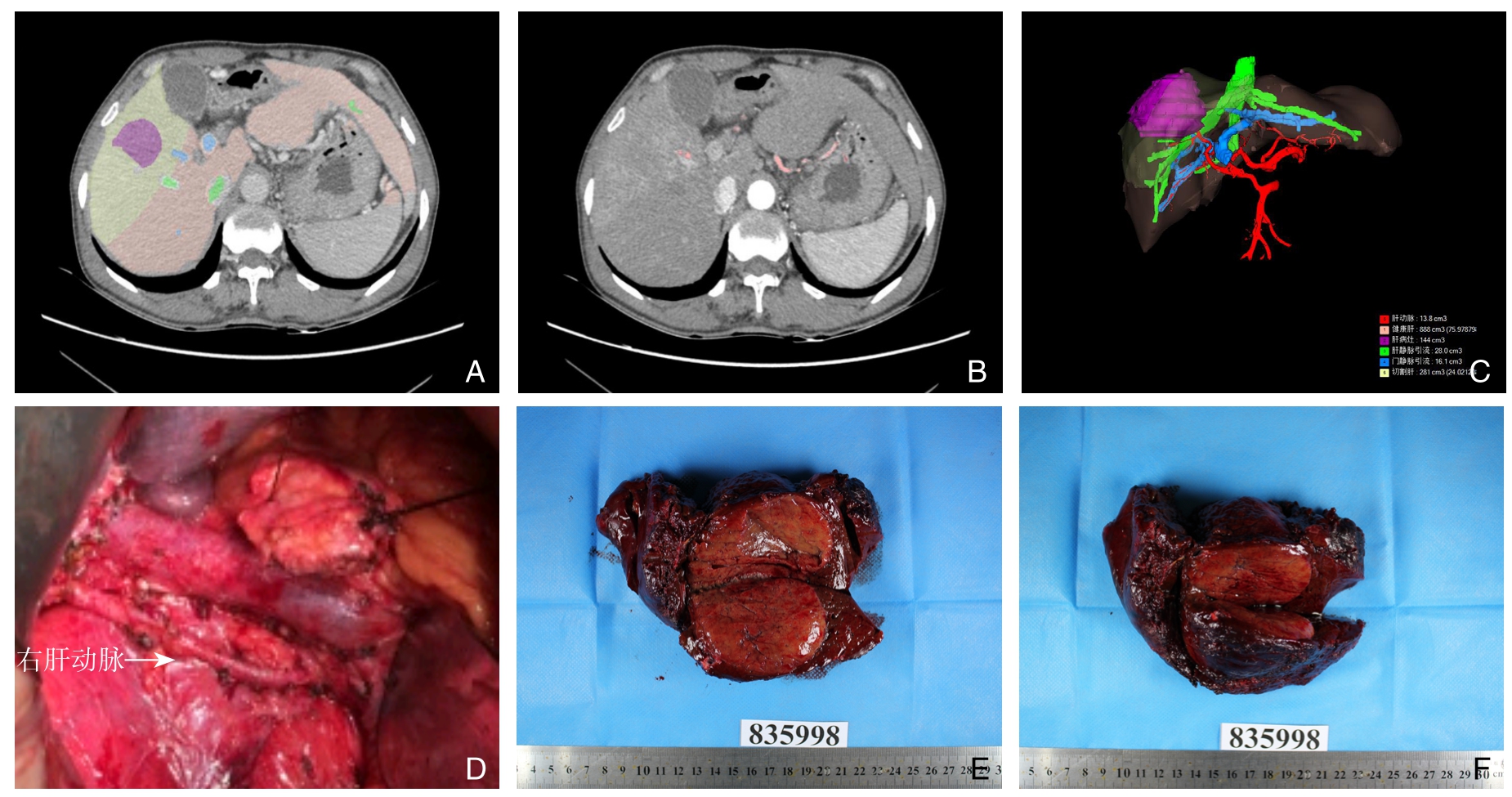
图1 患者1相关图片 A:二维图像基础上对感兴趣区域染色;B:与A同一层面的二维图像;C:重建后的模型(肝脏、肿瘤及vRLV);D:术中实际术野,箭头处为右肝动脉;E-F:实际标本
Figure 1 Pictures from the cases 1 A: Staining of the regions of interest based on two-dimensional image; B: Two-dimensional image of the same plane of A; C: Reconstructed model (liver, tumor and vRLV); D: Intraoperative view and arrow showing the right hepatic artery;E–F: Actual specimen
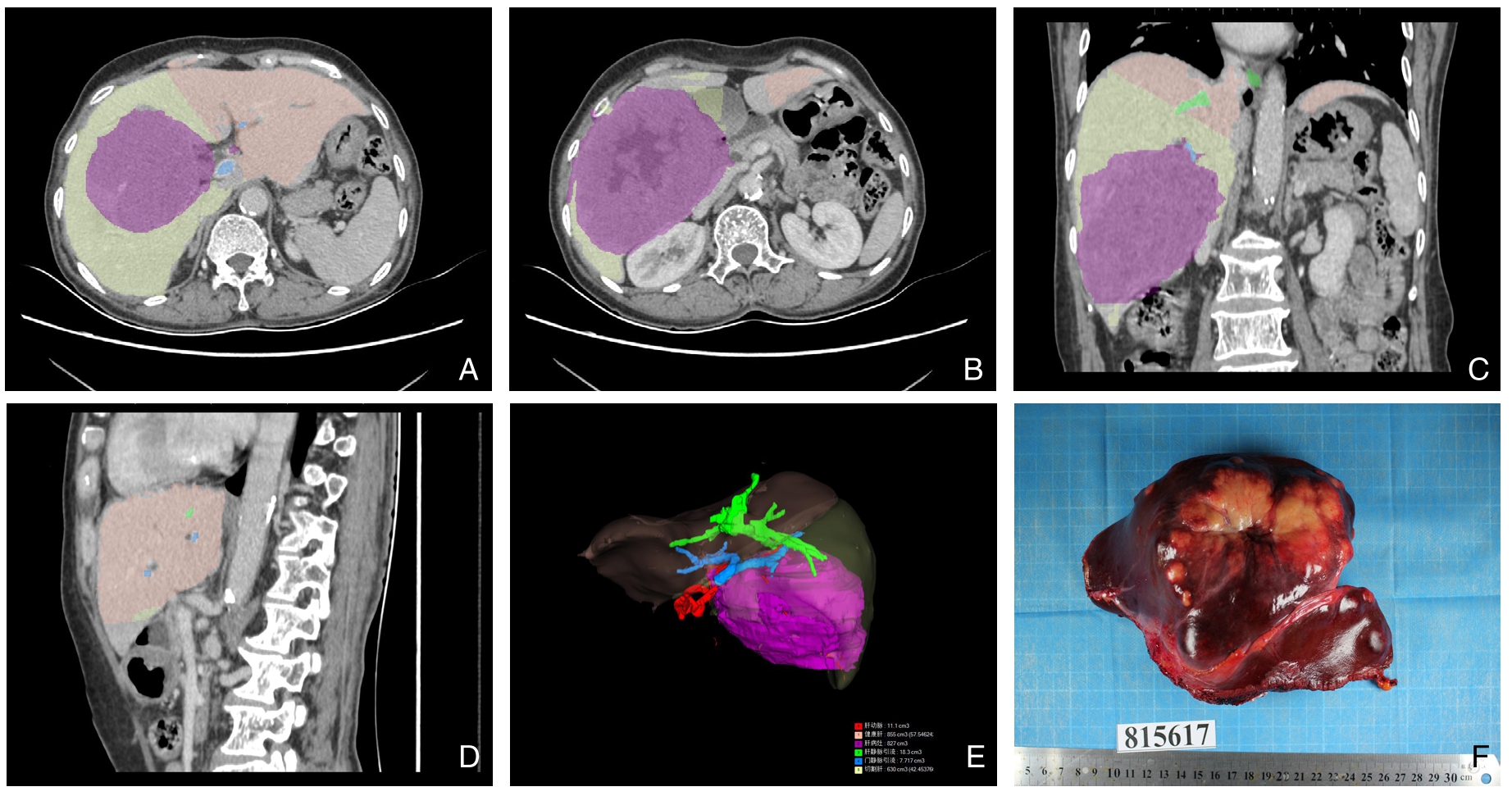
图2 患者2相关图片 A-B:二维层面基础上染色后的图像;C:冠状位角度成像;D:矢状位角度成像;E:成像后的肝脏后面观,可以多角度旋转,任意方向分析比较;F:术中实际标本
Figure 2 Pictures from the cases 2 A–B: Staining of the regions of interest based on two-dimensional image; C: Coronal image; D:Sagittal image; E: Posterior view of the liver after imaging offering multidimensional rotations and arbitrary direction comparison; F:Actual specimen
2.4 术前虚拟肝脏体积与术中实际标本体积相关性分析
全组21例术前三维重建的结果见表1,TLV为(1 827.9±314.8)cm3,TuV为(593.4±283.2)cm3,vRLV为(511.2±180.0)cm3,vRSV为(1 104.6±292.3)cm3。术后测量aRSW为(1 212.9±278.46)g,用排水法测量aRSV为(1 101.0±280.4)cm3。
表1 21例肝癌患者术前三维重建数据
Table 1 Data of three-dimensional reconstruction of the 21 liver cancer patients
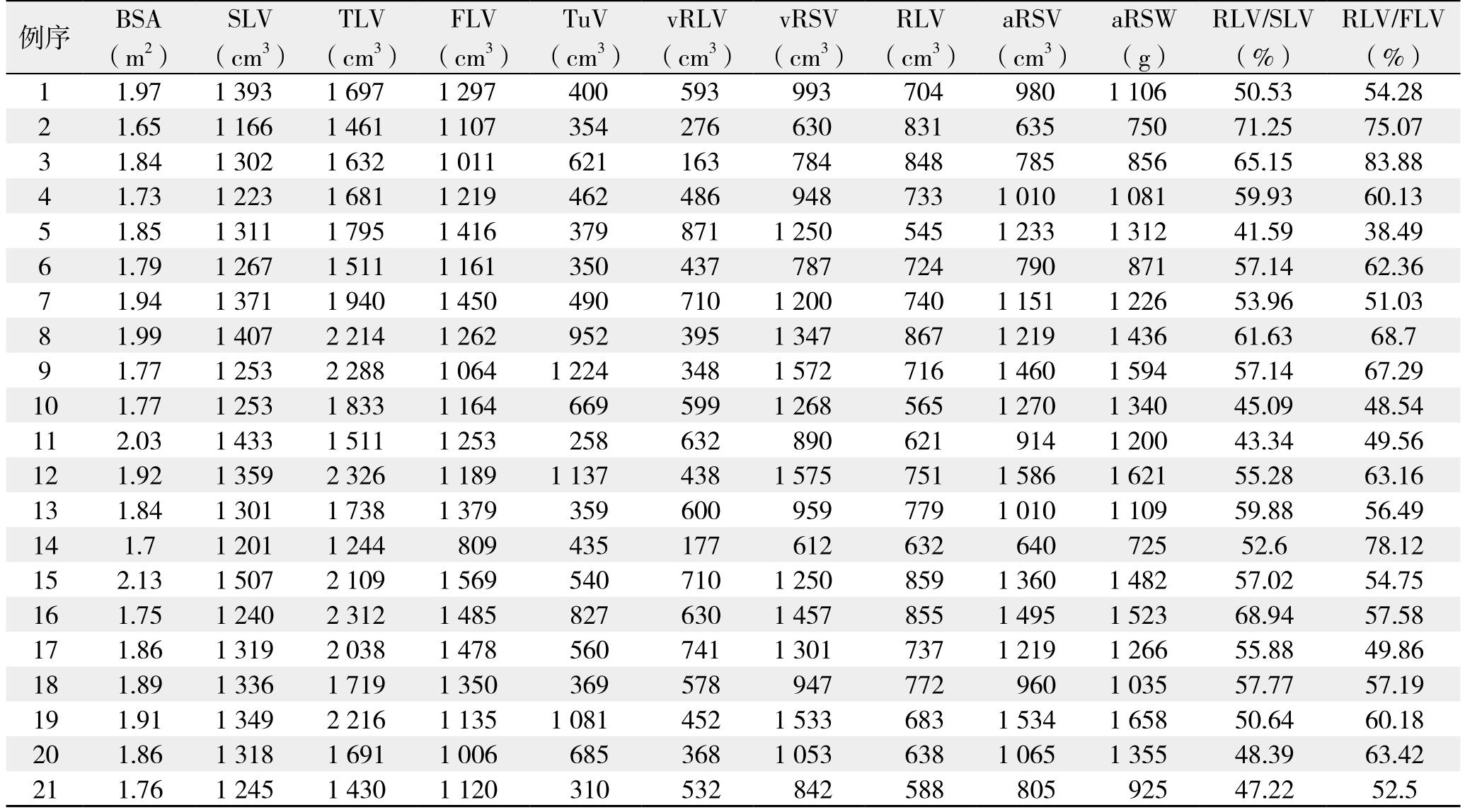
例序 BSA(m2)SLV(cm3)TLV(cm3)FLV(cm3)TuV(cm3)vRLV(cm3)vRSV(cm3)RLV(cm3)aRSV(cm3)aRSW(g)RLV/SLV(%)RLV/FLV(%)1 1.97 1 393 1 697 1 297 400 593 993 704 980 1 106 50.53 54.28 2 1.65 1 166 1 461 1 107 354 276 630 831 635 750 71.25 75.07 3 1.84 1 302 1 632 1 011 621 163 784 848 785 856 65.15 83.88 4 1.73 1 223 1 681 1 219 462 486 948 733 1 010 1 081 59.93 60.13 5 1.85 1 311 1 795 1 416 379 871 1 250 545 1 233 1 312 41.59 38.49 6 1.79 1 267 1 511 1 161 350 437 787 724 790 871 57.14 62.36 7 1.94 1 371 1 940 1 450 490 710 1 200 740 1 151 1 226 53.96 51.03 8 1.99 1 407 2 214 1 262 952 395 1 347 867 1 219 1 436 61.63 68.7 9 1.77 1 253 2 288 1 064 1 224 348 1 572 716 1 460 1 594 57.14 67.29 10 1.77 1 253 1 833 1 164 669 599 1 268 565 1 270 1 340 45.09 48.54 11 2.03 1 433 1 511 1 253 258 632 890 621 914 1 200 43.34 49.56 12 1.92 1 359 2 326 1 189 1 137 438 1 575 751 1 586 1 621 55.28 63.16 13 1.84 1 301 1 738 1 379 359 600 959 779 1 010 1 109 59.88 56.49 14 1.7 1 201 1 244 809 435 177 612 632 640 725 52.6 78.12 15 2.13 1 507 2 109 1 569 540 710 1 250 859 1 360 1 482 57.02 54.75 16 1.75 1 240 2 312 1 485 827 630 1 457 855 1 495 1 523 68.94 57.58 17 1.86 1 319 2 038 1 478 560 741 1 301 737 1 219 1 266 55.88 49.86 18 1.89 1 336 1 719 1 350 369 578 947 772 960 1 035 57.77 57.19 19 1.91 1 349 2 216 1 135 1 081 452 1 533 683 1 534 1 658 50.64 60.18 20 1.86 1 318 1 691 1 006 685 368 1 053 638 1 065 1 355 48.39 63.42 21 1.76 1 245 1 430 1 120 310 532 842 588 805 925 47.22 52.5
肝脏三维重建软件计算的vRSV与术中aRSV进行组间数据比较,采用配对t检验分析,结果提示差异无统计学意义(P=0.76),表明三维重建结果与肝脏实际情况十分接近。Pearson检验相关性分析提示,aRSW与aRSV、aRSW与vRSV、aRSV与vRSV呈高度正相关(r=0.9964、0.9201、0.9345,均P<0.0001)(图3)。
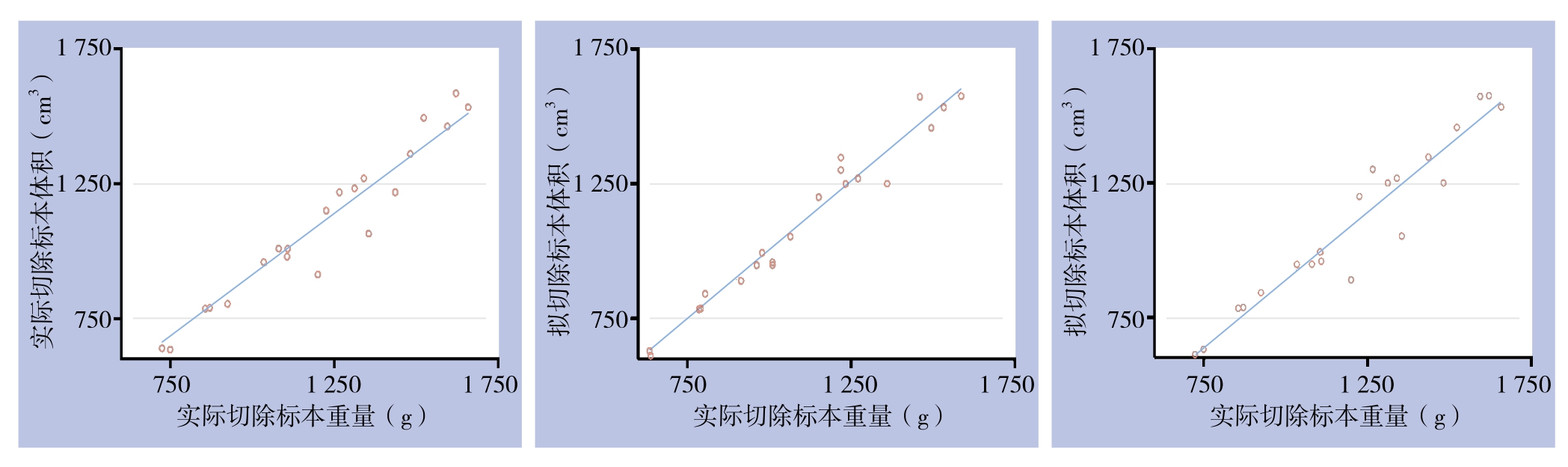
图3 21例肝癌患者vRSV、aRSW和aRSV的相关性分析
Figure 3 Correlation analysis among vRSV, aRSW and aRSV in the 21 patients
2.5 手术结果及术后恢复情况
21例术中手术方案与术前通过三维重建软件虚拟手术方案一致(100%,21/21),平均手术时间(149.76±51.8)min,术中出血量(350.00±247.8)mL,平均住院日为(18.82±4.6)d。
引流管少量出血2例;术后胆汁漏1例;大量腹腔积液4例,经腹腔穿刺引流、保肝等对症治疗后恢复正常,少量积液未给予处理;严重的肺部感染及胸腔积液各1例,经胸腔穿刺引流、抽液、抗感染等治疗后痊愈;下肢静脉血栓1例,保守治疗后好转;切口感染3例。无围手术期死亡,无肝衰竭。
3 讨 论
肝癌治疗的任何方法都是以改善患者生活质量,延长患者生存期为目的,而外科手术切除术仍占主导地位,是根治性高、治疗较为彻底的治疗方式[16]。肝脏解剖结构复杂,血供丰富,血管变异多见,肝组织质脆、易出血,较晚期肝癌肿瘤与重要血管及胆管紧密粘连,肝脏切除手术难度加大。本课题研究中发现2例rLHA来至于LGA,4例rRHA起自SMA(图1),部分肿瘤毗邻甚至压迫门静脉系统(图2)。肝脏数字化三维重建系统的应用在术前形成立体的画面,术中更好避免误伤这些血管、胆管,减少术后残留肝的缺血或坏死的可能性[17],有利于精准肝切除并缩短手术时间。Radtke等[18]和国内学者唐敏等[12]在其研究中发现肝段水平血管系统变异率约为 67%;Erbay等[19]研究发现肝内血管变异发生率高达70%,因此术前充分了解肝内血管系统的解剖结构及变异,重新定位肝脏肿瘤,对肝脏手术方案的制定、手术的预后及并发症的早期发现和处理都有重要的意义。但是我们的研究结果也提示,Myrian肝脏三维重建软件对肝内血管的末端分支显示成像不理想,这与肝脏血管对造影剂的摄取时限以及三维重建软件对血管类型及细微血管的成像方式有关,有学者在应用Myrian三维重建软件对门静脉血管成像的研究结果提示,Myrian 三维重建软件较常规二维CT有其独特的优点,门静脉期可以显示4级及4级以上分支[20]。
肝癌经常合并有肝实质损害,特别是巨大肝癌患者。巨大肝癌指肿瘤直径>10 cm的肝细胞癌,目前手术治疗仍为首选的治疗方法[21-22]。巨大肝癌在手术切除的过程中,往往遇到肿瘤体积过大和肿瘤压迫重要血管(图2),术前由于未合理进行肝脏体积评估,导致术后出现肝功能衰竭,成为围术期死亡的重要原因[23-24]。因此,术前精确计算肝脏体积、虚拟手术切除对术中治疗方案的选择以及降低术后并发症的发生具有重要意义。RLV/SLV(%)和RLV/FLV(%)及肝脏体积测量能客观地反映肝脏的大小和肝实质容量,结合术前Child-Pugh分级评估,肝功能储备测定(吲哚青绿试验)、以及患者自身情况,可以及时调整手术方案,对精准肝切除提供重要的依据。随着医学影像技术的发展,三维重建对术前肝体积测量在肝癌精准肝切除的应用日益广泛。本研究利用三维重建软件Myrian系统,结合二维CT客观、准确等特点,将断层图像进行三维重建,进而计算出感兴趣肝脏的体积,通过术前精确的肝体积测量、肿瘤与脉管系统的分析,减少了肝癌精准肝切除术中出血及术后胆汁瘘和肝功能障碍,甚至肝衰竭和死亡的发生率[25]。本课题全组病例的三维重建图像均清晰显示了肝内脉管系统的立体形态及其与肿瘤的空间解剖关系,对肝段可以个体化分段以及体积测量,对肿瘤能形成精确的定位。本研究全组患者,aRSW与aRSV、aRSW与vRSV、aRSV与vRSV的相关性分析结果显示差异均无统计学意义,术前拟切除标本体积与实际标本体积大致相符,说明Myrian三维重建软件准确性高的特点。并且,在三维可视化模型上,我们可以反复,多次对肿瘤进行虚拟切除,通过对不同虚拟切除的肝脏体积的比较,以及切除平面的观察,可明确各脉管系统的切除与保留情况、剩余肝脏体积和肿瘤切缘的大小,进而选择出对患者更加适合的手术方式。
本研究全组患者实际手术切除过程与术前虚拟切除完全一致,手术顺利,术后并发症少,恢复快,围手术期无病例死亡。显示了术前肝脏三维重建对精准肝切除治疗原发性肝癌的重要价值。
[1] 蔡庆. 145例肝细胞癌根治性切除术后复发相关因素的临床分析[D]. 广州: 南方医科大学, 2016.Cai Q. Clinical analysis of recurrence related factors in 145 cases of hepatocellular carcinoma after radical hepatectomy[D]. Guangzhou:Southern Medical University, 2016.
[2] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2):69–90. doi: 10.3322/caac.20107.
[3] 贾萌. 三维重建技术联合腹腔镜精准肝切除术治疗原发性肝癌的临床疗效观察[J]. 肝胆外科杂志, 2017, 25(2):115–117.doi:10.3969/j.issn.1006–4761.2017.02.009.Jia M. Observation on the clinical efficacy of three dimensional reconstruction technique combined with laparoscopic precise hepatectomy for primary liver cancer[J]. Journal of Hepatobiliary Surgery, 2017, 25(2):115–117. doi:10.3969/j.issn.1006–4761.2017.02.009.
[4] 汪勇, 王小明. 三维重建技术在肝癌诊疗中的研究进展[J]. 沈阳医学院学报, 2014, 16(4):229–230. doi:10.3969/j.issn.1008–2344.2014.04.013.Wang Y, Wang XM. Research progress of three-dimensional reconstruction in diagnosis and treatment of liver cancer[J]. Journal of Shenyang Medical College, 2014, 16(4):229–230. doi:10.3969/j.issn.1008–2344.2014.04.013.
[5] 中华人民共和国卫生和计划生育委员会医政医管局. 原发性肝癌诊疗规范(2017年版)[J]. 中华消化外科杂志, 2017, 16(7):635–647. doi:10.3760/cma.j.issn.1673–9752.2017.07.001.Bureau of Medical Administration, National Health and Family Planning Commission of the PRC. Standardization of diagnosis and treatment for hepatocellular carcinoma (2017 edition)[J]. Chinese Journal of Digestive Surgery, 2017, 16(7):635–647. doi:10.3760/cma.j.issn.1673–9752.2017.07.001.
[6] 荚卫东. 精准肝切除治疗肝细胞癌关键技术[J]. 中国普通外科杂志, 2014, 23(1):1–5. doi:10.7659/j.issn.1005–6947.2014.01.001.Jia WD. Key techniques in precise hepatectomy for hepatocellular carcinoma[J]. Chinese Journal of General Surgery, 2014, 23(1):1–5.doi:10.7659/j.issn.1005–6947.2014.01.001.
[7] Yeo CT, MacDonald A, Ungi T, et al. Utility of 3D Reconstruction of 2D Liver Computed Tomography/Magnetic Resonance Images as a Surgical Planning Tool for Residents in Liver Resection Surgery[J]. J Surg Educ, 2018, 75(3):792–797. doi: 10.1016/j.jsurg.2017.07.031.
[8] 张松, 潘树波, 谢坤, 等. 精准肝脏外科理念在肝细胞肝癌治疗中的价值[J]. 安徽医科大学学报, 2016, 51(1):94–97.Zhang S, Pan SB, Xie K, et al. Clinical value of precision liver surgery concept in the treatment of hepatocellular carcinoma[J].Acta Universitatis Medicinalis Anhui, 2016, 51(1):94–97.
[9] Jones RP, Brudvik KW, Franklin JM, et al. Precision surgery for colorectal liver metastases: Opportunities and challenges of omicsbased decision making[J]. Eur J Surg Oncol, 2017, 43(5):875–883.doi: 10.1016/j.ejso.2017.02.014.
[10] Bliznakova K, Kolev N, Buliev I, et al. Computer aided preoperative evaluation of the residual liver volume using computed tomography images[J]. J Digit Imaging, 2015, 28(2):231–239. doi:10.1007/s10278–014–9737–5.
[11] 王桂林, 梅铭惠, 席江伟. 标准残肝体积在肝硬化肝脏功能储备评估的应用[J]. 中华肝胆外科杂志, 2013, 19(1):15–18.doi:10.3760/cma.j.issn.1007–8118.2013.01.006.Wang GL, Mei MH, Xi JW. The application of standard remnant liver volume to assessment of cirrhotic liver function reserve[J].Chinese Journal of Hepatobiliary Surgery, 2013, 19(1):15–18.doi:10.3760/cma.j.issn.1007–8118.2013.01.006.
[12] 唐敏, 杨尚文, 王磊, 等. 基于64排螺旋CT扫描数据的肝血管解剖变异分析[J]. 放射学实践, 2013, 28(4):436–439. doi:10.3969/j.issn.1000–0313.2013.04.022.Tang M, Yang SW, Wang L, et al. Application of 64-slice spiral CT in the analysis of anatomic variation of hepatic vessels[J].Radiologic Practice, 2013, 28(4):436–439. doi:10.3969/j.issn.1000–0313.2013.04.022.
[13] 贾长库, 翁杰, 陈有科, 等. 以解剖性肝切除为基础的精准肝切除治疗肝胆恶性肿瘤[J]. 中国普通外科杂志, 2013, 22(1):109–112.doi:10.7659/j.issn.1005–6947.2013.01.025.Jia CK, Weng J, Chen YK, et al. Anatomic hepatectomy as basis for precise hepatectomy in the treatment of malignant hepatobiliary tumors[J]. Chinese Journal of General Surgery, 2013, 22(1):109–112. doi:10.7659/j.issn.1005–6947.2013.01.025.
[14] 蔺虹名, 宋文, 郭少贤, 等. 标准残肝体积分数联合Child-Pugh评分在大肝癌γ-SBRT治疗前的风险评估价值[J]. 中国医学装备,2017, 14(3):24–28. doi:10.3969/J.ISSN.1672–8270.2017.03.006.Lin HM, Song W, Guo SX, et al. The research for risk assessment value of SFLVR associated with the Child-Pugh beforeγ-SBRT for large liver cancer[J]. China Medical Equipment, 2017, 14(3):24–28.doi:10.3969/J.ISSN.1672–8270.2017.03.006.
[15] 陈晓亮, 王川红, 宋志, 等. 肝血管成像三维重建联合区域血流阻断美蓝持久染色在精准肝切除手术中的应用[J].中国普通外科杂志, 2015, 24(7):1001–1006. doi:10.3978/j.issn.1005–6947.2015.07.015.Chen XL, Wang CH, Song Z, et al. Application of hepatic angiography with 3-D reconstruction plus regional blood flow occlusion and persistent methylene blue dyeing in precise hepatectomy[J]. Chinese Journal of General Surgery, 2015,24(7):1001–1006. doi:10.3978/j.issn.1005–6947.2015.07.015.
[16] 相迪, 戴建国. 原发性肝癌的综合治疗研究进展[J]. 山东医药,2017, 57(20):111–113. doi:10.3969/j.issn.1002–266X.2017.20.037.Xiang D, Dai JG. Research progress of comprehensive treatment of liver cancer[J]. Shandong Medical Journal, 2017, 57(20):111–113.doi:10.3969/j.issn.1002–266X.2017.20.037.
[17] 张朋飞, 于松宁, 雷鹏, 等. 3D打印技术在精准肝切除术前评估的应用[J]. 中国普通外科杂志, 2017, 26(7):831–837. doi:10.3978/j.issn.1005–6947.2017.07.004.Zhang PF, Yu SN, Lei P, et al. Application of 3D printing technology in preoperative assessment of precise hepatectomy[J]. Chinese Journal of General Surgery, 2017, 26(7):831–837. doi:10.3978/j.issn.1005–6947.2017.07.004.
[18] Radtke A, Nadalin S, Sotiropoulos GC, et al. Computer-assisted operative planning in adult living donor liver transplantation: a new way to resolve the dilemma of the middle hepatic vein [J]. World J Surg, 2007, 31(1):175–185. doi: 10.1007/s00268–005–0718–1.
[19] Erbay N, Raptopoulos V, Pomfret EA, et al. Living donor liver transplantation in adults: vascular variants important in surgical planning for donors and recipients.[J]. AJR Am J Roentgenol, 2003,181(1):109–114. doi: 10.2214/ajr.181.1.1810109.
[20] 李修奎, 余永强, 刘斌. 64层螺旋CT肝血管成像的临床研究[J].中国医学影像技术, 2007, 23(12):1838–1843. doi:10.3321/j.issn:1003–3289.2007.12.024.Li XK, Yu YQ, Liu B. The clinical study on hepatic vessels with 64-slice spiral computed tomographic angiography[J]. Chinese Journal of Medical Imaging Technology, 2007, 23(12):1838–1843.doi:10.3321/j.issn:1003–3289.2007.12.024.
[21] 刘付宝, 耿小平. 巨大肝癌外科手术治疗的抉择[J]. 肝胆外科杂志, 2017, 25(1):1–4. doi:10.3969/j.issn.1006–4761.2017.01.001.Liu FB, Geng XP. Options of surgical treatment for large liver cancer[J]. Journal of Hepatobiliary Surgery, 2017, 25(1):1–4.doi:10.3969/j.issn.1006–4761.2017.01.001.
[22] Bégin A, Martel G, Lapointe R, et al. Accuracy of preoperative automatic measurement of the liver volume by CT-scan combined to a 3D virtual surgical planning software (3DVSP)[J]. Surg Endosc,2014, 28(12):3408–3412. doi: 10.1007/s00464–014–3611-x.
[23] 陈琳, 罗鸿萍, 董水林, 等. 三维重建技术在评估大肝癌手术安全性中的作用[J]. 中华外科杂志, 2016, 54(9):669–674. doi:10.3760/cma.j.issn.0529–5815.2016.09.005.Chen L, Luo HP, Dong SL, et al. Safety assessment of hepatectomy for huge hepatocellular carcinoma by three dimensional reconstruction technique[J]. Chinese Journal of Surgery, 2016,54(9):669–674. doi:10.3760/cma.j.issn.0529–5815.2016.09.005.
[24] 杨方集, 彭亮, 刘月英, 等. 2016年肝衰竭诊治进展[J]. 中华肝脏病杂志, 2017, 25(2):94–99. doi:10.3760/cma.j.issn.1007–3418.2017.02.003.Yang FJ, Peng L, Liu YY, et al. Research advances in diagnosis and treatment of liver failure in 2016][J]. Chinese Journal of Hepatology,2017, 25(2):94–99. doi:10.3760/cma.j.issn.1007–3418.2017.02.003.
[25] 李鹏鹏, 刘辉, 傅思源, 等. 肝脏三维可视化技术在第二肝门区肿瘤手术切除中的应用[J]. 中华外科杂志, 2016, 54(9):675–679.doi:10.3760/cma.j.issn.0529–5815.2016.09.006.Li PP, Liu H, Fu SY, et al. Application of liver visualization technologies in hilar tumor resection at the second hepatic portal area[J]. Chinese Journal of Surgery, 2016, 54(9):675–679.doi:10.3760/cma.j.issn.0529–5815.2016.09.006.