原发性肝癌是我国最常见的恶性肿瘤之一,发病率位居恶性肿瘤的第3位,每年约有36.2万例新发肝癌患者[1]。因肝癌发病隐匿而进展迅速等特点,多数患者在确诊时已为临床晚期,故而及早诊断和治疗尤为关键。近年来,许多肝癌血清学标志物相继被发现,主要包括胚胎性抗原类、酶类、蛋白质类、细胞因子类和癌基因类等5大类[2]。高尔基体蛋白73(GP73)是一种分子质量为73 kDa的II型高尔基体跨膜糖蛋白,Kladney等[3]于2000年首次发现GP73正常情况下主要在肝胆管上皮细胞表达,而几乎不表达于肝细胞。有基础研究[4-5]发现肝癌细胞中过表达的GP73会倾覆microRNA的抑制作用,促进癌细胞增殖,同时还可通过激活CREB-MMP-13信号通路,增加基质金属蛋白酶的表达来降解癌组织外基质,从而增强癌细胞的侵犯能力[6]。
当前有大量关于GP73诊断肝癌的原始研究,并有Meta分析的研究结果提示其诊断准确性为中等,但暂无研究重点探讨其在肝癌诊断中的临床应用价值。目前,所有类似Meta分析中收集原始研究的最近截止年限为2015年[7],此后又有许多相关原始研究陆续发表,研究结果不尽相同,GP73对肝癌的诊断意义尚未定论。同时,目前暂无乙型肝炎病毒(HBV)相关性肝癌的Meta分析,故本Meta分析将对血清GP73诊断HBV相关性肝癌的原始研究进行系统评价和定量合并分析。
1 资料与方法
1.1 文献检索
计算机系统性检索英文数据库包括PubMed、Embase、the Cochrane Library和中文数据库包括中国知网、中国生物医学文献数据库、万方数据库。检索从建库至2017年12月时间段公开发表的文献。英文检索词包括:Golgi protein 73、GP73、Golgi phosphoprotein 2、 Golgi Membrane Protein 1、Liver Cancer、Hepatic Carcinoma、Hepatocellular Carcinoma、HCC。 中文检索词包括:高尔基体蛋白73、高尔基体磷酸蛋白2、高尔基体膜蛋白1、原发性肝癌、肝细胞癌、肝癌、肝恶性肿瘤。为避免遗漏,各英文数据库采用“All fields”检索方式,知网和万方数据库采用主题检索方式,中国生物医学文献数据库采用“所有字段”检索方式。
1.2 文献的纳入与排除标准
本文按照Cochrane准确性系统评价标准(CRDAT)制定文献纳入标准如下:⑴ 国内外公开发表的GP73诊断HBV相关性肝癌的原始研究;⑵ 原始研究选择研究对象时,试验组中所有原发性肝癌患者均具有HBV感染背景,即为HBV相关性肝癌;肝癌诊断标准符合我国《原发性肝癌诊疗规范》;对照组包含肝癌高发人群(乙型肝炎、肝硬化);⑶ 血清GP73检测方法和试剂来源明确;⑷ 能提取完整的诊断四格表数据包括真阳性数(TP)、假阳性数(FP)、真阴性数(TN)和假阴性数(FN)。排除标准:⑴ 原始研究中所有肝癌患者均合并肝硬化,对照组全为健康人或乙型肝炎病毒携带者;⑵ 研究对象在测定血清GP73时已经接受抗肿瘤治疗;⑶ 文献综述、会议摘要;⑷ 重复发表、已撤回的文献;⑸ 同一单位机构及研究标本来源,且标本量无明显差异、标本采取时间为同一时间段、研究结果无明显区别的相似研究,纳入质量较高者。
1.3 资料提取
首先,由2名研究者各自阅读文献标题及摘要,剔除明显不符合纳入标准者。然后,仔细阅读初步纳入文献的全文,按照纳排标准确定文献是否被纳入。当存在不同意见时,经两者商酌后决定是否纳入该文献。从纳入文献中提取信息包括第一作者、发表年限、研究对象来源国家、样本量、肝癌患者年龄、检测方法、试剂来源、诊断界值和四格表数据。
1.4 质量评价
应用QUADAS研发小组于2011年修订的诊断准确性研究的质量评价工具QUADAS-2对纳入文献进行质量评估[8]。该工具由病例遴选、待评价试验、金标准及病例流程和进展情况共4部分组成。所有组成部分在标志性问题的辅助下评估偏倚风险,前3部分也会评估临床适用性。研究人员根据各部分的标志性问题的回答“是”、“否”或“不确定”,可相应将偏倚风险级别判定为“低”、“高” 或“不确定”。同时按照文献与研究问题的匹配程度,将临床适应性判定为“高”、“低”、“不清楚”。所有过程由2名相关专业研究人员利用Revman5.3软件提供的QUADAS-2工具各自进行,当意见存在分歧时经双方讨论后达成一致。
1.5 统计学处理
1.5.1 异质性检验 利用Meta-Disc1.4软件进行Spearman相关分析检测是否存在由阈值效应引起的异质性,若无阈值效应,则运用Cochrane Q检验和I²统计量对纳入研究的诊断比值比(DOR)值进行异质性分析,P<0.1认为存在明显的异质性,I2为25%、50%和75%时分别表示低、中和高度异质性,I2≥50%时也表明研究结果间存在比较明显的异质性。若存在异质性,则用Meta回归分析探索异质性根源。
1.5.2 诊断准确性指标汇总 当存在异质性时使用随机效应模型,反之则采用固定效应模型对敏感度、特异度、DOR值、阳性似然比和阴性似然比进行汇总,描绘综合受试者工作特征曲线(SROC)曲线,并计算曲线下面积(AUC)和Q*指数,同时进行亚组分析。
1.5.3 敏感度分析 将纳入文献逐一剔除,再观察余下研究诊断指标的变化。若变化程度较小,说明纳入文献的稳定性较好,反之则稳定性较差。
1.5.4 发表偏倚分析 使用Stata 14.0软件进行Deeks检验来评价纳入文献的发表偏倚情况,若P<0.05则提示存在发表偏倚。
1.5.5 Fagan图 基于贝叶斯理论方法,利用Stata 14.0统计软件绘制的Fagan图显示当GP73为阳性或阴性且验前概率分别为25%、50%、75%时相对应的验后概率大小。根据从验前概率到验后概率的变化程度来评估GP73的临床应用价值[9]。
2 结 果
2.1 文献检索结果
从各数据库中初步检索出文献共1 822篇,去除重复文献后剩余990篇。经阅读标题及摘要后剔除956篇,阅读余下文献的全文后再剔除20篇。最终纳入14篇文献[10-23],中文11篇,英文3篇,共纳入研究对象3 953例(图1)。纳入文献的基本资料和诊断数据详见表1-2。
表1 纳入文献的基本资料
Table 1 General information of the included studies
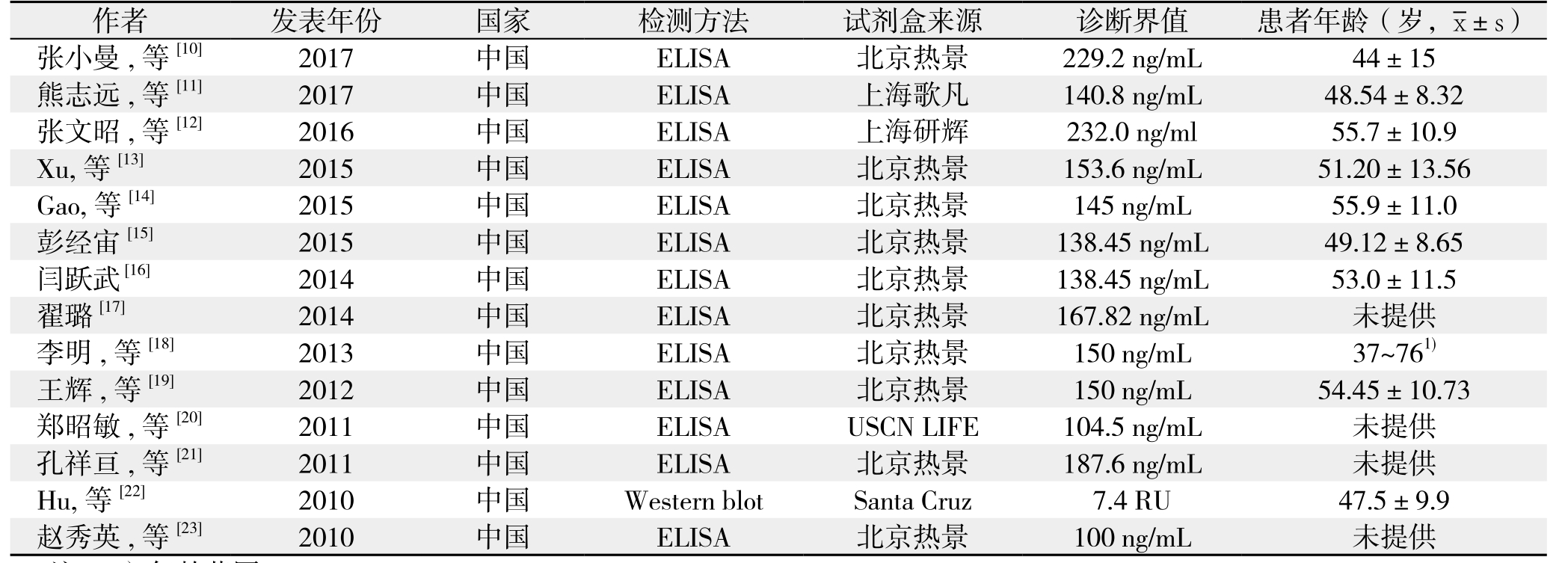
注:1)年龄范围
Note: 1) Age range
?
表2 纳入文献的诊断数据
Table 2 Diagnostic data of the included studies
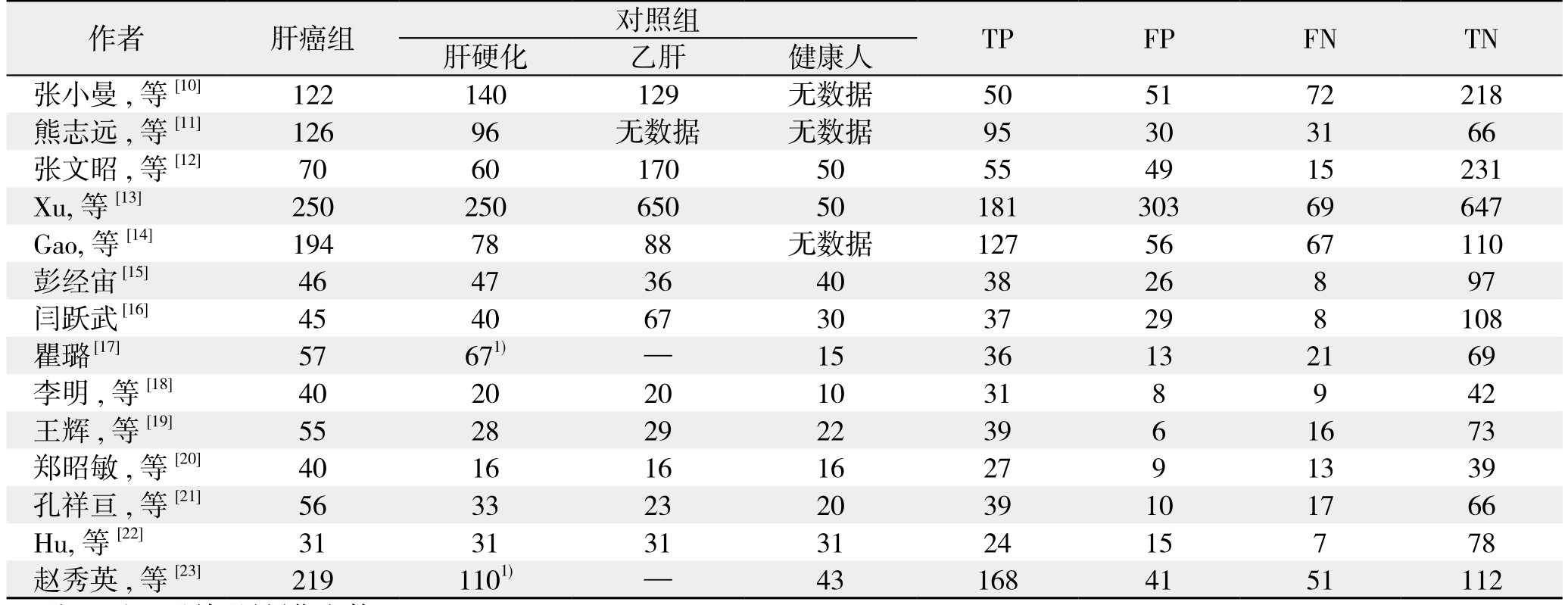
注:1)乙肝加肝硬化人数
Note: 1) Number of cases with hepatitis B plus cases with liver cirrhosis
作者 肝癌组 对照组 TP FP FN TN肝硬化 乙肝 健康人张小曼,等[10] 122 140 129 无数据 50 51 72 218熊志远,等[11] 126 96 无数据 无数据 95 30 31 66张文昭,等[12] 70 60 170 50 55 49 15 231 Xu,等[13] 250 250 650 50 181 303 69 647 Gao,等[14] 194 78 88 无数据 127 56 67 110彭经宙 [15] 46 47 36 40 38 26 8 97闫跃武 [16] 45 40 67 30 37 29 8 108瞿璐 [17] 57 671) — 15 36 13 21 69李明,等[18] 40 20 20 10 31 8 9 42王辉,等[19] 55 28 29 22 39 6 16 73郑昭敏,等[20] 40 16 16 16 27 9 13 39孔祥亘,等[21] 56 33 23 20 39 10 17 66 Hu,等[22] 31 31 31 31 24 15 7 78赵秀英,等[23] 219 1101) — 43 168 41 51 112
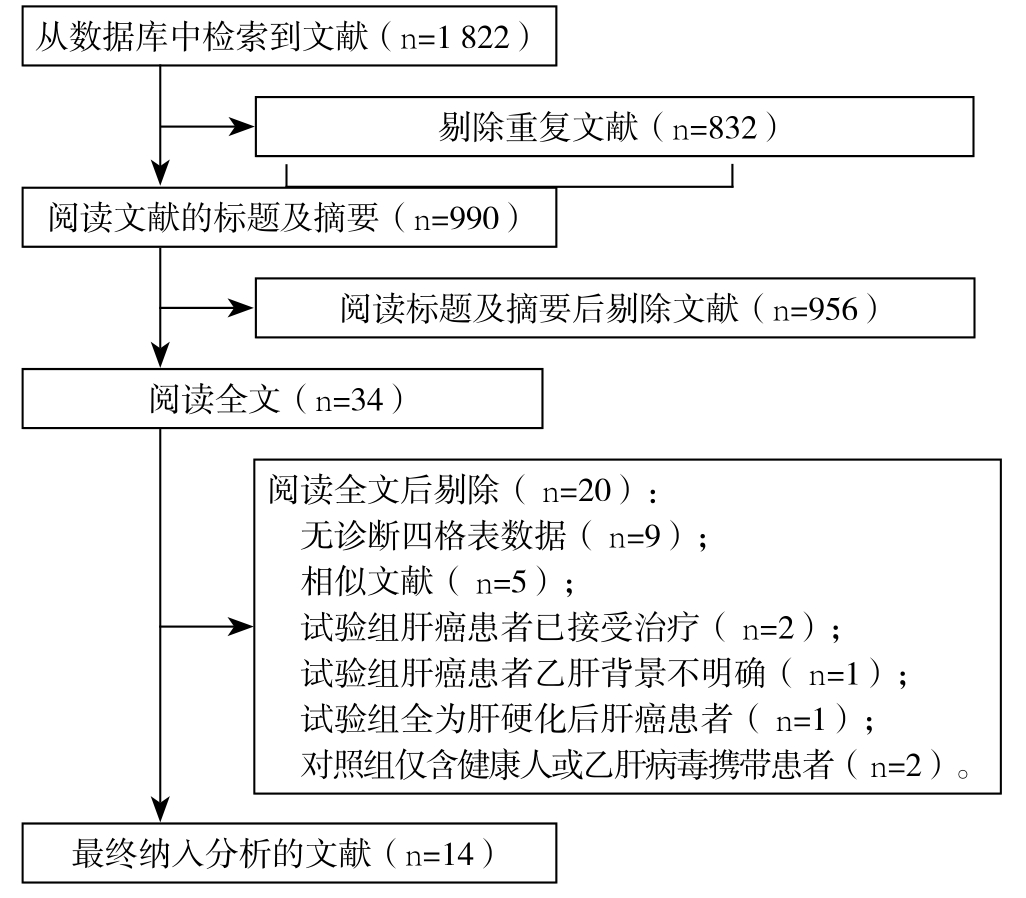
图1 文献筛选流程
Figure 1 Literature screening process
2.2 纳入研究的基本特征和质量评价
使用QUADAS-2工具对纳入研究进行质量评价,总的来说,结果不够理想。具体评价如下:⑴ 在病例选择中,仅有2篇研究[12-13]的病例为连续性纳入;有7篇研究[10-16]详细制定了病例的纳排标准;有2篇研究[19-20]试验组全为早期肝癌患者;有2篇研究[10, 14]的对照组未纳入健康人,熊志远等[11]的研究仅纳入肝硬化患者为对照。⑵ 在待评价试验中,仅1篇研究[13]明确说明试验遵循了盲法原则,2篇研究[18-19]预先设定了肝癌诊断阈值为GP73≥150 ng/mL。除2篇研究[12, 19]外均有详细说明GP73的检测方法和实验步骤,具有可重复性。⑶ 在诊断金标准中,有2篇研究[11-12]未详细说明肝癌的具体诊断标准,其余12篇研究均提供了肝癌的诊断金标准,且符合我国《原发性肝癌诊疗规范》。⑷ 在病例流程和进展情况中,仅1篇研究[14]有丢失病例标本情况(图2)。
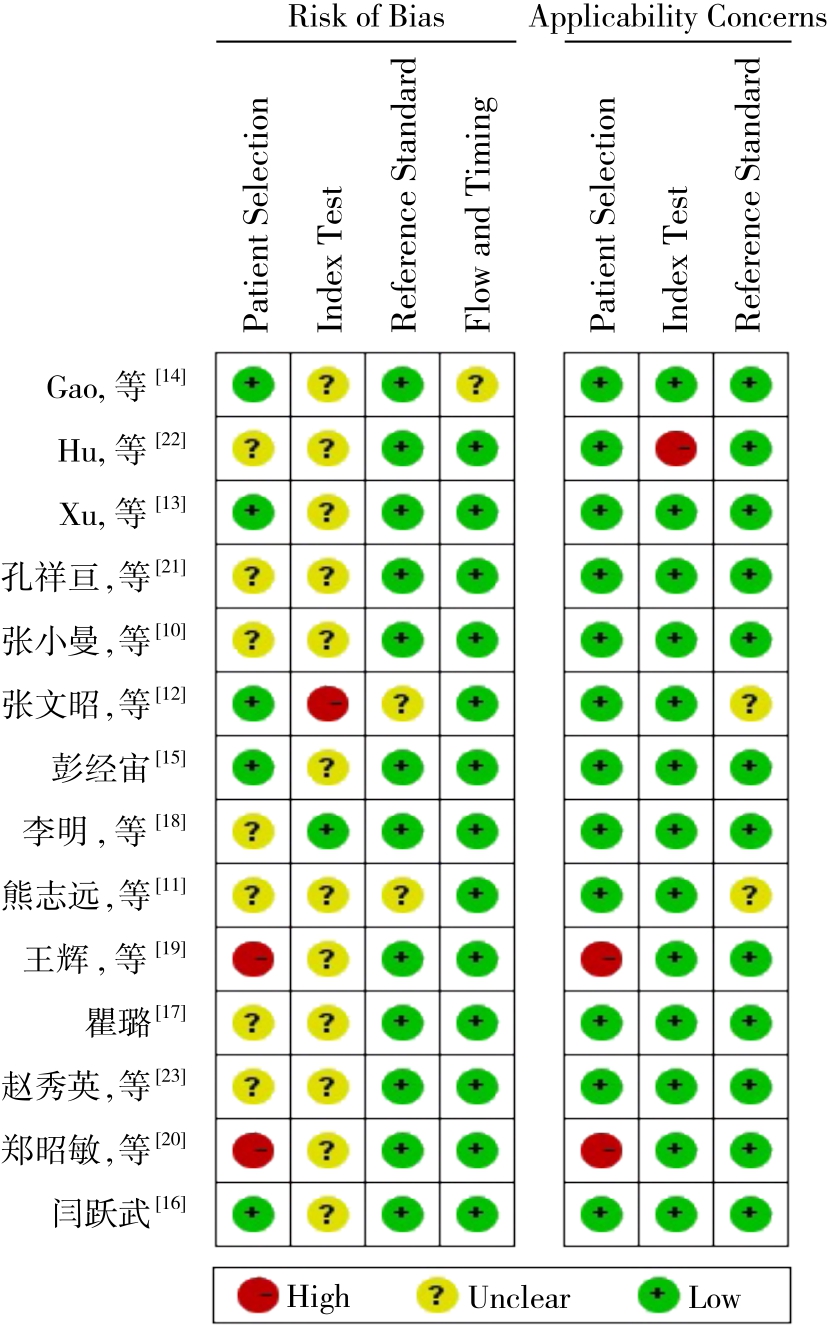
图2 文献质量评价
Figure 2 Quality assessment of the included studies
2.3 异质性分析
利用Meta-disc 1.4软件绘制SROC平面图,结果显示不呈“肩臂”状分布,提示本研究不存在阈值效应(图略)。同时,计算敏感度对数与(1-特异度)对数的Spearman相关系数r=0.090,P=0.759,亦表示无阈值效应。以DOR值来探讨非阈值效应引起的异质性,结果为DOR值为9.67(95%CI=6.72~13.91),Cochran-Q=57.41,P<0.10,I2=77.4%,说明纳入研究间存在非阈值效应引起的异质性(图3)。
2.4 合并统计效应量
由于各研究间异质性较大,故采用随机效应模型合并各统计效应量。GP73诊断肝癌的总敏感度和特异度分别为0.70(95% CI=0.68~0.73)、0.75(95% CI=0.73~0.77),总阳性似然比和阴性似然比分别为3.37(95% CI=2.75~4.13)、0.36(95% CI=0.29-0.45)(图4)。SROC曲线下面积AUC=0.826,Q*指数为0.759(图5)。
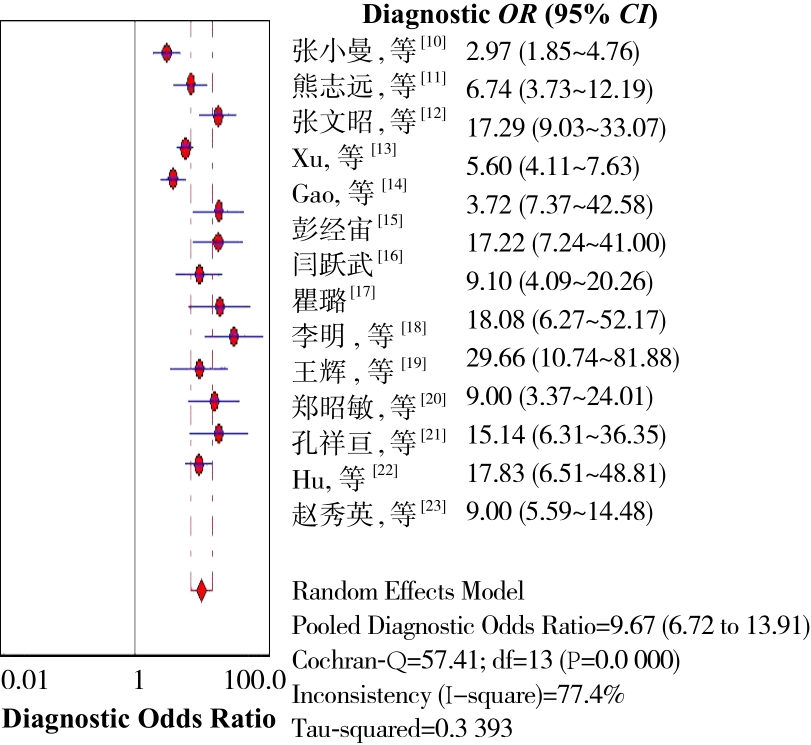
图3 DOR值森林图
Figure 3 Forest plot of DOR
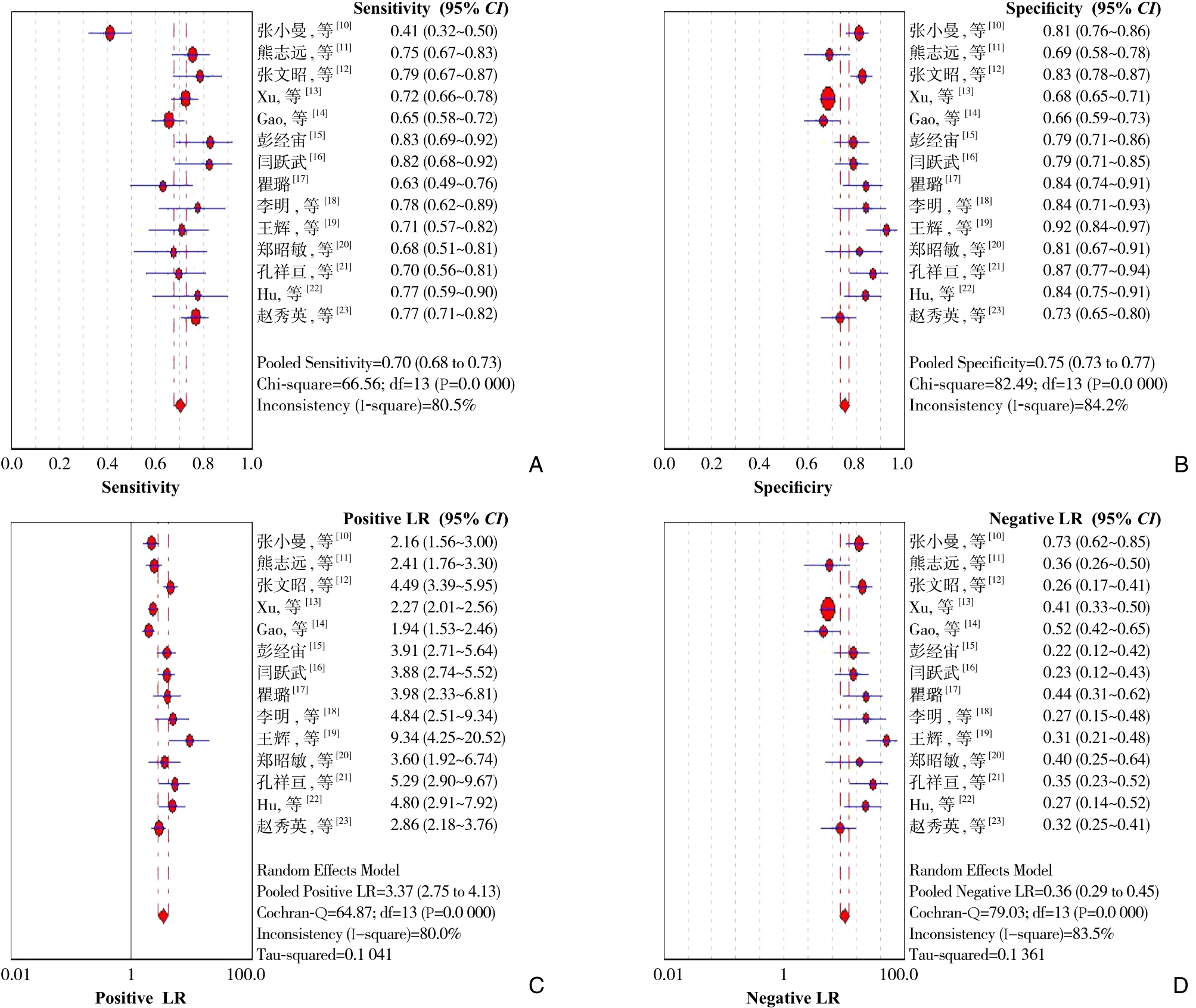
图4 各诊断指标森林图 A:敏感度;B:特异度;C:阳性似然比;D:阴性似然比
Figure 4 Forest plots of the diagnostic indexes A: Sensitivity; B: Specificity; C: Positive likelihood ratio; D: Negative likelihood ratio
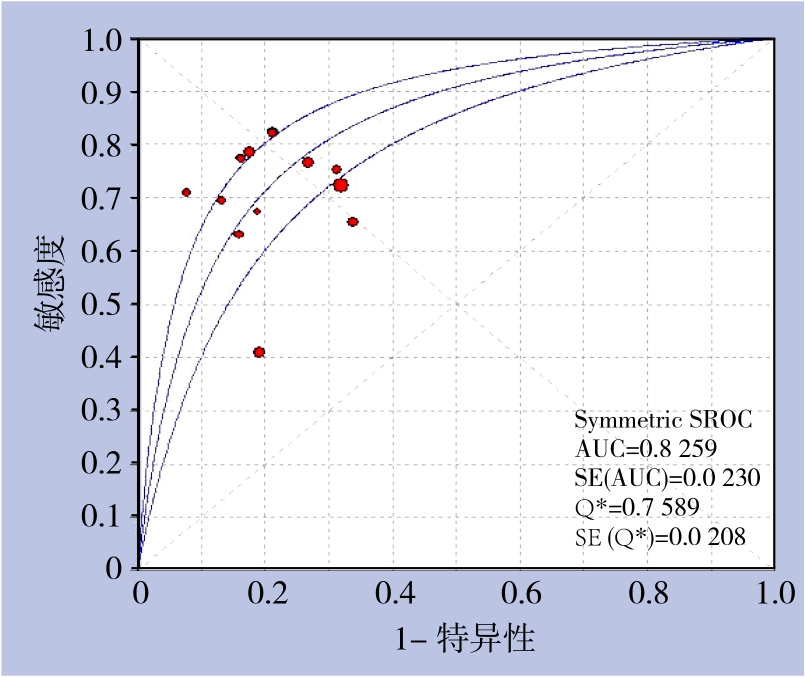
图5 血清GP73诊断肝癌的SROC曲线图
Figure 5 SROC curve of serum GP73 in diagnosis of HCC
2.5 Meta回归分析
为探讨异质性来源,将肝癌患者年龄、试剂来源、对照组人群共3个变量进行Meta回归分析,结果发现异质性来源与研究间对照人群差异有关(RDOR=3.28,95% CI=1.27~8.46,P=0.0 193)(表3)。
表3 Meta回归分析
Table 3 Meta regression analysis
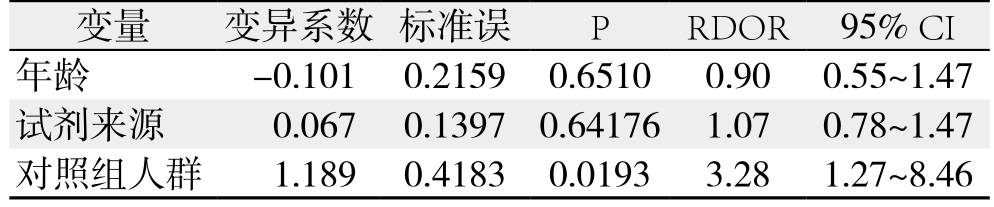
变量 变异系数 标准误 P RDOR 95% CI年龄 -0.101 0.2159 0.6510 0.90 0.55~1.47试剂来源 0.067 0.1397 0.64176 1.07 0.78~1.47对照组人群 1.189 0.4183 0.0193 3.28 1.27~8.46
2.6 亚组分析
以对照组人群为依据进行亚组分析:有11个原始研究纳入肝炎、肝硬化和健康人为对照(A组),另3个研究仅纳入了肝炎或肝硬化等肝癌高发人群为对照(B组),前者敏感度、DOR值、AUC均高于后者(0.74 vs. 0.62、12.60 vs. 4.07、0.836 vs.0.739)(表4)。
表4 血清GP73诊断肝癌的亚组分析
Table 4 Subgroup analysis of serum GP73 in diagnosis of HCC

?
2.7 敏感度分析
将所有原始研究逐一剔除后再对其余研究进行Meta分析,结果显示各诊断准确性指标均无明显变化,说明本研究结论稳定性较好(表5)。
表5 敏感度分析
Table 5 Sensitivity analysis
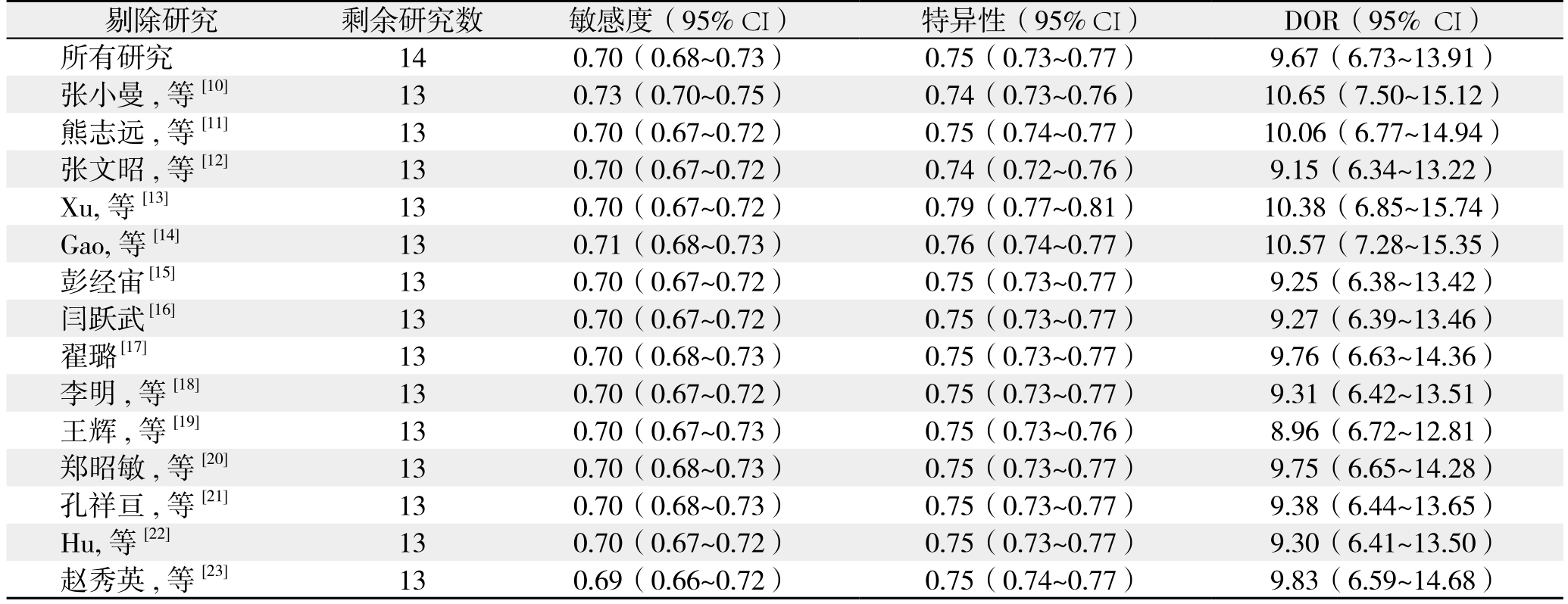
剔除研究 剩余研究数 敏感度(95% CI) 特异性(95% CI) DOR(95% CI)所有研究 14 0.70(0.68~0.73) 0.75(0.73~0.77) 9.67(6.73~13.91)张小曼,等[10] 13 0.73(0.70~0.75) 0.74(0.73~0.76) 10.65(7.50~15.12)熊志远,等[11] 13 0.70(0.67~0.72) 0.75(0.74~0.77) 10.06(6.77~14.94)张文昭,等[12] 13 0.70(0.67~0.72) 0.74(0.72~0.76) 9.15(6.34~13.22)Xu,等[13] 13 0.70(0.67~0.72) 0.79(0.77~0.81) 10.38(6.85~15.74)Gao,等[14] 13 0.71(0.68~0.73) 0.76(0.74~0.77) 10.57(7.28~15.35)彭经宙 [15] 13 0.70(0.67~0.72) 0.75(0.73~0.77) 9.25(6.38~13.42)闫跃武 [16] 13 0.70(0.67~0.72) 0.75(0.73~0.77) 9.27(6.39~13.46)翟璐 [17] 13 0.70(0.68~0.73) 0.75(0.73~0.77) 9.76(6.63~14.36)李明,等[18] 13 0.70(0.67~0.72) 0.75(0.73~0.77) 9.31(6.42~13.51)王辉,等[19] 13 0.70(0.67~0.73) 0.75(0.73~0.76) 8.96(6.72~12.81)郑昭敏,等[20] 13 0.70(0.68~0.73) 0.75(0.73~0.77) 9.75(6.65~14.28)孔祥亘,等[21] 13 0.70(0.68~0.73) 0.75(0.73~0.77) 9.38(6.44~13.65)Hu,等[22] 13 0.70(0.67~0.72) 0.75(0.73~0.77) 9.30(6.41~13.50)赵秀英,等[23] 13 0.69(0.66~0.72) 0.75(0.74~0.77) 9.83(6.59~14.68)
2.8 发表偏倚分析
利用Stata14.0软件对纳入的14篇原始研究绘制漏斗图,观察发现散点于回归线两侧为不对称分布,Deeks检验结果提示存在发表偏倚(P=0.01)(图6)。
2.9 验后概率
用Stata 14.0软件绘制Fagan图显示当设定验前概率为50%时,GP73阳性用于诊断肝癌的正确率为78%,而有26%的GP73阴性患者可能为肝癌。当设定验前概率为25%、75%时,GP73阳性验后概率分别为54%、91%,阴性验后概率分别为11%、52%(图7)。
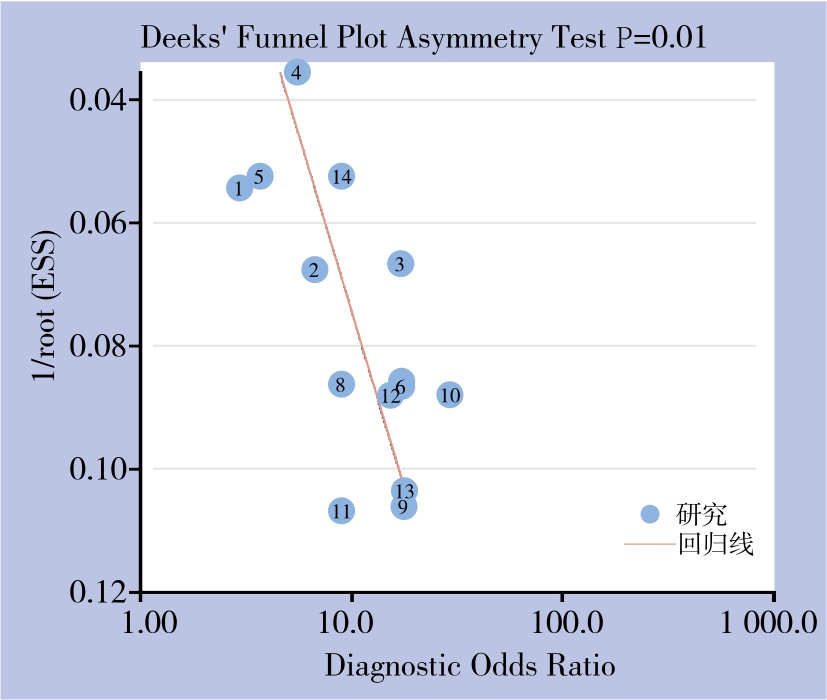
图6 Deeks漏斗图
Figure 6 Deeks’ funnel plot
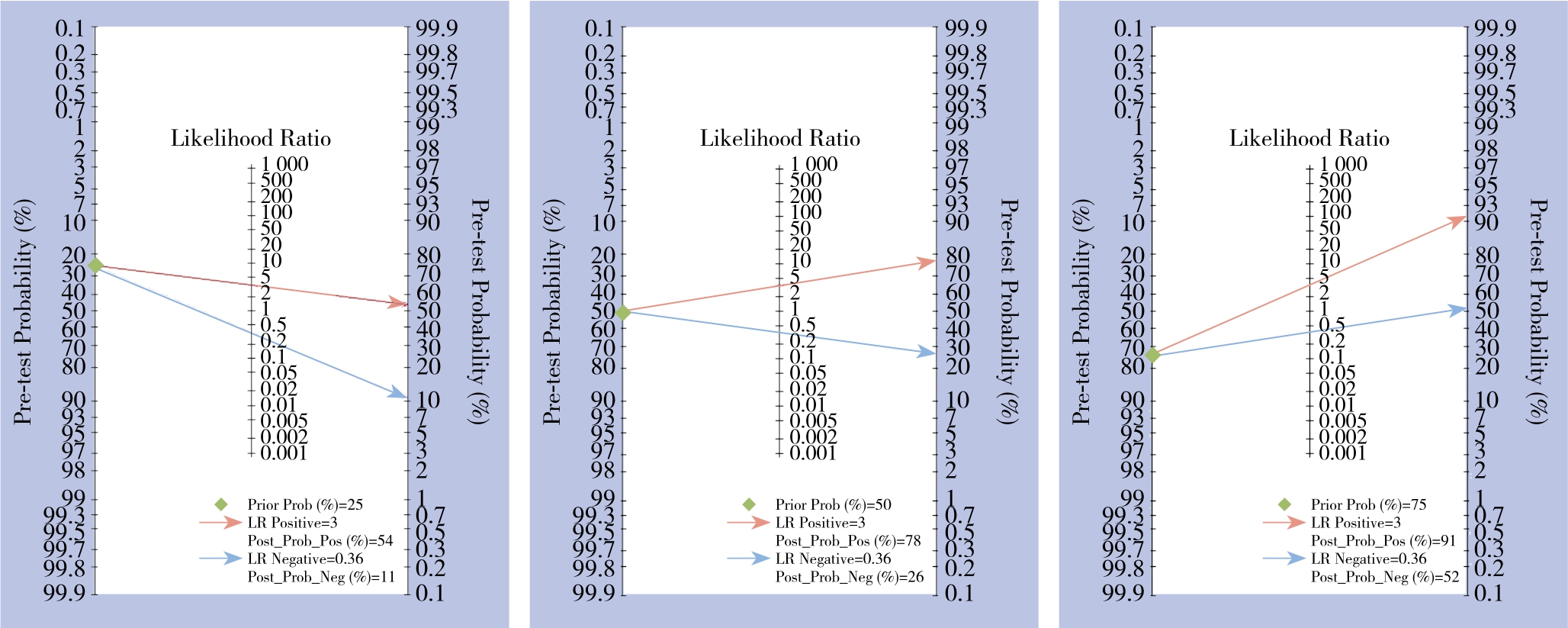
图7 血清GP73诊断肝癌的Fagan图
Figure 7 Fagan plots of serum GP73 in diagnosis of HCC
3 讨 论
原发性肝癌早期症状不典型、恶性程度高且病情发展迅速,严重危害人类健康和生命,其病因主要源于慢性病毒感染。全球约有55%的肝癌患者因HBV感染所致,HBV感染使男性或女性患者发生肝癌的风险增加20倍或16倍 [24-25],故本研究着重分析HBV相关性肝癌。
GP73是当前最引人注目的肝癌血清学标志物之一。在肝脏疾病中,上皮细胞特异性转录因子可结合GP73启动子促进肝细胞的GP73蛋白表达,GP73蛋白再通过胞内体运输暴露于弗林蛋白酶,经酶切作用裂解出外功能区后分泌至细胞外,最后进入外周血液系统[26-27]。Mao等[28]的大样本、多中心研究报道GP73水平在肝炎、肝硬化和肝癌患者中呈逐步递增趋势。陈建国等[29]随访研究发现GP73水平≥67 ng/mL(ELISA法)的HBsAg携带者2年后发生肝癌的危险性是低GP73的23.6倍。随后,Zhou等[30]通过Meta分析比较GP73和AFP对肝癌诊断价值的研究结果显示两者敏感度、特异度、DOR值分别为76% vs.70%、86%vs. 89%、18.59 vs.18.00,提示GP73有望成为继AFP之后的原发性肝癌诊断标志物。
在本Meta分析中,GP73诊断肝癌的敏感度、特异度和DOR值分别为0.70(95% CI=0.68~0.73)、0.75(95% CI=0.73~0.77)、9.67(95% CI=6.72~13.91),稍低于Yang等[31]的Meta分析结果;可能原因是本研究纳入的所有患者均具有HBV感染背景,即与研究目标人群不同有关。本研究的SROC曲线下面积为0.826,与Yang等[31]的研究相似,提示GP73对肝癌有着中等的诊断价值。
因本Meta分析的研究人群无种族和HBV感染背景差异,故异质性稍低于Yang等[31]的研究(I2:77.4% vs. 95.4%)。Meta回归分析提示研究间异质性与对照人群差异有关,亚组分析发现仅纳入肝癌高发患者为对照的B亚组敏感度、DOR值和AUC低于同时纳入肝癌高发患者和健康人为对照的A亚组。此结果可能原因为:⑴ 肝癌高发患者的GP73水平明显高于健康人[28, 32],故B亚组对照人群的GP73平均水平高于A亚组,以致通过ROC曲线决定的肝癌诊断阈值相应变大,而引起敏感度下降和诊断效能降低;⑵ B亚组的总原始研究数(n=3)和样本量均低于A亚组(n=11),亚组分析的实际结果可能是与两亚组中其他临床混杂因素相关,故此结论还需大样本数据进一步验证。因此,研究对照应同时纳入健康人和患有与该疾病相鉴别的患者,否则将会夸大或低估真实诊断价值[33]。例如,Zhang等[34]仅以健康人为对照的研究结果发现GP73诊断肝癌的敏感度、特异度和AUC高达97%、87%和0.98。故而,本Meta分析在制定纳排标准时排除了仅以健康人为对照的原始数据。
另外,本研究还绘制Fagan图发现当设定验前概率为50%时,阳性、阴性GP73的验后概率分别为78%和26%。即当假设临床医师综合就诊患者的临床表现和个人经验诊断其患肝癌的可能性为50%时,通过检测GP73水平后,若结果为阳性,则医师明确诊断该患者为肝癌的正确率从50%增加至78%;若GP73水平为阴性则该患者患肝癌的可能性从50%降至26%,故从验前概率到验后概率的变化程度并不明显。由此可知,GP73单独应用于确定或排除肝癌诊断的临床应用价值有限。
通过发表偏倚分析发现,在8篇样本量低于200例的原始研究中有6篇研究效应量较大,DOR值约为15.14~29.66,另2篇研究效应量较小,DOR值为9.00和9.10。可能因部分GP73诊断肝癌的阴性研究结果未予发表,而导致了发表偏倚的存在,故呈现为回归线两侧不对称的漏斗图,这也是目前许多诊断性Meta分析共同存在的问题。因此,本Meta分析可能会高估GP73对肝癌的诊断作用。
本研究仍存在一些局限性:⑴ 收集文献局限于各数据库公开发表的原始研究,而未搜索可能含阴性结果的灰色文献;⑵ 纳入的原始研究间异质性较大,故在合并效应量时选择了随机效应模型;⑶ 纳入的总样本量较小;⑷ 多数原始研究未连续性或随机纳入研究病例,以致入选的病例不符合疾病的流行病学特征 ,且仅1篇研究在试验过程中遵循了盲法原则,质量较低,故以后的相关研究应尽量避免此类弊端。
综上所述,GP73对肝癌有一定的诊断意义,但作为肿瘤标志物单独应用于确诊或排除肝癌患者的价值有限,尚需结合其他检查。目前GP73的诊断价值仍需高质量、大样本、多中心的研究数据来论证,为其能应用于临床提供更加牢靠的依据。
[1] 陈万青, 郑荣寿, 张思维,等. 2013年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2017, 26(1):1–7.Chen WQ, Zheng RS, Zhang SW, et al. Report of Cancer Incidence and Mortality in China,2013[J]. Bulletin of Chinese Cancer, 2017,26(1):1–7.
[2] Waidely E, Al-Yuobi AR, Bashammakh AS, et al. Serum protein biomarkers relevant to hepatocellular carcinoma and their detection[J]. Analyst, 2016, 141(1):36–44. doi: 10.1039/c5an01884f.
[3] Kladney RD, Bulla GA, Guo L, et al. Gp73, a novel golgi-localized protein upregulated by viral infection[J]. Gene, 2000, 249(1/2):53–65.
[4] Zhao J, Xu T, Wang F, et al. miR-493–5p suppresses hepatocellular carcinoma cell proliferation through targeting GP73[J].Biomed Pharmacother, 2017, 90:744–751. doi: 10.1016/j.biopha.2017.04.029.
[5] Zhang YL, Zhang YC, Han W, et al. Effect of GP73 silencing on proliferation and apoptosis in hepatocellular cancer[J]. World J Gastroenterol, 2014, 20(32):11287–11296. doi: 10.3748/wjg.v20.i32.11287.
[6] Jin D, Tao J, Li D, et al. Golgi protein 73 activation of MMP-13 promotes hepatocellular carcinoma cell invasion[J]. Oncotarget,2015, 6(32):33523–33533. doi: 10.18632/oncotarget.5590.
[7] Dai M, Chen X, Liu X, et al. Diagnostic Value of the Combination of Golgi Protein 73 and Alpha-Fetoprotein in Hepatocellular Carcinoma: A Meta-Analysis[J]. PLoS One, 2015, 10(10):e0140067.doi: 10.1371/journal.pone.0140067.
[8] Whiting PF, Rutjes AW, Westwood ME, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies[J].Ann Intern Med, 2011, 155(8):529–536. doi: 10.7326/0003–4819–155–8–201110180–00009.
[9] Jaeschke R, Guyatt GH, Sackett DL. Users' guides to the medical literature. III. How to use an article about a diagnostic test. B. What are the results and will they help me in caring for my patients?The Evidence-Based Medicine Working Group[J]. JAMA, 1994,271(9):703–707.
[10] 张小曼, 魏梅娟, 许正锯, 等. 血清甲胎蛋白、白细胞介素-6和高尔基体蛋白73在肝脏疾病中的表达特点及其对肝细胞癌的诊断价值[J]. 中华实验和临床感染病杂志:电子版, 2017, 11(4):339–344. doi:10.3877/cma.j.issn.1674–1358.2017.04.006.Zhang XM, Wei MJ, Xu ZJ, et al. Pattern of serum α-fetal protein,intereleukin-6 and Golgi protein 73 expressed in liver diseases and their diagnostic value on hepatocellular carcinoma[J].Chinese Journal of Experimental and Clinical Infectious Diseases:Electronic Version, 2017, 11(4):339–344. doi:10.3877/cma.j.issn.1674–1358.2017.04.006.
[11] 熊志远, 倪东京, 何维新. 血清GP73及DCP水平用于乙肝病毒相关肝细胞癌诊断的研究[J]. 浙江临床医学, 2017, 19(10):1888–1889.Xiong ZY, Ni DJ, He WX. Analysis of using serum GP73 and DCP levels in diagnosis of hepatitis B virus-related hepatocellular carcinoma[J]. Zhejiang Clinical Medical Journal, 2017,19(10):1888–1889.
[12] 张文昭, 陶才华, 李莹. 乙肝患者血清高尔基蛋白73水平改变及其临床意义[J]. 检验医学与临床, 2016, 13(23):3325–3328.doi:10.3969/j.issn.1672–9455.2016.23.016.Zhang WZ, Tao CH, Li Y. The changes and clinical value of serum Golgi protein 73 level in chronic HBV patient[J]. Laboratory Medicine and Clinic, 2016, 13(23):3325–3328. doi:10.3969/j.issn.1672–9455.2016.23.016.
[13] Xu Z, Liu L, Pan X, et al. Serum Golgi protein 73 (GP73)is a diagnostic and prognostic marker of chronic HBV liver disease[J]. Medicine (Baltimore), 2015, 94(12):e659. doi: 10.1097/MD.0000000000000659.
[14] Gao G, Dong F, Xu X, et al. Diagnostic value of serum Golgi protein 73 for HBV-related primary hepatic carcinoma[J]. Int J Clin Exp Pathol, 2015, 8(9):11379–11385.
[15] 彭经宙. 血清GP73在HBsAg阳性原发性肝癌中的检测价值[J]. 实用癌症杂志, 2015, 30(11):1615–1617. doi:10.3969/j.issn.1001–5930.2015.11.010.Peng JZ. Value of Serum GP73 in the Detection of HBsAg Positive Primary Hepatic Carcinoma[J]. The Practical Journal of Cancer, 2015, 30(11):1615–1617. doi:10.3969/j.issn.1001–5930.2015.11.010.
[16] 闫跃武. 血清GP73在HBsAg阳性原发性肝癌中的检测及其临床意义[D]. 银川: 宁夏医科大学, 2014.Yan YW. Detection serum GP73 and HBsAg in primary liver cancer and the clinical significance[D]. Yinchuan: Ningxia Medical University, 2014.
[17] 翟璐. 血清AFP联合GP73、Vimentin、SCCA-IgM IC对HBV相关早期HCC的诊断价值[D]. 天津: 天津医科大学, 2014.Zhai L. Value of combined detection of serum AFP, GP73, Vimentin and SCCA-IgM IC in early diagnosis of HBV-related HCC[D].Tianjin: Tianjin Medical University, 2014.
[18] 李明, 胥萍, 朱传武, 等. 高尔基体糖蛋白73在乙型肝炎相关性肝细胞癌患者血清及肝组织表达的研究[J]. 中华临床医师杂志:电子版, 2013, 7(20):9126–9130. doi:10.3877/cma.j.issn.1674–0785.2013.20.028.Li M, Xu P, Zhu CW, et al. Expression of Golgi glycoprotein(GP73)in serum and liver tissues from patients with hepatocellular carcinoma in a hepatitis B-endemic population[J]. Chinese Journal of Clinicians:Electronic Edition, 2013, 7(20):9126–9130.doi:10.3877/cma.j.issn.1674–0785.2013.20.028.
[19] 王辉, 高国生, 祝成亮, 等. 血清高尔基体蛋白联合甲胎蛋白诊断HBsAg阳性原发性肝癌价值探讨[J]. 中国预防医学杂志, 2012,13(7):486–488.Wang H, Gao GS, Zhu CL, et al. Evaluation of serum Goigi protein 73 and Aipha-fetoprotein on diagnosis of HBsAg hepatoceilular carcinoma[J]. China Preventive Medicine, 2012, 13(7):486–488.
[20] 郑昭敏, 韩绍磊, 杜文军, 等. 血清高尔基体蛋白73在乙型肝炎相关性肝细胞癌早期诊断中的价值[J]. 中华实验和临床感染病杂志:电子版, 2011, 5(4):459–464. doi:10.3877/cma.j.issn.1674–1358.2011.04.010.Zheng ZM, Han SL, Du WJ, et al. Value of serum GP73 on early diagnosis of hepatocellular carcinoma based on hepatitis B[J].Chinese Journal of Experimental and Clinical Infectious Diseases:Electronic Version, 2011, 5(4):459–464. doi:10.3877/cma.j.issn.1674–1358.2011.04.010.
[21] 孔祥亘, 韩绍磊, 郑昭敏, 等. 高尔基体蛋白73联合甲胎蛋白异质体在原发性肝癌诊断中的价值[J]. 山东大学学报:医学版, 2011,49(4):110–114.Kong XG, Han SL, Zheng ZM, et al. Values of Golgi protein 73 and Alpha-fetoprotein-L3 in the diagnosis of primary hepatic carcinoma[J]. Journal of Shandong University:Health Science,2011, 49(4):110–114.
[22] Hu JS, Wu DW, Liang S, et al. GP73, a resident Golgi glycoprotein,is sensibility and specificity for hepatocellular carcinoma of diagnosis in a hepatitis B-endemic Asian population [J]. Med Oncol,2010, 27(2):339–345. doi: 10.1007/s12032–009–9215-y.
[23] 赵秀英, 李宁, 丁惠国, 等. 血清高尔基体糖蛋白73在肝细胞癌诊断中的作用[J]. 中华肿瘤杂志, 2010, 32(12):943–946.doi:10.3760/cma.j.issn.0253–3766.2010.12.014.Zhao XY, Li N, Ding HG, et al. Detection and evaluation of serum GP73, a resident Golgi glycoprotein, as a marker in diagnosis of hepatocellular carcinoma[J]. Chinese Journal of Oncology, 2010,32(12):943–946. doi:10.3760/cma.j.issn.0253–3766.2010.12.014.
[24] Kew MC. Hepatocellular carcinoma: epidemiology and risk factors[J]. J Hepatocell Carcinoma, 2014, 1:115–125. doi: 10.2147/JHC.S44381.
[25] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J].CA Cancer J Clin, 2015, 65(2):87–108. doi: 10.3322/caac.21262.
[26] Wang F, Long Q, Gong Y, et al. Epithelium-Specific ETS (ESE)-1 upregulated GP73 expression in hepatocellular carcinoma cells[J].Cell Biosci, 2014, 4(1):76. doi: 10.1186/2045–3701–4–76.
[27] Bachert C, Fimmel C, Linstedt AD. Endosomal trafficking and proprotein convertase cleavage of cis Golgi protein GP73 produces marker for hepatocellular carcinoma[J]. Traffic, 2007, 8(10):1415–1423. doi: 10.1111/j.1600–0854.2007.00621.x.
[28] Mao Y, Yang H, Xu H, et al. Golgi protein 73 (GOLPH2) is a valuable serum marker for hepatocellular carcinoma[J]. Gut, 2010,59(12):1687–1693. doi: 10.1136/gut.2010.214916.
[29] 陈建国, 朱源荣, 陆卫中, 等. 高尔基体糖蛋白73在启东地区人群中的分布与随访[J]. 中华肝脏病杂志, 2012, 20(10):780–784.doi:10.3760/cma.j.issn.1007–3418.2012.010.015.Chen JG, Zhu YR, Lu WZ, et al. Survey of the serum hepatocellular carcinoma marker Golgi glycoprotein (GP73) among Qidong residents and correlation analysis to outcome at two-year followup[J]. Chinese Journal of Hepatology, 2012, 20(10):780–784.doi:10.3760/cma.j.issn.1007–3418.2012.010.015.
[30] Zhou Y, Yin X, Ying J, et al. Golgi protein 73 versus alphafetoprotein as a biomarker for hepatocellular carcinoma: a diagnostic meta-analysis[J]. BMC Cancer, 2012, 12:17. doi:10.1186/1471–2407–12–17.
[31] Yang J, Li J, Dai W, et al. Golgi protein 73 as a biomarker for hepatocellular carcinoma: A diagnostic meta-analysis[J]. Exp Ther Med, 2015, 9(4):1413–1420. doi: 10.3892/etm.2015.2231.
[32] 陆兴热, 骆葱, 陈凤羽, 等. AFP、GP73、SOD联合检测在原发性肝癌患者诊断中应用价值[J]. 中国普通外科杂志, 2016,25(7):1076–1080. doi:10.3978/j.issn.1005–6947.2016.07.023.Lu XR, Luo C, Chen FY, et al. The applicable value of combined detection of AFP, GP73 and SOD in diagnosis of primary liver cancer[J]. Chinese Journal of General, 2016, 25(7):1076–1080.doi:10.3978/j.issn.1005–6947.2016.07.023.
[33] Lijmer JG, Mol BW, Heisterkamp S, et al. Empirical evidence of design-related bias in studies of diagnostic tests[J]. JAMA, 1999,282(11):1061–1066.
[34] Zhang Y, Xi Y, Fang J, et al. Identification and characterization of monoclonal antibodies against gp73 for use as a potential biomarker in liver cancer screening and diagnosis[J]. J Immunoassay Immunochem, 2016, 37(4):390–406. doi:10.1080/15321819.2016.1154866.