肝部分切除术是目前治疗肝脏良恶性肿瘤的主要根治性手段,但手术中肝脏断面出血仍是广大肝脏外科医生面临的首要问题,也是影响患者预后的重要因素[1-2]。肝切除术控制术中出血的方法主要包括入肝和出肝血流的控制。相对于入肝血流的阻断,出肝血流的控制一直被认为是复杂肝切除手术(主要包括左、右半肝和中肝切除)的难点[3-4]。研究[5-6]认为来自肝脏静脉系统的出血和中心静脉压(central venous pressure,CVP)密切相关,降低CVP可以明显减少来自静脉系统的出血。目前临床上常用的手段为控制性低CVP(controlled lower central venous pressure,CLCVP)技术,包括限制液体入量、应用利尿剂或血管舒张剂、改变体位等[7],而通过肝下下腔静脉(infrahepatic inferior vena cava,IIVC)阻断的方式降低CVP也在临床中逐步开展[8]。本研究对上述两种方法对控制复杂肝切除术中出血的有效性和安全性进行比较,并报告如下。
1 资料与方法
1.1 一般资料
回顾性分析四川省人民医院自2016年3月—2017年12月符合纳入标准并在肝胆胰外科进行择期左、右半肝或中肝切除手术治疗的103例原发性肝癌患者临床资料。其中男87例(84.5%),女16例(15.5%);年龄35~74岁,平均(51.64±14.38)岁。病例纳入标准:⑴ 符合2011年卫生部《原发性肝癌诊疗规范》中肝细胞癌临床诊断标准及手术适应证,且术后病理诊断结果证实为肝细胞性肝癌。⑵ 根据术前及术中的综合评估,最终行标准左、右半肝或中肝切除手术。⑶ 患者一般情况良好,术前检查未发现合并其他系统严重疾病。⑷ 术前未接受免疫抑制剂治疗、抗肿瘤治疗或化疗。⑸ 术前肝功能Child-Pugh分级为A级或B级。⑹ 术中不涉及除胆囊外的其他脏器联合切除。排除标准:⑴ 术前或术中发现有肺部或其他肝外组织转移。⑵ 术前或术中发现肿瘤自发破裂或出血。⑶ 严重肝硬化,如ICGR15>15%,凝血功能异常者。所有患者术前均签署由医院伦理委员会批准的患者知情同意书。
1.2 分组情况
103例患者根据术中控制出血方式的不同分为两组,其中行IIVC阻断56例(IIVC组),CLCVP 47例(CLCVP组)。两组患者的术前(性别、年龄、Child-Pugh分级、ICGR15、肝肾功能及肿瘤最大直径)及术中情况(麻醉时间、手术时间、第一肝门总阻断时间及手术切除方式)均用χ2检验和方差分析进行统计分析。通过检验,上述指标在两组中差异无统计学意义(均P>0.05)。两组患者术前及术中资料见表1。
表1 两组患者一般资料比较
Table 1 Comparison of the general data between the two groups of patients
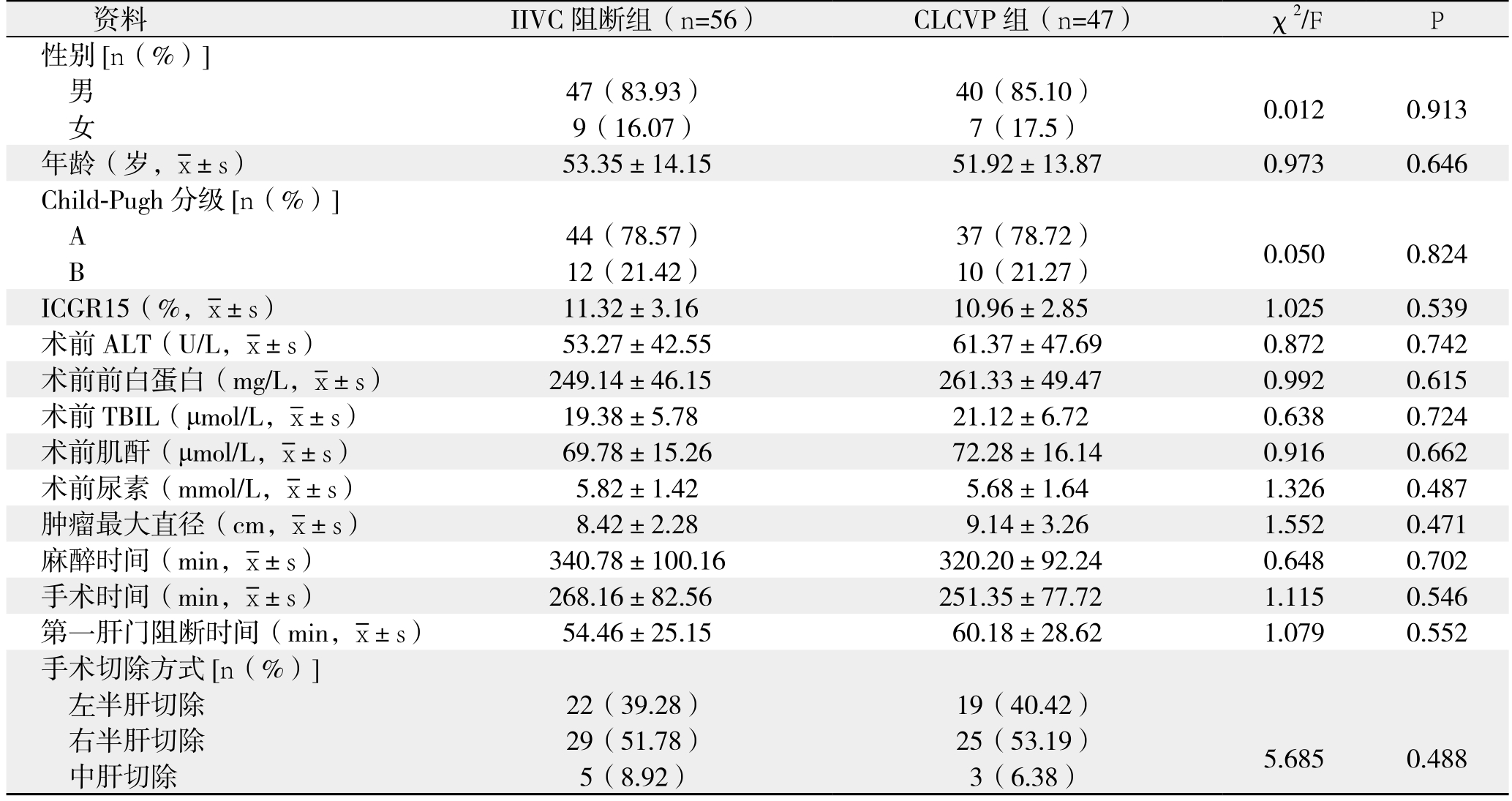
资料 IIVC阻断组(n=56) CLCVP组(n=47) χ2/F P性别[n(%)]男47(83.93) 40(85.10) 0.012 0.913女9(16.07) 7(17.5)年龄(岁,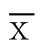 ±s) 53.35±14.15 51.92±13.87 0.973 0.646 Child-Pugh分级[n(%)]A 44(78.57) 37(78.72) 0.050 0.824 B 12(21.42) 10(21.27)ICGR15(%,
±s) 53.35±14.15 51.92±13.87 0.973 0.646 Child-Pugh分级[n(%)]A 44(78.57) 37(78.72) 0.050 0.824 B 12(21.42) 10(21.27)ICGR15(%,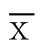 ±s) 11.32±3.16 10.96±2.85 1.025 0.539术前 ALT(U/L,
±s) 11.32±3.16 10.96±2.85 1.025 0.539术前 ALT(U/L,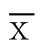 ±s) 53.27±42.55 61.37±47.69 0.872 0.742术前前白蛋白(mg/L,
±s) 53.27±42.55 61.37±47.69 0.872 0.742术前前白蛋白(mg/L,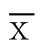 ±s) 249.14±46.15 261.33±49.47 0.992 0.615术前 TBIL(μmol/L,
±s) 249.14±46.15 261.33±49.47 0.992 0.615术前 TBIL(μmol/L,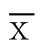 ±s) 19.38±5.78 21.12±6.72 0.638 0.724术前肌酐(μmol/L,
±s) 19.38±5.78 21.12±6.72 0.638 0.724术前肌酐(μmol/L,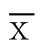 ±s) 69.78±15.26 72.28±16.14 0.916 0.662术前尿素(mmol/L,
±s) 69.78±15.26 72.28±16.14 0.916 0.662术前尿素(mmol/L,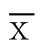 ±s) 5.82±1.42 5.68±1.64 1.326 0.487肿瘤最大直径(cm,
±s) 5.82±1.42 5.68±1.64 1.326 0.487肿瘤最大直径(cm,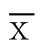 ±s) 8.42±2.28 9.14±3.26 1.552 0.471麻醉时间(min,
±s) 8.42±2.28 9.14±3.26 1.552 0.471麻醉时间(min,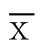 ±s) 340.78±100.16 320.20±92.24 0.648 0.702手术时间(min,
±s) 340.78±100.16 320.20±92.24 0.648 0.702手术时间(min,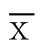 ±s) 268.16±82.56 251.35±77.72 1.115 0.546第一肝门阻断时间(min,
±s) 268.16±82.56 251.35±77.72 1.115 0.546第一肝门阻断时间(min,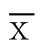 ±s) 54.46±25.15 60.18±28.62 1.079 0.552手术切除方式[n(%)]左半肝切除 22(39.28) 19(40.42)右半肝切除 29(51.78) 25(53.19) 5.685 0.488中肝切除 5(8.92) 3(6.38)
±s) 54.46±25.15 60.18±28.62 1.079 0.552手术切除方式[n(%)]左半肝切除 22(39.28) 19(40.42)右半肝切除 29(51.78) 25(53.19) 5.685 0.488中肝切除 5(8.92) 3(6.38)
1.3 手术及麻醉方法
所有患者均采用气管插管静吸复合全麻下手术,术前行右侧颈部深静脉穿刺置管接中心静脉测压装置监测CVP,桡动脉插管监测动脉血压。手术均行右上腹部反L型切口,根据切除部位游离肝脏韧带。两组患者均游离肝十二指肠韧带韧带后用红色细导尿管环绕肝十二指肠韧带行Pringle法行第一肝门阻断。具体阻断方法为:切肝开始连续阻断15 min后,松开阻断带恢复入肝血流5 min,再开始下一次阻断,直至切肝结束。IIVC阻断组患者于右肾静脉开口上方IVC右侧切开腹膜,大血管钳钝性分离,用线带环绕IIVC,切肝开始后用乳胶管收紧线带行IIVC阻断。IIVC阻断组液体管理按照累积损失量和生理需要量以1.5:1的比例输入晶体液和胶体液。CLCVP组患者采用CLCVP技术。其具体方案为:患者取仰卧头高脚低15°体位,切肝开始时通过控制液体输入量和复合静脉麻醉控制CVP在2~5 cm H2O(1 cmH2O=0.098 kPa),如CVP仍>5 cmH2O,静脉输注少量硝酸甘油降低CVP。切肝结束后快速补充胶体液和晶体液使CVP恢复至6 cm H2O以上。两组患者均使用术中超声定位肿瘤范围及与管道关系,并采用超声刀加钳夹法离断肝脏实质。如果术中血压过低、心率加快等,应用去甲肾上腺素或多巴胺维持血压,保持术中动脉SBP≥90 mmHg(1 mmHg=0.133 kPa)或者平均动脉压(MAP)≥60 mmHg,各组患者尿量不少于1 mL/(kg·h)。术中血红蛋白低于80 g/L开始输血。术后均予以常规保肝、预防感染、补充能量、水电解质平衡等治疗,并嘱早期恢复饮食及下床活动。
1.4 观察指标
观察并记录两组患者切肝前和切肝过程中CVP,切肝过程和手术总出血量,术中尿量,术后并发症(包括术后腹腔出血、胆汁漏、肝衰、肾衰、大量胸腔积液、大量腹腔积液、肺部感染、伤口感染、肺栓塞)发生率,术中输血率,术后1、3、7 d肝功能(TBIL)、ALT、前白蛋白及肾功能(肌酐、尿素)情况。
1.5 统计学处理
采用SPSS 19.0软件包对数据进行统计描述和分析。计量资料以均数±标准差( ±s)表示,计数资料用频数表示。分别采用单因素方差分析和Pearson χ2检验进行统计学分析。P<0.05为差异有统计学意义。
±s)表示,计数资料用频数表示。分别采用单因素方差分析和Pearson χ2检验进行统计学分析。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者CVP变化及相关临床指标比较
两组患者切肝前CVP对比,差异无统计学意义(P>0.05);两组在切肝过程中CVP均明显下降,与切肝前对比,差异均有统计学意义(均P<0.05);IIVC阻断组切肝过程中CVP值明显低于CLCVP组,且出血量和手术总出血量均低于CLCVP组(均P<0.05);两组患者术中尿量均正常;两组术中尿量、输血率及术后并发症发生率差异均无统计学意义(均P>0.05)(表2)。
表2 两组患者术中及术后情况比较
Table 2 Comparison of the intra- and postoperative variables between the two groups of patients
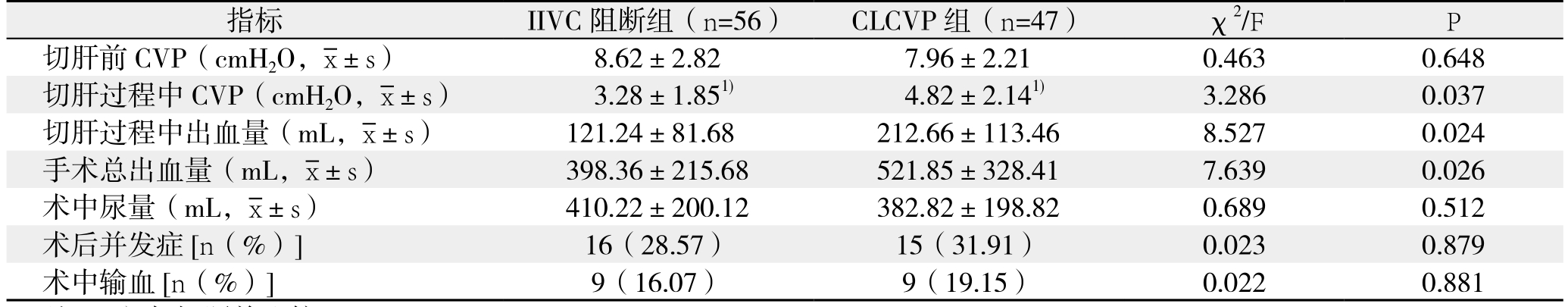
注:1)与切肝前比较,P<0.05
Note: P<0.05 vs. preoperative value
指标 IIVC阻断组(n=56) CLCVP组(n=47) χ2/F P切肝前 CVP(cmH2O, ±s) 8.62±2.82 7.96±2.21 0.463 0.648切肝过程中CVP(cmH2O,
±s) 8.62±2.82 7.96±2.21 0.463 0.648切肝过程中CVP(cmH2O, ±s) 3.28±1.851) 4.82±2.141) 3.286 0.037切肝过程中出血量(mL,
±s) 3.28±1.851) 4.82±2.141) 3.286 0.037切肝过程中出血量(mL,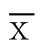 ±s) 121.24±81.68 212.66±113.46 8.527 0.024手术总出血量(mL,
±s) 121.24±81.68 212.66±113.46 8.527 0.024手术总出血量(mL,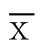 ±s) 398.36±215.68 521.85±328.41 7.639 0.026术中尿量(mL,
±s) 398.36±215.68 521.85±328.41 7.639 0.026术中尿量(mL,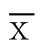 ±s) 410.22±200.12 382.82±198.82 0.689 0.512术后并发症[n(%)] 16(28.57) 15(31.91) 0.023 0.879术中输血[n(%)] 9(16.07) 9(19.15) 0.022 0.881
±s) 410.22±200.12 382.82±198.82 0.689 0.512术后并发症[n(%)] 16(28.57) 15(31.91) 0.023 0.879术中输血[n(%)] 9(16.07) 9(19.15) 0.022 0.881
2.2 两组患者术后肝、肾功能变化情况
与术前比较,两组患者术后ALT均在术后第1天明显上升,随后逐渐下降;组间对比,术后第1、7天两组之间无无统计学差异(均P>0.05),术后第3天IIVC组下降更明显,与CLCVP组差异有统计学意义(P<0.05);两组患者术后前白蛋白与术前比较,均逐渐下降,组间对比无统计学差异(均P>0.05);两组患者术后TBIL与术前相比,均在术后第1天开始升高,术后第3天开始下降,组间对比,术后第3、7天IIVC阻断组均低于CLCVP组,差异均有统计学意义(均P<0.05);两组患者术后肾功能指标与术前及组间比较,差异均无统计学意义(均P>0.05)(表3)。
表3 两组患者术后肝肾功能情况比较(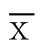 ±s)
±s)
Table 3 Comparison of parameters for liver and renal functions between the two groups of patients (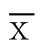 ±s)
±s)
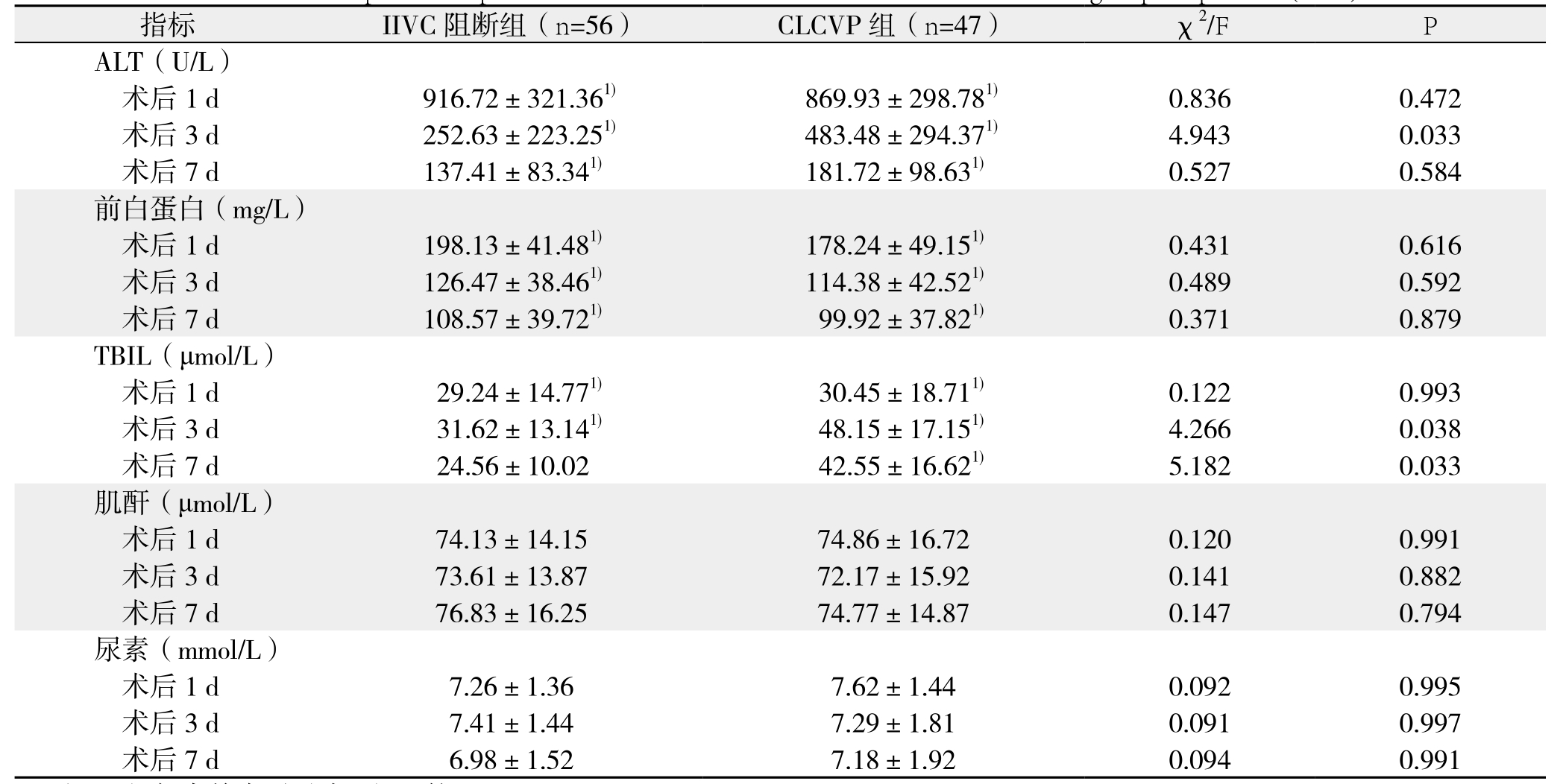
注:1)与术前水平(表1)比较,P<0.05
Note: 1) P<0.05 vs. preoperative level (table 1)
?
3 讨 论
肝脏是人体内最大的消化器官,由于其位置深在,血管丰富,解剖结构复杂,因此在肝切除术中容易出现断面大量出血,特别是复杂的肝切除(主要是左、右半肝及中肝切除)过程中,大量的出血或输血可明显增加肝癌术后的并发症发生率。控制肝切除术中出血主要包括控制流入道和流出道的血流。其中流入道血流的控制常用间歇性阻断肝十二指肠韧带(Pringle法),其操作简单,容易掌握。但流出道血流的控制一直是广大肝脏外科医生探索的热点和难点[2, 8]。选择性全肝血流阻断和半肝血流完全阻断法虽然可有效阻断或控制来自肝静脉系统的反流性出血,但其因需要解剖第二肝门或建立肝后隧道等复杂的操作,不但使手术风险明显增大,且不能适用于一些与第二肝门关系密切的肿瘤[9-10]。
已有大量研究[11-12]发现肝脏流出道血流与CVP关系密切,降低CVP并在术中维持低压水平(<5 cmH2O)可明显减少肝切除术中来源于肝静脉系统的反流性出血。研究认为肝切除术中低CVP不但可使肝静脉血管压力降低,管径缩小,减少单位时间出血量,更为重要的是其避免腔静脉膨胀,使得复杂肝切除术中更容易解剖和控制肝静脉和肝短静脉,从而有效减少术中出血[3, 8]。目前临床上常用的降低CVP方法是CLCVP技术,即通过术中麻醉干预的方法维持低CVP,具体措施包括限制术中液体入量、应用利尿剂和(或)血管舒张剂、调整术中体位以及减少呼吸机潮气量等[5, 7]。2004年,日本学者Otsubo等[13]首先报道了IIVC阻断降低CVP在肝切除术中的应用,并发现其术中出血量明显低于单纯Pringle法,引起了广大肝脏外科医生的浓厚兴趣。但目前IIVC阻断与CLCVP两者对CVP控制、减少出血和安全性等方面比较目前仍无定论[8, 14-15]。
本研究分别采用CLCVP下单纯Pringle法和IIVC阻断联合Pringle法进行复杂肝切除术,比较发现:⑴ 两者均能有效降低CVP至5 cmH2O以下, IIVC阻断后CVP降低更明显(P<0.05)。分析原因主要是因为术中发现CLCVP技术要求限制液体量,部分患者容易引起血压波动,特别是在术中一旦出现快速出血后,限制入量和利尿剂、血管舒张剂等的应用难以进行。且此方法增加了麻醉管理的复杂性,并且有时很难调整和逆转,给部分麻醉医生带来心理上的畏惧。研究中也发现IIVC阻断后3例患者出现血压一过性下降(收缩压<80 mmHg),在立即放松阻断带或使用少量升压药物后血压恢复正常,随后采用不完全阻断IIVC(适当松开阻断带)3例患者均能平稳耐受。⑵ IIVC阻断联合Pringle法切肝过程中出血量和手术总出血量均少于CLCVP下单纯Pringle法(P<0.05)。其原因不仅有IIVC阻断后CVP降低更明显,有部分学者[16]也认为CLCVP容易引起血流动力学改变,全身重要器官灌注不足,而导致肝血窦内血液瘀滞、回流受阻,因此断肝过程中相对出血过多;而IIVC阻断后,肾静脉下方组织回心血量减少,阻断水平以上部位的血液回流加速,从而引起肝静脉系统的压力明显降低[17-18]。⑶ 两组患者均未发现肺栓塞、肾功能衰竭等严重并发症。对比发现两者术中尿量、术后肾功能及术后并发症无统计学意义。但IIVC阻断联合Pringle法组患者术后第3天ALT和术后第3、7天TBIL均低于CLCVP下单纯Pringle法组(P<0.05),证实IIVC阻断联合Pringle法术后肝功能恢复更快。分析其原因应该与IIVC阻断其麻醉诱导时间较短、术中血流动力学稳定、肝脏灌注影响较小等有关[19-20]。
综上所述,IIVC阻断联合Pringle法操作简单方便,相对于CLCVP技术,其对全身血流动力学影响较小,对肾功能无不良影响,肝功能恢复更快,且更容易降低CVP,减少术中肝脏断面出血,有利于提高复杂肝切除术的安全性,值得推广应用。
[1] Forner A, Reig M, Bruix J. Hepatocellular carcinoma[J]. Lancet,2018, 391(10127):1301–1314. doi: 10.1016/S0140–6736(18)30010–2.
[2] 张冲, 张超. 腹腔镜肝切除术中预防和控制出血的策略[J]. 中国普通外科杂志, 2017, 26(1):96–101. doi:10.3978/j.issn.1005–6947.2017.01.016.Zhang C, Zhang C. Strategy for prophylaxis and control of bleeding during laparoscopic hepatectomy[J]. Chinese Journal of General Surgery, 2017, 26(1):96–101. doi:10.3978/j.issn.1005–6947.2017.01.016.
[3] Moggia E, Rouse B, Simillis C, et al. Methods to decrease blood loss during liver resection: a network meta-analysis[J]. Cochrane Database Syst Rev, 2016, 10:CD010683. doi: 10.1002/14651858.CD010683.
[4] 佟庆, 丁伟, 晏冬, 等. 腹腔镜与开腹肝切除术治疗肝癌疗效的Meta分析[J]. 中国普通外科杂志, 2015, 24(1):27–33. doi:10.3978/j.issn.1005–6947.2015.01.006.Tong Q, Ding W, Yan D, et al. Meta-analysis of efficacy of laparoscopic versus open liver resection for liver cancer[J]. Chinese Journal of General Surgery, 2015, 24(1):27–33. doi:10.3978/j.issn.1005–6947.2015.01.006.
[5] 朱荣涛, 郭文治, 李捷, 等. 控制性低中心静脉压在腹腔镜肝叶切除术中的应用[J]. 中国普通外科杂志, 2018, 27(1):42–48.doi:10.3978/j.issn.1005–6947.2018.01.007.Zhu RT, Guo WZ, Li J, et al. Application of controlled low central venous pressure in laparoscopic hepatic lobectomy[J]. Chinese Journal of General Surgery, 2018, 27(1):42–48. doi:10.3978/j.issn.1005–6947.2018.01.007.
[6] Ratti F, Cipriani F, Reineke R, et al. Intraoperative monitoring of stroke volume variation versus central venous pressure in laparoscopic liver surgery: a randomized prospective comparative trial[J]. HPB (Oxford), 2016, 18(2):136–144. doi: 10.1016/j.hpb.2015.09.005.
[7] Zatloukal J, Pradl R, Kletecka, et al. Comparison of absolute fluid restriction versus relative volume redistribution strategy in low central venous pressure anesthesia in liver resection surgery:a randomized controlled trial[J]. Minerva Anestesiol, 2017,83(10):1051–1060. doi: 10.23736/S0375–9393.17.11824–9.
[8] Hughes MJ, Ventham NT, Harrison EM, et al. Central venous pressure and liver resection: a systematic review and metaanalysis[J]. HPB (Oxford), 2015, 17(10):863–871. doi: 10.1111/hpb.12462.
[9] 郝杰, 王博, 刘学民, 等. 肝下下腔静脉阻断降低中心静脉压在肝切除手术中应用的系统评估[J]. 现代肿瘤医学, 2016, 24(4):614–617. doi:10.3969/j.issn.1672–4992.2016.04.031.Hao J, Wang B, Liu XM, et al. Systematic evaluation for the role of decreasing central venous pressure by intrahepatic inferior vena cava clamping in liver resection[J]. Journal of Modern Oncology,2016, 24(4):614–617. doi:10.3969/j.issn.1672–4992.2016.04.031.
[10] Rekman J, Wherrett C, Bennett S, et al. Safety and feasibility of phlebotomy with controlled hypovolemia to minimize blood loss in liver resections[J]. Surgery, 2017, 161(3):650–657. doi: 10.1016/j.surg.2016.08.026.
[11] Sucher R, Seehofer D, Pratschke J. Management of intraoperative and postoperative bleeding in liver surgery[J]. Chirurg. 2015,86(2):114–120. doi: 10.1007/s00104–014–2879–7.
[12] 陈孝平. 肝脏外科的发展历程与展望[J]. 中华消化外科杂志, 2015, 14(1):前插9-前插10. doi:10.3760/j.issn.1673–9752.2015.01.025.Chen XP. Development history and prospects of liver surgery[J].Chinese Journal of Digestive Surgery, 2015, 14(1): front insert 9–10.doi:10.3760/j.issn.1673–9752.2015.01.025.
[13] Otsubo T, Takasaki K, Yamamoto M, et al. Bleeding during hepatectomy can be reduced by clamping the inferior vena cava below the liver[J]. Surgery, 2004, 135(1):67–73. doi: 10.1016/S0039.
[14] Ueno M, Kawai M, Hayami S, et al. Partial clamping of the infrahepatic inferior vena cava for blood loss reduction during anatomic liver resection: A prospective, randomized, controlled trial[J]. Surgery, 2017, 161(6):1502–1513. doi: 10.1016/j.surg.2016.12.010.
[15] Rahbari NN, Koch M, Zimmermann JB, et al. Infrahepatic inferior vena cava clamping for reduction of central venous pressure and blood loss during hepatic resection: a randomized controlled trial[J]. Ann Surg, 2011, 253(6):1102–1110. doi: 10.1097/SLA.0b013e318214bee5.
[16] Correa-Gallego C, Berman A, Denis SC, et al. Renal function after low central venous pressure-assisted liver resection: assessment of 2116 cases[J]. HPB(Oxford), 2015, 17(3):258–264. doi: 10.1111/hpb.12347.
[17] Zhang W, Wang J, Li C, et al. Infrahepatic inferior vena cava clamping with Pringle maneuvers for laparoscopic extracapsular enucleation of giant liver hemangiomas[J]. Surg Endosc, 2017,31(9):3628–3636. doi: 10.1007/s00464–016–5396–6.
[18] 隋承军, 陆炯炯, 杨甲梅. 肝下下腔静脉阻断在肝切除术中的应用[J]. 中国实用外科杂志, 2013, 33(6):522–525.Sui CJ, Lu JJ, Yang JM. Application of infrahepatic inferior vena cava clamping in liver resection[J]. Chinese Journal of Practical Surgery, 2013, 33(6):522–525.
[19] Zhou Y, Zhang Z, Wan T. Effect of infrahepatic inferior vena cava clamping on bleeding during hepatic resection: A meta-analysis[J].Asian J Surg, 2017, pii: S1015–9584(17)30465–7. doi: 10.1016/j.asjsur.2017.11.003. [Epub ahead of print]
[20] Hamady Z, Toogood G. Infrahepatic inferior vena cava clamping for reduction of central venous pressure and blood loss during hepatic resection: a randomized controlled trial[J]. Ann Surg, 2015,261(1):e8. doi: 10.1097/SLA.0000000000000320.