淋巴瘤是原发于淋巴造血组织的恶性肿瘤,最常见侵犯部位为淋巴结、胃肠道、脾脏和骨髓,也可发生于肝脏。而非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)发生于肝外胆管在临床上是较罕见的,只有少数国内外病例报道,其临床表现、实验室检查及影像学检查缺乏特异性[1-3]。因此,临床诊断较困难,误诊率高,往往易误诊为胆管癌。其主要治疗方式包括手术切除、化疗、放疗或者不同方式联合治疗,但因原发性肝总管NHL在临床上较罕见,其缺乏最佳的治疗方案及预后共识。2017年9月本院收治1例原发性胆管NHL患者,现结合相关文献分析报告如下。
1 资料与方法
1.1 病例资料
患者 81岁,男性,因不明原因乏力、纳差,皮肤巩膜黄染1个月到医院就诊。体检:皮肤巩膜中度黄染,浅表淋巴结未扪及肿大。腹部平坦,无压痛及反跳痛,Murphy征阳性。余无其他阳性体征。腹部B超:肝内胆管普遍扩张,肝总管内径1.4 cm,胰头区探及一6.4 cm×4.2 cm类圆形团块回声像,边界清,内回声低,欠均匀,可见小片状无回声区,团块后方回声略强,胰体、胰尾部不大,形态尚规则,腺体回声均匀,主胰管未见扩张。腹部CT平扫+增强:胰头区见团块状软组织肿物影,增强扫描均匀尚强化,边界较清,与胰头及钩突部分界不清(接触面呈杯口样改变),大小约5.6 cm×4.5 cm,胆总管末段显示不清,以上水平胰管、胆总管、肝内胆管及胆囊不同程度扩张(图1A)。胰腺MRI+胰胆管水成像:胰头区见团块状异常信号肿物影,信号尚均匀,等T1、等T2信号改变,增强扫描轻度不均匀强化,边界较清,与胰头及钩突部分界不清(接触面呈杯口样改变),大小约5.5 cm×5.0 cm,邻近十二指肠及下腔静脉受压移位且与之关系密切,胆总管末段显示不清,以上水平胰管、胆总管、肝内胆管及胆囊不同程度扩张(图1B)。实验室检查:甲胎蛋白1.55 ng/mL,糖类抗原125 6.6 U/mL,糖类抗原153 12.8 U/mL,糖类抗原199(CA19-9)28 U/mL,总胆红素(TBIL)242.3 µmol/L,直接胆红素(DBIL)184.1 µmol/L,间接胆红素(IBIL)58.2 µmol/L,谷丙转氨酶(ALT)80 U/L,谷草转氨酶(AST)70 U/L,乳酸脱氢酶(LDH)175 U/L,乳酸脱氢酶同工酶1(LDH1)43 U/L。初步诊断:梗阻性黄疸原因待查(胰头癌?),于2017年10月12日在全麻下行胰十二指肠切除术,大体组织标本见图2;组织病理学及免疫组化:弥漫性大B细胞淋巴瘤 ;免疫表型:CD20(+),CD3(-),CD21(+),CD10(-),bcl-6(+),MUM-1(+),CD5(-),bcl-2(+,100%),C-myc(+,30%,阴性),Ki-67(+,80%)(图3)。术后诊断:胆总管弥漫性大B细胞淋巴瘤。
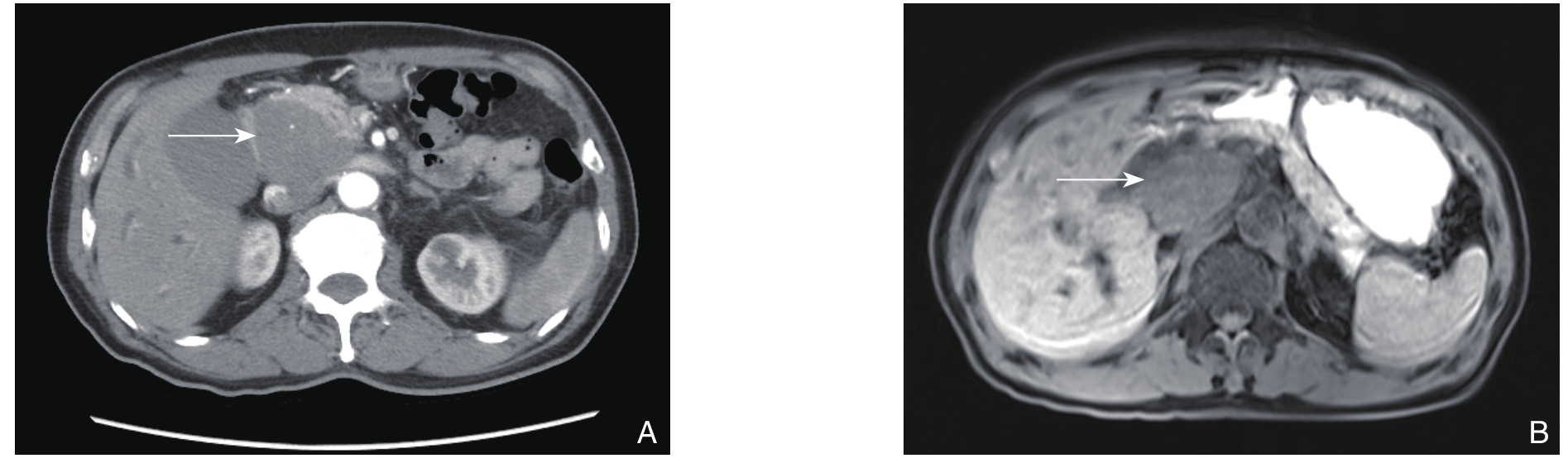
图1 患者影像学资料 A:腹部增强CT;B:腹部MRI
Figure 1 Imaging data the patient A: Enhanced abdominal CT scan; B: Abdominal MRI image
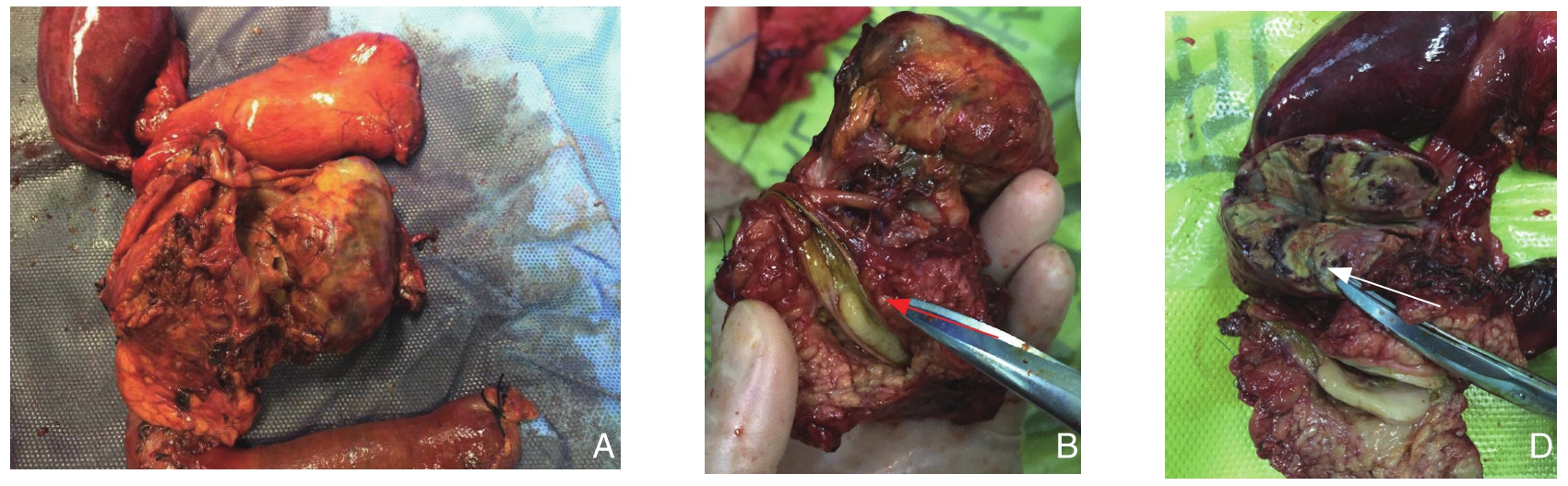
图2 大体组织标本 A:胆总管下段及胰头旁均可见明显肿物,质硬,与周围组织分界尚清; B:胰头部胆总管下段内见一肿物,大小4 cm×3.5 cm×3 cm,切面灰白实性质软,有出血坏死(箭头所示);C:胰头旁肠周脂肪组织内见另一肿物,大小6 cm×5 cm×4 cm,切面淡黄实性质软,绝大部分有出血坏死(箭头所示)
Figure 2 Gross tissue specimens A: Lesions in both the lower end of the common bile duct and the side of the head of pancreas, with firm consistency and relatively clear borders to the surrounding tissues; B: A lesion involving the pancreatic head and lower end of the common bile duct, 4 cm×3.5 cm×3 cm in size, and its gray colored, solid and soft section, with hemorrhage and necrosis (shown by arrow); C: Another lesion in fatty tissue by the side of pancreatic head, 6 cm×5 cm×4 cm in size, and its light yellow colored, solid and soft section, with extensive hemorrhage and necrosis (shown by arrow)
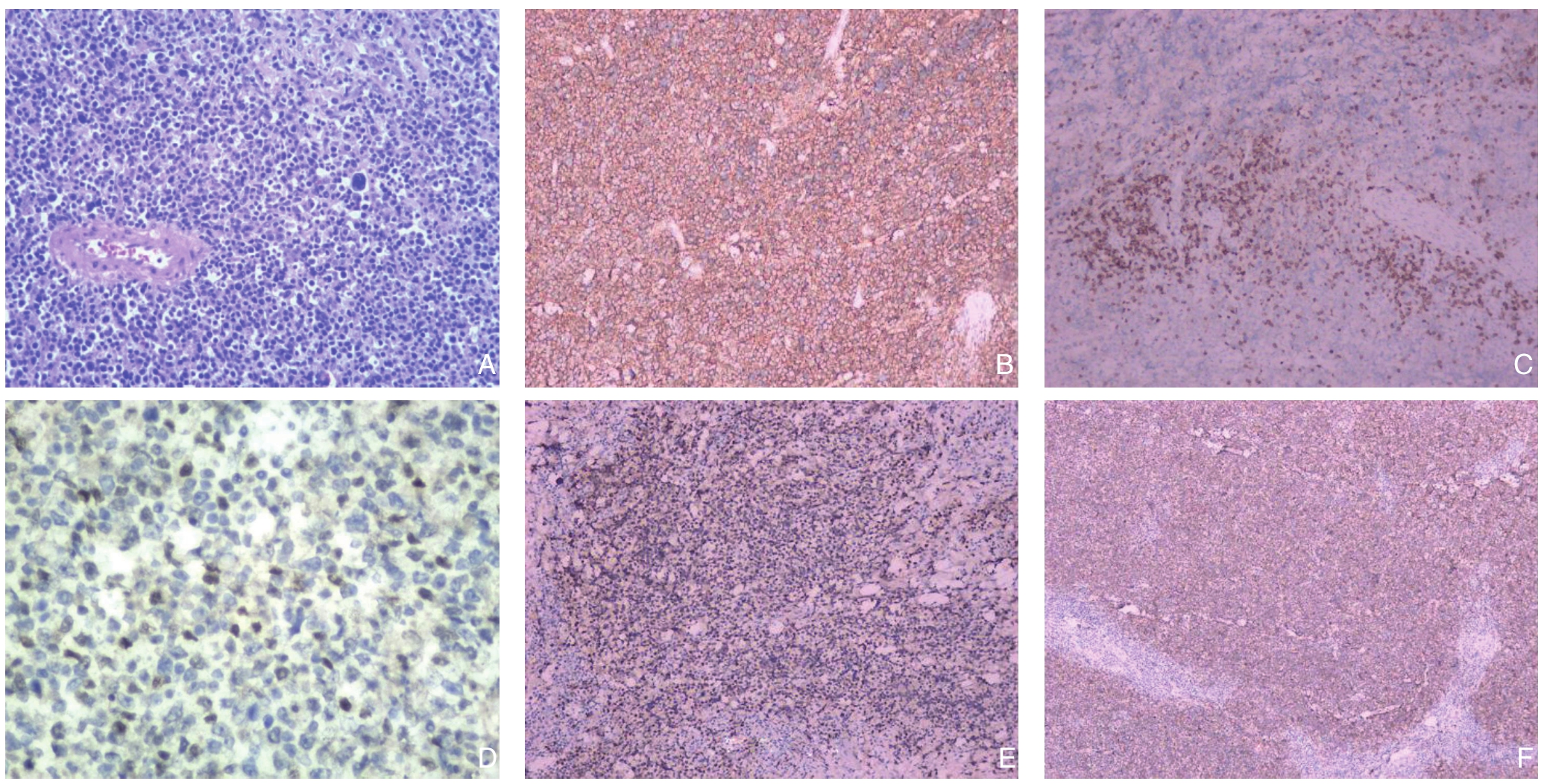
图3 组织病理学资料 A:HE染色显示,胆总管壁及黏膜上皮大量肿瘤细胞浸润,瘤细胞浆少,核深染,核仁清晰,可见核分裂(×200);B:CD20免疫组化染色(×200);C:CD3免疫组化染色(×100);D:C-myc免疫组化染色(×200);E:MUM-1免疫组化染色(×100);F:CD21免疫组化染色(×50)
Figure 3 Histopathological data A: HE staining showing infiltration of a large number of tumor cells in the common bile duct wall and mucosa epithelium, which presenting as scanty cytoplasm, deeply stained nuclei, clear nucleolus with nuclear division (×200);B: Immunohistological staining for CD20 (×200); C: Immunohistological staining for CD3 (×100); D: Immunohistological staining for C-myc (×200); E: Immunohistological staining for MUM-1 (×100); F: Immunohistological staining for CD21 (×50)
1.2 国内外报道病例检索
联合检索PubMed、Paper-Link、清华同方、维普、万方等数据库,检索词:胆总管,NHL,诊断,治疗。经查阅全文,排除相同的病例报道文献,最终从1982—2017年获得34篇文献[4-37],均经病理学确诊为原发性胆总管NHL。详细阅读并建立数据库,进行统计学分析。
1.3 统计学处理
生存率的比较用Kalan-Meier法,组间差异的比较用Log-rank检验法。P<0.05为差异有统计学意义。
2 结 果
2.1 患者一般资料与治疗情况
共计35例患者,其中男21例(60.0%),女14例(40.0%);0~18岁共1例(2.8%),18~40岁共10例(28.6%),40岁以上共24例(68.6%)。黄疸31例(88.6%),腹痛14例(40.0%),体表淋巴结肿大4例(11.4%),伴发热4例(11.4%)。大部分患者入院辅助检查提示TBIL、转氨酶及ALP升高,CA19-9肿瘤标志物可正常或升高。4例患者行化疗治疗,10例患者行手术治疗,16例患者行手术及辅助化疗治疗,1例患者手术辅助放疗治疗,3例患者行手术辅助化疗及放疗治疗,1例患者治疗方案未知(表1)。
2.2 患者预后分析
35例患者的生存时间曲线见图4A。单纯手术组与综合治疗组(手术联合化疗和/或放疗组)生存时间比较,差异无统计学意义(均P>0.05)(图4B)。
表1 35例患者的临床资料
Table 1 Clinical data of the 35 patients
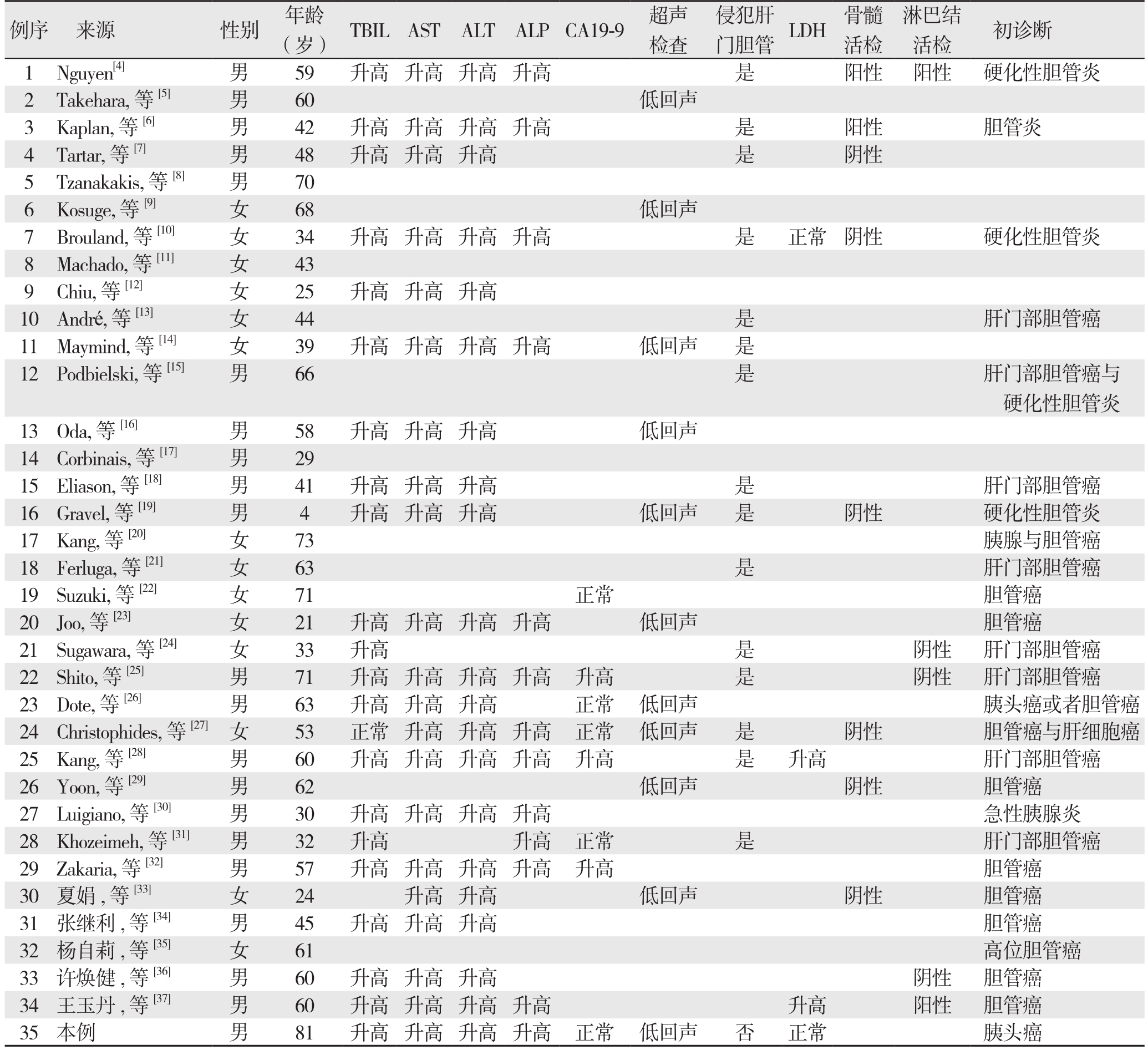
例序 来源 性别 年龄(岁) TBILAST ALT ALPCA19-9 超声检查侵犯肝门胆管 LDH 骨髓活检淋巴结活检 初诊断1 Nguyen[4] 男 59 升高 升高 升高 升高 是 阳性 阳性 硬化性胆管炎2 Takehara, 等[5] 男 60 低回声3 Kaplan, 等[6] 男 42 升高 升高 升高 升高 是 阳性 胆管炎4 Tartar, 等[7] 男 48 升高 升高 升高 是 阴性5 Tzanakakis, 等[8] 男 70 6 Kosuge, 等[9] 女 68 低回声7 Brouland, 等[10] 女 34 升高 升高 升高 升高 是 正常 阴性 硬化性胆管炎8 Machado, 等[11] 女 43 9 Chiu, 等[12] 女 25 升高 升高 升高10 André, 等 [13] 女 44是肝门部胆管癌11 Maymind, 等[14] 女 39 升高 升高 升高 升高 低回声 是12Podbielski, 等[15] 男 66 是 肝门部胆管癌与硬化性胆管炎13 Oda, 等[16] 男 58 升高 升高 升高 低回声14 Corbinais, 等[17] 男 29 15Eliason, 等[18] 男 41 升高 升高 升高 是 肝门部胆管癌16 Gravel, 等[19] 男 4 升高 升高 升高 低回声 是 阴性 硬化性胆管炎17 Kang, 等[20] 女 73 胰腺与胆管癌18Ferluga, 等[21] 女 63 是 肝门部胆管癌19Suzuki, 等[22] 女 71 正常 胆管癌20 Joo, 等[23] 女 21 升高 升高 升高 升高 低回声 胆管癌21 Sugawara, 等[24] 女 33 升高 是 阴性 肝门部胆管癌22 Shito, 等[25] 男 71 升高 升高 升高 升高 升高 是 阴性 肝门部胆管癌23 Dote, 等[26] 男 63 升高 升高 升高 正常 低回声 胰头癌或者胆管癌24 Christophides, 等[27]女 53 正常 升高 升高 升高 正常 低回声 是 阴性 胆管癌与肝细胞癌25 Kang, 等[28] 男 60 升高 升高 升高 升高 升高 是 升高 肝门部胆管癌26 Yoon, 等[29] 男 62 低回声 阴性 胆管癌27 Luigiano, 等[30] 男 30 升高 升高 升高 升高 急性胰腺炎28 Khozeimeh, 等[31] 男 32 升高 升高 正常 是 肝门部胆管癌29 Zakaria, 等[32] 男 57 升高 升高 升高 升高 升高 胆管癌30 夏娟, 等[33] 女 24 升高 升高 低回声 阴性 胆管癌31 张继利, 等[34] 男 45 升高 升高 升高 胆管癌32 杨自莉, 等[35] 女 61 高位胆管癌33 许焕健, 等[36] 男 60 升高 升高 升高 阴性 胆管癌34 王玉丹, 等[37] 男 60 升高 升高 升高 升高 升高 阳性 胆管癌35本例 男 81 升高 升高 升高 升高 正常 低回声 否 正常 胰头癌
表1 35例患者的临床资料(续)
Table 1 Clinical data of the 35 patients (continued)
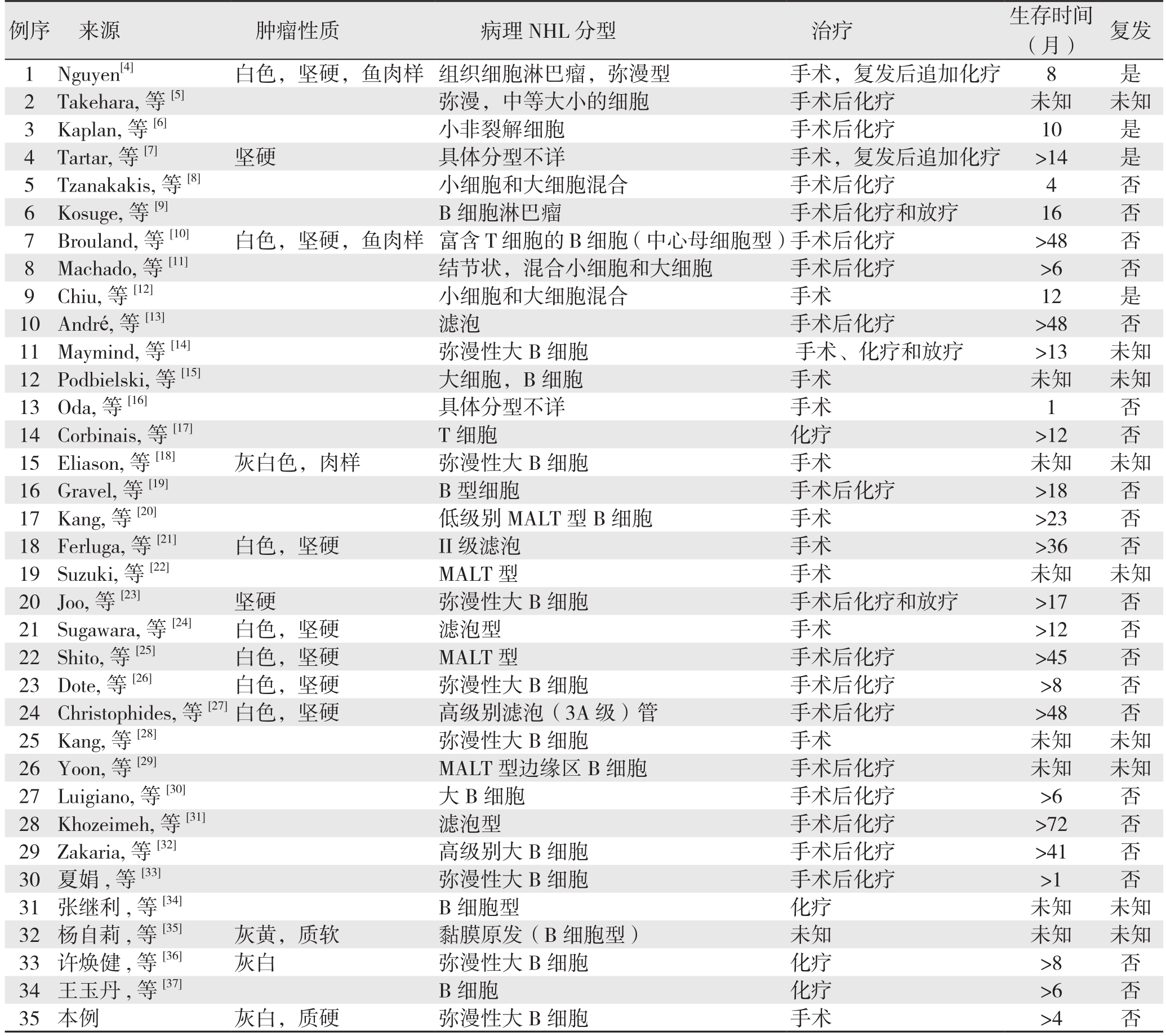
例序 来源 肿瘤性质 病理NHL分型 治疗 生存时间(月) 复发1 Nguyen[4] 白色,坚硬,鱼肉样 组织细胞淋巴瘤,弥漫型 手术,复发后追加化疗 8 是2 Takehara, 等[5] 弥漫,中等大小的细胞 手术后化疗 未知 未知3 Kaplan, 等[6] 小非裂解细胞 手术后化疗 10 是4 Tartar, 等[7] 坚硬 具体分型不详 手术,复发后追加化疗 >14 是5 Tzanakakis, 等[8] 小细胞和大细胞混合 手术后化疗 4 否6 Kosuge, 等[9] B细胞淋巴瘤 手术后化疗和放疗 16 否7 Brouland, 等[10] 白色,坚硬,鱼肉样 富含T细胞的B细胞(中心母细胞型)手术后化疗 >48 否8 Machado, 等[11] 结节状,混合小细胞和大细胞 手术后化疗 >6 否9 Chiu, 等[12] 小细胞和大细胞混合 手术 12 是10 André, 等[13] 滤泡 手术后化疗 >48 否11 Maymind, 等[14] 弥漫性大B细胞 手术、化疗和放疗 >13 未知12 Podbielski, 等[15] 大细胞,B细胞 手术 未知 未知13Oda, 等[16] 具体分型不详 手术 1 否14 Corbinais, 等[17] T细胞 化疗 >12 否15 Eliason, 等[18] 灰白色,肉样 弥漫性大B细胞 手术 未知 未知16 Gravel, 等[19] B型细胞 手术后化疗 >18 否17 Kang, 等[20] 低级别MALT型B细胞 手术 >23 否18 Ferluga, 等[21] 白色,坚硬 II级滤泡 手术 >36 否19 Suzuki, 等[22] MALT型 手术 未知 未知20 Joo, 等[23] 坚硬 弥漫性大B细胞 手术后化疗和放疗 >17 否21 Sugawara, 等[24] 白色,坚硬 滤泡型 手术 >12 否22 Shito, 等[25] 白色,坚硬 MALT型 手术后化疗 >45 否23 Dote, 等[26] 白色,坚硬 弥漫性大B细胞 手术后化疗 >8 否24 Christophides, 等[27]白色,坚硬 高级别滤泡(3A级)管 手术后化疗 >48 否25 Kang, 等[28] 弥漫性大B细胞 手术 未知 未知26 Yoon, 等[29] MALT型边缘区B细胞 手术后化疗 未知 未知27 Luigiano, 等[30] 大B细胞 手术后化疗 >6 否28 Khozeimeh, 等[31] 滤泡型 手术后化疗 >72 否29 Zakaria, 等[32] 高级别大B细胞 手术后化疗 >41 否30 夏娟, 等[33] 弥漫性大B细胞 手术后化疗 >1 否31 张继利, 等[34] B细胞型 化疗 未知 未知32 杨自莉, 等[35] 灰黄,质软 黏膜原发(B细胞型) 未知 未知 未知33 许焕健, 等[36] 灰白 弥漫性大B细胞 化疗 >8 否34 王玉丹, 等[37] B细胞 化疗 >6 否35 本例 灰白,质硬 弥漫性大B细胞 手术 >4 否
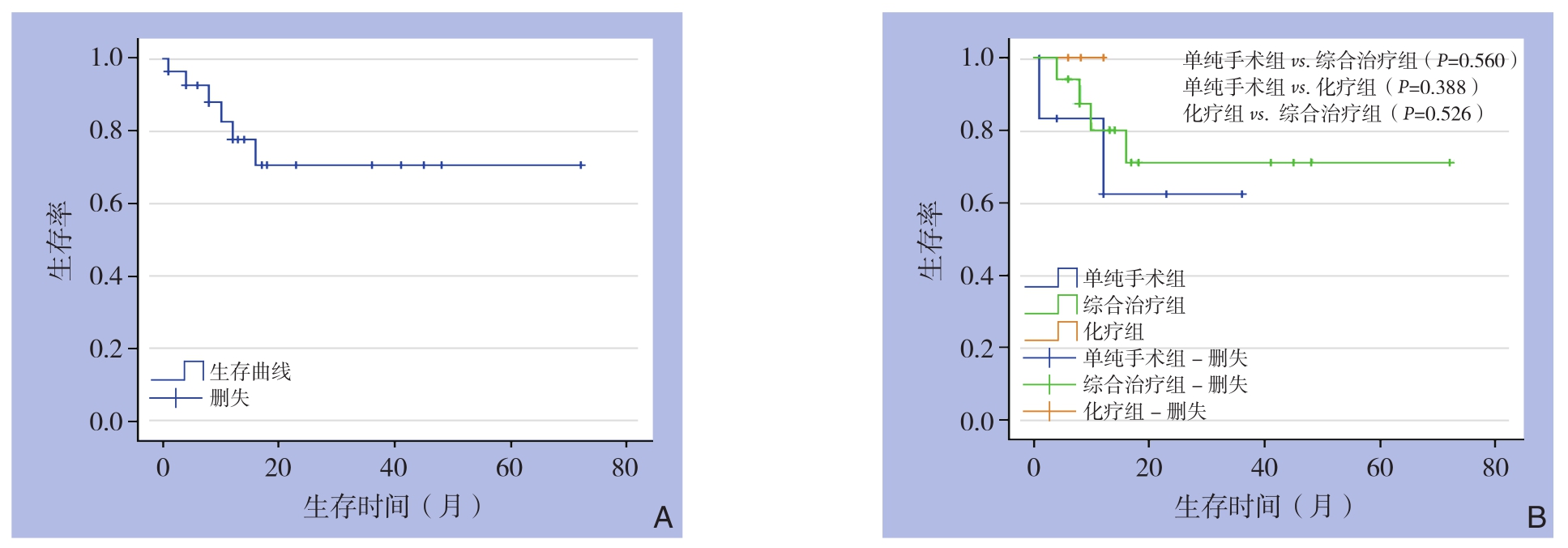
图4 生存曲线 A:全组患者的生存曲线;B:不同治疗方式患者的生存曲线
Figure 4 Survival curves A: Survival curve of the entire group of patients; B: Survival curves of patients with different treatment methods
3 讨 论
NHL是来源于淋巴组织的恶性实体淋巴造血组织肿瘤,好发于淋巴结,但也可以发生于机体的其他部位,大约25%~40%的NHL病例表现为原发性结外病变[1],男女均可发病,男性多于女性,具体原因不详[2]。弥漫性大B细胞淋巴瘤(DLBCL)是NHL中最常见的淋巴肿瘤,是NHL最常见的组织学亚型,约占所有病例的25%[3]。原发于胆管的NHL在临床上较罕见[38],有文献[23]回顾了既往相关病例报道,最常见的肝外胆管NHL位置是左右肝管汇合部,最常见的累及肝外胆道系统的淋巴瘤是来源于B细胞的淋巴瘤。发生于结外其他部位的NHL,也多以B细胞来源多见,例如原发乳腺淋巴瘤[39],原发性甲状腺淋巴瘤[40]等。
本组检索1982—2017年34篇文献[4-37]报道,包括本院1例,共35例原发胆总管NHL临床病例资料,临床主要表现为黄疸、腹痛等,黄疸是最常见的临床表现,少数患者还伴随皮肤瘙痒、发热及淋巴结肿大等症状体征。其中有1例患者是因急性胰腺炎到医院就诊,血淀粉酶和脂肪酶相应增高。大部分患者入院辅助检查提示胆红素、转氨酶及ALP升高,CA19-9肿瘤标志物可正常或升高。原发性胆总管NHL临床表现及实验室检查无明显的特异性。B超、CT及MRI等影像学检查提示胆管占位性病变或不规则增厚,胆管狭窄,继发近端胆管扩张,11例行超声检查表现为胆总管低回声包块。15例行CT或者MRI提示肿瘤侵犯肝门部胆管,有部分肿块可表现为增强扫描后强化。因胆总管NHL临床表现及影像学检查在临床上易被误诊为硬化性胆管炎或胆管癌,所以组织病理及免疫组化作为诊断的金标准尤其重要[34]。原发胆总管NHL术前较难鉴别诊断,总结分析本组35例病例特点如下:⑴ 原发性胆管NHL,男女均可发病,男性发病率大于女性,发病年龄4~81岁,40岁以上发病率高于其他年龄段。临床可表现为黄疸,腹痛,皮肤瘙痒,发热、体质量减轻,浅表淋巴结肿大;⑵ 可出现肝功能损害,如表现为TBIL、转氨酶、ALP升高,白细胞、血红蛋白、LDH、CA19-9可升高或正常;⑶ 影像学检查彩超、CT及MRI可表现为胆总管壁增厚,管腔狭窄,近端胆管扩张。大部分彩超检查提示低回声肿块,最常见的肝外胆管NHL位置是肝门部,与文献[23]报道的相符;⑷ 多数累及肝外胆道系统的淋巴瘤是来源于B细胞的淋巴瘤,其中大部分为弥漫性大B细胞淋巴瘤,滤泡性淋巴瘤仅占少部分;⑸ 大部分患者行手术后联合全身化疗治疗,预后较好,有1例生存期超过72个月,无复发[31]。
原发性胆总管NHL在临床上较罕见,临床病例资料少,少数原发性胆总管NHL患者早期可出现颈部、腋窝及腹腔淋巴结肿大,但本组资料中只有1例术前行腹腔淋巴结穿刺活检明确诊断的病例报道[37]。王玉丹等[37]报道了1例胆管占位并腹腔多发淋巴结肿大的临床案例。入院后予胆道置管引流胆汁,后经腹腔淋巴结穿刺活检明确为弥漫性大B细胞淋巴瘤,予R-CHOP化疗(长春新碱+环磷酰胺+吡柔比星+氟美松针),2个化疗周期后患者腹腔肿块明显缩小,胆道受压解除,随访半年未再出现皮肤巩膜黄染等情况。复查腹部CT,提示腹腔肿块完全缓解。虽然只通过化疗仍可能取得较好的治疗效果,但是术前淋巴结穿刺诊断出现假阴性的可能性大,本组中另有1例行淋巴结穿刺活检阴性,行骨髓穿刺活检发现淋巴瘤细胞[12],及另外1例腹水涂片中发现淋巴瘤细胞的报道[34]。有5例术前行骨髓穿刺活检出现阴性[13, 19, 25, 33, 36]。因原发性胆总管NHL术前诊断困难,易误诊,因此如高度怀疑该病,可在超声、CT、腹腔镜引导下进行胆总管肿物穿刺活检,待明确病理诊断后,可行局部放疗或者全身化疗治疗,避免手术给耐受能力较差的患者带来不必要的创伤,改善患者预后。
综上所述,现术前鉴别诊断仍然是一大难题,大多数患者仍需要行手术切除,经组织病理及免疫组化才能鉴别诊断。原发胆总管NHL误诊为胆管癌的概率较高,虽然两者的临床表现及影像学检查相似,但两者治疗方案及预后差别大,组织病理及免疫组化明确诊断是选择治疗方案及延长生存期的关键。本组资料中大多数患者是术前误诊,行手术切除后经组织病理及免疫组化明确诊断。本组研究中,单纯手术组、化疗组和手术联合化疗和/或放疗组的生存时间无统计学差异,应此病在临床上较罕见,目前该病尚无统一的治疗方案。我院的病例为术前误诊,术后患者未同意行术后全身化疗及局部放疗等辅助治疗,但目前该病仍以手术切除联合术后全身化疗或/和局部放疗为主要治疗方案。虽然单纯手术组和手术切除联合术后全身化疗或/和局部放疗组之间生存时间无统计学差异,但是由生存曲线可得出似乎手术切除联合术后全身化疗或/和局部放疗组的生存率较高,目前该病仍然以手术为主,以全身化疗及局部放疗等多种治疗为辅的综合治疗方式。经进一步分析,可导致无统计学差异的原因有如下:⑴ 患者的疾病分期、病理分型等多种因素均可能影响患者生存预后,因本组研究未能进一步行亚组分析,所以各治疗组间生存期未体现明显差异;⑵ 本组资料中,患者随访时间均较短,无法长期随访患者的生存情况,导致生存分析差异不明显。现该病的临床报道少,临床资料缺乏,术前行骨髓及淋巴结穿刺活检的病例较少,及穿刺结果提示较难发现肿瘤细胞,故也未能根据骨髓及淋巴结的穿刺病理结果总结出该病的典型临床特点及分析该病预后情况。目前众多的国外知名肿瘤研究中心将LDH列为评价淋巴瘤预后的主要指标之一,国内也不断有研究认为LDH在淋巴瘤评估中具有重要作用。且在国际预后指数(International Prognostic Index,IPI)的5项指标里,也包括了LDH[41-42]。但是因为本研究回顾的病例分析关于LDH的报道仅有少数几例,未能统计分析出LDH与患者预后的相关性,仍需要通过后续更多临床报道及研究,总结归纳该病的临床特点及寻找合适的治疗方案。除了报道中较多的手术联合化疗治疗病例,也有少部分患者术后联合放射治疗,有文献报道NHL也可以结合局部放疗以局限病灶位置[43]。本组资料中,有1例患者行手术联合放疗治疗,获得了超过6个月的生存期。在检索的病例资料中,大多数患者通过手术、化疗及放疗或者上述方式的不同联合治疗均获得了较长的生存期,手术切除联合化疗治疗是其中最主要的治疗方式。因此,早期通过组织病理及免疫组化明确诊断,并行手术切除联合化疗治疗是较合理的治疗方案。
[1]Newton R, Ferlay J, Beral V,et al. The epidemiology of non-Hodgkin's lymphoma: comparison of nodal and extra-nodal sites[J].Int J Cancer, 1997, 72(6):923-930.
[2]卢兴国. 骨髓细胞学和病理学[M]. 北京: 科学出版社, 2008:865-867.Lu XG. Cytology and pathology of bone marrow[M]. Beijing:Science Press, 2008:865-867.
[3]Swerdlow SH, Campo E, Harris NL, et al. World Health Organization Classification of Tumours of Haematopoietic and Lymphoid Tissues[M]. Lyon: IARC Press, 2008.
[4]Nguyen GK. Primary extranodal non-Hodgkin's lymphoma of the extrahepatic bile ducts. Report of a case[J]. Cancer, 1982,50(10):2218-2222.
[5]Takehara T, Matsuda H, Naitou M, et al. A case report of primary extranodal non-Hodgkin's lymphoma of the extrahepatic bile duct[J]. Acta Hepatol Jpn, 1989, 30(2):247-252.
[6]Kaplan LD, Kahn J, Jacobson M, et al. Primary bile duct lymphoma in the acquired immunodeficiency syndrome (AIDS)[J]. Ann Intern Med, 1989, 110(2):161-162.
[7]Tartar VM, Balfe DM. Lymphoma in the wall of the bile ducts:radiologic imaging[J]. Gastrointest Radiol, 1990, 15(1):53-57. doi:10.1007/BF01888735.
[8]Tzanakakis GN, Vezeridis MP, Jackson BT, et al. Primary extranodal non-Hodgkin's lymphoma of the extrahepatic biliary tract[J]. RI Med J, 1990, 73(10):483-486.
[9]Kosuge T, Makuuchi M, Ozaki H, et al. Primary lymphoma of the common bile duct[J]. Hepatogastroenterology, 1991, 38(3):235-238.
[10]Brouland JP, Molimard J, Nemeth J, et al. Primary T-cell rich B-cell lymphoma of the common bile duct[J]. Virchows Arch A Pathol Anat Histopathol, 1993, 423(6):513-517.
[11]Machado MC, Abdo EE, Penteado S, et al. Lymphoma of the biliary tract: report of two cases[J]. Rev Hosp Clin Fac Med Sao Paolo,1994, 49(2):64-68.
[12]Chiu KW, Changchien CS, Chen L, et al. Primary malignant lymphoma of common bile duct presenting as acute obstructive jaundice: report of a case[J]. J Clin Gastroenterol, 1995, 20(3):259-261.
[13]André SB, Farias AQ, Bittencourt PL, et al. Primary extranodal non-Hodgkin lymphoma of the extrahepatic bile duct mimmicking Klatskin tumor[J]. Rev Hosp Clin Fac Med Sao Paulo, 1996,51(5):192-194.
[14]Maymind M, Mergelas JE, Seibert DG, et al. Primary non-Hodgkin's lymphoma of the common bile duct[J]. Am J Gastroenterol, 1997,92(9):1543-1546.
[15]Podbielski FJ, Pearsall GF Jr, Nelson DG, et al. Lymphoma of the extrahepatic biliary ducts in acquired immunodeficiency syndrome[J]. Am Surg, 1997, 63(9):807-810.
[16]Oda I, Inui N, Onodera Y, et al. An autopsy case of primary non-Hodgkin's lymphoma of the extrahepatic bile duct[J]. Nihon Shokakibyo Gakkai Zasshi, 1999, 96(4):418-422.
[17]Corbinais S, Caulet-Maugendre S, Pagenault M, et al. Primary T-cell lymphoma of the common bile duct[J]. Gastroenterol Clin Biol,2000, 24(8/9):843/7.
[18]Eliason SC, Grosso LE. Primary biliary lymphoma clinically mimicking cholangiocarcinoma: a case report and review of the literature[J]. Ann Diagn Pathol, 2001, 5(1):25-33.
[19]Gravel J, Lallier M, Garel L, et al. Primary non-Hodgkin lymphoma of the extrahepatic biliary tract and gallbladder in a child[J]. J Pediatr Gastroenterol Nutr, 2001, 32(5):598-601.
[20]Kang CS, Lee YS, Kim SM, et al. Primary low-grade B cell lymphoma of mucosa-associated lymphoid tissue type of the common bile duct[J]. J Gastroenterol Hepatol, 2001, 16(8):949-951.
[21]Ferluga D, Luzar B, Gadzijev EM. Follicular lymphoma of the gallbladder and extrahepatic bile ducts[J]. Virchows Arch, 2003,442(2):136-140.
[22]Suzuki S, Tanaka S, Suzuki M, et al. Mucosa-associated lymphoid tissue-type lymphoproliferative lesion of the common bile duct[J].Hepatogastroenterology, 2004, 51(55):110-113.
[23]Joo YE, Park CH, Lee WS. Primary non-Hodgkin's lymphoma of the common bile duct presenting as obstructive jaundice[J]. J Gastroenterol, 2004, 39(7):692-696. doi: 10.1007/s00535-004-1367-0.
[24]Sugawara G, Nagino M, Oda K, et al. Follicular lymphoma of the extrahepatic bile duct mimicking cholangiocarcinoma[J]. J Hepatobiliary Pancreat Surg, 2008, 15(2):196-199. doi: 10.1007/s00534-007-1248-z.
[25]Shito M, Kakefuda T, Omori T, et al. Primary non-Hodgkin's lymphoma of the main hepatic duct junction[J]. J Hepatobiliary Pancreat Surg, 2008, 15(4):440-443. doi: 10.1007/s00534-007-1229-2.
[26]Dote H, Ohta K, Nishimura R, et al. Primary extranodal non-Hodgkin's lymphoma of the common bile duct manifesting as obstructive jaundice: report of a case[J]. Surg Today, 2009,39(5):448-451. doi: 10.1007/s00595-008-3894-4.
[27]Christophides T, Samstein B, Emond J, et al. Primary follicular lymphoma of the extrahepatic bile duct mimicking a hilar cholangiocarcinoma: a case report and review of the literature[J]. Hum Pathol, 2009, 40(12):1808-1812. doi: 10.1016/j.humpath.2009.05.012.
[28]Kang HG, Choi JS, Seo JA, et al. A case of primary biliary malignant lymphoma mimicking Klatskin tumor[J]. Korean J Gastroenterol, 2009, 54(3):191-195.
[29]Yoon MA, Lee JM, Kim SH, et al. Primary biliary lymphoma mimicking cholangiocarcinoma: a characteristic feature of discrepant CT and direct cholangiography findings[J]. J Korean Med Sci, 2009, 24(5):956-959. doi: 10.3346/jkms.2009.24.5.956.
[30]Luigiano C, Ferrara F, Fabbri C, et al. Primary lymphoma of the common bile duct presenting with acute pancreatitis and cholangitis[J]. Endoscopy, 2010, 42(Suppl 2):E265-266. doi:10.1055/s-0030-1255766.
[31]Khozeimeh N, Bhatti T, Ponsky TA, et al. Primary Non-Hodgkin's Lymphoma of the Extrahepatic Bile Duct[J]. J Gastrointest Cancer,2012, 43(Suppl 1):S46-49. doi: 10.1007/s12029-011-9353-2.
[32]Zakaria A, Al-Obeidi S, Daradkeh S. Primary non-Hodgkin's lymphoma of the common bile duct: A case report and literature review[J]. Asian J Surg, 2017, 40(1):81-87. doi: 10.1016/j.asjsur.2013.09.009.
[33]夏娟, 罗启翅, 秦海银, 等. 胆总管弥漫性大 B 细胞淋巴瘤一例[J]. 现代医学, 2015, 43(1):106-107. doi: 10.3969/j.issn.1671-7562.2015.01.031.Xia J, Luo QC, Qin HY, et al. Diffuse large B cell lymphoma of the common bile duct: a report of one case[J]. Modern Medical JOurnal,2015, 43(1):106-107. doi: 10.3969/j.issn.1671-7562.2015.01.031.
[34]张继利, 周道银. 恶性淋巴瘤误诊为胆管癌[J]. 临床误诊误治,2002, 15(2):155-155. doi:10.3969/j.issn.1002-3429.2002.02.075.Zhang JL, Zhou DY. Malignant lymphoma misdiagnosed as cholangiocarcinoma[J]. Clinical Misdiagnosis & Mistherapy, 2002,15(2):155-155. doi:10.3969/j.issn.1002-3429.2002.02.075.
[35]杨自莉, 王志波, 陆江阳. 肝外胆管原发性非霍奇金恶性淋巴瘤1例[J]. 诊断病理学杂志, 2000, 7(2):106-107. doi:10.3969/j.issn.1007-8096.2000.02.040.Yang ZL, Wang ZB, Lu JY. Primary non-Hodgkin’s malignant lymphoma of the extrahepatic bile duct: a report of one case[J].Chinese Journal of Diagnostic Pathology, 2000, 7(2):106-107.doi:10.3969/j.issn.1007-8096.2000.02.040.
[36]许焕建, 王伟, 刘忠民. 肝外胆管原发性非霍奇金淋巴瘤一例[J]. 中华肝胆外科杂志, 2005, 11(9):615. doi:10.3760/cma.j.issn.1007-8118.2005.09.029.Xu HJ, Wang W, Liu ZM. Primary non-Hodgkin’s lymphoma of the extrahepatic bile duct: a report of one case[J]. Chinese Journal of Hepatobiliary Surgery, 2005, 11(9):615. doi:10.3760/cma.j.issn.1007-8118.2005.09.029.
[37]王玉丹, 曹会存, 刘诗义, 等. 胰头区非霍奇金淋巴瘤导致阻塞性黄疸[J]. 分子影像学杂志, 2014, 37(4):235-237. doi:10.3969/j.issn.1674-4500.2014.04.05.Wang YD, Cao HC, Liu SY, et al. Clinical analysis of obstructive jaundice resulted from non Hodgkin's lymphoma of pancreatic head[J]. Journal of Molecular Imaging, 2014, 37(4):235-237.doi:10.3969/j.issn.1674-4500.2014.04.05.
[38]Ueda K, Nagayama Y, Narita K, et al. Pancreatic involvement by non-Hodgkin's lymphoma[J]. J Hepatobiliary Pancreat Surg, 2000,7(6):610-613. doi: 10.1007/s005340050243.
[39]邵云, 吴永芳, 张博, 等. 原发性乳腺淋巴瘤8例临床病理分析并文献复习[J]. 中国普通外科杂志, 2016, 25(5):724-728.doi:10.3978/j.issn.1005-6947.2016.05.017.Shao Y, Wu YF, Zhang B, et al. Primary breast lymphoma: a clinicopathologic analysis of 8 cases and literature review[J].Chinese Journal of General Surgery, 2016, 25(5):724-728.doi:10.3978/j.issn.1005-6947.2016.05.017.
[40]欧阳小明, 郝卓芳, 郅程, 等. 甲状腺原发性结外NK/T细胞淋巴瘤1例并文献复习[J]. 中国普通外科杂志, 2015, 24(5):739-742.doi:10.3978/j.issn.1005-6947.2015.05.024.Ouyang XM, Hao ZF, Zhi C, et al. Primary thyroid NK/T-cell lymphoma: report of a case and review of literature[J]. Chinese Journal of General Surgery, 2015, 24(5):739-742. doi:10.3978/j.issn.1005-6947.2015.05.024.
[41]万祥辉, 杨细媚, 邹学森. CBC联合LDH对白血病、淋巴瘤骨髓侵犯诊断价值的ROC分析研究[J]. 实验与检验医学, 2015,33(2):140-143. doi:10.3969/j.issn.1674-1129.2015.02.004.Wan XH, Yang XM, Zou XS. Diagnostic value of using ROC curve to evaluate CBC and LDH in leukemia and lymphoma with bone marrow involve-ment[J]. Experimental and Laboratory Medicine,2015, 33(2):140-143. doi:10.3969/j.issn.1674-1129.2015.02.004.
[42]陈维, 魏涛. 血清LDH、TPS、CEA和β2-MG在非霍奇金淋巴瘤诊断中的价值[J]. 分子影像学杂志, 2015, 38(3):257-259.doi:10.3969/j.issn.1674-4500.2015.03.27.Chen W, Wei T. Value of serum LDH, TPS,CEA and β2-MG in the diagnosis of non-Hodgkin's lymphoma[J]. Journal of Molecular Imaging, 2015, 38(3):257-259. doi:10.3969/j.issn.1674-4500.2015.03.27.
[43]Gospodarowicz M. Radiotherapy in non-Hodgkin lymphomas[J].Ann Oncol, 2008, 19(Suppl 4):iv47-50. doi: 10.1093/annonc/mdn195.