胆囊的主要功能是储存和浓缩胆汁,胆囊癌的主要危险因素是胆道系统长时间暴露于某些因素中,目前胆囊癌规范化诊治专家共识及国内外学者普遍认为胆囊癌的发生、发展与以下因素相关[1-5]:女性、年龄>50岁、胆囊结石、长期胆囊慢性炎症(黄色肉芽肿性胆囊炎、瓷化)、胆囊腺瘤性息肉(单发且病变≥1 cm)、胆管囊肿、胰胆管异常汇合畸形、胆道系统感染、代谢紊乱综合症及遗传学等。胆囊癌的治疗首选手术治疗,对于晚期、已失去手术机会的胆囊癌患者,目前采用姑息治疗,如:放射治疗、化疗、靶向治疗,以下从几个方面分别综述。
1 外科手术治疗
目前胆囊癌的治疗措施中,外科手术治疗是最为积极、有效的手段,进行彻底根治性手术可为患者提供唯一长期生存和治愈的机会[6-7]。然而,由于胆囊癌发病隐匿,恶性程度之高,仅有约10%的患者适合根治性手术治疗,胆囊癌手术的实施应尽可能的完整切除肿瘤,以达到R0切除[8]。
1.1 胆囊癌的分期决定手术切除范围
由美国癌症联合委员会(AJCC)和国际抗癌联盟(UICC)联合制定的第7版胆囊癌TNM分期在临床上被广泛应用,对胆囊癌的治疗和预后的判断均有帮助。胆囊癌局部浸润深度是决定手术方式的基础(表1)。TNM常用分期符号:原发肿瘤无法评估(Tx);无原发肿瘤证据(T0);原位癌(Tis);肿瘤侵犯黏膜固有层或肌层(T1);侵犯黏膜固有层(T1a);侵犯肌层(T1b);侵犯肌层周围结缔组织,未突破浆膜层或肝脏(T2);侵透浆膜和(或)直接侵犯肝脏,和(或)侵犯1个其他临近器官(T3);侵犯肝动脉、门静脉、2个或以上肝外器官或结构(T4);区域淋巴结情况无法评估(Nx);无区域淋巴结转移(N0);区域淋巴结转移(胆囊管、胆总管、肝动脉、肝门静脉旁淋巴结)(N1);远处淋巴结转移(腹主动脉旁、下腔静脉旁、肠系膜上动脉旁、胰腺旁、腹腔干旁淋巴结)(N2);尚无远处转移(M0);已有远处转移(M1)。
表1 美国癌症联合委员会(AJCC)和国际抗癌联盟(UICC)胆囊癌TNM分期(第7版)
Table 1 TNM staging for gallbladder cancer of the American Joint Committee on Cancer (AJCC) and Union for International Cancer Control (UICC) (the 7th edition)
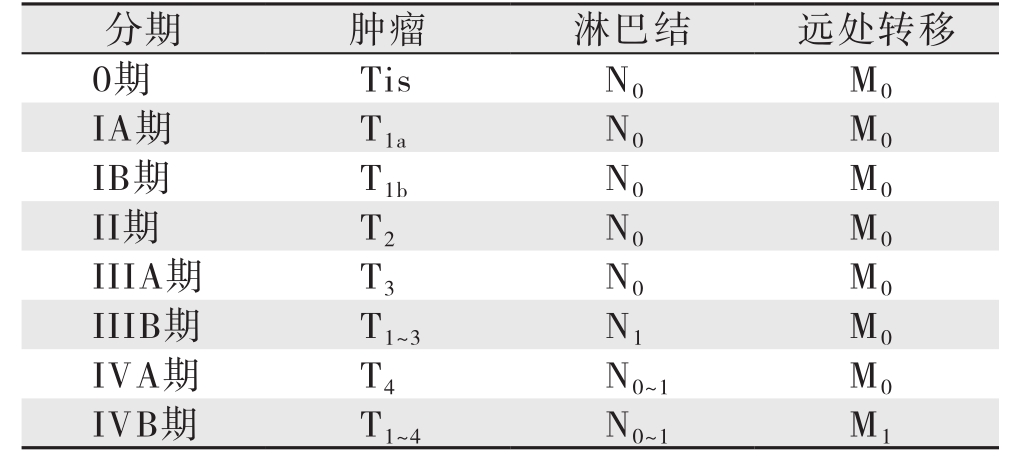
分期 肿瘤 淋巴结 远处转移0期 Tis N0 M0 IA期 T1a N0 M0 IB期 T1b N0 M0 II期 T2 N0 M0 IIIA期 T3 N0 M0 IIIB期 T1~3 N1 M0 IVA期 T4 N0~1 M0 IVB期 T1~4 N0~1 M1
1.2 胆囊癌手术时肝切除范围的选择
学者们依据肿瘤T分期的不同、浸润范围和入侵途径来确认,切除方式包含胆囊窝周围2 cm肝楔形切除、肝S4b+S5切除、右半肝或右三肝切除。
1.3 术中腹腔淋巴结清扫清扫范围
国内外学者尚未达成共识,文献报道并不统一,但主要依据淋巴受累的路径来确认。根据日本JSBS分期方法,将胆囊癌的淋巴结转移分为N1、N2和N3站[9]。第一站N1:肝十二指肠韧带淋巴结(12组),根据周围的关系分为胆囊管旁(12c组),胆总管旁(12b组)、门静脉后(12p组),肝固有动脉旁(12a组)。第二站N2:胰腺后上(13a组)和沿肝总动脉旁淋巴结(8组)。第三站N3:腹主动脉(16组),腹腔干(9组),肠系膜(14组)或胰前(17组)和胰腺后下(13b组)淋巴结。N1阳性,会使手术切除的疗效明显降低;N2阳性,标志这手术无法根治性切除,导致并发症发生率和病死率增高;N3阳性,可被视作手术禁忌[10]。
1.4 肝外胆管的处理
有学者[10-11]认为胆囊癌手术常规切除肝外胆管并不能带来明显益处,切除的并发症也随之增加,更重要的是肝外胆管切除并不能改善淋巴结清扫的彻底性。若术中胆囊管切缘活检结果阳性,此时需要联合肝外胆道切除,切除范围从胰头后上方至第一肝门部,再行胆管空肠Roux-en-Y吻合。
1.5 联合脏器切除及血管重建
当胆囊癌合并邻近脏器转移时,应结合具体情况,可行联合受侵脏器的切除。血管受侵并不是手术的绝对禁忌证,门静脉、肝动脉受侵时,可行血管切除和重建[12]。
1.6 手术范围与手术方式
依据2016年中国抗癌协会胆囊癌规范化诊治专家共识[3],不同临床分期胆囊癌采取不同手术治疗方式(表2)。
表2 根据TNM分期的胆囊癌手术切除范围与手术方式
Table 2 Surgical scopes and procedures for gallbladder carcinoma according to TNM stages

TNM分期 切除范围 淋巴结清扫范围Tis/T1a 胆囊切除 不需要淋巴结清扫T1b 清扫12、8组13a(+) 胆囊床2 cm以上肝楔形切除+扩大淋巴结清扫 扩大清扫12、8、13、9组T2 13a(-) 肝S4b+S5清扫12、8组13a(+) 肝S4b+S5 扩大清扫12、8、13、9组T3 16(-)侵犯肝<2 cm 肝S4b+S5扩大清扫12、8、13、9组16(-)侵犯肝>2 cm 胆囊连同右半肝或右三肝整块切除 扩大清扫12、8、13、9组16(-)侵犯相邻器官 胆囊连同右半肝或右三肝整块切除+联合受累器官切除 扩大清扫12、8、13、9组16(+) 不推荐手术,姑息治疗T4 16(-) 胆囊连同右半肝或右三肝整块切除+联合受累器官切除+联合血管切除重建 扩大清扫12、8、13、9组16(+) 不推荐手术,姑息治疗13a(-) 胆囊床2 cm以上肝楔形切除
2 放 疗
放疗通过阻止癌细胞的扩散和生长,从而减缓肿瘤的生长,有时放疗甚至能杀掉全部癌细胞。胆囊癌常见的放疗方式中以外照射最多见,另外还有术中放疗、胆道腔内近距放疗等[13]。对于胆囊癌尤其是难治性胆囊癌患者,单独应用放疗方案的应用价值目前仍未得到广泛共识。中国抗癌协会建议对已发生肿瘤淋巴结转移、肝转移、腹壁转移、骨转移等进展期或晚期胆囊癌患者,应同时联合化疗,进行姑息性辅助治疗[3]。2015年Wang等[14]报道了,在确定的112例胆囊癌术后患者中,61%接受了辅助放疗。术后辅助放疗组和单纯手术治疗组相比,虽然两者总生存期相近(5年生存期:49.7% vs. 52.5%,P=0.20),但是术后辅助放疗明显减低了局部复发率(RR=0.17)。Mojica等[15]对SEER数据库的回顾性分析研究显示,对3 187例胆囊癌患者进行了监测,其中542例进行了术后辅助放疗,结果显示接受辅助放疗的患者的中位生存期为14个月,而未接受辅助放疗的患者的中位生存期为8个月(P<0.001),并得出辅助放疗的益处主要是存在肿瘤局部淋巴结转移和肿瘤浸润肝脏的患者。在另一项分析中,Wang等[16]同样回顾性分析研究4 000例胆囊癌患者,认为辅助放疗可以明显延长胆囊癌患者总生存期,对于淋巴结受累或T2期以上的患者,研究者强烈推荐术后行辅助放疗。最近相关研究[17]认为,术后动脉灌注化疗(IAC)可有效安全地减少T2~3期胆囊癌行根治性切除术后的肝转移,改善T2-3期GBC 术后3年的无肝转移生存期(HMFS)和中位总生存期(OS)。Mitin等[18]使用国家癌症数据库(NCDB)评估了5 029例胆囊癌分期为T1-3N0-1的患者,并证明辅助放疗与3年总体生存率提高有关系(RR=0.63,95% CI=0.44~0.92)。近几年,三维适形放疗(3D-CRT)快速发展,这不仅使得放疗照射剂量更加精准的分布在肿瘤中,提高了疗效,而且对正常组织器官的损伤程度也有所降低,从而减少了放疗所引起的各种并发症。在2D普通放疗和三维适形放疗的基础上发展起来的调强放疗(IMRT),它在胆囊癌放射疗法的探索之路上,起到了强有力的推动作用,在胆囊癌综合治疗方面具有重要意义[19]。在3D-CRT和IMRT等适形放疗时代,新的放疗手段已被广泛用于治疗腹部恶性肿瘤,通过改善放疗靶区识别,从而实现最佳的定性治疗,以提高局部控制率和减少毒性[20]。有研究[21]显示,胆囊癌根治术后的局部复发、区域淋巴结转移和远处转移是治疗失败的主要原因。胆囊癌术后辅助放疗可以减少区域淋巴结的复发和转移,瘤床区、肝门至肠系膜上动脉水平是胆囊癌术后较为合适的临床放疗靶区[22]。
3 化 疗
对于早期胆囊癌来说,胆囊癌根治性切除术仍是目前有效的治疗方法,晚期的大多数患者常选择药物及放射治疗,全身化疗的临床应用也日渐突出。目前胆囊癌化疗方案的循证医学高级别证据仍较缺乏,化疗方案以吉西他滨+铂类药物为主,标准化辅助治疗方案目前学者们尚未达成一致共识,目前积极采取化疗方案的胆囊癌有:胆囊癌浸润肌层及以外部位的术后辅助化疗、晚期胆囊癌姑息性辅助化疗,以及复发性胆囊癌化疗。李人杰等[23]通过采用以吉西他滨联合顺铂为主的化疗方案对25例胆囊癌术后或晚期胆囊癌患者进行疗效评价和不良反应分析,其中位总生存期达15.5(1.9~19.4)个月,研究认为胆囊癌患者通过化疗可达到良好疗效。Sirohi等[24]报道了37例行新辅助化疗(吉西他滨+顺铂)的局部晚期胆囊癌患者,其中有17例(46%)达到R0切除,有48.6%的患者达到了降低分期目的,总反应率达67.5%;中位生存期和无进展生存期分别为13.4个月和8.1个月,研究者认为在提高手术切除率及生存期上局部晚期胆囊癌行新辅助化疗是有效的。近期Siebenhüner等[25]进行了一项胆囊癌前瞻性、非随机的II期研究,以评估顺铂和吉西他滨在胆囊癌症中作为辅助治疗的可行性和有效性,从2008—2016年该研究共选取30例患者,第一组前9例患者接受单药吉西他滨治疗,第二组21例患者接受顺铂联合吉西他滨治疗;中位无病生存期(DFS)为14.9个月,相应的3年DFS为(43.1±9.1)%。中位总生存期(OS)为40.6个月,3年OS为(55.7±9.2)%;两个治疗组之间无统计学差异。吉西他滨辅助化疗联合或不联合顺铂治疗耐受性良好,患者生存良好。该研究表明,对于耐受性良好的胆囊癌患者吉西他滨单独或联合顺铂治疗是可行的。目前针对吉西他滨联合顺铂治疗胆囊癌的多国前瞻性III期试验正在进行中,将有助于晚期胆囊癌患者最佳治疗方案的制定。
4 靶向治疗
近年来,分子靶向治疗研究已成为热门,胆囊癌的分子靶向治疗研究均取得了一定的进展,但国内外已经结束的多个靶向治疗研究仍未取得突破性成果。分析其原因可能有:一是胆囊癌发生是多个基因与通路共同作用的结果,发生机制十分复杂,而单靶点治疗不足以完全阻止胆囊癌的发生和发展。二是,对于预测不同靶向治疗药物的疗效,目前尚缺乏一个可靠的特异性指标。分子靶向治疗主要针对的是肿瘤发生发展过程中的特异信号通路和关键基因,如血管内皮生长因子(VEGF)、HER2(c-erbB基因)、表皮生长因子受体(EGFR)、胰岛素样生长因子(IGFs)、IGF-IR/PI3K信号通路、胸苷磷酸化酶(TP)、KRAS、环氧合酶-2(COX-2)等[26-31]。然而改善胆囊癌预后的基础之一是阻断胆囊癌淋巴结转移的相关分子靶点。目前发现的常见与胆囊癌侵袭转移相关的分子有锌指蛋白X染色体、nemo 样激酶、抗波形丝蛋白、肝癌衍生生长因子HDGF、VEGFR-3、LYVE-1、Prox-1、Podoplanin、Maspin等[32-35] 。有研究[36]显示,在KRAS野生型晚期转移性胆囊癌患者中联合应用吉西他滨、奥沙利铂联合帕尼单抗,在接受治疗的患者中其反应率达45%,中位无进展生存期(PFS)为10.6个月,OS为20.3个月。另有研究[37]表明,治疗进展期胆囊癌时,贝伐珠单抗联合吉西他滨和奥沙利铂总体有效率为69%,中位PFS为7.0个月,OS达12.7个月。此外,生长抑素联合化疗可有效地抑制胆囊癌细胞的生长,生长抑素通过上调RB蛋白的磷酸化水平异常活化E2F⁃1,通过将胆囊癌细胞阻滞在S期和诱导ICBP90的过量表达,从而增加药物作用的靶细胞数量和触发TopoII过量表达来增加化疗效果[38-40]。另有研究[41]表明,生长抑素也可以诱导PTEN蛋白表达,抑制AKT通路活性,进而增强GBC-SD和SGC996细胞对顺铂的敏感性,发挥协同抑制细胞增殖,诱导凋亡的作用。这种精准靶点、联合打击有望成为今后临床胆囊癌治疗的有力探索。因此,胆囊癌患者预后的改进需要更好地了解生物信号传导途径以及有效靶向药物的应用。
5 小 结
综上所述,胆囊癌有多种治疗手段,提高胆囊癌的治疗效果可以从以下几个方面着手:发现早期敏感诊断方法、提高手术R0切除率、探索新的化疗药物及放化疗方法、寻找精准的靶向治疗方案、以及探求全新治疗办法。但目前国内外仍以外科手术治疗为主,相信随着精准医疗概念的深入,积极寻找最佳的胆囊癌的治疗办法,对于胆囊癌治疗现状和不良预后的改善具有重要意义。
[1]Raki M, Patrlj L, Kopljar M, 等. 胆囊癌的临床诊疗现状与挑战[J]. 中国普通外科杂志, 2016, 25(2):157–161. doi:10.3978/j.issn.1005–6947.2016.02.001.Raki M, Patrlj L, Kopljar M, et al. Current status and challenges in diagnosis and treatment of gallbladder cancer[J]. Chinese Journal of General Surgery, 2016, 25(2):157–161. doi:10.3978/j.issn.1005–6947.2016.02.001.
[2]Singh SK, Talwar R, Kannan N, et al. Chemotherapy Compared with Best Supportive Care for Metastatic/Unresectable Gallbladder Cancer: a Non-randomized Prospective Cohort Study[J]. Indian J Surg Oncol, 2016, 7(1):25–31. doi: 10.1007/s13193–015–0443–7.
[3]中国抗癌协会. 胆囊癌规范化诊治专家共识(2016)[J]. 临床肝胆病杂志, 2017, 33(4):611–620. doi:10.3969/j.issn.1001–5256.2017.04.002.Chinese Anti-Cancer Association. Guideline for the diagnosis and therapy of gallbladder carcinoma(2016) [J]. Journal of Clinical Hepatology, 2017, 33(4):611–620. doi:10.3969/j.issn.1001–5256.2017.04.002.
[4]Larsson SC, Håkansson N, Wolk A. Healthy dietary patterns and incidence of biliary tract and gallbladder cancer in a prospective study of women and men[J]. Eur J Cancer, 2017, 70:42–47. doi:10.1016/j.ejca.2016.10.012.
[5]徐建庆, 陈晨, 宋虎伟, 等. 胆囊癌发病相关危险因素分析[J]. 中国普通外科杂志, 2015, 24(2):190–194. doi:10.3978/j.issn.1005–6947.2015.02.007.Xu JQ, Chen C, Song HW, et al. Analysis of relevant factors in pathogenesis of gallbladder cancer[J]. Chinese Journal of General Surgery, 24(2):190–194. doi:10.3978/j.issn.1005–6947.2015.02.007.
[6]Wernberg JA, Lucarelli DD. Gallbladder cancer[J]. Surg Clin North Am, 2014, 94(2):343–360. doi: 10.1016/j.suc.2014.01.009.
[7]董娜娜, 段晓峰, 张倜, 等. 原发性胆囊癌的治疗策略和预后分析[J]. 中华消化外科杂志, 2012, 11(3):267–270. doi:10.3760/cma.j.issn.1673–9752.2012.03.020.Dong NN, Duan XF, Zhang T, et al. Analysis of treatment and prognosis of primary gallbladder cancer[J]. Chinese Journal of Digestive Surgery, 2012, 11(3):267–270. doi:10.3760/cma.j.issn.1673–9752.2012.03.020.
[8]Hundal R, Shaffer EA. Gallbladder cancer: epidemiology and outcome[J]. Clin Epidemiol, 2014, 6:99–109. doi: 10.2147/CLEP.S37357.
[9]Miyazaki M, Ohtsuka M, Miyakawa S, et al. Classification of biliary tract cancers established by the Japanese Society of Hepato-Biliary-Pancreatic Surgery: 3(rd) English edition[J]. J Hepatobiliary Pancreat Sci, 2015, 22(3):181–196. doi: 10.1002/jhbp.211.
[10]张永杰, 傅晓辉. 胆囊癌外科治疗的几点意见[J]. 肝胆外科杂志,2017, 25(3):168–169. doi:10.3969/j.issn.1006–4761.2017.03.003.Zhang YJ, Fu XH. Several opinions on surgical treatment of gallbladder cancer[J]. Journal of Hepatobiliary Surgery, 2017,25(3):168–169. doi:10.3969/j.issn.1006–4761.2017.03.003.
[11]Sternby Eilard M, Lundgren L, Cahlin C, et al. Surgical treatment for gallbladder cancer - a systematic literature review[J]. Scand J Gastroenterol, 2017, 52(5 ):505–514. doi:10.1080/00365521.2017.1284895.
[12]李斌, 张柏和, 刘辰, 等. 解读胆道肿瘤TNM分期变化,规范胆道肿瘤的外科治疗[J]. 中华普通外科杂志, 2012, 27(3):255–257.doi:10.3760/cma.j.issn.1007–631X.2012.03.031.Li B, Zhang BH, Liu C, et al. Interpretation of the changes in TNM staging of biliary tumors and standardization of the surgical treatment of biliary tumors[J]. Zhong Hua Pu Tong Wai Ke Za Zhi, 2012, 27(3):255–257. doi:10.3760/cma.j.issn.1007–631X.2012.03.031.
[13]Kudo A, Tanaka S, Ban D, et al. Anatomic resection reduces the recurrence of solitary hepatocellular carcinoma ≤5 cm without macrovascular invasion[J]. Am J Surg, 2014, 207(6):863–869. doi:10.1016/j.amjsurg.2013.06.009.
[14]Wang J, Narang AK, Sugar EA, et al. Evaluation of Adjuvant Radiation Therapy for Resected Gallbladder Carcinoma: A Multiinstitutional Experience[J]. Ann Surg Oncol, 2015, 22(Suppl 3):S1100–1106. doi: 10.1245/s10434–015–4685-y.
[15]Mojica P, Smith D, Ellenhorn J. Adjuvant radiation therapy is associated with improved survival for gallbladder carcinoma with regional metastatic disease[J]. J Surg Oncol, 2007, 96(1):8–13. doi:10.1002/jso.20831.
[16]Wang SJ, Fuller CD, Kim JS, et al. Prediction model for estimating the survival benefit of adjuvant radiotherapy for gallbladder cancer[J]. J Clin Oncol, 2008, 26(13):2112–2117. doi: 10.1200/JCO.2007.14.7934.
[17]Chen C, Feng W, Zheng Y, et al. Intra-arterial chemotherapy improved survival of stage 2–3 gallbladder cancer after curative resection[J]. Onco Targets Ther, 2018, 11:2975–2979. doi: 10.2147/OTT.S166246.
[18]Mitin T, Enestvedt CK, Jemal A, et al. Limited Use of Adjuvant Therapy in Patients With Resected Gallbladder Cancer Despite a Strong Association With Survival[J]. J Natl Cancer Inst, 2017,109(7). doi: 10.1093/jnci/djw324.
[19]张亦弛, 王许安, 刘颖斌, 等. 放射治疗在胆囊癌综合治疗中的应用进展[J]. 肝胆胰外科杂志, 2017, 29(5):430–432. doi:10.11952/j.issn.1007–1954.2017.05.022.Zhang YC, Wang XA, Liu YB, et al. Application progress of radiotherapy in comprehensive treatment of gallbladder cancer[J].Journal of Hepatopancreatobiliary Surgery, 2017, 29(5):430–432.doi:10.11952/j.issn.1007–1954.2017.05.022.
[20]Kim TG. Patterns of initial failure after resection for gallbladder cancer: implications for adjuvant radiotherapy[J]. Radiat Oncol J,2017, 35(4):359–367. doi: 10.3857/roj.2017.00388.
[21]水永杰, 魏启春. 辅助放化疗在胆囊癌综合治疗中的作用和地位[J]. 中国实用外科杂志, 2016, 36(10):1122–1124.Shui YJ, Wei QC. Effect and role of adjuvant chemoradiotherapy in comprehensive treatment of gallbladder cancer[J]. Chinese Journal of Practical Surgery, 2016, 36(10):1122–1124.
[22]施利明. 胆囊癌根治术后辅助放化疗生存分析及放疗靶区初步探讨[D]. 杭州: 浙江大学, 2014.Shi LM. Survival analysis of adjuvant chemoradiotherapy for gallbladder cancer after radical surgery and preliminary analysis of the target volume of radiotherapy[D]. Hangzhou: Zhejiang University, 2014.
[23]李人杰, 田淑婷, 童舟, 等. 原发性胆囊癌化疗25例临床分析[J].肿瘤学杂志, 2017, 23(6):553–556. doi:10.11735/j.issn.1671–170X.2017.06.B019.Li RJ, Tian ST, Tong Z, et al. Clinical Analysis of Chemotherapy in the Treatment for 25 Cases with Primary Gallbladder Carcinoma[J].Journal of Chinese Oncology, 2017, 23(6):553–556. doi:10.11735/j.issn.1671–170X.2017.06.B019.
[24]Sirohi B, Mitra A, Jagannath P, et al. Neoadjuvant chemotherapy in patients with locally advanced gallbladder cancer[J]. Future Oncol,2015, 11(10):1501–1509. doi: 10.2217/fon.14.308.
[25]Siebenhüner AR, Seifert H, Bachmann H, et al. Adjuvant treatment of resectable biliary tract cancer with cisplatin plus gemcitabine:A prospective single center phase II study[J]. BMC Cancer, 2018,18(1):72. doi: 10.1186/s12885–017–3967–0.
[26]闵军, 林浩铭. 原发性胆囊癌相关基因研究与分子靶向治疗进展[J]. 中国实用外科杂志, 2011, 31(3):261–264.Min J, Lin HM. Progress of research on genes relevant to primary gallbladder cancer and its molecular target therapy[J]. Chinese Journal of Practical Surgery, 2011, 31(3):261–264.
[27]Li M, Zhang Z, Li X, et al. Whole-exome and targeted gene sequencing of gallbladder carcinoma identifies recurrent mutations in the ErbB pathway[J]. Nat Genet, 2014, 46(8):872–876. doi:10.1038/ng.3030.
[28]Giatromanolaki A, Sivridis E, Simopoulos C, et al. Hypoxia inducible factors 1alpha and 2alpha are associated with VEGF expression and angiogenesis in gallbladder carcinomas[J]. J Surg Oncol, 2006, 94(3):242–247. doi: 10.1002/jso.20443
[29]Lunardi A, Webster KA, Papa A, et al. Role of aberrant PI3K pathway activation in gallbladder tumorigenesis[J]. Oncotarget,2014, 5(4):894–900. doi: 10.18632/oncotarget.1808.
[30]Kornprat P, Rehak P, Rüschoff J, et al. Expression of IGF-I, IGFII, and IGF-IR in gallbladder carcinoma. A systematic analysis including primary and corresponding metastatic tumours[J]. J Clin Pathol, 2006, 59(2):202–206. doi: 10.1136/jcp.2005.028480.
[31]Li Q, Yang Z. Expression of phospho-ERK1/2 and PI3-K in benign and malignant gallbladder lesions and its clinical and pathological correlations[J]. J Exp Clin Cancer Res, 2009, 28:65.doi: 10.1186/1756–9966–28–65.
[32]Tan Z, Zhang S, Li M, et al. Regulation of cell proliferation and migration in gallbladder cancer by zinc finger X-chromosomal protein[J]. Gene, 2013, 528(2):261–266. doi: 10.1016/j.gene.2013.06.064.
[33]Li M, Zhang S, Wang Z, et al. Prognostic significance of nemolike kinase(NLK) expression in patients with gallbladder cancer[J].Tumour Biol, 2013, 34(6):3995–4000. doi: 10.1007/s13277–013–0988–4.
[34]Li M, Shen J, Wu X, et al. Downregulated expression of hepatomaderived growth factor (HDGF) reduces gallbladder cancer cell proliferation and invasion[J]. Med Oncol, 2013, 30(2):587. doi:10.1007/s12032–013–0587–7.
[35]Dong P, Zhang Y, Gu J, et al. Wogonin, an active ingredient of Chinese herb medicine Scutellaria baicalensis, inhibits the mobility and invasion of human gallbladder carcinoma GBC-SD cells by inducing the expression of maspin[J]. J Ethnopharmacol, 2011,137(3):1373–1380. doi: 10.1016/j.jep.2011.08.005.
[36]Hezel AF, Noel MS, Allen JN, et al. Phase II study of gemcitabine,oxaliplatin in combination with panitumumab in KRAS wild-type unresectable or metastatic biliary tract and gallbladder cancer[J]. Br J Cancer, 2014, 111(3):430–436. doi: 10.1038/bjc.2014.343.
[37]Zhu AX, Meyerhardt JA, Blaszkowsky LS, et al. Efficacy and safety of gemcitabine, oxaliplatin, and bevacizumab in advanced biliarytract cancers and correlation of changes in 18-fluorodeoxyglucose PET with clinical outcome: a phase 2 study[J]. Lancet Oncol, 2010, 11(1):48–54. doi: 10.1016/S1470–2045(09)70333-X.
[38]刘颖斌, 吴文广. 胆囊癌综合治疗进展[J]. 上海医药, 2014,35(14):6–8.Liu YB, Wu WG. Progress in comprehensive treatment of gallbladder cancer[J]. Shanghai Medical & Pharmaceutical Journal,2014, 35(14):6–8.
[39]Quan ZW, Yue JN, Li JY, et al. Somatostatin elevates topoisomerase II alpha and enhances the cytotoxic effect of doxorubicin on gallbladder cancer cells[J]. Chemotherapy, 2008, 54(6):431–437.doi: 10.1159/000158662.
[40]Quan ZW, Yang Y, Li JY, et al. The mechanisms of somatostatin induced enhanced chemosensitivity of gallbladder cancer cell line to doxorubicin: cell cycle modulation plus target enzyme upregulation[J]. Biomed Pharmacother, 2010, 64(7):451–457. doi:10.1016/j.biopha.2010.01.010.
[41]尹佳欢, 黑振宇, 靳龙洋, 等. 生长抑素联合顺铂对胆囊癌细胞生长的协同抑制作用[J]. 中华肝胆外科杂志, 2017, 23(4):239–245.doi:10.3760/cma.j.issn.1007–8118.2017.04.007.Yin JH, Hei ZY, Jin LY, et al. Somatostatin enhances growth inhibition by cisplatin in gallbladder cancer cells through inducing PTEN expression[J]. Chinese Journal of Hepatobiliary Surgery, 2017, 23(4):239–245. doi:10.3760/cma.j.issn.1007–8118.2017.04.007.