胰周感染是急性胰腺炎(AP)的少见并发症,由于其治疗难度大且明显增加患者病死率[1-2],因而通过早期识别胰周感染的危险因素,从而对高危患者进行尽早的治疗具有极其重要的临床意义。然而目前关于胰周感染危险因素的研究较少,笔者遂通过回顾性分析2010年1月—2016年10月间中南大学湘雅医院连续收治的,起病72 h以内入院的826例AP患者的临床资料,研究胰周感染的早期危险因素 ,从而为预防、诊断及治疗胰周感染提供重要的理论依据。
1 资料与方法
1.1 研究对象
检索中南大学湘雅医院电子病历系统自2010年1月—2016年10月间的信息,收集出院诊断中包含“胰腺炎”关键词的所有患者,通过设立排除标准,将不符合纳入条件的患者剔除,以确立最终的研究对象。具体筛选流程及排除标准见图1。
1.2 诊断标准
AP诊断及严重程度分类标准均遵照中华医学会外科学分会胰腺外科学组2014年所制定的标准《急性胰腺炎诊治指南(2014)》[1]。器官功能衰竭的诊断标准依据改良Marshall评分系统,任何器官评分≥2分即可定义存在器官功能衰竭。胰周感染诊断:所有胰周感染患者均有明确的引流液病原学微生物培养及药敏结果。
1.3 治疗方法
患者入院后均常规予以禁食、补液、抑酶和肠内营养支持等治疗,必要时入住ICU予以器官功能支持。如需预防性使用抗生素,选用针对革兰阴性菌的头孢三代或碳青霉烯类药物。一旦发生胰周感染,均根据培养和药敏结果,选用抗生素治疗。如抗生素治疗仍难以控制感染时,积极地进行外科干预[3]。
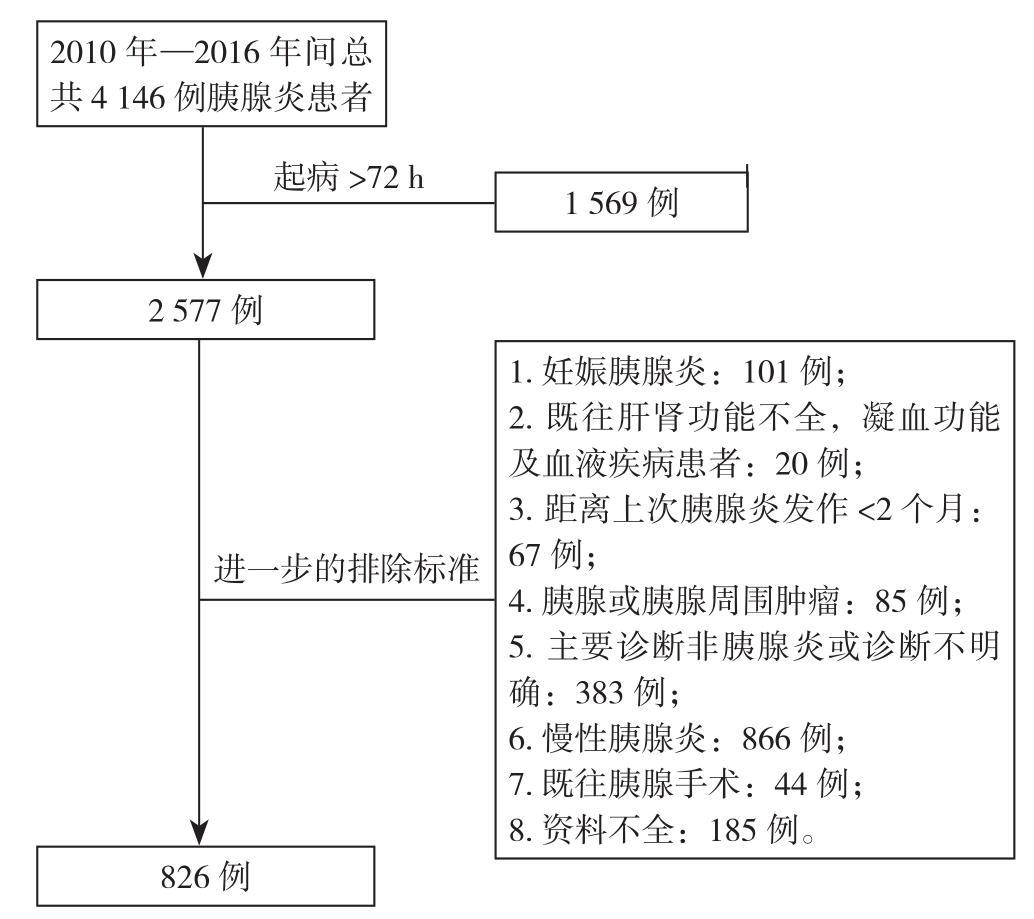
图1 研究对象的筛选流程和排除标准
Figure 1 The screen process and exclusion criteria for the study subjects
1.4 研究资料
搜集患者一般信息包括,性别、年龄、病因、疾病严重程度、住院期间是否发生胰周感染和死亡等;入院24 h血化验指标包括,白细胞计数、中性粒细胞计数、血小板计数、淋巴细胞计数、红细胞比积、中性粒细胞百分比、淋巴细胞百分比、白蛋白、总胆红素、直接胆红素、肌酐、尿素、血钙、血钠、血钾、D-二聚体、凝血酶原时间、凝血酶原百分率、国际标准化比值、活化部分凝血活酶时间、凝血酶时间和纤维蛋白原等;对急性重症胰腺炎(SAP )患者还搜集指标包括,住院时间、入院第1天APACHE II评分、器官功能衰竭距离起病的时间、器官功能衰竭的部位、入院时的膀胱压、入院后开始使用抗生素和肠内营养的时间,器官功能衰竭持续的时间和是否在起病1周内对胰周或腹腔积液进行外科操作(主要包括经皮穿刺置管引流及开腹胰周坏死组织清除)等。
1.5 统计学处理
采用SPSS 22.0软件进行统计学分析,定性资料采用χ2检验或Fisher确切概率法,定量资料的比较采用t检验或Mann-Whitney U检验进行比较,多因素Logistic回归分析用于寻找胰周感染的独立危险因素,P<0.05为差异有统计学意义。
2 结 果
2.1 胰周感染患者的一般资料
826例患者中,共有30例患者在住院期间出现胰周感染,将其归为感染组,其余796例患者住院期间未发生胰周感染,将其归为非感染组。对比两组的一般资料显示,感染组中男性比例明显高于非感染组(83.3% vs. 59.6%,P=0.017);发病年龄在两组间无统计学差异(P=0.831);在病因方面,两组间的差异具有统计学意义(P=0.001)。感染组的SAP患者比例明显高于非感染组(76.7% vs. 6.3%,P<0.001)。感染组患者的住院期间病死率明显增高(46.7% vs. 2.3%,OR=37.8,P<0.001)(表1)。
表1 非感染组与感染组一般情况的单因素分析
Table 1 Univariate analysis of the general conditions between non-infection group and infection group
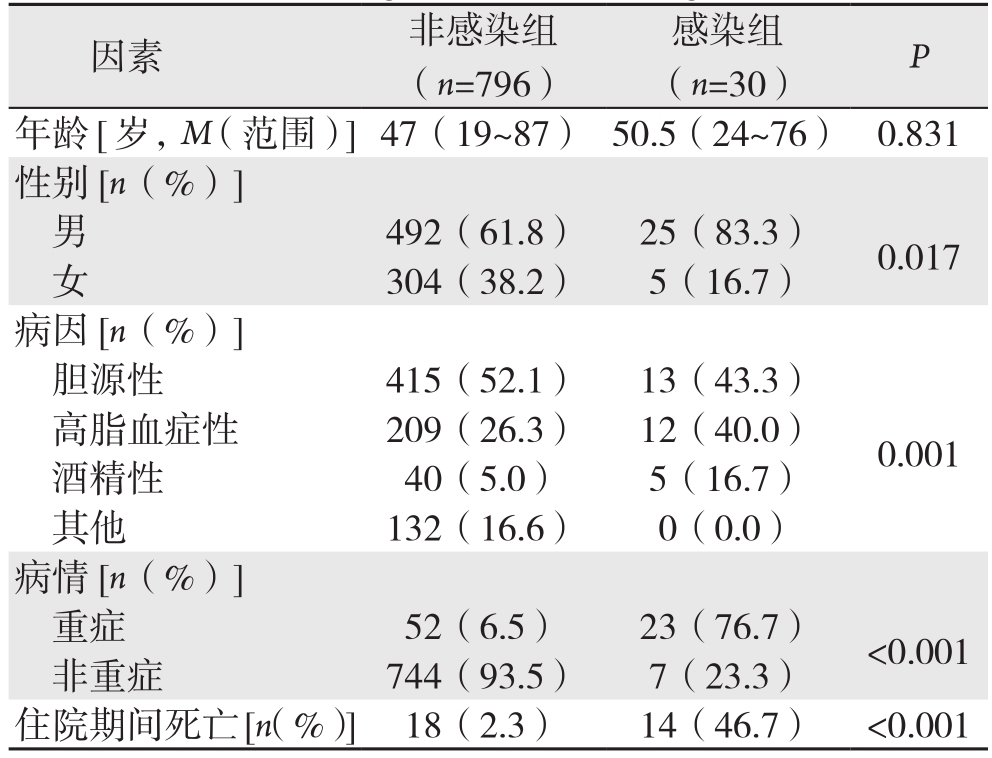
因素 非感染组(n=796)感染组(n=30) P年龄[岁,M(范围)]47(19~87) 50.5(24~76) 0.831性别[n(%)]男492(61.8) 25(83.3) 0.017女304(38.2) 5(16.7)病因[n(%)]胆源性 415(52.1) 13(43.3)高脂血症性 209(26.3) 12(40.0)酒精性 40(5.0) 5(16.7)其他 132(16.6) 0(0.0)病情[n(%)]重症 52(6.5) 23(76.7) <0.001非重症 744(93.5) 7(23.3)住院期间死亡[n(%)]18(2.3) 14(46.7) <0.001 0.001
2.2 胰周感染患者的病原学结果
826例患者中,发生胰周感染30例(3.6%)。胰周感染组患者的引流液病原学结果包括:鲍曼不动杆菌13株,克雷伯菌8株,屎肠球菌7株,葡萄球菌5株,大肠埃希菌5株,铜绿假单胞菌4株,产气肠杆菌3株,弗氏柠檬酸杆菌3株,嗜麦芽窄食单胞菌3株,热带念珠菌3株,光滑念珠菌3株,白色念珠菌3株,鹑鸡肠球菌2株,铅黄肠球菌2株,光滑假丝酵母菌2株,阴沟肠杆菌1株,洋葱伯克霍尔德菌1株。13例(43.3%)患者为混合病原菌感染。
2.3 胰周感染患者的早期预测因素分析
826例AP患者中,感染组与非感染组比较,患者性别、病因、疾病严重程度以及入院24 h以内的常规血化验指标包括,白蛋白、血肌酐、尿素、血钙、血钾、D-二聚体、凝血酶时间、凝血酶原百分率、国际标准比值、活化部分凝血活酶时间和纤维蛋白原等有统计学差异(均P<0.05)。进一步多因素Logistic回归分析显示,患者持续器官功能衰竭(>48 h)(OR=21.143,P<0.001),男性(OR=11.659,P=0.003)以及入院24 h内白蛋白降低(OR=0.872,P=0.006)是预测AP患者发生胰周感染的独立危险因素(表2-3)。
表2 非感染组与感染组入院24 h内常规血化验指标的单因素分析
table 2 Univariate analysis of the variables of routine blood tests with 24 h after admission between non-infection group and infection group
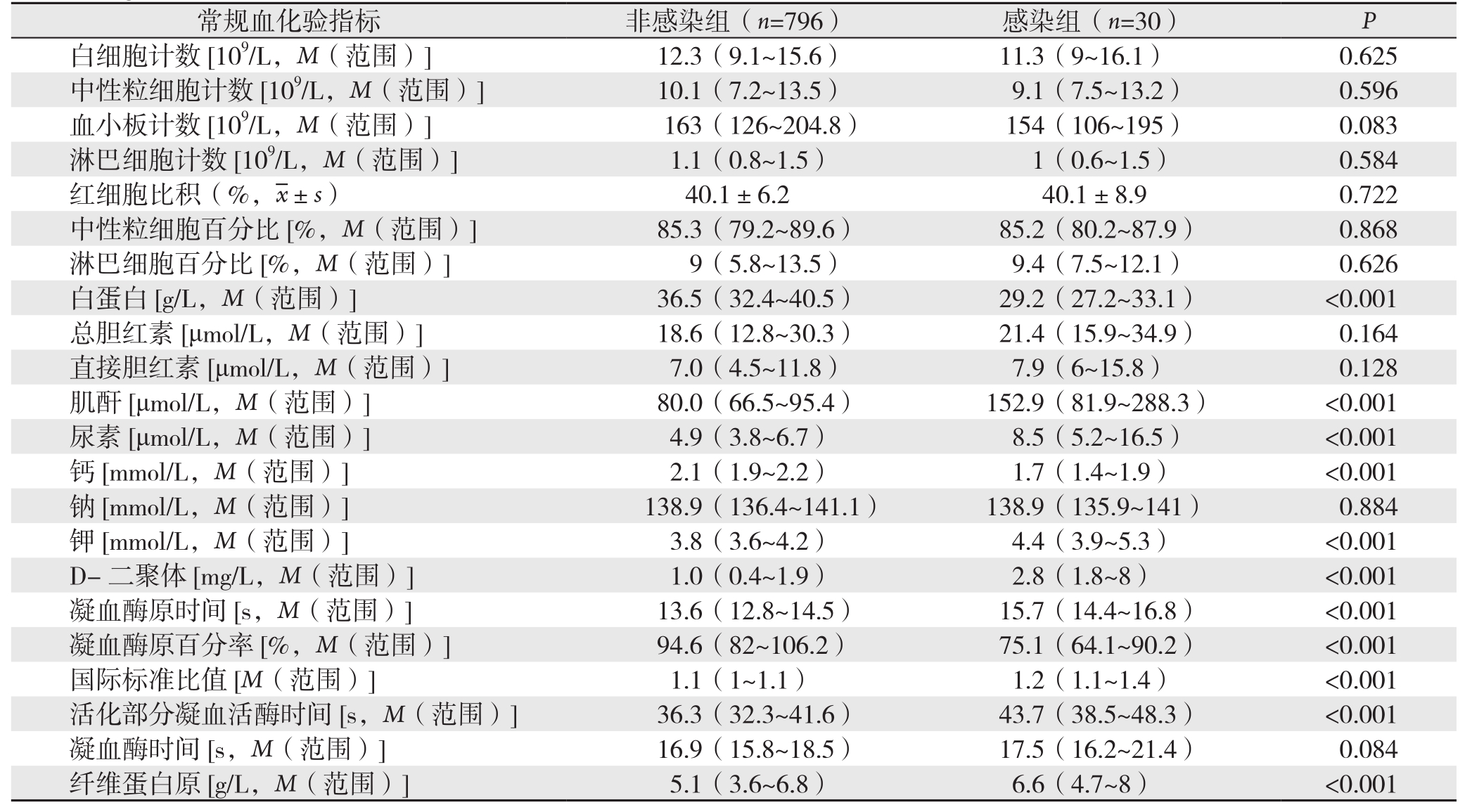
常规血化验指标 非感染组(n=796) 感染组(n=30) P白细胞计数[109/L,M(范围)]12.3(9.1~15.6) 11.3(9~16.1) 0.625中性粒细胞计数[109/L,M(范围)]10.1(7.2~13.5) 9.1(7.5~13.2) 0.596血小板计数[109/L,M(范围)]163(126~204.8) 154(106~195) 0.083淋巴细胞计数[109/L,M(范围)]1.1(0.8~1.5) 1(0.6~1.5) 0.584红细胞比积(%, ±s) 40.1±6.2 40.1±8.9 0.722中性粒细胞百分比[%,M(范围)]85.3(79.2~89.6) 85.2(80.2~87.9) 0.868淋巴细胞百分比[%,M(范围)]9(5.8~13.5) 9.4(7.5~12.1) 0.626白蛋白[g/L,M(范围)]36.5(32.4~40.5) 29.2(27.2~33.1) <0.001总胆红素[μmol/L,M(范围)]18.6(12.8~30.3) 21.4(15.9~34.9) 0.164直接胆红素[μmol/L,M(范围)]7.0(4.5~11.8) 7.9(6~15.8) 0.128肌酐[μmol/L,M(范围)]80.0(66.5~95.4) 152.9(81.9~288.3) <0.001尿素[μmol/L,M(范围)]4.9(3.8~6.7) 8.5(5.2~16.5) <0.001钙[mmol/L,M(范围)]2.1(1.9~2.2) 1.7(1.4~1.9) <0.001钠[mmol/L,M(范围)]138.9(136.4~141.1) 138.9(135.9~141) 0.884钾[mmol/L,M(范围)]3.8(3.6~4.2) 4.4(3.9~5.3) <0.001 D-二聚体[mg/L,M(范围)]1.0(0.4~1.9) 2.8(1.8~8) <0.001凝血酶原时间[s,M(范围)]13.6(12.8~14.5) 15.7(14.4~16.8) <0.001凝血酶原百分率[%,M(范围)]94.6(82~106.2) 75.1(64.1~90.2) <0.001国际标准比值[M(范围)]1.1(1~1.1) 1.2(1.1~1.4) <0.001活化部分凝血活酶时间[s,M(范围)]36.3(32.3~41.6) 43.7(38.5~48.3) <0.001凝血酶时间[s,M(范围)]16.9(15.8~18.5) 17.5(16.2~21.4) 0.084纤维蛋白原[g/L,M(范围)]5.1(3.6~6.8) 6.6(4.7~8) <0.001
±s) 40.1±6.2 40.1±8.9 0.722中性粒细胞百分比[%,M(范围)]85.3(79.2~89.6) 85.2(80.2~87.9) 0.868淋巴细胞百分比[%,M(范围)]9(5.8~13.5) 9.4(7.5~12.1) 0.626白蛋白[g/L,M(范围)]36.5(32.4~40.5) 29.2(27.2~33.1) <0.001总胆红素[μmol/L,M(范围)]18.6(12.8~30.3) 21.4(15.9~34.9) 0.164直接胆红素[μmol/L,M(范围)]7.0(4.5~11.8) 7.9(6~15.8) 0.128肌酐[μmol/L,M(范围)]80.0(66.5~95.4) 152.9(81.9~288.3) <0.001尿素[μmol/L,M(范围)]4.9(3.8~6.7) 8.5(5.2~16.5) <0.001钙[mmol/L,M(范围)]2.1(1.9~2.2) 1.7(1.4~1.9) <0.001钠[mmol/L,M(范围)]138.9(136.4~141.1) 138.9(135.9~141) 0.884钾[mmol/L,M(范围)]3.8(3.6~4.2) 4.4(3.9~5.3) <0.001 D-二聚体[mg/L,M(范围)]1.0(0.4~1.9) 2.8(1.8~8) <0.001凝血酶原时间[s,M(范围)]13.6(12.8~14.5) 15.7(14.4~16.8) <0.001凝血酶原百分率[%,M(范围)]94.6(82~106.2) 75.1(64.1~90.2) <0.001国际标准比值[M(范围)]1.1(1~1.1) 1.2(1.1~1.4) <0.001活化部分凝血活酶时间[s,M(范围)]36.3(32.3~41.6) 43.7(38.5~48.3) <0.001凝血酶时间[s,M(范围)]16.9(15.8~18.5) 17.5(16.2~21.4) 0.084纤维蛋白原[g/L,M(范围)]5.1(3.6~6.8) 6.6(4.7~8) <0.001
表3 826例AP患者胰周感染的多因素Logistics回归分析
Table 3 Multivariate analysis of risk factors for peripancreatic infection in 826 AP patients
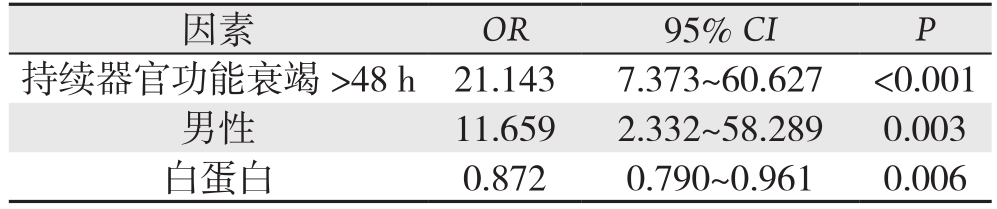
因素 OR 95% CI P持续器官功能衰竭 >48 h 21.143 7.373~60.627 <0.001男性 11.659 2.332~58.289 0.003白蛋白 0.872 0.790~0.961 0.006
2.4 SAP患者中感染组与非感染组比较
根据胰周感染常见发病时间,排除SAP中因早期死亡而无法判断是否将发生胰周感染的患者,遂从75例SAP患者中,剔除16例住院时间不足10 d的患者,以59例SAP患者进一步研究。59例SAP中,有21例发生胰周感染。性别、年龄、病因以及入院第1天的急性生理与慢性健康(APCHE II)评分在两组间无统计学差异(均P>0.05)。感染组住院时间明显长于非感染组(40 d vs. 20.5 d,P=0.004)(表4)。比较两组临床指标,结果显示,入院24 h以内淋巴细胞计数和淋巴细胞百分比、器官功能衰竭数目、持续性器官功能衰竭(>1周)和入院1周内针对胰周感染进行外科操作的人数在两组间存在统计学差异(均P<0.05)(表5-6)。进一步多因素Logistic回归分析结果显示,持续性器官功能衰竭(>1周)(P=0.007,OR=7.47)是SAP继发胰周感染的独立危险因素。
表4 59例SAP患者一般情况的单因素分析
Table 4 Univariate analysis of the general conditions in the 59 patients with SAP
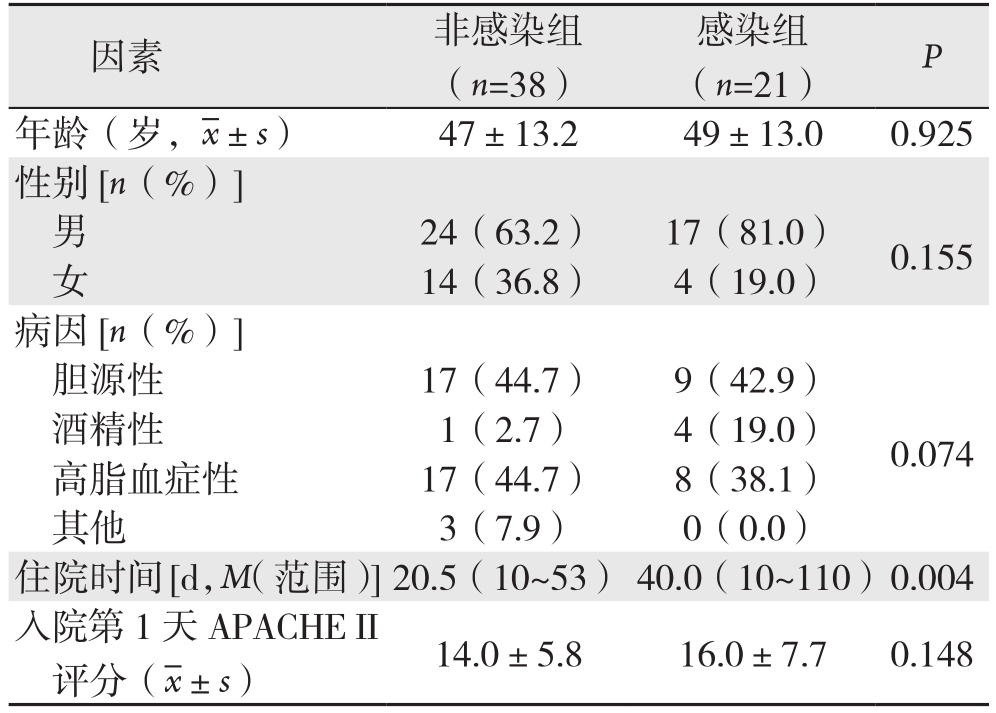
因素 非感染组(n=38)感染组(n=21) P年龄(岁,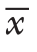 ±s) 47±13.2 49±13.0 0.925性别[n(%)]男24(63.2) 17(81.0) 0.155女14(36.8) 4(19.0)病因[n(%)]胆源性 17(44.7) 9(42.9)酒精性 1(2.7) 4(19.0) 0.074高脂血症性 17(44.7) 8(38.1)其他 3(7.9) 0(0.0)住院时间[d,M(范围)]20.5(10~53) 40.0(10~110)0.004入院第1天APACHE II评分(
±s) 47±13.2 49±13.0 0.925性别[n(%)]男24(63.2) 17(81.0) 0.155女14(36.8) 4(19.0)病因[n(%)]胆源性 17(44.7) 9(42.9)酒精性 1(2.7) 4(19.0) 0.074高脂血症性 17(44.7) 8(38.1)其他 3(7.9) 0(0.0)住院时间[d,M(范围)]20.5(10~53) 40.0(10~110)0.004入院第1天APACHE II评分(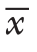 ±s) 14.0±5.8 16.0±7.7 0.148
±s) 14.0±5.8 16.0±7.7 0.148
表5 SAP中非感染组与感染组入院24 h常规血化验指标的单因素分析
Table 5 Univariate analysis of the variables of routine blood tests with 24 h after admission between non-infection group and infection group among those with SAP
常规血化验指标 非感染组(n=38) 感染组(n=21) P白细胞计数[109/L,M(范围)]14.6(10.5~16.4) 11.6(10.1~17) 0.361中性粒细胞计数(109/L, ±s) 11.1±5.4 10.4±3.9 0.616血小板计数[109/L,M(范围)]170.5(128.8~211.5) 129.0(102.3~189.8) 0.076淋巴细胞计数[109/L,M(范围)]1.5(1~2.2) 1.0(0.6~1.5) 0.017红细胞比积(%,
±s) 11.1±5.4 10.4±3.9 0.616血小板计数[109/L,M(范围)]170.5(128.8~211.5) 129.0(102.3~189.8) 0.076淋巴细胞计数[109/L,M(范围)]1.5(1~2.2) 1.0(0.6~1.5) 0.017红细胞比积(%, ±s) 43.1±8.7 42.0±8.8 0.679中性粒细胞百分比[%,M(范围)]85.4(77.4~87.8) 86.3(79.8~89.1) 0.410淋巴细胞百分比[%,M(范围)]13.1(9.3~16.6) 8.7(7.1~12.3) 0.046白蛋白(g/L,
±s) 43.1±8.7 42.0±8.8 0.679中性粒细胞百分比[%,M(范围)]85.4(77.4~87.8) 86.3(79.8~89.1) 0.410淋巴细胞百分比[%,M(范围)]13.1(9.3~16.6) 8.7(7.1~12.3) 0.046白蛋白(g/L, ±s) 32.3±6.3 32.4±7.5 0.937总胆红素[μmol/L,M(范围)]20.7(14.7~32.3) 19.1(14.5~37.7) 0.920直接胆红素[μmol/L,M(范围)]8.9(5~13.1) 7.5(5.9~17.1) 0.993肌酐[μmol/L,M(范围)]137.9(87.5~204) 174.8(104.8~294.5) 0.229尿素[μmol/L,M(范围)]8.6(6~12) 11.3(6.3~16.7) 0.212钙(mmol/L,
±s) 32.3±6.3 32.4±7.5 0.937总胆红素[μmol/L,M(范围)]20.7(14.7~32.3) 19.1(14.5~37.7) 0.920直接胆红素[μmol/L,M(范围)]8.9(5~13.1) 7.5(5.9~17.1) 0.993肌酐[μmol/L,M(范围)]137.9(87.5~204) 174.8(104.8~294.5) 0.229尿素[μmol/L,M(范围)]8.6(6~12) 11.3(6.3~16.7) 0.212钙(mmol/L,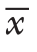 ±s) 1.7±0.4 1.6±0.3 0.359钠(mmol/L,
±s) 1.7±0.4 1.6±0.3 0.359钠(mmol/L,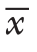 ±s) 140.0±4.8 139.2±6.4 0.623钾(mmol/L,
±s) 140.0±4.8 139.2±6.4 0.623钾(mmol/L,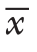 ±s) 4.6±0.9 4.8±0.9 0.483 D-二聚体[mg/L,M(范围)]1.9(1.25~5) 2.4(1.6~5.7) 0.261凝血酶原时间[s,M(范围)]15.1(13.9~17.5) 15.4(14.2~16.8) 0.939凝血酶原百分率(%,
±s) 4.6±0.9 4.8±0.9 0.483 D-二聚体[mg/L,M(范围)]1.9(1.25~5) 2.4(1.6~5.7) 0.261凝血酶原时间[s,M(范围)]15.1(13.9~17.5) 15.4(14.2~16.8) 0.939凝血酶原百分率(%,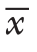 ±s) 79.3±21.5 80.4±20.7 0.858国际标准比值[M(范围)]1.3(1.1~1.4) 1.2(1.1~1.4) 0.908活化部分凝血活酶时间[s,M(范围)]44.1(37~50.4) 41.3(34.6~45.9) 0.365凝血酶时间[s,M(范围)]19.7(16.6~22) 18.0(17.2~22) 0.870纤维蛋白原(g/L,
±s) 79.3±21.5 80.4±20.7 0.858国际标准比值[M(范围)]1.3(1.1~1.4) 1.2(1.1~1.4) 0.908活化部分凝血活酶时间[s,M(范围)]44.1(37~50.4) 41.3(34.6~45.9) 0.365凝血酶时间[s,M(范围)]19.7(16.6~22) 18.0(17.2~22) 0.870纤维蛋白原(g/L,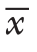 ±s) 6.4±1.7 5.7±2.3 0.230
±s) 6.4±1.7 5.7±2.3 0.230
表6 SAP中非感染组与感染组临床指标的单因素分析
Table 6 Univariate analysis of the clinical factors between non-infection group and infection group among those with SAP
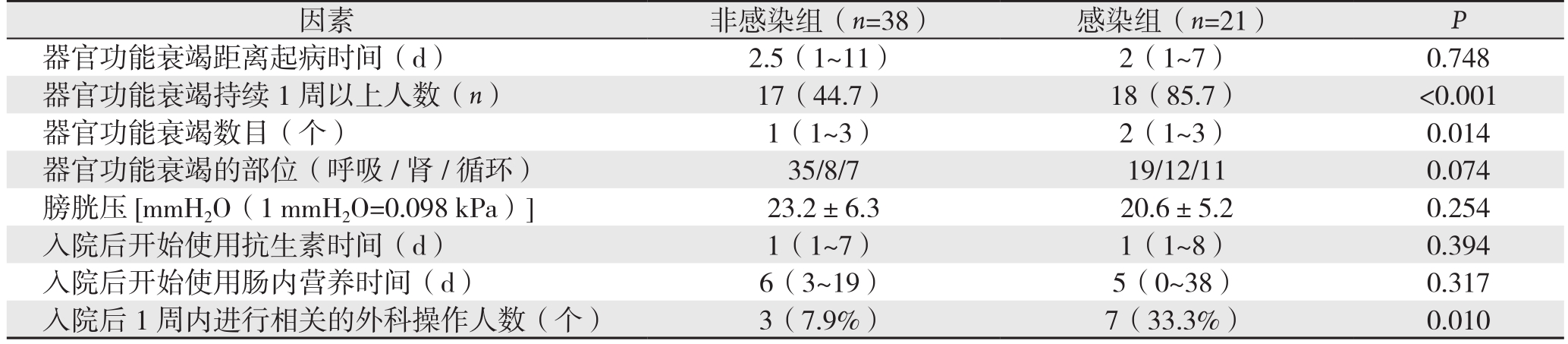
因素 非感染组(n=38) 感染组(n=21) P器官功能衰竭距离起病时间(d) 2.5(1~11) 2(1~7) 0.748器官功能衰竭持续1周以上人数(n) 17(44.7) 18(85.7) <0.001器官功能衰竭数目(个) 1(1~3) 2(1~3) 0.014器官功能衰竭的部位(呼吸/肾/循环) 35/8/7 19/12/11 0.074膀胱压[mmH2O(1 mmH2O=0.098 kPa)]23.2±6.3 20.6±5.2 0.254入院后开始使用抗生素时间(d) 1(1~7) 1(1~8) 0.394入院后开始使用肠内营养时间(d) 6(3~19) 5(0~38) 0.317入院后1周内进行相关的外科操作人数(个) 3(7.9%) 7(33.3%) 0.010
3 讨 论
胰周感染是AP较为凶险的并发症,据统计,SAP中将有1/3胰周积液将进展为胰周感染,患者一旦继发胰周感染,病死率将高达43%~100%[4-5]。尽管近年来提出的“升阶梯”治疗策略使得胰周感染患者的预后得到极大改善[6-7],但胰周感染的治疗仍然存在争议。例如:⑴ 是否需要早期预防性使用抗生素[8-9]?⑵ 尽管目前认为PCD应尽量推迟到起病4周以后[10-11],但对部分患者早期行PCD术是否更为有益[12-13]?⑶ 对于临床部分患者,是否将开腹手术作为第一选择[14]?此外,胰周感染常发生于起病后2周左右,这意味着临床医生有充足的时间来防治这一致命并发症。由此可见,胰周感染的治疗还存在较大的提升空间,而通过寻找胰周感染的危险因素,进而对高危患者进行“个体化”治疗,对于进一步提高急性重症胰腺炎的疗效有着十分重要的临床意义。
然而,目前尚无理想的胰周感染预测指标。尽管有较多学者发现降钙素原(PCT),C反应蛋白(CRP)可作为胰周感染较为准确的预测指标。一项纳入17个前瞻性研究的Meta分析结果显示PCT预测胰周感染的灵敏度和特异度分别为80%、91%,是有价值的预测指标。但是也有学者指出,该Meta分析存在以下几个主要缺陷:⑴ 需要动态监测患者2周内的PCT值,这给患者带来很大的经济负担;⑵ 纳入研究的PCT截取值差异较大,不利于实际运用;⑶ 单个研究的样本量偏少(n<100)[15-16]。CRP主要由肝脏合成,常常在AP起病后24~48 h才明显升高,在72~96 h达到峰值,不适合于在疾病早期预测胰周感染,也不能即时评估胰周感染的风险,且其准确性在不同研究中存在较大差异[17]。
本研究结果显示,持续性器官功能衰竭(>48 h)是AP继发胰周感染的独立危险因素之一。已有研究[18]表明,相比一过性器官功能衰竭,持续性器官功能衰竭的患者并发症发生率和病死率更高。Lytras等[19]也发现持续性器官功能衰竭(>48 h)患者胰周感染和致死性并发症发生率是TOF的12.54倍及8.84倍。值得注意的是,SAP中仍有少部分患者对治疗反应差,器官功能衰竭较难被逆转且持续时间长,对于此类患者是否更易继发胰周感染缺乏相关文献报道。笔者通过研究发现,器官功能衰竭持续时间与胰周感染发病率存在明显的相关性,持续性器官功能衰竭(>1周)继发胰周感染的风险是持续性器官功能衰竭(>48 h)患者的7.47倍。此外,本组研究发现白蛋白减少是胰周感染的危险因素之一,目前尚无文献报道,但有研究表明AP患者出现低蛋白血症预示着更长的住院时间和更高的经皮穿刺置管引流(PCD)失败率[20-21]并且是患者并发急性呼吸窘迫综合征(ARDS)的独立危险因素[22],其机制尚不清楚,可能为:⑴ 低蛋白血症提示AP患者的毛细血管通透性明显增加,“渗漏综合征”严重,血管反应重,进而反映患者存在严重的全身严重反应综合征。⑵ 白蛋白作为反映患者营养状况的指标之一,其降低提示患者存在营养不良和负氮平衡,病情处于持续进展之中。本研究还发现,男性患者继发胰周感染的风险明显高于女性。Hollemans等[23]在一项前瞻性的关于130例感染性胰腺坏死患者PCD失败的危险因素的研究中也发现男性是独立危险因素之一,尽管他们未能明确地解释性别与胰周感染的关系,但指出有部分重症医学领域的研究表明,男性相比女性更容易出现重症感染,需要更严密的监护及更为频繁的侵入性操作。此外,由于本研究胰周感染病例仅30例,不能排除因样本量小所产生的偏倚。
值得注意的是,胰周积液面积、胰腺坏死程度及坏死部位可能与胰周感染存在相关性,是需要考虑的重要因素之一[24-25],但由于该回顾性研究时间跨度大,许多患者影像学资料已经不能获得,无法进行研究,这是本研究的缺陷。
综上所述,住院期间出现持续性器官功能衰竭(>48 h),男性以及入院24 h内白蛋白减少将是AP患者继发胰周感染的独立危险因素,且器官功能衰竭持续时间越长,发生胰周感染的风险越高。
[1]王春友,杨明.《急性胰腺炎诊治指南 (2014)》解读——急性胰腺炎外科诊治现状与进展[J].中国实用外科杂志,2015,35(1):8–10.doi: 10.7504/CJPS.ISSN1005–2208.2015.01.03.Wang CY,Yang M.Interpretation of guidelines for the diagnosis and treatment of acute pancreatitis (2014)-Present status and development actuality of treatment of acute pancreatitis[J].Chinese Journal of Practical Surgery,2015,35(1):8–10.doi: 10.7504/CJPS.ISSN1005–2208.2015.01.03.
[2]沈骁,杨栋梁,邹磊,等.急性胰腺炎后期感染性胰腺坏死影响因素分析(附153例报告)[J].中国实用外科杂志,2015,35(5):522–524.doi: 10.7504/CJPS.ISSN1005–2208.2015.05.20.Shen X,Yang DL,Zou L,et al.Analysis of risk factors of infected pancreatic necrosis in the later stage of acute pancreatitis: a report of 153 patients[J].Chinese Journal of Practical Surgery,2015,35(5):522–524.doi: 10.7504/CJPS.ISSN1005–2208.2015.05.20.
[3]黄耿文,申鼎成,亢浩,等.微创腹膜后入路胰腺坏死组织清除术治疗感染性胰腺坏死18例疗效分析[J].中国实用外科杂志,2016,36(11): 1197–1199.doi: 10.7504/CJPS.ISSN1005–2208.2016.11.16.Huang GW,Shen DC,Kang H,et al.Role of minimal access retroperitoneal pancreatic necrosectomy in the treatment of infected pancreatic necrosis: an analysis of 18 cases[J].Chinese Journal of Practical Surgery,2016,36(11): 1197–1199.doi: 10.7504/CJPS.ISSN1005–2208.2016.11.16.
[4]Petrov MS,Shanbhag S,Chakraborty M,et al.Organ failure and infection of pancreatic necrosis as determinants of mortality in patients with acute pancreatitis[J].Gastroenterol,2010,139(3):813–820.doi: 10.1053/j.gastro.2010.06.010.
[5]Werge M,Novovic S,Schmidt PN,et al.Infection increases mortality in necrotizing pancreatitis: a systematic review and metaanalysis[J].Pancreatology,2016,16(5):698–707.doi: 10.1016/j.pan.2016.07.004.
[6]Ukai T,Shikata S,Inoue M,et al.Early prophylactic antibiotics administration for acute necrotizing pancreatitis: a meta-analysis of randomized controlled trials[J].J Hepatobiliary Pancreat Sci,2015,22(4): 316–321.doi: 10.1002/jhbp.221.
[7]许贲,郑晓博,刘卫辉,等.经皮穿刺置管引流前行腹腔穿刺引流治疗合并液体积聚的急性胰腺炎[J].中国普通外科杂志,2014,23(9):1161–1165.doi:10.7659/j.issn.1005–6947.2014.09.001.Xu B,Zheng XB,Liu WH,et al.Abdominal paracentesis drainage prior to percutaneous catheter drainage for acute pancreatitis with fluid collections[J].Chinese Journal of General Surgery,2014,23(9):1161–1165.doi:10.7659/j.issn.1005–6947.2014.09.001.
[8]Yokoe M,Takada T,Mayumi T,et al.Japanese guidelines for the management of acute pancreatitis: Japanese Guidelines 2015[J].J Hepatobiliary Pancreat Sci,2015,22(6):405–432.doi: 10.1002/jhbp.259.
[9]Tenner S,Baillie J,DeWitt J,et al.American College of Gastroenterology guideline: management of acute pancreatitis[J].Am J Gastroenterol,2013,108(9):1400–1415.doi: 10.1038/ajg.2013.218.
[10]van Grinsven J,van Santvoort HC,Boermeester MA,et al.Timing of catheter drainage in infected necrotizing pancreatitis[J].Nat Rev Gastroenterol Hepatol,2016,13(5):306–312.doi: 10.1038/nrgastro.2016.23.
[11]黄耿文,申鼎成.意大利重症急性胰腺炎共识指南(2015)解读[J].中国普通外科杂志,2016,25(3):313–317.doi:10.3978/j.issn.1005–6947.2016.03.001.Huang GW,Shen DC.Interpretation of consensus guidelines for severe acute pancreatitis (2015) in Italy[J].Chinese Journal of General Surgery,2016,25(3):313–317.doi:10.3978/j.issn.1005–6947.2016.03.001.
[12]Sugimoto M,Sonntag DP,Flint GS,et al.Better outcomes if percutaneous drainage is used early and proactively in the course of necrotizing pancreatitis[J].J Vas Interv Radiol,2016,27(3):418–425.doi: 10.1016/j.jvir.2015.11.054.
[13]Jafri NS,Mahid SS,Idstein SR,et al.Antibiotic prophylaxis is not protective in severe acute pancreatitis: a systematic review and meta-analysis[J].Am J Surg,2009,197(6):806–813.doi: 10.1016/j.amjsurg.2008.08.016.
[14]Tong Z,Li W,Yu W,et al.Percutaneous catheter drainage for infective pancreatic necrosis: is it always the first choice for all patients?[J].Pancreas,2012,41(2):302–305.doi: 10.1097/MPA.0b013e318229816f.
[15]Besselink MG,van Santvoort HC,Buskens E,et al.Probiotic prophylaxis in predicted severe acute pancreatitis: a randomised,double-blind,placebo-controlled trial[J].Lancet,2008,371(9613):651–659.doi: 10.1016/S0140–6736(08)60207-X.
[16]Mof i di R,Suttie S A,Patil PV,et al.The value of procalcitonin at predicting the severity of acute pancreatitis and development of infected pancreatic necrosis: systematic review[J].Surgery,2009,146(1):72–81.doi: 10.1016/j.surg.2009.02.013.
[17]Talukdar R,Nechutova H,Clemens M,et al.Could rising BUN predict the future development of infected pancreatic necrosis?[J].Pancreatology,2013,13(4):355–359.doi: 10.1016/j.pan.2013.05.003.
[18]Johnson CD,Abu-Hilal M.Persistent organ failure during the first week as a marker of fatal outcome in acute pancreatitis[J].Gut,2004,53(9):1340–1344.doi: 10.1136/gut.2004.039883.
[19]Lytras D,Manes K,Triantopoulou C,et al.Persistent early organ failure: defining the high-risk group of patients with severe acute pancreatitis?[J].Pancreas,2008,36(3):249–254.doi: 10.1097/MPA.0b013e31815acb2c.
[20]Harrison S,Kakade M,Varadarajula S,et al.Characteristics and Outcomes of Patients Undergoing Debridement of Pancreatic Necrosis Discussion[J].J Gastrointest Surg,2010,14(2):245–251.doi: 10.1007/s11605–009–1100–7.
[21]Shenvi S,Gupta R,Kang M,et al.Timing of surgical intervention in patients of infected necrotizing pancreatitis not responding to percutaneous catheter drainage[J].Pancreatology,2016,16(5):778–787.doi: 10.1016/j.pan.2016.08.006.
[22]邵斌霞,何斌,刘红梅,等.急性重症胰腺炎并发ARDS多因素回归分析[J].临床急诊杂志,2014,15(8):449–451.doi: 10.13201/j.issn.1009–5918.2014.08.001.Shao BX,He B,Liu HM,et al.Multivariate regression analysis for severe acute pancreatitis patients with ARDS[J].Journal of Clinical Emergency Call,2014,15(8):449–451.doi: 10.13201/j.issn.1009–5918.2014.08.001.
[23]Hollemans RA,Bollen TL,van Brunschot S,et al.Predicting success of catheter drainage in infected necrotizing pancreatitis[J].Ann Surg,2016,263(4):787–792.doi: 10.1097/SLA.0000000000001203.
[24]Garg PK,Madan K,Pande GK,et al.Association of extent and infection of pancreatic necrosis with organ failure and death in acute necrotizing pancreatitis[J].Clin Gastroenterol Hepatol,2005,3(2):159–166.
[25]Bakker OJ,van Santvoort H,Besselink MG,et al.Extrapancreatic necrosis without pancreatic parenchymal necrosis: a separate entity in necrotising pancreatitis?[J].Gut,2013,62(10):1475–1480.doi:10.1136/gutjnl-2012–302870.