原发性肝癌是全球第六大恶性肿瘤,是癌症相关性死亡的第二大原因,其每年造成全球约70万人死亡[1]。在我国,原发性肝癌发病率居第二位,仅次于肺癌[2],它的病理类型主要包括肝细胞癌(HCC)、肝内胆管癌(ICC)和混合型肝癌(HCC-ICC),其中85%~90%为HCC[3]。乙型肝炎病毒(HBV)持续感染后导致肝硬化进而演变成为HCC是其发病率骤升的主要原因[4],慢性HBV感染患者发展成为HCC的风险相较于未感染者增加了近100倍[5]。尽管肝切除和肝移植仍是目前HCC最有效的治疗方法,但由于HCC早期症状比较隐匿,很多患者一经诊断便失去了手术治疗的机会[6],那么对于HCC的早期诊断便变得尤为重要。目前临床上常用甲胎蛋白(AFP)作为HCC的筛查,但因AFP在转录上受多种因素调控,约1/3的HCC患者血清AFP正常,因而具有一定局限性[7]。因此,探寻新的HCC早期特异性诊断标志物具有重要意义。
外泌体是直径在40~100 nm之间的具有生物学功能的细胞外囊泡,可以由多种类型的细胞所分泌,包括肿瘤细胞、免疫细胞、肝细胞及神经元细胞[8]。它可以存在于各种体液当中,如血液、尿液、唾液以及母乳[9],外泌体中富含大量的脂类、蛋白质、mRNA和microRNA(miRNA)以及能够介导细胞间信息传递的活性分子,它可以通过转移功能蛋白、miRNA和其他活性物质来增强细胞与细胞之间的联系,广泛参与细胞间物质交换与信息交流[10]。当肿瘤发生时,肿瘤细胞可以比正常细胞分泌更多的外泌体,将miRNA和或活性分子传递至特定细胞或组织,形成有利于肿瘤生长和发展的微环境,不同程度地参与肿瘤进展的病理过程[11]。miRNA是一种小的长度为19~24 nt内源性非编码的小分子RNA[12],它在转录后水平起作用,参与细胞增殖与分化、细胞凋亡、肿瘤转移、血管形成和免疫应答等多种生物过程[13]。由于外泌体具有脂质双层膜结构,能很好的保护其包被的物质,因此外泌体内miRNA相比于循环miRNA更加稳定。因此,越来越多的研究发现外泌体中miRNA可以作为多种肿瘤疾病潜在标志物及治疗靶标[14]。
笔者前期实验通过对HCC细胞系HepG2与过表达乙型肝炎病毒X蛋白(HBx)的HepG2细胞系的细胞上清外泌体进行高通量测序,发现miR-1290在过表达HBx的HepG2细胞培养上清的外泌体中含量显著增高,由于HBx能够诱导肝细胞内多种miRNA的异常表达从而促进HBV相关HCC的发生发展[15-17],且外泌体的旁分泌途径可能是一种新的致癌机制,故推测外泌体miR-1290可能与HBx参与肝癌有关。本研究通过收集HBV相关HCC患者标本,探讨HBV相关HCC患者血清外泌体miR-1290水平与疾病的关联以及对其诊断效能的评估。
1 资料与方法
1.1 临床样本及数据收集
90例血液样本均全部来自于中南大学湘雅医院,于2017年8月—2018年11月收集。其中健康体检者(健康对照)19例,HBV携带者20例,乙型肝炎肝硬化患者20例,HBV相关HCC患者31例。HBV携带者样本通过相关血清学检验诊断;乙型肝炎肝硬化通过肝穿刺活检或影像学检查确诊;HCC均通过组织病理学确诊,且HCC患者血液样本均在患者行外科手术或介入治疗之前采集,4组样本均排除合并其他肿瘤、丙肝病毒感染、自身免疫疾病及血液系统疾病。收集各组研究对象的基本信息及临床相关资料。本项研究通过了中南大学湘雅医院伦理委员会的批准,所有的研究对象均提供了知情同意和签署了知情同意书。
1.2 血清外泌体的分离及鉴定
采用血清试管采集研究对象外周血3~5 mL,静置15 min,室温下3000 g离心15 min后吸取上层血清至EP管内,放至-80 ℃冰箱保存备用。利用血清外泌体分离试剂盒(ExoQuick exosome precipitation solution;货号:EXOQ5A-1,美国SBI公司)分离提取血清外泌体,严格按照试剂盒使用说明进行操作。将提取的外泌体样品通过磷钨酸负染色后置于透射电镜下观察外泌体颗粒的形态。利用Nano Sight纳米颗粒跟踪分析技术对所提取的外泌体颗粒粒径进行检测,通过Western blot来检测血清外泌体表面特异性蛋白标志物(CD63和TSG101蛋白分子),所使用的抗体包括CD63(中国ABclonal公司,A5271)、TSG101(美国Sigma-Aldrich公司,HPA00616)、羊抗兔二抗(美国Proteintech公司,SA00001-2)。
1.3 外泌体miR-1290水平的检测
应用血清/血浆miRNA提取试剂盒(The miRNeasy Serum/Plasma Kit;目录号:217184,德国Qiagen公司)严格依照使用说明提取血清外泌体中的miRNA,测定miRNA的浓度,利用逆转录试剂盒(All-in-One™ miRNA First-Strand cDNA Synthesis Kit;货号:QP013,美国GeneCopoeia ™公司)对提取的外泌体miRNA进行逆转录(反应条件为:37 ℃ 1 h;85 ℃5 min),获得cDNA。应用RT-PCR试剂盒(Allin-One™ miRNA qPCR Kit;货号:QP010,美国 GeneCopoeia™公司),采用SYBR法,以miR-16-5p为内参进行qPCR[18-19] (反应条件为:95 ℃预变性10 min;95 ℃变性12 s;60 ℃退火延伸1 min,上述进行40个循环)。miR-1290正义链:5'-TGG ATT TTT GGA TCA GGG A-3',反义链:5'-CGC GTG GAT TTT TGG ATC AGG GA-3';miR-16-5p正义链:5'-TAG CAG CAC GTA AAT ATT GGC G-3',反义链:5'-CGC TAG CAG CAC GTA AAT ATT GGC G-3'。通过应用差异倍数=2-△△Ct法计算各组间miR-1290的相对表达量。
1.4 统计学处理
采用SPSS18.0软件进行数据分析,GraphPad Prism 7软件制图。计量资料符合正态分布采用均数±标准差(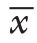 ±s)表示,偏态分布采用中位数(四分位间距)[M(Q)]表示。计量资料组间比较采用t检验或者Mann-Whitney U检验;计数资料组间比较采用χ2检验。利用ROC曲线评价血清外泌体miR-1290在HBV相关HCC中的诊断效能。P<0.05为差异有统计学意义。
±s)表示,偏态分布采用中位数(四分位间距)[M(Q)]表示。计量资料组间比较采用t检验或者Mann-Whitney U检验;计数资料组间比较采用χ2检验。利用ROC曲线评价血清外泌体miR-1290在HBV相关HCC中的诊断效能。P<0.05为差异有统计学意义。
2 结 果
2.1 研究对象的一般资料
健康对照组年龄(43.95±13.53)岁,男13例,女6例;乙型肝炎肝硬化组和HBV携带组及HBV相关HCC组年龄分别为(49.35±10.74)岁、(44.95±10.73)岁、(50.58±12.8)岁,乙型肝炎肝硬化组和HBV携带组男、女性均为14例和6例,HBV相关HCC组为26例和5例。各组在性别、年龄、丙氨酸氨基转移酶(ALT)方面均无统计学差异(均P>0.05);天门冬氨酸氨基转移酶(AST)、白蛋白、总胆汁酸、AFP以及合并肝硬化方面均存在统计学意义(均P<0.05),尤其是在白蛋白、AFP及合并肝硬化方面差异有明显差异(均P<0.001)。根据2017年版原发性肝癌诊疗规范[20]对HCC组进行TNM分期及病理分级,其中早期(I+II期)与晚期(III+IV期)分别为13例和18例,分化程度良好(I+II级)与分化程度差(III+IV级)分别为26例和5例(表1)。
表1 各组研究对象的一般资料
Table1 General information of each group of subjects
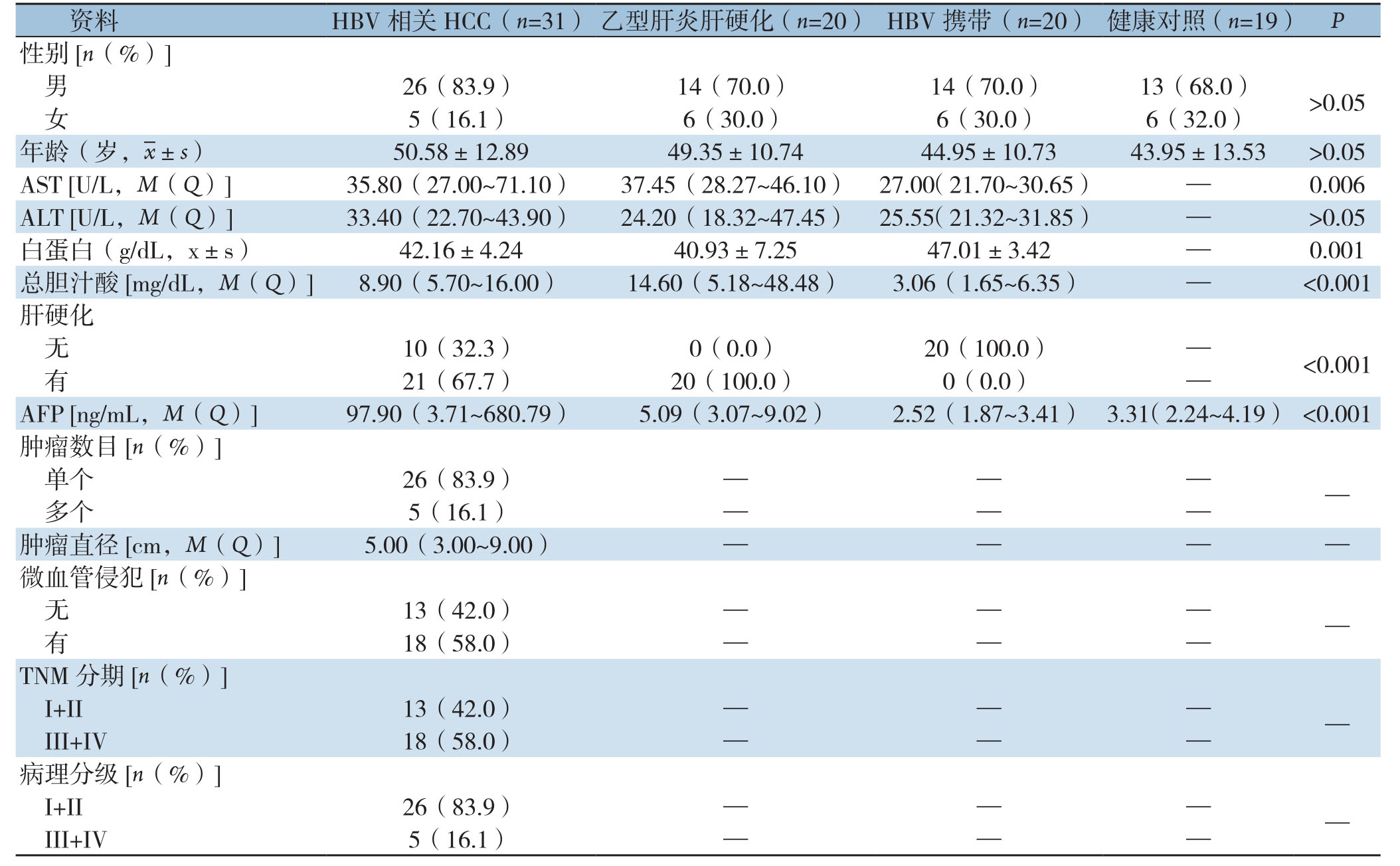
资料 HBV相关HCC(n=31) 乙型肝炎肝硬化(n=20) HBV携带(n=20) 健康对照(n=19) P性别[n(%)]男26(83.9) 14(70.0) 14(70.0) 13(68.0) >0.05女5(16.1) 6(30.0) 6(30.0) 6(32.0)年龄(岁,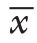 ±s) 50.58±12.8949.35±10.7444.95±10.7343.95±13.53 >0.05 AST [U/L,M(Q)] 35.80(27.00~71.10) 37.45(28.27~46.10) 27.00(21.70~30.65) — 0.006 ALT [U/L,M(Q)] 33.40(22.70~43.90) 24.20(18.32~47.45) 25.55(21.32~31.85) — >0.05白蛋白(g/dL,x±s) 42.16±4.2440.93±7.2547.01±3.42 — 0.001总胆汁酸[mg/dL,M(Q)] 8.90(5.70~16.00) 14.60(5.18~48.48) 3.06(1.65~6.35) — <0.001肝硬化无10(32.3) 0(0.0) 20(100.0) — <0.001有21(67.7) 20(100.0) 0(0.0) —AFP [ng/mL,M(Q)] 97.90(3.71~680.79) 5.09(3.07~9.02) 2.52(1.87~3.41) 3.31(2.24~4.19) <0.001肿瘤数目[n(%)]单个 26(83.9) — — — —多个 5(16.1) — — —肿瘤直径[cm,M(Q)] 5.00(3.00~9.00) — — — —微血管侵犯[n(%)]无13(42.0) — — — —有18(58.0) — — —TNM分期[n(%)]I+II 13(42.0) — — — —III+IV 18(58.0) — — —病理分级[n(%)]I+II 26(83.9) — — — —III+IV 5(16.1) — — —
±s) 50.58±12.8949.35±10.7444.95±10.7343.95±13.53 >0.05 AST [U/L,M(Q)] 35.80(27.00~71.10) 37.45(28.27~46.10) 27.00(21.70~30.65) — 0.006 ALT [U/L,M(Q)] 33.40(22.70~43.90) 24.20(18.32~47.45) 25.55(21.32~31.85) — >0.05白蛋白(g/dL,x±s) 42.16±4.2440.93±7.2547.01±3.42 — 0.001总胆汁酸[mg/dL,M(Q)] 8.90(5.70~16.00) 14.60(5.18~48.48) 3.06(1.65~6.35) — <0.001肝硬化无10(32.3) 0(0.0) 20(100.0) — <0.001有21(67.7) 20(100.0) 0(0.0) —AFP [ng/mL,M(Q)] 97.90(3.71~680.79) 5.09(3.07~9.02) 2.52(1.87~3.41) 3.31(2.24~4.19) <0.001肿瘤数目[n(%)]单个 26(83.9) — — — —多个 5(16.1) — — —肿瘤直径[cm,M(Q)] 5.00(3.00~9.00) — — — —微血管侵犯[n(%)]无13(42.0) — — — —有18(58.0) — — —TNM分期[n(%)]I+II 13(42.0) — — — —III+IV 18(58.0) — — —病理分级[n(%)]I+II 26(83.9) — — — —III+IV 5(16.1) — — —
2.2 血清外泌体的鉴定
首先利用透射电镜观察所提取血清外泌体颗粒的形态,视野下可见多个直径约50~100 nm呈茶托型或一侧凹陷半球形的具有脂质双层膜囊状颗粒(图1A)。然后采用Western blot检测外泌体表面特征性蛋白,结果显示所提取的外泌体颗粒均表达CD63、TSG101标志性蛋白分子,而无外泌体的血清则不表达或低表达CD63和TSG101(图1B)。最后通过Nano Sight纳米颗粒跟踪分析技术来检测外泌体颗粒的粒径,结果显示样品中颗粒分散均一,直径呈单峰正态分布,主要分布在20~100 nm之间,峰值大约为66 nm(图1C)。
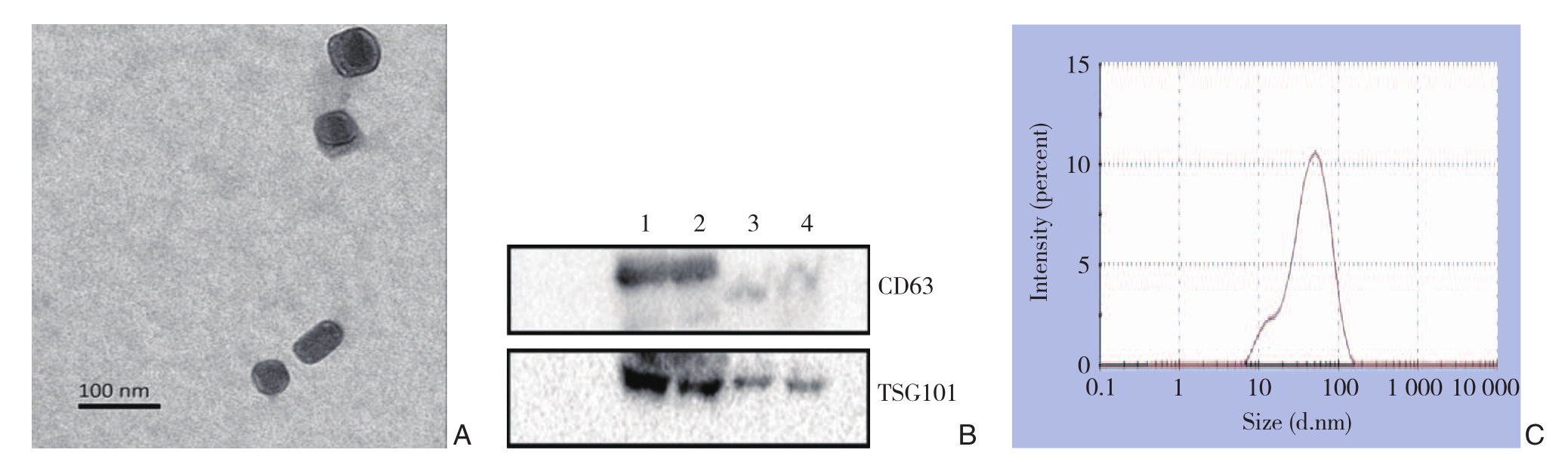
图1 血清外泌体鉴定 A:透射电镜下观察外泌体的形态;B:Western blot检测外泌体CD63、TSG101特征性蛋白分子的表达(1、2为外泌体颗粒,3、4为无外泌体颗粒的血清);C:Nanosight检测外泌体颗粒粒径
Figure1 Identification of serum exosomes A:Morphology of exosomes was observed at 100 nm under transmission electron microscopy;B:Determination of the expression of characteristic molecules of exosome CD63 and TSG101 by Western blot (1, 2 showing the exosomal particles, and 3, 4 showinbg serum without exosomal particles); C:Detecting exosome particle size by Nanosight
2.3 血清外泌体miR-1290的表达
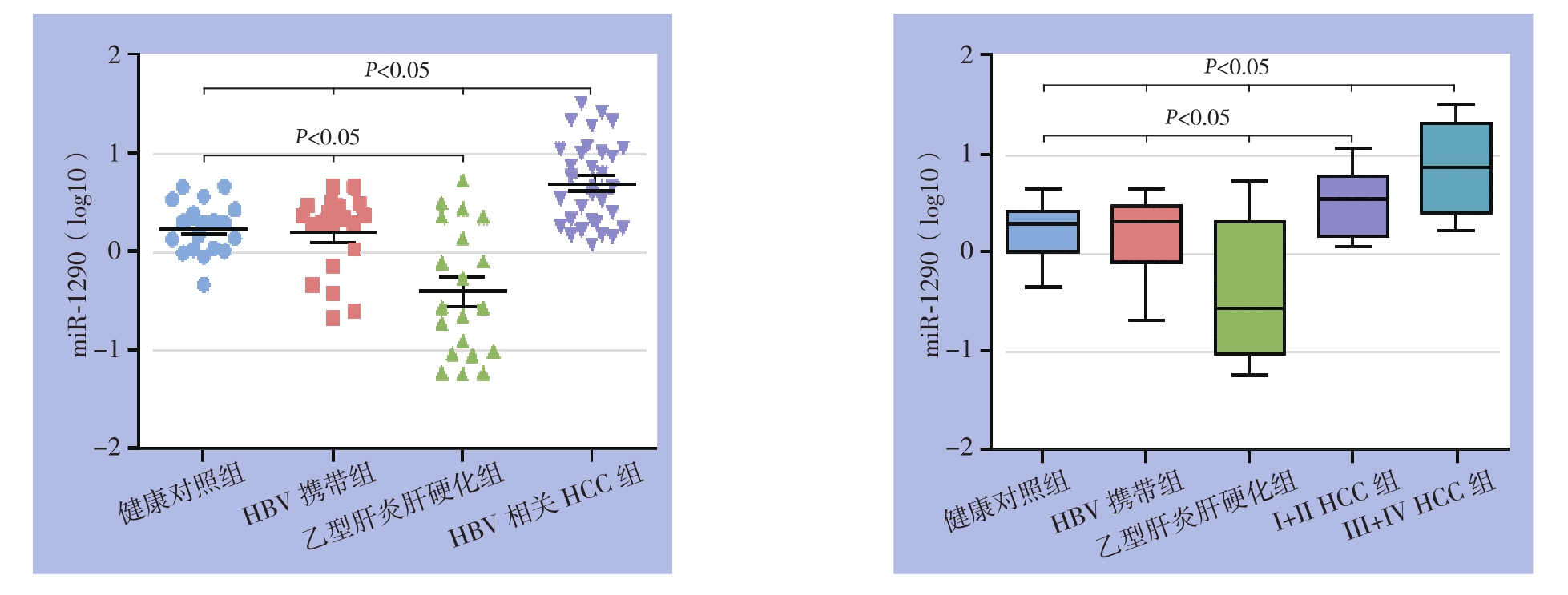
图2 血清外泌体miR-1290在不同组间的表达情况
Figure2 Expressions of serum exosomeal miR-1290 among different groups
各组之间两两比较血清外泌体miR-1290的表达水平,外泌体miR-1290在健康对照组与HBV携带组之间无统计学差异(P>0.05);相较于其他3组,外泌体miR-1290在HBV相关HCC组的水平明显升高(健康对照vs. HBV相关HCC,P<0.001;乙型肝炎肝硬化vs. HBV相关HCC,P<0.001;HBV携带vs. HBV相关HCC,P=0.002),但在乙型肝炎肝硬化组表达却明显下调(健康对照vs.乙型肝炎肝硬化:P=0.0036;HBV携带vs.乙型肝炎肝硬化:P=0.006)。此外,早、晚期HCC患者血清外泌体miR-1290相较于健康对照组表达均存在统计学差异(健康对照vs. I+II HCC:P=0.0264;健康对照vs. III+IV HCC:P<0.001),并且外泌体miR-1290在晚期HCC患者中的水平较早期HCC患者明显升高(P=0.036)(图2)。
2.4 血清外泌体miR-1290诊断效能的评估
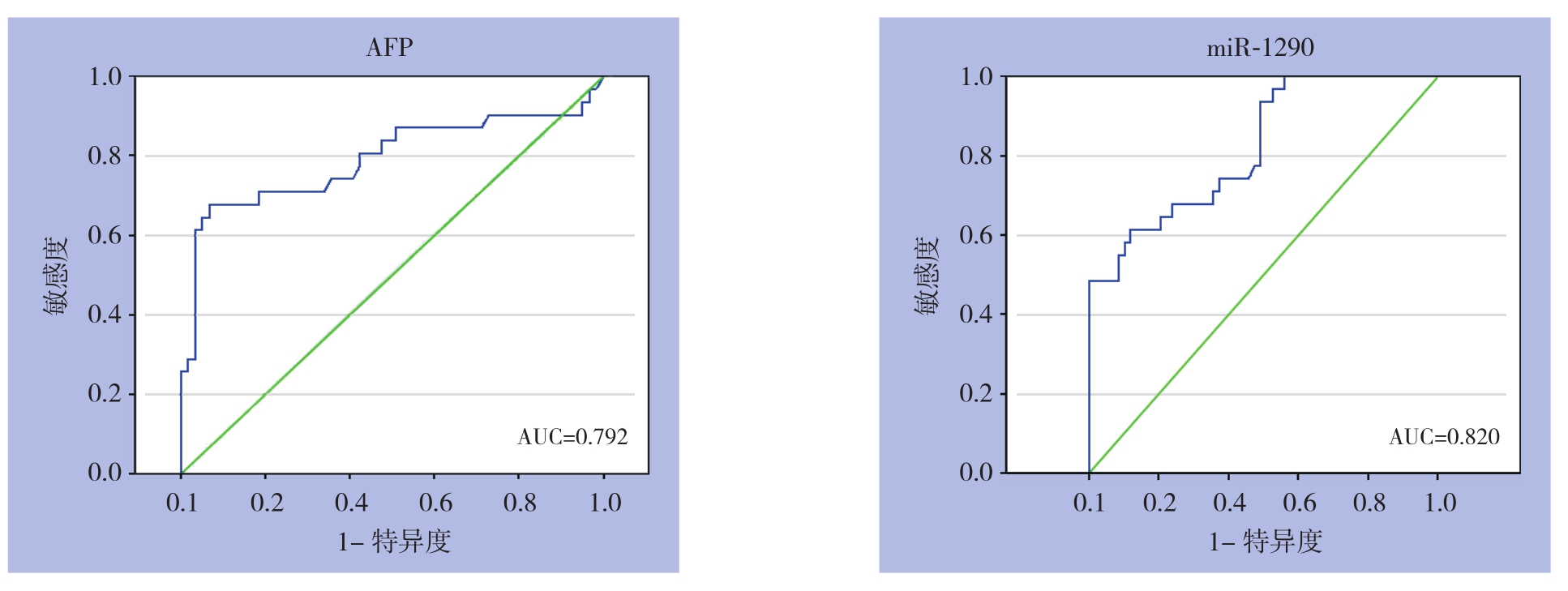
图3 外泌体miR-1290和AFP对HBV相关HCC的诊断效能
Figure3 Diagnostic efficiencies of exosomeal miR-1290 and AFP for HBV-related HCC
采用ROC曲线评估外泌体miR-1290及AFP在HBV相关HCC中的诊断效能,结果显示AFP的曲线下面积AUC值为0.792(95% CI=0.676~0.907,P<0.001)(图3)。外泌体miR-1290的曲线下面积AUC值为0.820(95% CI=0.730~0.910,P<0.001)(图3),灵敏度为61.3%,特异度为88.1%,截断值为0.511,具有良好的诊断效能。
3 讨 论
HCC是世界范围内发病率及病死率最高的恶性肿瘤之一,其病情进展迅速,治疗困难,预后差,成为了全世界公认的难题[21]。HBV感染是导致其发生发展的最主要因素,高达50%的新诊断的HCC归因于HBV的慢性感染,其中HBx可以干扰参与细胞增殖和凋亡相关的几种信号通路从而促进HCC的发生[22]。而且由于我国是乙肝大国,是世界上乙肝疾病负担最重的国家[23],因此针对乙肝人群的癌症筛查诊断十分重要,就目前来说,发现更为准确和非侵入性的生物标志物去筛查及诊断肝癌仍然是具有紧迫性及挑战性。
相较于血清而言,外泌体的应用对于发现诊断生物标志物具有一定的优势。事实上,外泌体可以选择性地包装和携带miRNA来代表其原始细胞或特定疾病,与健康个体相比,其在癌症患者中的产量增加[24]。而且,研究[25]已经证明外泌体可以保护其含有的miRNA免受富含循环的RNase的影响,这意味着外泌体miRNA更稳定。最近的研究[26-30]就证明了循环外泌体miRNA可以作为各种疾病包括癌症生物标志物的潜能。本研究发现HBV相关HCC患者血清外泌体miR-1290表达显著高于健康体检者、HBV携带者及乙肝肝硬化患者,在HCC的不同阶段表达也有所不同,HCC晚期较HCC早期表达明显增高,并且经分析发现血清外泌体miR-1290有比AFP更好的检测效能,这一发现提示外泌体miR-1290水平可能具有衡量疾病发生发展的潜力,并提示HCC疾病的预后情况。miR-1290是一个新近发现的小分子RNA,尽管已经有很多研究先后发现miR-1290在各种癌症中作用及影响,例如,Kobayashi等[31]发现外泌体miR-1290在高级别浆液性卵巢癌患者血清中的水平显著升高,可以作为高级别浆液性卵巢癌的一种新的潜在诊断生物标志物;Mo等[32]发现miR-1290在非小细胞性肺癌中高表达,可用作非小细胞性肺癌的潜在预后生物标志物;Huang等[33]发现外泌体miR-1290可以作为前列腺癌的预后标志物;同时还有大量的研究[34-35]证明miR-1290在胰腺癌、结直肠癌中发生发展的作用,但是miR-1290在HCC中却甚少有研究,这也是本研究的创新点。
虽然外泌体miR-1290水平在HBV相关HCC中明显增高,然而在肝硬化组表达降低,其具体原因不明确,笔者推测这一趋势与肝硬化患者生理基础和代谢循环改变有关。肝硬化患者肝非实质细胞活化以及血管床的紊乱增生,其中肝星状细胞(HSC)活化是肝纤维化起始及进展中的关键因素,然而肝硬化阶段肝实质细胞的生物活性是受到抑制的[36-38],从而导致外泌体分泌量的降低和miR-1290水平的变化。而当肝硬化进展到肝癌阶段,出现了克隆增生活跃的肝癌细胞,相应的病理生理发生改变,在HBx的作用下细胞的外泌体分泌量和外泌体miR-1290含量均呈显著增高趋势,从而决定其对HCC发生发展的敏感性,然而具体原因及其作用机制仍有待进一步研究。
另一方面,本研究也存在一定的局限性。首先是每组所收集的标本量有限,这可能在一定程度上对实验研究产生一定影响;其次,研究对象并没有拓展到对非HBV相关的HCC,外泌体miR-1290在这类HCC患者中表达情况是否也是上调仍然不得而知,同时也是将来进一步探讨研究的方向。
总之,血清外泌体miR-1290水平在HBV相关HCC患者中升高,且在晚期HCC高于早期HCC,因此,血清外泌体miR-1290在未来可能能成为诊断HBV相关HCC潜在的血清学标志物。
[1] Chen L, Guo P, He Y, et al. HCC-derived exosomes elicit HCC progression and recurrence by epithelial-mesenchymal transition through MAPK/ERK signaling pathway[J]. Cell Death Dis, 2018,9(5):513. doi:10.1038/s41419-018-0534-9.
[2] 中国抗癌协会肝癌专业委员会, 中国抗癌协会临床肿瘤学协作专业委员会, 中华医学会肝病学分会肝癌学组. 原发性肝癌规范化诊治的专家共识[J]. 中华肝脏病杂志, 2009, 17(6):403-410.doi:10.3760/cma.j.issn.1007-3418.2009.06.002.Chinese Societies of Liver Cancer, Clinical Oncology, Chinese Anti-Cancer Association, Liver Cancer Study Group, Chinese Society of Hepatology. Expert consensus on standardization of the management of primary liver cancer[J]. Chinese Journal of Hepatology, 2009, 17(6):403-410. doi:10.3760/cma.j.issn.1007-3418.2009.06.002.
[3] 肖亮, 王志明. microRNA在肝细胞癌发生发展和诊治中的作用[J]. 中国普通外科杂志, 2014, 23(1):106-110. doi:10.7659/j.issn.1005-6947.2014.01.021.Xiao L, Wang ZM. Oncogenic role and both diagnostic and therapeutic potential of microRNA in liver cancer [J]. Chinese Journal of General Surgery, 2014, 23(1):106-110. doi:10.7659/j.issn.1005-6947.2014.01.021.
[4] 陈世发, 赵礼金. 肝癌发生发展机制的研究进展及其治疗现状[J]. 中国普通外科杂志, 2018, 27(7):910-923. doi:10.3978/j.issn.1005-6947.2018.07.016.Chen SF, Zhao LJ. Research progress on mechanisms for occurrence of liver cancer and its treatment status[J]. Chinese Journal of General Surgery, 2018, 27(7):910-923. doi:10.3978/j.issn.1005-6947.2018.07.016.
[5] El-Serag HB. Epidemiology of viral hepatitis and hepatocellular carcinoma[J]. Gastroenterology, 2012, 142(6):1264-1273.doi:10.1053/j.gastro.2011.12.061.
[6] 冯思嘉, 殷莲华. 外泌体在肝癌中作用的研究进展[J]. 复旦学报:医学版, 2018, 45(2):262-265. doi:10.3969/j.issn.1672-8467.2018.02.019.Feng SJ, Yin LH. Research progress in the role of exosomes in hepatocellular carcinoma[J]. Fudan University Journal of Medical Sciences, 2018, 45(2):262-265. doi:10.3969/j.issn.1672-8467.2018.02.019.
[7] 王静, 石明伟, 张侠. 甲胎蛋白阴性原发性肝癌诊断进展[J]. 医学综述, 2016, 22(2):269-273. doi:10.3969/j.issn.1006-2084.2016.02.018.Wang J, Shi MW, Zhang X. The Progress in Diagnosis of AFP Negative Primary Liver Cancer[J]. Medical Recapitulate, 2016,22(2):269-273. doi:10.3969/j.issn.1006-2084.2016.02.018.
[8] Liao W, Du Y, Zhang C, et al. Exosomes:The next generation of endogenous nanomaterials for advanced drug delivery and therapy[J]. Acta Biomater, 2018, pii:S1742-7061(18)30770-0. doi:10.1016/j.actbio.2018.12.045. [Epub ahead of print]
[9] Li K, Chen Y, Li A, et al. Exosomes play roles in sequential processes of tumor metastasis[J]. Int J Cancer, 2018, doi:10.1002/ijc.31774. [Epub ahead of print]
[10] Yang TT, Liu CG, Gao SC, et al. The Serum Exosome Derived MicroRNA-135a, -193b, and -384 Were Potential Alzheimer's Disease Biomarkers[J]. Biomed Environ Sci, 2018, 31(2):87-96.doi:10.3967/bes2018.011.
[11] Hu C, Chen M, Jiang R, et al. Exosome-related tumor microenvironment [J]. J Cancer, 2018, 9(17):3084-3092. doi:10.7150/jca.26422.
[12] Li D, Liu X, Lin L, et al. MicroRNA-99a inhibits hepatocellular carcinoma growth and correlates with prognosis of patients with hepatocellular carcinoma[J]. J Biol Chem, 2011, 286(42):36677-36685. doi:10.1074/jbc.M111.270561.
[13] Zhang J, Li S, Li L, et al. Exosome and exosomal microRNA:trafficking, sorting, and function[J]. Genomics Proteomics Bioinformatics, 2015, 13(1):17-24. doi:10.1016/j.gpb.2015.02.001.
[14] Melo SA, Sugimoto H, O'Connell JT, et al. Cancer exosomes perform cell-independent microRNA biogenesis and promote tumorigenesis[J]. Cancer Cell, 2014, 26(5):707-721. doi:10.1016/j.ccell.2014.09.005.
[15] 邓小红, 黄俊琪. 外泌体内mircoRNAs在肝癌中的作用[J].中国生物化学与分子生物学报, 2017, 33(11):1105-1109.doi:10.13865/j.cnki.cjbmb.2017.11.04.Deng XH, Huang JQ. Role of Exosome-derived MircoRNAs in Liver Cancer[J]. Chinese Journal of Biochemistry and Molecular Biology, 2017, 33(11):1105-1109. doi:10.13865/j.cnki.cjbmb.2017.11.04.
[16] Lamontagne J, Steel LF, Bouchard MJ. Hepatitis B virus and microRNAs:Complex interactions affecting hepatitis B virus replication and hepatitis B virus-associated diseases[J]. World J Gastroenterol, 2015, 21(24):7375-7399. doi:10.3748/wjg.v21.i24.7375.
[17] 付沙, 范学工. HBx在肿瘤微环境中的作用及其对肝癌发生发展的影响[J]. 世界华人消化杂志, 2016, 24(10):1477-1484. doi:10.11569/wcjd.v24.i10.1477.Fu S, Fan XG. Pathophysiological implications of hepatitis B X protein in tumor microenvironment of hepatocellular carcinoma[J].World Chinese Journal of Digestology, 2016, 24(10):1477-1484.doi:10.11569/wcjd.v24.i10.1477.
[18] Xiang M, Zeng Y, Yang R, et al. U6 is not a suitable endogenous control for the quantification of circulating microRNAs[J]. Biochem Biophys Res Commun, 2014, 454(1):210-214. doi:10.1016/j.bbrc.2014.10.064.
[19] Yan S, Jiang Y, Liang C, et al. Exosomal miR-6803-5p as potential diagnostic and prognostic marker in colorectal cancer[J]. J Cell Biochem, 2018, 119(5):4113-4119. doi:10.1002/jcb.26609.
[20] 中华人民共和国卫生和计划生育委员会医政医管局. 原发性肝癌诊疗规范(2017年版)[J]. 中华肝脏病杂志, 2017, 25(12):886-895. doi:10.3760/cma.j.issn.1007-3418.2017.12.002.Medical and Health Care Bureau of the Health and Family Planning Commission of the People's Republic of China. Diagnosis,management, and treatment of hepatocellular carcinoma (V2017)[J].Chinese Journal of Hepatology, 2017, 25(12):886-895. doi:10.3760/cma.j.issn.1007-3418.2017.12.002.
[21] 秦麒麟, 李清龙. miRNA-122与肝细胞癌的研究进展[J]. 中国普通外科杂志, 2015, 24(1):105-109. doi:10.3978/j.issn.1005-6947.2015.01.020.Qin QL, Li QL. Research progress of miRNA-122 and hepatocellular carcinoma[J]. Chinese Journal of General Surgery,2015, 24(1):105-109. doi:10.3978/j.issn.1005-6947.2015.01.020.
[22] Xu C, Zhou W, Wang Y, et al. Hepatitis B virus-induced hepatocellular carcinoma[J]. Cancer Lett, 2014 , 345(2):216-222.doi:10.1016/j.canlet.2013.08.035.
[23] 崔富强, 庄辉. 中国乙型肝炎的流行及控制进展[J]. 中国病毒病杂志, 2018, 8(4):257-264. doi:10.16505/j.2095-0136.2018.0073.Cui FQ, Zhuang H. Epidemics and control of hepatitis B in China[J]. Chinese Journal of Viral Diseases, 2018, 8(4):257-264.doi:10.16505/j.2095-0136.2018.0073.
[24] Wei JX, Lv LH, Wan YL, et al. Vps4A functions as a tumor suppressor by regulating the secretion and uptake of exosomal microRNAs in human hepatoma cells[J]. Hepatology, 2015,61(4):1284-1294. doi:10.1002/hep.27660.
[25] Endzeliņš E, Berger A, Melne V, et al. Detection of circulating miRNAs:comparative analysis of extracellular vesicle-incorporated miRNAs and cell-free miRNAs in whole plasma of prostate cancer patients[J]. BMC Cancer, 2017, 17(1):730. doi:10.1186/s12885-017-3737-z.
[26] Feng Y, Zhong M, Zeng S, et al. Exosome-derived miRNAs as predictive biomarkers for diffuse large B-cell lymphoma chemotherapy resistance[J]. Epigenomics, 2018, doi:10.2217/epi-2018-0123. [Epub ahead of print]
[27] Eichelser C, Stückrath I, Müller V, et al. Increased serum levels of circulating exosomal microRNA-373 in receptor-negative breast cancer patients[J]. Oncotarget, 2014, 5(20):9650-9663.doi:10.18632/oncotarget.2520.
[28] Ma M, Chen S, Liu Z, et al. miRNA-221 of exosomes originating from bone marrow mesenchymal stem cells promotes oncogenic activity in gastric cancer[J]. Onco Targets Ther, 2017, 10:4161-4171. doi:10.2147/OTT.S143315.
[29] Fang JH, Zhang ZJ, Shang LR, et al. Hepatoma cell-secreted exosomal microRNA-103 increases vascular permeability and promotes metastasis by targeting junction proteins[J]. Hepatology,2018, 68(4):1459-1475. doi:10.1002/hep.29920.
[30] Wang F, Li L, Piontek K, et al. Exosome miR-335 as a novel therapeutic strategy in hepatocellular carcinoma[J]. Hepatology,2018, 67(3):940-954. doi:10.1002/hep.29586.
[31] Kobayashi M, Sawada K, Nakamura K, et al. Exosomal miR-1290 is a potential biomarker of high-grade serous ovarian carcinoma and can discriminate patients from those with malignancies of other histological types[J]. J Ovarian Res, 2018, 11(1):81. doi:10.1186/s13048-018-0458-0.
[32] Mo D, Gu B, Gong X, et al. miR-1290 is a potential prognostic biomarker in non-small cell lung cancer[J]. J Thorac Dis, 2015,7(9):1570-1579. doi:10.3978/j.issn.2072-1439.2015.09.38.
[33] Huang X, Yuan T, Liang M, et al. Exosomal miR-1290 and miR-375 as prognostic markers in castration-resistant prostate cancer[J].Eur Urol, 2015, 67(1):33-41. doi:10.1016/j.eururo.2014.07.035.
[34] Imaoka H, Toiyama Y, Fujikawa H, et al. Circulating microRNA-1290 as a novel diagnostic and prognostic biomarker in human colorectal cancer[J]. Ann Oncol, 2016, 27(10):1879-1886.doi:10.1093/annonc/mdw279.
[35] Wang N, Wang L, Yang Y, et al. A serum exosomal microRNA panel as a potential biomarker test for gastric cancer[J]. Biochem Biophys Res Commun, 2017, 493(3):1322-1328. doi:10.1016/j.bbrc.2017.10.003.
[36] Zhou W C, Zhang QB, Qiao L. Pathogenesis of liver cirrhosis[J].World J Gastroenterol, 2014, 20(23):7312-7324. doi:10.3748/wjg.v20.i23.7312.
[37] Böttcher K, Pinzani M. Pathophysiology of liver fibrosis and the methodological barriers to the development of anti-fibrogenic agents[J]. Adv Drug Deliv Rev, 2017, 121:3-8. doi:10.1016/j.addr.2017.05.016.
[38] Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma[J]. Lancet,2012, 379(9822):1245-1255. doi:10.1016/S0140-6736(11)61347-0.
