胃癌是全球常见的消化道恶性肿瘤,其发病率及病死率均位居前列,根据最新的发表在CA-A Cancer Journal for Clinicians杂志上的全球癌症数据统计,2012年全球范围内胃癌新发病例近100万例,死亡病例超过70万例[1]。在我国,由于胃镜普查率低等原因致早期胃癌发现率低,确诊病例中有80%~90%为进展期胃癌,因此预后较差。进展期胃上部癌易发生No.10淋巴结转移,文献[2-4]报道其淋巴结转移率为9.8%~27.9%,第14版日本胃癌治疗指南[5]也明确规定进展期胃上部癌需要行脾门淋巴结清扫。然而,目前国内仅有少数几个中心能够常规开展腹腔镜保脾No.10淋巴结清扫术,且这几个中心均仅行脾门前方淋巴结的清扫,常常无法完整清扫所有的脾门淋巴结,导致阳性淋巴结的遗漏。为保证脾门淋巴结清扫的彻底性,本中心近年首创提出膜解剖指导的腹腔镜下保脾脾门淋巴结环周清扫的手术理念并应用于临床,现总结近年行该术式手术患者的近期疗效,以评估该术式的安全性及可行性。
1 资料与方法
1.1 一般资料
本研究回顾性分析2014年1月—2018年1月期间福建省莆田市第一医院胃肠外科一区的169例进展期胃上部癌患者施行腹腔镜保脾脾门淋巴结清扫术,其中92例仅清扫脾门前方淋巴结(对照组),77例行脾门环周清扫,即在常规清扫脾门前方淋巴结情况下加做脾门后方的淋巴结清扫(观察组)。所有患者的手术均由同一位有主刀500台以上腹腔镜胃癌根治术的经验丰富的外科医生完成。手术及清扫标准:依据《日本胃癌治疗指南》第3版,实施全胃切除、D2(包括保脾的No.10淋巴结)淋巴结清扫术,TNM分期遵循AJCC第7版分期标准。
1.2 病例选择标准
纳入标准:⑴ 年龄18~78岁;⑵ 胃原发病灶经内镜活检组织病理学诊断为胃腺癌(乳头状腺癌、管状腺癌、黏液腺癌、印戒细胞癌、低分化腺癌);⑶ 术前临床分期为局部进展期胃上部癌(cT2~4a,N-/+,M0);⑷ 术前检查未见远处转移,肿瘤无直接侵犯胰腺、脾脏及其他临近器官;⑸ 术前ECOG体力状态评分0/1;⑹ 术前ASA评分I~III。排除标准:⑴ 妊娠或哺乳期妇女;⑵ 患有严重精神疾病;⑶ 上腹部手术史(腹腔镜胆囊切除史除外);⑷ 术前影像学检查提示区域融合肿大淋巴结(最大径≥3 cm)包括No.10淋巴结明显肿大或者融合成团者;⑸ 已实施新辅助治疗;⑹ 1个月内有持续全身皮质激素治疗史;⑺ 胃癌合并症(出血、穿孔、梗阻)而需要急诊手术;⑻ 因脾脏及脾血管存在明显的肿瘤浸润需行联合脾切除的患者。剔除标准:⑴ 术中/术后证实为M1者:术前检查未发现远处转移证据,而术中探查/术后病理证实远处转移;术后证实腹腔灌洗细胞学检查阳性。⑵ 术中/术后证实为T4b期,或侵犯十二指肠的肿瘤。⑶ 术中证实区域淋巴结融合成团无法确保R0切除或包绕重要血管不具备可切除性。⑷ 术中因脾脏及脾血管存在明显的肿瘤浸润需行联合脾切除的患者
1.3 手术步骤
腹腔镜胃癌原位保脾脾门环周淋巴结清扫术四步法:⑴ 显露胰腺后上间隙。切开胰前筋膜,顺胰腺实质上极达脾动脉起始部,沿脾动脉表面向后方游离达脾静脉上极或后方胰腺,进入胰腺后上间隙,继续沿此间隙全程显露胰腺段脾动脉干即胰腺后筋膜与后腹膜形成的胰后Tolt筋膜的前间隙(图1A)。此间隙为疏松的无血管层面,沿此间隙向左侧游离至胰体、尾后方达脾上极,向上游离至左侧膈肌前筋膜,完整清扫No.11p、No.11d组淋巴结。⑵ 显露胰腺后下间隙。切开胃系膜与横结肠系膜左侧的附着缘,进入两者之间的系膜间隙,向胰尾后下方向游离,在胰腺下缘延续为胰腺下后间隙,外达脾下级,内达胰体部,并继续向上游离与先前的胰腺后上间隙相会师(图1B)。⑶ 显露脾门后方。外侧:沿脾下级切开胃系膜附着缘,向内侧游离胃系膜。内侧:沿胰体尾部后方切开胃系膜在胰腺的附着缘,向外侧游离,完成内外会师,解剖分离胃系膜附着在胰尾及脾脏后方的脂肪结缔组织,完成脾门后方的淋巴结清扫(图1C)。⑷ 显露脾门前方。切开胰前筋膜,进入脾叶血管前间隙,近端向远端逐根裸化脾叶血管直至脾上极,完成脾门前方的淋巴结清扫(图1D-E)。
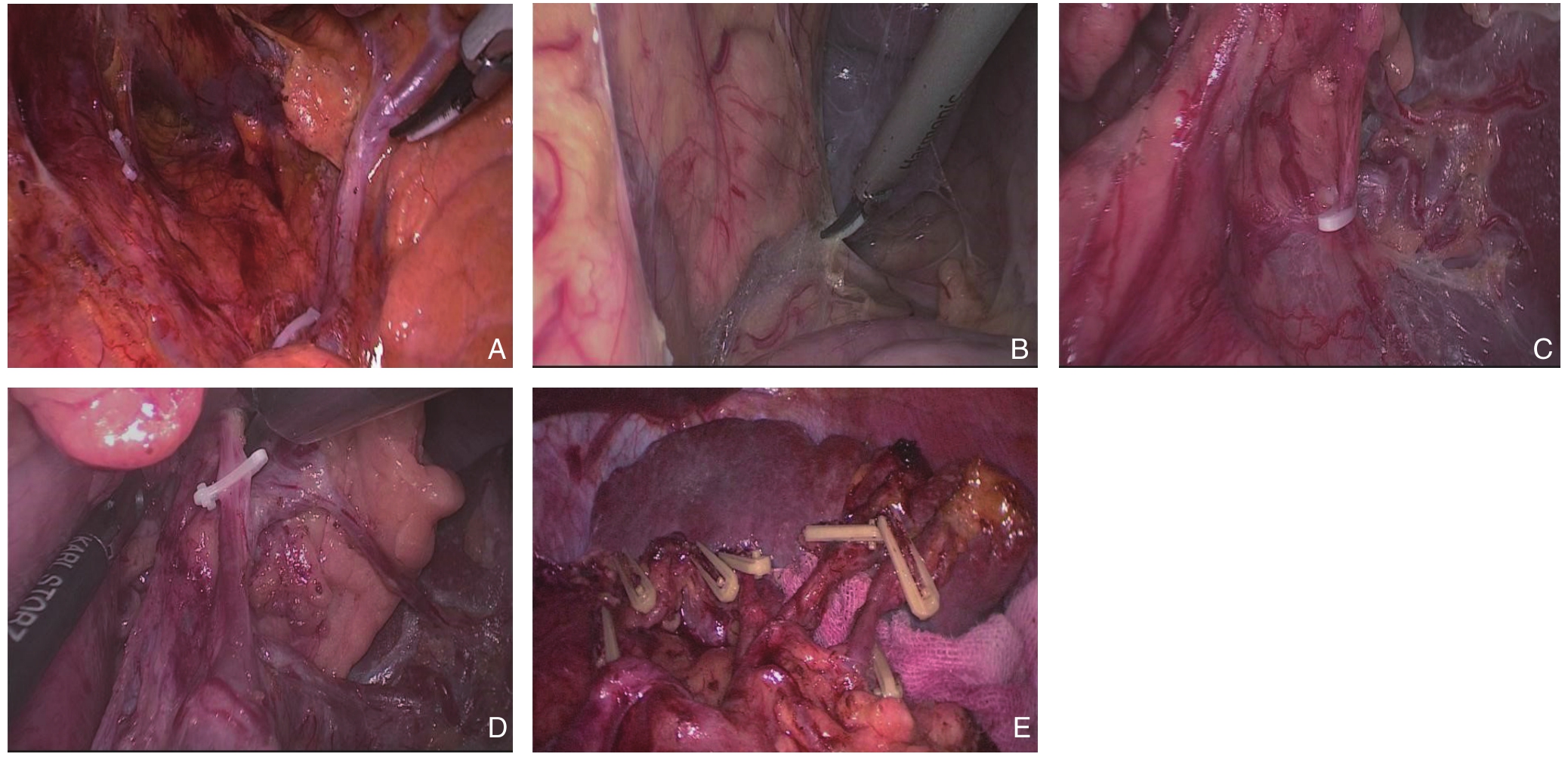
图1 腹腔镜保脾脾门环周淋巴结清扫术 A:显露胰腺后上间隙;B:显露胰腺后下间隙;C:显露脾门后方;D:显露脾门前方;E:脾门环周清扫后
Figure 1 Laparoscopic spleen-preserving circumferential splenichilar lymph node dissection A: Exposure of the upper posterior space of the pancreas; B: Exposure of the inferior posterior space of the pancreas; C: Exposure of the posterior side of the splenic hilar;D: Exposure of the anterior side of the splenichilar; E: View after circumferential splenichilar lymph node dissection
1.4 统计学处理
采用SPSS 19.0统计软件进行数据统计分析。计量资料采用t检验,均值以均数±标准差(x±s)表示,计数资料采用Pearson's χ2试验(n≥40和t≥5)、连续性校正χ2试验(n≥40和1≤t<5)或Fisher精确检验(n<40或<1),等级资料采用Wilcoxon秩和检验。以P<0.05为差异有统计学意义,所有检验均为双侧。
2 结 果
2.1 两组患者临床基线比较
两组患者在年龄、性别、肿瘤大小、分化程度、肿瘤分期等基线资料方面均无统计学差异(均P>0.05)(表1),具有可比性。
2.2 两组围手术期指标比较
两组在总手术时间、术中出血量、术后排气时间、术后进流质时间、术后住院时间、阳性淋巴结数方面均无统计学差异(均P>0.05);与对照组比较,观察组脾门淋巴结清扫时间显明显延长[(48.09±13.24)min vs.(40.23±9.51)min,P<0.001],但淋巴结清扫总数目明显增加[(47.74±17.15)枚 vs.(39.04±15.16)枚,P=0.001]、收获脾门淋巴结阳性患者例数增加(19例 vs.8例,P=0.005),脾门淋巴结清扫数目增加[(3.90±2.52)枚 vs.(3.02±3.07)枚,P=0.036](表2)。
2.3 两组术后并发症及围手术期死亡情况比较
观察组发生术后并发症1 7例,发生率为22.1%,对照组发生术后并发症20例,发生率为21.7%,两组术后总并发症发生率、并发症等级及各并发症发生率差异均无统计学意义(均P>0.05),术后并发症均主要集中在肺部感染、吻合口出血、腹腔出血、切口感染、肠梗阻等。两组均无围手术期死亡病例(表3)。
表1 两组患者临床基线资料比较
Table 1 Comparison of the baseline data between the two groups of patients
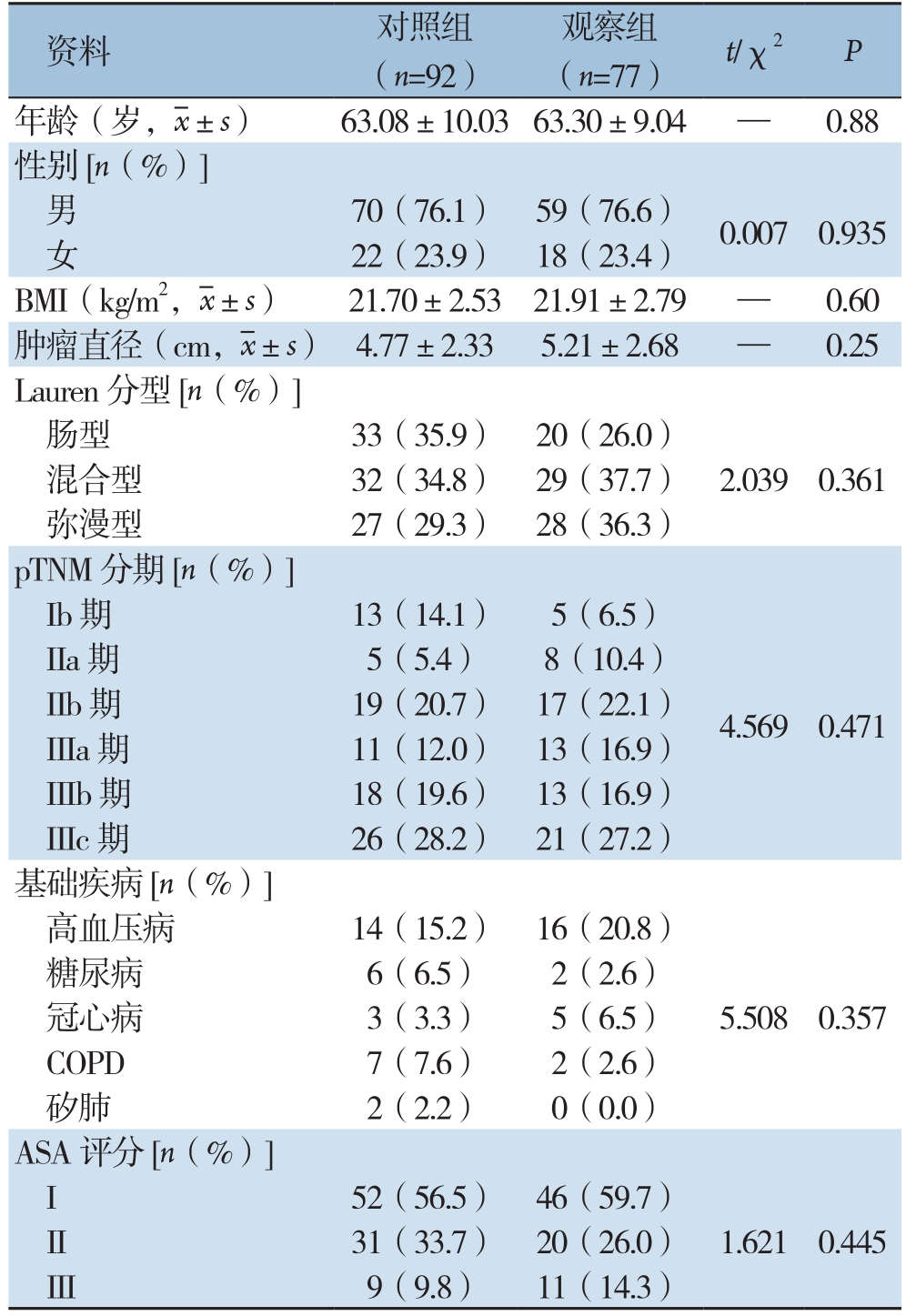
资料 对照组(n=92)观察组(n=77) t/χ2 P年龄(岁,x±s) 63.08±10.03 63.30±9.04 — 0.88性别[n(%)]男70(76.1) 59(76.6) 0.007 0.935女22(23.9) 18(23.4)BMI(kg/m2,x±s) 21.70±2.53 21.91±2.79 — 0.60肿瘤直径(cm,x±s) 4.77±2.33 5.21±2.68 — 0.25 Lauren分型[n(%)]肠型 33(35.9) 20(26.0)混合型 32(34.8) 29(37.7) 2.039 0.361弥漫型 27(29.3) 28(36.3)pTNM分期[n(%)]Ib期 13(14.1) 5(6.5)4.569 0.471 IIa期 5(5.4) 8(10.4)IIb期 19(20.7) 17(22.1)IIIa期 11(12.0) 13(16.9)IIIb期 18(19.6) 13(16.9)IIIc期 26(28.2) 21(27.2)基础疾病[n(%)]高血压病 14(15.2) 16(20.8)5.508 0.357糖尿病 6(6.5) 2(2.6)冠心病 3(3.3) 5(6.5)COPD 7(7.6) 2(2.6)矽肺 2(2.2) 0(0.0)ASA评分[n(%)]I 52(56.5) 46(59.7)1.621 0.445 II 31(33.7) 20(26.0)III 9(9.8) 11(14.3)
表2 两组患者围手术期指标比较
Table 2 Comparison of the perioperative variables between the two groups of patients
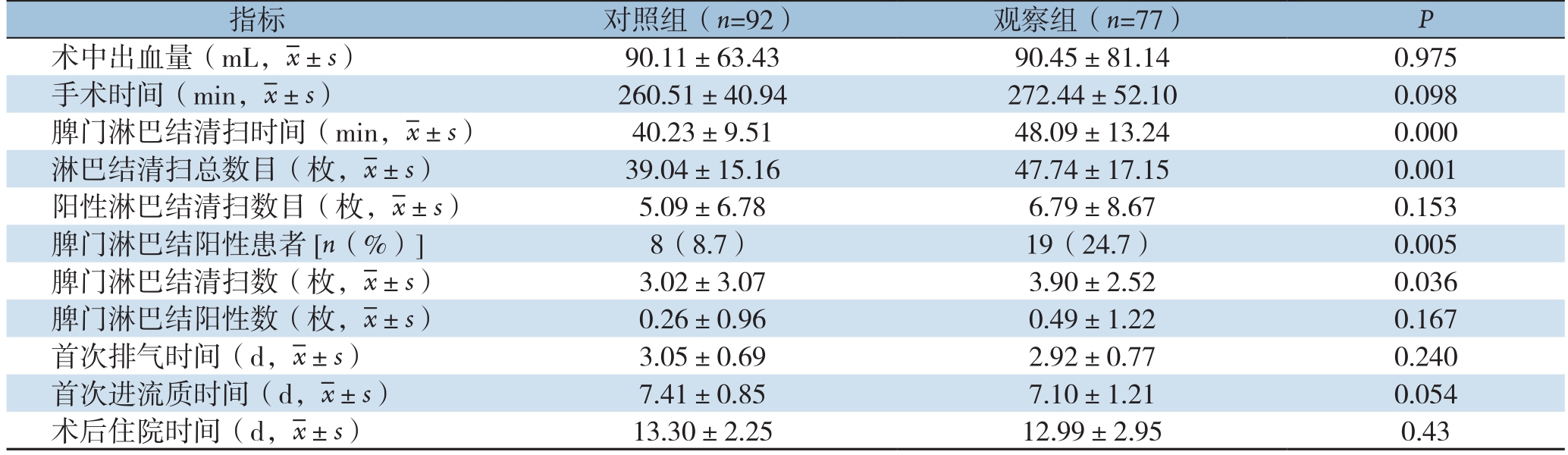
指标 对照组(n=92) 观察组(n=77) P术中出血量(mL,x±s) 90.11±63.43 90.45±81.14 0.975手术时间(min,x±s) 260.51±40.94 272.44±52.10 0.098脾门淋巴结清扫时间(min,x±s) 40.23±9.51 48.09±13.24 0.000淋巴结清扫总数目(枚,x±s) 39.04±15.16 47.74±17.15 0.001阳性淋巴结清扫数目(枚,x±s) 5.09±6.78 6.79±8.67 0.153脾门淋巴结阳性患者[n(%)] 8(8.7) 19(24.7) 0.005脾门淋巴结清扫数(枚,x±s) 3.02±3.07 3.90±2.52 0.036脾门淋巴结阳性数(枚,x±s) 0.26±0.96 0.49±1.22 0.167首次排气时间(d,x±s) 3.05±0.69 2.92±0.77 0.240首次进流质时间(d,x±s) 7.41±0.85 7.10±1.21 0.054术后住院时间(d,x±s) 13.30±2.25 12.99±2.95 0.43
表3 两组患者术后并发症及围手术期死亡情况比较[n(%)]
Table 3 Comparison of the rates of postoperative complications and perioperative death between the two groups of patients [n (%)]
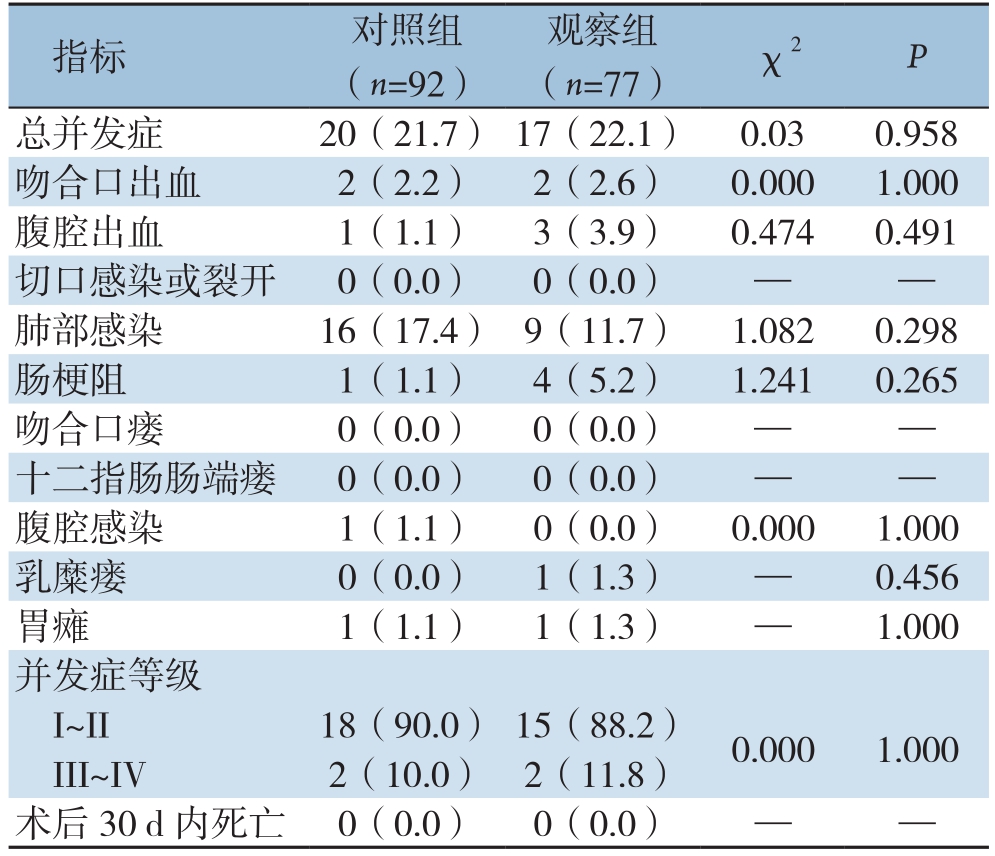
指标 对照组(n=92)观察组(n=77) χ2 P总并发症 20(21.7) 17(22.1) 0.03 0.958吻合口出血 2(2.2) 2(2.6) 0.000 1.000腹腔出血 1(1.1) 3(3.9) 0.474 0.491切口感染或裂开 0(0.0) 0(0.0) — —肺部感染 16(17.4) 9(11.7) 1.082 0.298肠梗阻 1(1.1) 4(5.2) 1.241 0.265吻合口瘘 0(0.0) 0(0.0) — —十二指肠肠端瘘 0(0.0) 0(0.0) — —腹腔感染 1(1.1) 0(0.0) 0.000 1.000乳糜瘘 0(0.0) 1(1.3) — 0.456胃瘫 1(1.1) 1(1.3) — 1.000并发症等级I~II 18(90.0) 15(88.2) 0.000 1.000 III~IV 2(10.0) 2(11.8)术后30 d内死亡 0(0.0) 0(0.0) — —
3 讨 论
进展期胃上部癌需要行脾门淋巴结清扫术,国内外学者对此已基本达成共识[3]。根据2010年第14版日本《胃癌处理规约》的定义,指胰尾末端以远的脾动脉周围、脾门部的淋巴结,胃短动脉根部和含至胃网膜左动脉的胃大弯第1支淋巴结[5]。由于脾门、脾叶血管、脾极血管等错综复杂,一不小心就会引起脾撕裂及大出血,脾门淋巴结清扫术难度大,风险高,因此国内外许多中心常常无法开展脾门淋巴结术,即便有开展,常常无法规范和完整的清扫,常常致阳性淋巴结的遗漏。而国内外的许多研究[6-8]已经证实,脾门淋巴结的完整清扫于患者的预后密切相关。因此,进展期胃上部癌行脾门淋巴结完整、彻底地清扫是有必要的。
目前国内外关于脾门淋巴结清扫的术式有保脾和非保脾两种术式。非保脾的脾门淋巴结清扫术由于手术创伤大,术后并发症、死亡发生率高,且不能提高术后5年生存率(35.6% vs.42.2%,P=0.622)[9-11],已逐渐被国内外多数中心所摈弃。而传统的开放脾门淋巴结清扫中,由于脾的位置深在,脾比较脆弱,稍有不慎即会导致脾撕裂,且脾门、脾叶及脾极血管等错综复杂,往往术者需将脾、胰体尾充分游离并托出体外,才可达到No.10淋巴结彻底的清扫,操作难度大,且术后容易出现脾扭转、脾游离等并发症。因此,开腹保脾的No.10淋巴结清扫术难以常规开展。腹腔镜由于视野的放大及超声刀的空泡效应,能够更清晰的循胃筋膜解剖间隙,通过正确的平面入路,达到全程显露脾动静脉及其各级分支来顺利、高效地完成脾门淋巴结清扫。韩国和日本的外科学者最先成功的开展了腹腔镜胃上部癌保脾的No.10淋巴结清扫手术[12-13]。国内黄昌明等[14-15]已陆续证实腹腔镜保脾No.10淋巴结清扫术的安全性、可行性。近年,Son等[16]研究认为针对于进展期胃上部癌腹腔镜保脾脾门淋巴结清扫能够得到于腹腔镜下非保脾脾门淋巴结清扫相类似的近远期疗效。然而,腹腔镜下保脾No.10淋巴结清扫术技术要求极高,难度大,国内仅几个中心能够常规开展,且大部分仅行脾门前方淋巴结的清扫,而导致脾门后方阳性淋巴结的遗漏[17]。仅有极少数的中心有报道腹腔镜下的脾门淋巴结的全方位清扫,但患者入组例数极少[18]。笔者认为腹腔镜下脾门后方淋巴结清扫没有常规开展究其原因主要由以下两个方面:⑴ 目前国内外关于腹腔镜下脾门血管后方淋巴结清扫尚无文献报道,脾门后方淋巴结清扫的必要性有待临床数据进一步证实。⑵ 因为脾门血管后方淋巴结毗邻重要组织和器官,前方紧贴脾血管及其分支,后方紧邻肾前筋膜,左右两侧分别为脾脏和胰尾,其解剖关系复杂,操作空间窄小,术中稍有不慎,即可能导致难以控制的大出血和增加切脾率。因此脾门血管后方淋巴结清扫被视为一项极其困难的手术。然而,笔者在术中也时常能够发现脾门后方有肿大的淋巴结,同时基于肿瘤根治术彻底清扫淋巴结的原则,进展期胃上部癌行脾门淋巴结环周完整、彻底地清扫至关重要。本中心的研究结果显示:169例患者中有27例患者脾门淋巴结阳性,阳性率15.38%,这与文献[2]报道其淋巴结转移率为9.8%~20.9%相一致。对照组:脾门淋巴结阳性者8例(阳性率8.7%)。观察组:脾门淋巴结阳性者19例(阳性率24.7%),19例脾门淋巴结阳性中有5例为脾门后方淋巴结阳性,脾门后方淋巴结阳性率为6.5%。充分说明脾门环周清扫组能够减少脾门阳性淋巴结的遗漏,使患者受益。同时本研究数据显示脾门环周清扫并不增加手术并发症的发生。因此,笔者认为针对进展期胃上部腺癌腹腔镜下保脾脾门淋巴结的环周清扫是安全且必要的。
如何把握腹腔镜保脾No.10淋巴结清扫的策略是顺利完成操作的关键。目前使用较多的手术入路包括左侧入路、胰后入路、右侧入路等[12,19-20],但大部分仅限于前方清扫。本中心总结一套完整的腹腔镜脾门环周清扫手术经验,提出“腹腔镜胃癌原位保脾脾门环周淋巴结清扫术四步法”,通过规范手术流程,循正确的膜解剖层面,使脾门后方淋巴结清扫成为可能,并大大降低了清扫的难度,具体操作的关键是我们遵循腹腔镜下胰后入路保留胰脾的原位脾门淋巴结清扫技术,脾脏质地脆弱易损伤,脾门血管细密且多变异,位置深在并有胰尾遮挡,腹腔镜下显露困难、难以形成有效牵张和出血不易控制是保留胰脾的脾门淋巴结清扫的主要障碍。胰腺位于横结肠系膜与胃、十二指肠系膜的愈着部。原肠系膜在发育过程中,与周围脏器形成了复杂的融合筋膜间隙,其中尾侧胰后间隙充满疏松结缔组织,后方以左侧肾脏上极、肾上腺前的肾前筋膜为界面,是极易进人并扩展的无血管的外科平面。胰后入路技术首先充分解剖游离胰尾及脾门后方的间隙,使得脾蒂悬空,易于牵拉形成张力,很好地解决了显露困难的问题,再由干到支解剖脾血管便可得心应手,这时即使损伤血管或脾脏,由于脾蒂已经完全游离,可以从容地控制脾蒂,避免大量失血。
关于腹腔镜脾门淋巴结清扫的远期疗效,国内外亦有少部分文献报道。研究[21]显示,胃上部癌T3、T4期的患者脾门淋巴结的阳性率高,脾门淋巴结阳性的患者预后不良。Chikara等[22]研究发现:No.10淋巴结转移阳性者的5年生存率明显低于阴性者(23.8% vs.4 1.4%,P<0.05)。然而Kosuga等[23]对280例胃癌患者行根治性全胃切除术并脾门淋巴结清扫,结果显示,有无脾门淋巴结清扫术后5年生存率差别无统计学意义(51.3% vs.42.1%)。Ikeguchi 等[24]报道亦显示,胃癌根治术合并脾门淋巴结清扫患者,脾门淋巴结有转移组与转移组术后5年生存无显著差异。国内黄昌明教授[25]研究显示:进展期胃上部癌行腹腔镜保脾脾门淋巴结清扫组与未清扫组相比,3年OS无统计学差异,3年DFS更优(61.6% vs.53.7%,P=0.034),进一步统计分析显示,在Ⅲ期患者中3年DFS获益更为明显(P=0.016)。然后上述研究均未行完整的脾门淋巴结的环周清扫,并不能完全反应腹腔镜下脾门淋巴结清扫与未清扫的确切疗效,理论上讲进展期胃上部癌行完整的脾门淋巴结环周清扫应该会取得更好的远期疗效。
综上,腹腔镜下保留胰脾的原位脾门淋巴结环周清扫术是安全可行,遵循正确膜解剖层面及适宜的手术流程能够大大降低腹腔镜保脾脾门淋巴结清扫的手术难度,该手术方法可能为腹腔镜治疗进展期胃上部癌提供新的技术选择。然而,本研究为单中心的回顾性分析,且例数不多,一定程度上影响了研究结果的说服力,因此,本中心下一阶段准备开展随访工作评估远期疗效,同时启动多中心前瞻性随机对照研究以提供更高级别的循证医学证据。
[1]Torre LA, Bray F, Siegel RL, et al.Global cancer statistics, 2012[J].CA Cancer J Clin, 2015, 65(2):87-108.doi: 10.3322/caac.21262.
[2]Mönig SP, Collet PH, Baldus SE, et al.Splenectomy in proximal gastric cancer: frequency of lymph node metastasis to the splenic hilus[J].J Surg Oncol, 2001, 76(2):89-92.
[3]Sasada S, Ninomiya M, Nishizaki M, et al.Frequency of lymph node metastasis to the splenic hilus and effect of splenectomy in proximal gastric cancer[J].Anticancer Res, 2009, 29(8):3347-3351.
[4]Lin M, Huang CM, Zheng CH, et al.Totally laparoscopic total gastrectomy for locally advanced middle-upper-third gastric cancer[J].J Vis Surg, 2017, 3:46.doi: 10.21037/jovs.2017.03.17.
[5]胡祥.第14版日本《胃癌处理规约》的重要变更[J].中国实用外科杂志, 2010, 30(4):241-246.
Hu X.Essential amendments of the 14th edition of Japans protocols of gastric cancer treatment[J].Chinese Journal of Practical Surgery,2010, 30(4):241-246.
[6]Chikara K, Hiroshi S, Masato N, et al.Association of the number of metastatic perigastric lymph nodes with long-term survival in gastric cancer[J].Hepatogastroenterology, 2005, 52(61):277-280.
[7]Zhu GL, Sun Z, Wang ZN, et al.Splenic hilar lymph node metastasis independently predicts poor survival for patients with gastric cancers in the upper and/or the middle third of the stomach[J].J Surg Oncol, 2012, 105(8):786-792.doi: 10.1002/jso.22149.
[8]Huang CM, Zhang JR, Zheng CH, et al.A 346 case analysis for laparoscopic spleen-preserving no.lumph node dissection for proximal gastric cancer: a single center study[J].PLos One,2014.9(9):e108480.doi: 10.1371/journal.pone.0108480.
[9]Yamamoto M, Baba H, Kakeji Y, et al.Postoperative morbidity/mortality and survival rates after total gastrectomy, with splenectomy/pancreaticosplenectomy for patients with advanced gastric cancer[J].Hepatogastroenterology, 2004, 51(55):298-302.
[10]Wang JY, Huang TJ, Chen FM, et al.A comparative study of pancreatectomy and pancreas-preserving gastrectomy in advanced gastric carcinomas[J].Hepatogastroenterology, 2004, 51(58):1229-1232.
[11]Nashimoto A, Yabusaki H, Matsuki A.The significance of splenectomy for advanced proximal gastric cancer[J].Int J Surg Oncol, 2012, 2012:301530.doi: 10.1155/2012/301530.
[12]Hyung WJ, Lim JS, Song J, et al.Laparoscopic spleen-preserving splenic hilar lymph node dissection during total gastrectomy for gastric cancer[J].J Am Coll Surg, 2008, 207(2):e6-11.doi: 10.1016/j.jamcollsurg.2008.04.027.
[13]Okabe H, Obama K, Kan T, et al.Medial approach for laparoscopic total gastrectomy with splenic lymph node dissection[J].J Am Coll Surg, 2010, 211(1):e1-6.doi: 10.1016/j.jamcollsurg.2010.04.006.
[14]李平, 黄昌明, 郑朝辉, 等.腹腔镜保脾的脾门淋巴结清扫在胃上部癌根治术中的应用[J].中华外科杂志, 2011, 49(9):795-798.doi:10.3760/cma.j.issn.0529-5815.2011.09.009.
Li P, Huang CM , Zheng CH, et al.Laparoscopic spleen-preserving splenic hilar lymph node dissection for proximal gastric cancer[J].Chinese Journal of Surgery, 2011, 49(9):795-798.doi:10.3760/cma.j.issn.0529-5815.2011.09.009.
[15]Huang CM, Chen QY, Lin JX, et al.Huang's three-step maneuver for laparoscopic spleen-preserving No.10 lymph node dissection for advanced proximal gastric cancer[J].Chin J Cancer Res, 2014,26(2):208-210.doi: 10.3978/j.issn.1000-9604.2014.04.05.
[16]Son SY, Shin DJ, Park YS, et al.Spleen-preserving lymphadenectomy versus splenectomy in laparoscopic total gastrectomy for advanced gastric cancer[J].Surg Oncol, 2017,26(2):207-211.doi: 10.1016/j.suronc.2017.04.002.
[17]Huang CM, Chen QY, Lin JX, et al.Laparoscopic spleen-preserving splenic hilar lymphadenectomy performed by following the perigastric fascias and the intrafascial space for advanced upperthird gastric cancer[J].PLoS One, 2014, 9(3):e90345.doi: 10.1371/journal.pone.0090345.
[18]王伟, 刘志伟, 熊文俊, 等.完全腹腔镜全方位脾门淋巴结清扫术治疗胃中上部癌11例[J].中华胃肠外科杂志, 2015, (5):505-507.doi:10.3760/cma.j.issn.1671-0274.2015.05.027.
Wang W, Liu ZW, Xiong WJ, et al.Total laparoscopic all-direction splenic hilar lymph node dissection in treatment of 11 patients with middle and proximal gastric cancer[J].Chinese Journal of Gastrointestinal Surgery, 2015, (5):505-507.doi:10.3760/cma.j.issn.1671-0274.2015.05.027.
[19]黄昌明, 陈起跃.“黄氏三步法”腹腔镜保脾脾门淋巴结清扫术要点及技巧[J].中国普通外科杂志, 2016, 25(10):1373-1376.doi:10.3978/j.issn.1005-6947.2016.10.001.
Huang CM, Chen QY.Technical essentials and tips of Huang's three-step maneuver for laparoscopic spleen-preserving splenic hilar lymphadenectomy[J].Chinese Journal of General Surgery, 2016,25(10):1373-1376.doi:10.3978/j.issn.1005-6947.2016.10.001.
[20]李国新, 牟廷裕, 余江, 等.胰后入路保留胰脾的原位脾门淋巴结清扫在腹腔镜胃癌根治术中的应用[J].中华消化外科杂志,2012, 11(1):58-60.doi:10.3760/cma.j.issn.1673-9752.2012.01.017.
Li GX, Mou TY, Yu J, et al.Laparoscopic pancreas- and spleenpreserving splenic hilar lymph nodes dissection through retropancreatic approach in radical gastrectomy for advanced gastric cancer[J].Chinese Journal of Digestive Surgery, 2012, 11(1):58-60.doi:10.3760/cma.j.issn.1673-9752.2012.01.017.
[21]Takayama T, Wakatsuki K, Matsumoto S, et al.Prognostic significance of splenic hilar nodal involvement in proximal third gastric carcinoma[J].Hepatogastroenterology, 2011, 58(106):647-651.
[22]Chikara K, Hiroshi S, Masato N, et al.Indicationgs for pancreaticosplenectomy in advanced gastric cancer[J].Hepatogastroenterology, 2001, 48(39):908-912.
[23]Kosuga T, Ichikawa D, Okamoto K, et al.Survival benefits from splenic hilar lymph node dissection by splenectomy in gastric cancer patients: relative comparison of the benefits in subgroups of patients[J].Gastric Cancer, 2011, 14(2):172-177.doi: 10.1007/s10120-011-0028-2.
[24]Ikeguchi M, Kaibara N.Lymph node metastasis at the splenic hilum in proximal gastric cancer[J].Am Surg, 2004, 70(7):645-648.
[25]Huang CM, Chen T, Lin JX, et al.The effects of laparoscopic spleen-preserving splenic hilar lymphadenectomy on the surgical outcome of proximal gastric cancer: a propensity score-matched,case-control study[J].Surg Endosc, 2017, 31(3):1383-1392.doi:10.1007/s00464-016-5126-0.
