由于老龄化以及社会人口学的变化,我国癌症发病率和病死率呈上升趋势,导致癌症已成为2010年以来的主要死亡原因,并成为我国主要的公共卫生问题[1-3]。胃癌是常见的恶性肿瘤之一,占消化道恶性肿瘤的首位。早期胃癌多无明显症状,易被忽略,大多数患者就诊时已为进展期。进展期胃癌是指癌组织已侵入胃壁肌层、浆膜层[4]。目前外科切除是胃癌的主要治疗方法,但患者术后生存率仍比较低,且较易出现转移和复发[5]。积极寻求其他可能根治肿瘤的手段并提高手术切除率(尤其是根治性切除率)成为改善胃癌患者预后的目标。
新辅助化疗是指对肿瘤进行手术切除或放疗前,应用全身化疗,缩小原发肿瘤,尽可能消灭微小转移病灶,可减少肿瘤复发和转移的机会,并利于之后的手术或放疗等。有研究[6-7]表明,术前行新辅助化疗可提高手术疗效并改善患者预后。随着现代外科诊疗水平的不断提高与改善,腹腔镜技术得到了全面发展,并逐渐应用于胃癌的治疗中。腹腔镜胃癌根治术创伤小、出血量少、疼痛轻,有利于患者术后的恢复,给胃癌患者带来了福音[8]。本研究旨在探讨新辅助化疗联合腹腔镜对进展期胃癌患者的治疗效果,现报道如下。
1 资料与方法
1.1 一般资料
选取2014年1月—2016年1月海口市第四人民医院普外科收治的96例进展期胃癌患者,所有患者均接受腹腔镜胃癌根治术。本研究获得医院伦理委员会批准。纳入标准:⑴ 均经术前病理、临床分期、术前胃镜、超声及CT均证实为进展期胃癌(以浸润深度、淋巴结转移和邻近器官侵犯情况为准)等确诊为进展期胃癌;⑵ 心肺功能良好,可耐受化疗及手术;⑶ 初治者;⑷ 患者及家属均知情同意并签署知情同意书。排除标准:⑴ 非初治者;⑵ 心、肝、肾等重要脏器功能障碍者;⑶ 肿瘤转移者;⑷ 严重精神类疾病患者。按照随机数字表法将所有患者分为联合治疗组(n=48)和对照组(n=48)。对照组患者接受腹腔镜胃癌根治术,联合治疗组患者先行新辅助化疗后接受腹腔镜胃癌根治术。两组患者一般资料无明显差异(P>0.05),具有可比性(表1)。
表1 两组患者一般资料比较
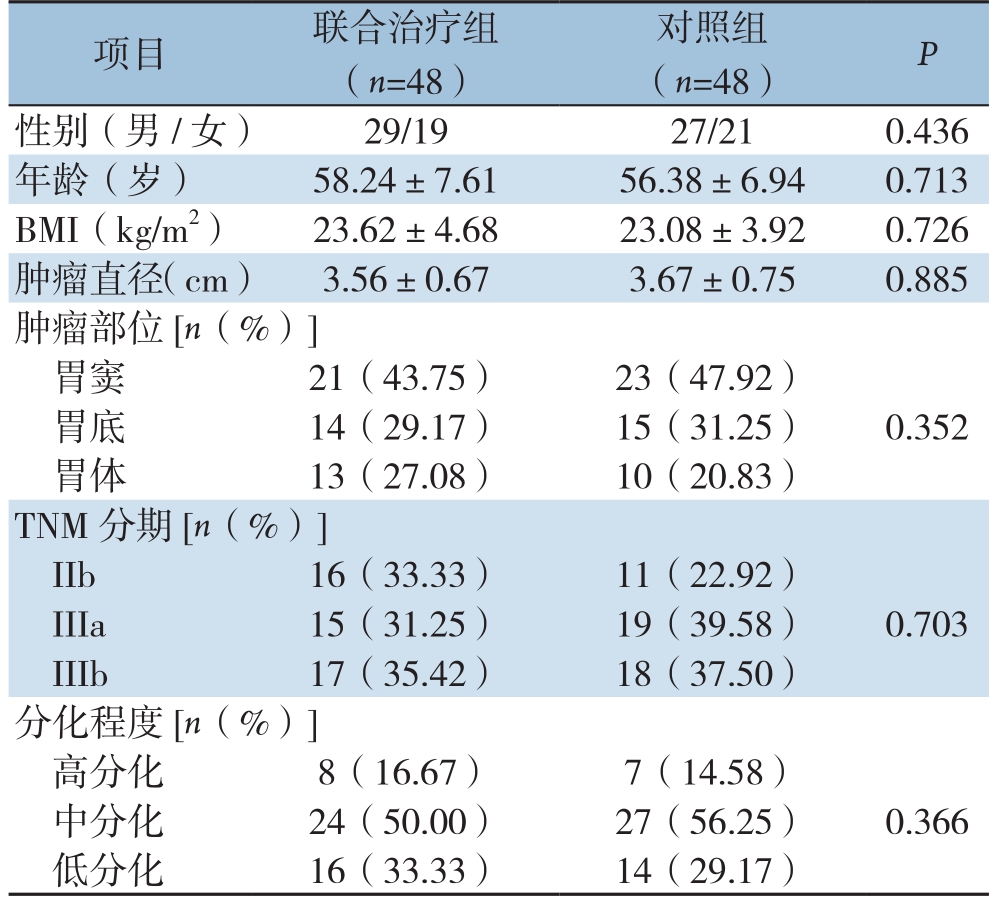
项目 联合治疗组(n=48)对照组(n=48) P性别(男/女) 29/19 27/21 0.436年龄(岁) 58.24±7.61 56.38±6.94 0.713 BMI(kg/m2) 23.62±4.68 23.08±3.92 0.726肿瘤直径(cm) 3.56±0.67 3.67±0.75 0.885肿瘤部位[n(%)]胃窦 21(43.75) 23(47.92)胃底 14(29.17) 15(31.25) 0.352胃体 13(27.08) 10(20.83)TNM分期[n(%)]IIb 16(33.33) 11(22.92)IIIa 15(31.25) 19(39.58) 0.703 IIIb 17(35.42) 18(37.50)分化程度[n(%)]高分化 8(16.67) 7(14.58)中分化 24(50.00) 27(56.25) 0.366低分化 16(33.33) 14(29.17)
1.2 治疗方法
对照组患者接受腹腔镜胃癌根治术。具体手术操作如下[8]:患者取截石位,气管插管,全麻,常规消毒,建立人工气腹,建立腹腔镜操作与观察通道。仔细观察肿瘤位置与大小,切除肿瘤并清扫相关淋巴结。
联合治疗组患者先行新辅助化疗后接受腹腔镜胃癌根治术。新辅助化疗方案为奥沙利铂联合卡培他滨,即XELOX方案:奥沙利铂(赛诺菲圣德拉堡民生制药,国药准字:J20100064)130 mg/m2静脉滴注,第1天;卡培他滨(上海罗氏制药有限公司,国药准字:H20073024)1 250 mg/m2,2次/天,第1~14天,停用7天,每3周为1个疗程,3个疗程后评估化疗效果。每周复查血常规及肝肾功能等指标,必要时给予患者重组人粒细胞集落刺激因子,以提高白细胞水平。化疗结束后,评估疗效并行腹腔镜胃癌根治术,手术方法同对照组。
两组患者术后均给予常规抗生素、胃肠减压等治疗。术后6周,两组患者均接受4个周期的XELOX化疗方案。
1.3 观察指标
1.3.1 围术期指标及术后并发症发生率 围术期指标主要包括手术时间、出血量、淋巴结清扫数目、下床活动时间、肛门排气时间、住院时间等。比较两组患者的术后并发症发生率,主要包括切口感染、肺部感染、腹腔感染、肠梗阻、吻合口瘘、下肢深静脉血栓、胃排空障碍等。
1.3.2 化疗近期疗效及不良反应 对联合治疗组患者新辅助化疗后近期疗效进行评价,疗效判断标准参照实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST),完全缓解(complete response,CR):病灶全部消失且维持4周。部分缓解(partial response,PR):病灶缩小30%~50%,维持4周。疾病稳定(stable disease,SD):病灶缩小<30%或不明显。疾病进展(progressive disease,PD):病灶增大20%或以上。以CR+PR计算客观有效率(objective response rate,ORR),以CR+PR+SD计算临床获益率(clinical benefit rate,CBR)[9]。根据美国国家癌症研究所通用毒性标准(National Cancer Institute Common Toxicity Criteria,NCI CTC)3.0版对联合治疗组出现的化疗毒性反应进行评价[10]。
1.3.3 R0切除率 手术方式分为R0、R1、R2切除术,R0为显微镜下达到完全切除,R1为显微镜下肿瘤残留,R2为肉眼肿瘤残留。比较两组患者的R0 切除率 [11]。
1.3.4 随访情况 采用电话和门诊就诊等方式进行随访,了解患者术后生存情况。随访截止时间为2018年12月。计算并比较两组患者的1、2、3年生存率。
1.4 统计学处理
采用SPSS 22.0对本研究所涉及的相关数据进行分析。围术期指标等计量资料表示为均数±标准差(x±s),检验方法为t检验。术后并发症发生率、根治性切除率及生存率等计数资料表示为率(%),检验方法为Fisher精确概率法。采用Kaplan-Meier绘制生存曲线。P<0.05表示数据间差异有统计学意义。
2 结 果
2.1 联合治疗组化疗近期疗效及不良反应情况
联合治疗组患者均完成2个或4个疗程的化疗,未出现治疗中断或停止现象。化疗结束后评估患者疗效,其中CR 2例,PR 20例,SD 23例,PD 3例;ORR为45.83%,CBR为93.75%。
联合治疗组化疗不良反应主要包括血液学毒性反应和非血液学毒性反应,绝大多数为I~II级,给予对症处理后症状缓解,患者均可耐受,无化疗相关死亡(表2)。
2.2 两组患者围术期指标比较
两组患者围术期指标手术时间、出血量、淋巴结清扫数目、下床活动时间、肛门排气时间、住院时间等比较,均无统计学差异(P>0.05)(表3)。
2.3 两组患者 术后并发症发生率比较
术后并发症主要包括切口感染、肺部感染、腹腔感染、肠梗阻、吻合口瘘、下肢深静脉血栓、胃排空障碍等。联合治疗组术后并发症发生率为20.83%,对照组为25.00%,组间差异无统计学意义(P>0.05)(表4)。
表2 联合治疗组化疗不良反应情况(n)
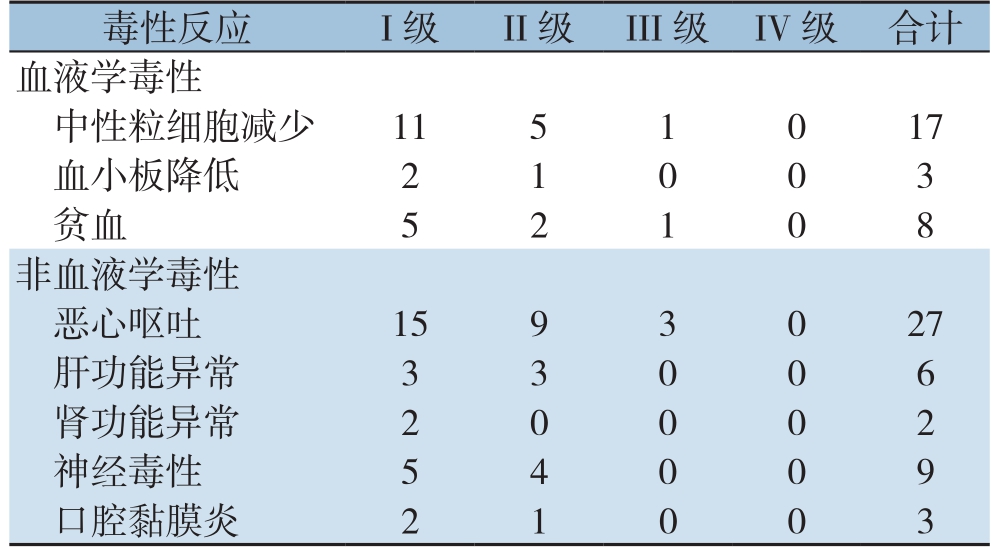
毒性反应 I级 II级 III级 IV级 合计血液学毒性中性粒细胞减少 11 5 1 0 17血小板降低 2 1 0 0 3贫血 5 2 1 0 8非血液学毒性恶心呕吐 15 9 3 0 27肝功能异常 3 3 0 0 6肾功能异常 2 0 0 0 2神经毒性 5 4 0 0 9口腔黏膜炎 2 1 0 0 3
表3 两组患者围术期指标比较(n=48, ±s)
±s)
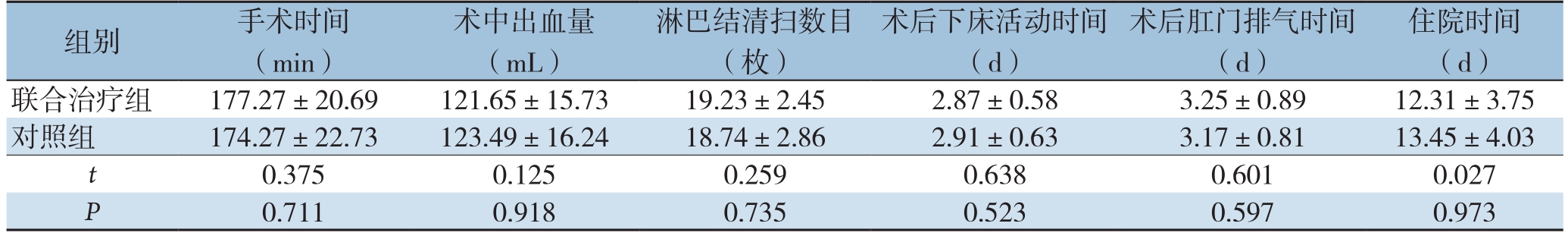
组别 手术时间(min)术中出血量(mL)淋巴结清扫数目(枚)术后下床活动时间(d)术后肛门排气时间(d)住院时间(d)联合治疗组 177.27±20.69 121.65±15.73 19.23±2.45 2.87±0.58 3.25±0.89 12.31±3.75对照组 174.27±22.73 123.49±16.24 18.74±2.86 2.91±0.63 3.17±0.81 13.45±4.03 t 0.375 0.125 0.259 0.638 0.601 0.027 P 0.711 0.918 0.735 0.523 0.597 0.973
表4 两组患者术后并发症发生率比较(n)
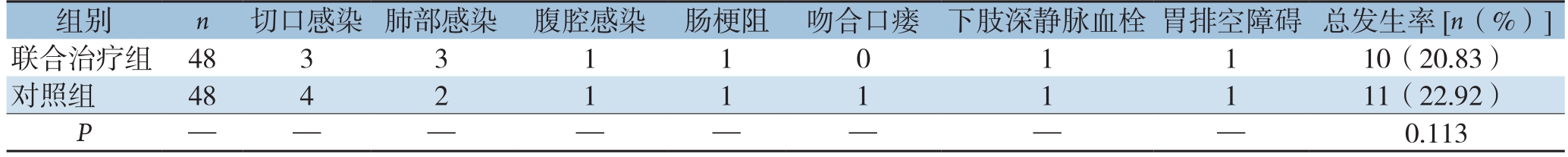
组别 n 切口感染 肺部感染 腹腔感染 肠梗阻 吻合口瘘 下肢深静脉血栓 胃排空障碍 总发生率[n(%)]联合治疗组 48 3 3 1 1 0 1 1 10(20.83)对照组 48 4 2 1 1 1 1 1 11(22.92)P— — — — — — 0.113
2.4 两组患者根治性切除率的比较
联合治疗组行R0切除39例,R1切除6例,3例行姑息性手术,R0切除率为81.25%;对照组行R0切除22例,R1切除15例,11例行姑息性手术,R0切除率为45.83%;两组患者R0切除率间差异有统计学意义(P<0.05)。
2.5 两组患者生存率比较
所有患者均完成随访。联合治疗组1、2年及3年生存率均高于对照组(76.35% vs.62.37%;61.07% vs. 38.62%;59.74% vs. 25.68%),差异均有统计学意义(P<0.05)(图1)。
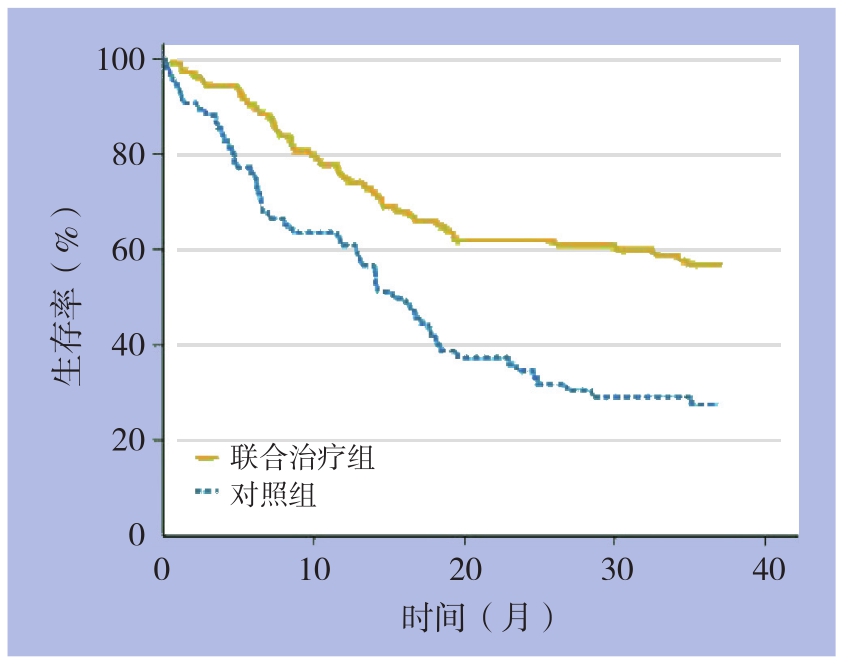
图1 两组患者生存率比较
3 讨 论
胃癌是消化系统中最常见的恶性肿瘤之一,具有发病率高、病死率高等特点。随着人们生活方式的改变,其发病率呈上升趋势,严重威胁人们群众的生命安全[12-14]。目前胃癌早期诊断率仍较低,多数患者就诊时已发展为进展期胃癌[15]。进展期胃癌的治疗效果差强人意,Yang等[16]比较了中韩两国进展期胃癌的生存率,5年生存率分别为26.0%~67.9%与23.6%~85.0%。进展期胃癌治疗方案的选择成为研究的热点,目前主要采取以外科手术为主、辅以术前新辅助化疗及术后辅助化疗的综合治疗手段。随着外科技术的发展,腹腔镜逐渐被应用到胃癌的治疗中,因其具有创伤小、恢复快等优势,已得到越来越广泛的认可[17-18]。胃癌对化疗药物较为敏感,化疗可提高治愈率,延长患者的总生存。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南也推荐进展期胃癌可行术前新辅助治疗[19]。Mansour等[20]研究表明,局部进展期胃癌患者接受术前和术后联合化疗后R0切除率及术后生存率均有所提高。Kim等[21]也探讨了新辅助化疗在可切除的局部进展期胃癌中的价值,结果表明,患者1年总生存期、1年无进展生存期及无远处转移生存期均得到显著提高。本研究旨在探讨新辅助化疗联合腹腔镜手术对进展期胃癌患者的疗效及预后的影响。
新辅助化疗方案的选择需综合考虑患者的身体体能状态、合并症及化疗药物的不良反应等,对于两药方案或三药方案的选择存在争议,由于两药方案不良反应发生率更低、化疗完成率更高而得到较广泛应用。NCCN指南推荐以氟尿嘧啶联合顺铂为基础的新辅助化疗方案,其中氟尿嘧啶可由卡培他滨替代,顺铂可由奥沙利铂替代[22-23]。本研究中使用的新辅助化疗方案即为奥沙利铂联合卡培他滨方案(XELOX方案)[24-25]。新辅助化疗的周期数也存在争议,化疗周期过短无法使肿瘤降期,而周期过长又会降低手术耐受性。中国腹腔镜胃肠外科联合治疗组(CLASS联合治疗组)最终商议后认为,基于新辅助化疗主要是为后续手术根治性切除做准备,最终确定新辅助化疗方案采用3周期的XELOX方案[20]。胃癌新辅助化疗疗效评价至今尚缺乏统一的标准。术前临床通常采用影像学手段评价化疗疗效,包括:计算机断层扫描(computed tomography,CT)、超声内镜(endoscopic ultrasonography,EUS)、磁共振成像(magnetic resonance imaging,MRI)、正电子发射计算机断层显像(positron emission tomography,PET)等。CT是最常用的评价手段,但其难于区别化疗后组织变化(如纤维化)及瘤体本身。EUS是评价胃癌新辅助化疗疗效研究较多的一种方法,但化疗会影响EUS对分期和瘤体厚度判断准确度,仅利用EUS评价胃癌新辅助化疗疗效不够全面。MRI对软组织的分辨力高并具有多平面、多参数成像能力,术前分期优势明显,但扫描时间过长而致胃蠕动及呼吸所带来的图像伪影是MRI准确分期的瓶颈。PET作为功能影像检查手段的突出代表,较传统影像检查在肿瘤分期等具有明显优势,尤其对化疗无效者的选择更具优势[26]。综合应用各种影像学方法,有条件者可行CT、EUS和PET联合评价,可能有助于提高胃癌新辅助化疗疗效评价的准确性[27]。本研究中联合治疗组患者经过3个周期的化疗后,获益明显,其中CR 2例,PR 20例,SD 23例,PD 3例,ORR为45.83%,CBR为93.75%。该化疗方案毒性小,无重度骨髓抑制。消化系统副反应发生率也不高,且均可控制,患者耐受性好,可完成化疗。周围感觉神经毒性经中心静脉给药可较好控制,同时用药期间应注意保暖。结果表明,该化疗方案具有较好的临床效果,且患者耐受性好。与张建斌[25]研究结果一致,进一步证实了奥沙利铂联合卡培他滨的新辅助化疗方案对胃癌的良好疗效。
新辅助化疗可能会导致胃及周围组织水肿及纤维化,尤其是在肿瘤周围及转移淋巴结周围。当重要血管附近的转移淋巴结周围组织因化疗后发生纤维化改变,可能会使解剖间隙模糊,增加手术难度及术中、术后并发症发生风险[28]。本研究结果提示,两组患者手术时间、出血量、淋巴结清扫数目等围术期指标及切口感染、肺部感染、腹腔感染等术后并发症发生率比较均无统计学差异(P>0.05)。该结果提示,围术期指标及术后并发症更大程度上受手术方式的影响,而新辅助化疗并不会对手术产生较为明显的影响[29]。原因可能在于术中精细解剖及操作和对淋巴管及血管的准确缝扎,对于减少术后并发症的发生尤为重要。腹腔镜在外科手术层面及解剖间隙的显露方面具有明显优势[19]。利用腹腔镜的放大优势,进行精细化的解剖及操作,减少术中意外损伤,可降低新辅助化疗后胃癌外科手术并发症的发生率[11,21,30]。本研究结果表明,新辅助化疗方案后行腹腔镜手术具有明显的加速康复优势,故对于进展期胃癌患者,在排除相关禁忌后应尽可能接受腹腔镜手术治疗。
根治性切除联合新辅助化疗可显著提高R0切除率,减少术后复发转移,提高患者术后生存率,是胃癌多学科协作治疗的重要组成部分[31-32]。Barone等[33]评估了新辅助化疗方案表阿霉素+依托泊苷+顺铂的价值,结果显示,患者的病理缓解率明显提高。本研究对两组手术根治率进行比较,联合治疗组患者行R0切除39例,R1切除6例,行姑息性手术3例,R0切除率为81.25%;对照组患者行R0切除22例,R1切除15例,行姑息性手术11例,R0切除率为45.83%;两组患者R0切除率间差异有统计学意义(P<0.05)。可见,术前给予新辅助化疗可控制复发风险较高人群的微小转移灶,提高手术根治切除率。同时,本研究对所有患者进行了为期3年的随访,结果发现,联合治疗组患者1、2年及3年生存率均高于对照组(P<0.05)。新辅助化疗可杀灭癌细胞,缩小肿瘤,减轻肿瘤组织与周围组织的粘连,增加了根治性切除的机会,进而提高了胃癌患者的R0切除率[34]。同时新辅助化疗还可杀灭微转移灶,预防血源性播散等,临床疗效更好,更利于患者的长期生存[35]。
新辅助化疗联合腹腔镜治疗进展期胃癌疗效确切,可提高手术R0切除率,降低肿瘤复发和转移,提高患者生存率,且对腹腔镜围术期指标及手术并发症并未产生明显影响,有较好的临床应用价值。
[1]Wang FH, Shen L, Li J, et al.The Chinese Society of Clinical Oncology (CSCO): clinical guidelines for the diagnosis and treatment of gastric cancer[J].Cancer Commun (Lond), 2019,39(1):10.doi:10.1186/s40880-019-0349-9.
[2]Chen W, Zheng R, Baade PD, et al.Cancer statistics in China,2015[J].CA Cancer J Clin, 2016, 66(2):115-132.doi:10.3322/caac.21338.
[3]Torre LA, Bray F, Siegel RL, et al.Global cancer statistics, 2012 [J].CA Cancer J Clin, 2015, 65(2):87-108.doi:10.3322/caac.21262.
[4]Pasechnikov V, Chukov S, Fedorov E, et al.Gastric cancer:prevention, screening and early diagnosis[J].World J Gastroenterol,2014, 20(38):13842-13862.doi: 10.3748/wjg.v20.i38.13842.
[5]仝德峰, 刘江文, 孙琳, 等.进展期胃癌腹腔镜辅助D2根治术的临床疗效分析[J].中国普通外科杂志, 2015, 24(8):1201-1204.doi:10.3978/j.issn.1005-6947.2015.08.030.
Tong DF, Liu JW, Sun L, et al.Laparoscopic-assisted D2 gastrectomy for advanced gastric cancer: a clinical study[J].Chinese Journal of General Surgery, 2015, 24(8):1201-1204.doi:10.3978/j.issn.1005-6947.2015.08.030.
[6]Zheng CH, Lu J, Huang CM, et al.Treatment of locally advanced gastric cancer with the XELOX program of neoadjuvant chemotherapy combined with laparoscopic surgery: the experience in China[J].Hepatogastroenterology, 2014, 61(135):1876-1882.
[7]陈磊, 林惠忠, 姜相君, 等.奥沙利铂联合氟尿嘧啶、亚叶酸钙方案(mFOLFOX7)对进展期胃癌的疗效分析[J].中国现代普通外科进展, 2010, 13(1):31-34.doi:10.3969/j.issn.1009-9905.2010.01.010.
Chen L, Lin HZ, Jiang XJ, et al.Effects of mFOLFOX7 neoadjuvant chemotherapy protocol on advanced gastric cancer[J].Chinese Journal of Current Advances in General Surgery, 2010,13(1):31-34.doi:10.3969/j.issn.1009-9905.2010.01.010.
[8]刘晓, 韩朝阳, 王银中, 等.腹腔镜与开腹胃癌根治术的临床疗效和对肿瘤微转移及胃肠激素水平的影响[J].中国普通外科杂志, 2017, 26(12):1637-1641.doi:10.3978/j.issn.1005-6947.2017.12.021.
Liu X, Han ZY, Wang YZ, et al.Clinical therapeutic effect of laparoscopic and laparotomy radical resection of gastric cancer and the influence on tumor micrometastasis and level of gastrointestinal hormones[J].Chinese Journal of General Surgery, 2017,26(12):1637-1641.doi:10.3978/j.issn.1005-6947.2017.12.021.
[9]Kim HS, Kim JW, Kim JH, et al.Single-lesion measurement per organ for assessing tumor response in advanced gastric cancer[J].Oncology, 2015, 88(2):69-75.doi: 10.1159/000367810.
[10]Ozdemir N, Abali H, Vural M, et al.Docetaxel, cisplatin, and fluorouracil combination in neoadjuvant setting in the treatment of locally advanced gastric adenocarcinoma: Phase II NEOTAX study[J].Cancer Chemother Pharmacol, 2014, 74(6):1139-1147.doi: 10.1007/s00280-014-2586-6.
[11]帅晓明, 高金波, 刘兴华, 等.新辅助化疗联合腹腔镜辅助胃癌根治术治疗进展期胃癌的疗效分析[J].中华消化外科杂志, 2016,15(3):241-246.doi:10.3760/cma.j.issn.1673-9752.2016.03.007.
Shuai XM, Gao JB, Liu XH, et al.Clinical efficacy of neoadjuvant chemotherapy combined with laparoscopy-assisted radical gastrectomy for advanced gastric cancer[J].Chinese Journal of Digestive Surgery, 2016, 15(3):241-246.doi: 10.3760/cma.j.issn.1673-9752.2016.03.007.
[12]刘宏斌.腹腔镜胃癌根治术[J].中华普外科手术学杂志(电子版),2013, 12(1):64.doi: 10.3877/cma.j.issn.16743946.2013.01.019.
Liu HB.Laparoscopic gastrectomy for gastric cancer [J].Chinese Journal of Operative Procedures of General Surgery(Electronic Version), 2013, 12(1):64.doi: 10.3877/cma.j.issn.16743946.2013.01.019.
[13]季加孚, 季鑫.胃癌新辅助化疗的现状与展望[J].中国肿瘤临床, 2012, 39(20):1458-1461.doi:10.3969/j.issn.1000-8179.2012.20.004.
Ji JF, Ji X.Present status and prospect of neoadjuvant chemotherapy for gastric cancer[J].Chinese Journal of Clinical Oncology, 2012,39(20):1458-1461.doi:10.3969/j.issn.1000-8179.2012.20.004.
[14]Aoyama T, Yoshikawa T.Adjuvant therapy for locally advanced gastric cancer[J].Surg Today, 2017, 47(11):1295-1302.doi:10.1007/s00595-017-1493-y.
[15]Song Z, Wu Y, Yang J, et al.Progress in the treatment of advanced gastric cancer[J].Tumour Biol, 2017, 39(7):1010428317714626.doi: 10.1177/1010428317714626.
[16]Yang K, Choi YY, Zhang WH, et al.Strategies to improve treatment outcome in gastric cancer: a retrospective analysis of patients from two high-volume hospitals in Korea and China[J].Oncotarget,2016, 7(28):44660-44675.doi: 10.18632/oncotarget.9378.
[17]Cardona K, Zhou Q, Gönen M, et al.Role of repeat staging laparoscopy in locoregionally advanced gastric or gastroesophageal cancer after neoadjuvant therapy[J].Ann Surg Oncol, 2013,20(2):548-554.doi: 10.1245/s10434-012-2598-6.
[18]张玉江, 周军, 阿合提别克, 等.快速康复外科理念在新辅助化疗联合腹腔镜下胃癌D2根治术治疗进展期胃癌中的应用[J].中华实用诊断与治疗杂志, 2018, 32(5):467-470.doi:10.13507/j.issn.1674-3474.2018.05.015.
Zhang YJ, Zhou J, Aheti BK, et al.Fast-track surgery in neoadjuvant chemotherapy combined with laparoscopic D2radical gastrectomy for advanced gastric cancer[J].Journal of Chinese Practical Diagnosis and Therapy, 2018, 32(5):467-470.doi:10.13507/j.issn.1674-3474.2018.05.015.
[19]胡建昆, 张维汉, 陈心足.从中国CLASS-03a研究的开展看腹腔镜手术联合新辅助化疗的胃癌治疗[J].中华胃肠外科杂志, 2018,21(2):138-142.doi:10.3760/cma.j.issn.1671-0274.2018.02.004.
Hu JK, Zhang WH, Chen XZ.Laparoscopic gastrectomy combined with neoadjuvant chemotherapy for gastric cancer patients:from the view of the CLASS-03a trial [J].Chinese Journal of Gastrointestinal Surgery, 2018, 21(2):138-142.doi:10.3760/cma.j.issn.1671-0274.2018.02.004.
[20]Mansour JC, Tang L, Shah M, et al.Does graded histologic response after neoadjuvant chemotherapy predict survival for completely resected gastric cancer?[J].Ann Surg Oncol, 2007,14(12): 3412-3418.doi: 10.1245/s10434-007-9574-6.
[21]Kim MS, Lim JS, Hyung WJ, et al.Neoadjuvant chemoradiotherapy followed by D2 gastrectomy in locally advanced gastric cancer[J].World J Gastroenterol, 2015, 21(9):2711-2718.doi: 10.3748/wjg.v21.i9.2711.
[22]赵群, 李勇, 檀碧波, 等.奥沙利铂联合卡培他滨新辅助化疗方案对进展期胃癌手术切除率及预后的影响[J].中华肿瘤杂志, 2013,35(10):773-777.doi:10.3760/cma.j.issn.0253-3766.2013.10.012.
Zhao Q, Li Y, Tan BB, et al.Effects of XELOX regimen as neoadjuvant chemotherapy on radical resection rate and prognosis in patients with advanced gastric cancer[J].Chinese Journal of Oncology, 2013, 35(10):773-777.doi:10.3760/cma.j.issn.0253-3766.2013.10.012.
[23]卞育海, 曹晖, 郁丰荣, 等.奥沙利铂联合5-FU术前动脉化疗对进展期胃癌的临床疗效[J].中国普通外科杂志, 2009, 18(9):955-959.
Bian YH, Cao H, Yu FR, et al.Effects of preoperative arterial infusion chemotherapy with oxaliplatin and 5-FU for patients with advanced gastric cancer[J].Chinese Journal of General Surgery,2009, 18(9):955-959.
[24]Li Z, Shan F, Ying X, et al.Laparoscopic or open distal gastrectomy after neoadjuvant chemotherapy for advanced gastric cancer:study protocol for a randomised phase II trial[J].BMJ Open, 2018,8(8):e021633.doi: 10.1136/bmjopen-2018-021633.
[25]张建斌.新辅助化疗联合腹腔镜手术治疗进展期胃癌的临床疗效及对患者围手术期免疫功能的影响[J].河北医药, 2015,37(19):2904-2907.doi:10.3969/j.issn.1002-7386.2015.19.006.
Zhang JB.Therapeutic effects of neoadjuvant chemotherapy combined with laparoscopic surgery on advanced gastric carc inoma ;and its effects on patient' s immune function at peroperative period[J].Hebei Medical Journal, 2015, 37(19):2904-2907.doi:10.3969/j.issn.1002-7386.2015.19.006
[26]汪劭婷, 朱朝晖, 李小毅, 等.胃癌新辅助化疗疗效临床评价方法及进展[J].中国普外基础与临床杂志, 2010, 17(2):200-204.
Wang ST, Zhu ZH, Li XY, et al.Advances and Clinical Efficacy Evaluation Method on Neoadjuvant Chemotherapy in Patients with Gastric Cancer[J].Chinese Journal of Bases and Clinics in General Surgery, 2010, 17(2):200-204.
[27]韩荣斌, 张云锋.新辅助化疗联合腹腔镜远端胃癌根治术治疗进展期胃癌疗效及安全性分析[J].现代消化及介入诊疗, 2017,22(2):245-247.doi:10.3969/j.issn.1672-2159.2017.02.028.
Han RB, Zhang YF.Therapeutic efficacy and safety analysis of neoadjuvant chemotherapy combined with laparoscopic radical resection of distal gastric cancer for treatment of advanced stage gastric cancer[J].Modern Digestion & Intervention, 2017,22(2):245-247.doi: 10.3969/j.issn.1672-2159.2017.02.028.
[28]杨兴业, 赵小军.新辅助化疗联合腹腔镜治疗进展期胃癌效果及MMP、PG、VEGF水平观察[J].中国中西医结合消化杂志,2019, 27(1):62-66.doi: 10.3969/j.issn.1671-038X.2019.01.14.
Yang XY, Zhao XJ.Effect of neoadjuvant chemotherapy combined with laparoscopy in the treatment of advanced gastric cancer and the expression levels of MMP, PG and VEGF [J].Chinese Journal of Integrated Traditional and Western Medicine on Digestion, 2019,27(1):62-66.doi: 10.3969/j.issn.1671-038X.2019.01.14.
[29]饶芸, 骆群, 徐萍, 等.局部进展期胃癌患者新辅助化疗后围手术期的临床观察[J].第三军医大学学报, 2018, 40(22):2098-2101.doi:10.16016/j.1000-5404.201805212.
Rao Y, Luo Q, Xu P, et al.Perioperative characteristics of patients with locally advanced gastric cancer receiving preoperative neoadjuvant chemotherapy [J].Journal of Third Military Medical University, 2018, 40(22):2098-2101.doi: 10.16016/j.1000-5404.201805212.
[30]王璟, 韩晓鹏, 苏琳, 等.新辅助化疗联合腹腔镜治疗进展期胃癌的近期疗效分析[J].现代肿瘤医学, 2014, 22(11):2632-2635.doi:10.3969/j.issn.1672-4992.2014.11.34.
Wang J, Han XP, Su L, et al.Comparision of the recent treatment effect between laparoscopic and open surgery following neoadjuvant chemortherapy for advanced gastric cancer [J].Journal of Modern Oncology, 2014, 22(11):2632-2635.doi:10.3969/j.issn.1672-4992.2014.11.34.
[31]吴梅青, 周旭坤, 李平, 等.新辅助化疗联合腹腔镜辅助D2近端胃癌根治术治疗近端进展期胃癌[J].中国微创外科杂志, 2014,14(2):109-111.doi:10.3969/j.issn.1009-6604.2014.02.004.
Wu MQ, Zhou XK, Li P, et al.Neoadjuvant Chemotherapy Combined with Laparoscopy-assisted Surgery for Advanced Proximal Gastric Cancer: a ClinicalResearch of 36 Cases [J].Chinese Journal of Minimally Invasive Surgery, 2014, 14(2):109-111.doi: 10.3969/j.issn.1009-6604.2014.02.004.
[32]Kim JS, Kang SH, Moon HS, et al.Clinical Outcome of Doublet and Triplet Neoadjuvant Chemotherapy for Locally Advanced Gastric Cancer [J].Korean J Gastroenterol, 2016, 68(5):245-252.doi: 10.4166/kjg.2016.68.5.245.
[33]Barone C, Cassano A, Pozzo C, et al.Long-term follow-up of a pilot phase II study with neoadjuvant epidoxorubicin, etoposide and cisplatin in gastric cancer[J].Oncology, 2004, 67(1):48-53.doi:10.1159/000080285.
[34]Wagner AD, Syn NLX, Moehler M, et al.Chemotherapy for advanced gastric cancer[J].Cochrane Database Syst Rev, 2017,2017(8):CD004064.doi: 10.1002/14651858.CD004064.
[35]Li Z, Shan F, Wang Y, et al.Laparoscopic versus open distal gastrectomy for locally advanced gastric cancer after neoadjuvant chemotherapy: safety and short-term oncologic results[J].Surg Endosc,2016, 30(10):4265-4271.doi: 10.1007/s00464-015-4739-z.
