直肠癌是消化系统常见的恶性肿瘤,全世界每年新发病例超过100万。由于饮食结构的改变与人口老龄化,我国直肠癌发病率也逐年上升,为全身恶性肿瘤的第4位[1-2]。早期直肠癌患者多无明显临床症状,就诊时多已为进展期,故患者预后较差,5年生存率约为50%[3]。手术切除是直肠癌的主要治疗手段。近年来,腹腔镜手术以创伤小、出血量少、并发症少、术后恢复快、住院时间短等优势在直肠癌中得到广泛应用[4]。新辅助化疗是指在肿瘤诊断明确后进行的化疗,属于辅助化疗的范畴,可诱导肿瘤细胞凋亡,缩小原发灶,减轻组织反应性水肿,改善肿瘤与周围组织黏连。新辅助化疗可使直肠癌局部复发率明显降低,手术切除率及保肛率明显提高[5]。2012年美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)结直肠癌治疗指南明确指出,直肠癌接受新辅助化疗可获得肿瘤降期和降级的效果[6-8]。多项研究[3,5-7]表明,新辅助化疗可有效缩小肿瘤体积,减少肿瘤及其邻近组织的血供,可提供有力的手术治疗保障,提高直肠癌患者的预后,近年来越来越受到临床的重视和认可。术前新辅助化疗结合根治性手术己成为NCCN及欧洲肿瘤内科学会年会(European Society for Medical Oncology,ESMO)指南推荐的直肠癌标准治疗模式,多数患者可达到病理完全缓解,预后良好。
腹腔镜手术及新辅助化疗治疗直肠癌疗效确切,但作为创伤性操作,腹腔镜手术会不可避免地影响患者的免疫功能,目前腹腔镜手术及新辅助化疗对机体免疫功能的影响尚无定论。本研究回顾性分析我院收治的117例直肠癌患者的临床资料,探讨新辅助化疗联合腹腔镜根治术对直肠癌患者的疗效及安全性,并评估其对患者围手术期免疫功能的影响。现报告如下。
1 资料与方法
1.1 一般资料
对2016年1月—2018年6月九江市第三人民医院收治的接受腹腔镜直肠癌根治术的117例患者的临床资料进行回顾性分析。根据治疗方法分为观察组(n=62)和对照组(n=55);观察组患者接受新辅助化疗联合腹腔镜直肠癌根治术,对照组患者直接行腹腔镜直肠癌根治术。所有患者术前均行纤维结肠镜、直肠指检及盆腔强化计算机断层扫描(computed tomography,CT)检查。排除标准:年龄>70岁;体质量指数(body mass index,BMI)>23 kg/m2;合并心、肺、肝、肾、脑及免疫系统等疾病;使用影响免疫功能药物的患者;气腹禁忌者;急性肠梗阻者;腹部手术史等[9]。
1.2 分组资料
⑴观察组:男27例,女35例;年龄21~68岁,平均年龄(54.26±4.33)岁。原发灶-淋巴结-转移(tumor-node-metastasis,TNM)分期:II期29例,IIII期33例;病理学分型:高分化腺癌10例,中分化腺癌24例,低分化腺癌14例,黏液腺癌14例;肿瘤距离肛门距离(8.59±1.23)cm;新辅助化疗前T分期:T2 2例,T3 44例,T4 16例;N分期:N0 5例,N1 35例;N2 22例;新辅助化疗后T分期:T0 7例,T1 3例,T2 18例,T3 24例,T4 10例;N分期:N0 20例,N1 23例,N2 19例。⑵对照组:男29例,女26例;年龄23~67岁,平均年龄(56.13±5.17)岁。TNM分期:II期26例,III期29例;病理学分型:高分化腺癌10例,中分化腺癌16例,低分化腺癌18例,黏液腺癌11例;肿瘤距离肛门距离(8.23±1.17)cm;术前T分期:T2 3例,T3 39例,T4 13例;N分期:N0 2例,N1 34例;N2 19例。两组患者一般资料差异无统计学意义(P>0.05),具有可比性。本研究中患者及家属均签署知情同意书,且本项研究经过医院伦理委员会批准。
1.3 治疗方法
所有患者术前3 d口服甲硝哗0.4 g,3次/d,进半流质饮食,术前2 d口服辉灵(C.B.Fleet Company,Inc.,注册证号:H20060212)45 mL/d,术前晚普通灌肠,术晨清洁灌肠。
观察组患者接受新辅助化疗联合腹腔镜直肠癌根治术,对照组患者直接行直肠癌腹腔镜根治术。
腹腔镜直肠癌根治术遵循全直肠系膜切除、彻底的淋巴结清扫及肿瘤操作的非接触原则,步骤如下:患者采用静吸复合麻醉,调整患者体位,以利手术操作,尽量保证手术部位高于其他部位,通过重力作用将小肠移开,减少肠管和肠系膜遮挡,以充分暴露病灶。建立人工气腹,气腹压为12~15 mmHg(1 mmHg=0.133 kPa),于脐轮上缘观察孔置入腹腔镜,根据手术方式设置3~4个直径为0.5~1.3 cm的穿刺孔,同时行1个4~6 cm的辅助切口,以方便取出标本。根据肿瘤部位选择Dixon术或Miles术式[10]。
新辅助化疗采用FOLFOX4方案[11]:奥沙利铂注射液(江苏恒瑞医药股份有限公司,国药准字:H20050962)85 mg/m2,静脉滴注2 h,d1;注射用亚叶酸钙(悦康药业集团有限公司,国药准字:H20044159),静脉滴注2 h,d1~2,5-氟尿嘧啶注射液(南通精华制药股份有限公司,国药准字:H32022246)400 mg/m2,静脉推注,联合5-氟尿嘧啶600 mg/m2持续静脉滴注22 h,d1~2;14 d为1个周期,共2个周期。
1.4 观察指标
观察两组患者手术指标,包括手术时间、术中出血量、下床时间、肠功能恢复时间、住院时间,比较两组中转开腹率、保肛率、根治率、回肠末端造口率及并发症发生率;分别于术前1 d、术后1 d及术后7 d抽取患者外周静脉血,分析血清中免疫球蛋白(IgG、IgA)、补体(C3、C4)及T细胞表面标志物(CD3+、CD4+、CD8+)等变化。
1.4.1 IgG、IgA、C3、C4测定 抽取患者外周静脉血3 mL,常温3 000 r/min 离心3 min,取上层血清,采用双光径免疫浊度分析法检测IgG、IgA、C3、C4 水平[12]。
1.4.2 T细胞表面标志物CD3+、CD4+、CD8+的测定 抽取患者静脉血3 mL,EDTA-K2抗凝,充分混匀,取100 μL抗凝血,滴入一抗CD3-FITc/CD56-Pe或CD4-FITc/CD8-Pe,混匀后,室温孵育30 min,之后将孵育的混合液置于免疫荧光制备仪上,利用裂解液裂解红细胞,采用Epics.XLⅡ型流式细胞仪检测上述T细胞表面标志物表达水平[13]。
1.5 统计学处理
采用统计学软件SPSS 19.0进行分析。计量资料采用t检验。计数资料采用χ2检验。以P<0.05为两组间差异有统计学意义。
2 结果
2.1 两组患者手术相关指标比较
两组患者手术相关指标比较,差异均无统计学意义(均P>0.05)(表1)。观察组与对照组中转开腹率[6.45%(4/62) vs.5.45%(3/55)]无统计学差异(P>0.05),观察组保肛率[80.65%(50/62) vs.65.45%(36/55)]、根治率[83.87%(52/62) vs.70.91%(39/55)]、回肠末端造口率[61.29%(38/62) vs.23.64%(13/55)]均高于对照组,差异均有统计学意义(均P<0.05)。
表1 两组患者手术相关指标比较( ±s)
±s)

组别 手术时间(min)术中出血量(mL)下床时间(d) 排气时间(d) 进半流食时间(d)住院时间(d)观察组(n=62) 130.25±37.96 101.25±29.34 2.45±0.52 2.75±0.61 4.17±0.94 11.56±3.25对照组(n=55) 142.26±41.28 105.27±32.57 2.59±0.67 2.63±0.75 4.35±1.12 12.69±3.47 t 1.175 0.737 0.830 0.557 0.879 0.652 P 0.036 0.635 0.423 0.731 0.217 0.688
2.2 两组并发症发生率比较
术后,观察组发生吻合口瘘3例,切口感染1例,尿潴留1例,并发症发生率为8.06%(5/62);对照组出现吻合口瘘1例,切口感染5例,尿潴留3例,切口裂开1例,并发症发生率为18.18%(10/55)。观察组并发症发生率明显低于对照组(P<0.05)。
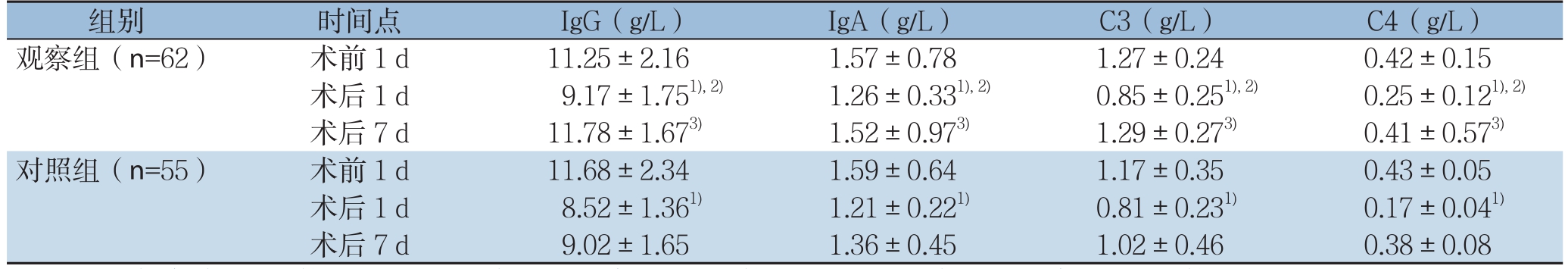
2.3 两组患者免疫球蛋白(IgG、IgA)、补体(C3、C4)水平比较
术前1 d,两组患者IgG、IgA、C3及C4水平间无统计学差异(P>0.05)。术后1 d,两组患者上述指标水平均降低且均低于术前1 d,但观察组高于对照组(P<0.05)。术后观察组上述指标恢复较快,且于术后7 d基本恢复至术前水平,而对照组恢复较慢,与观察组比较差异有统计学意义(P<0.05)(表2)。
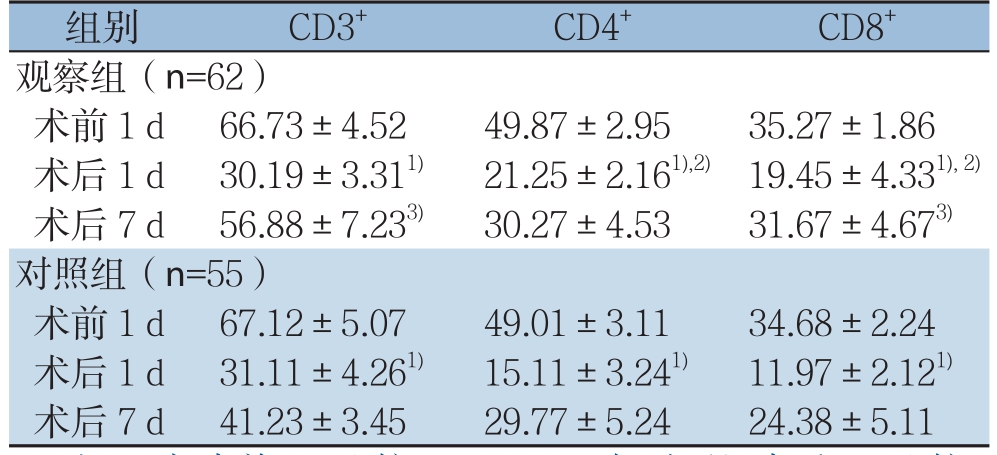
2.4 两组患者T细胞表面标志物CD3+、CD4+、CD8+比较
术前1 d,两组患者CD3+、CD4+、CD8+等指标比较无统计学差异(P>0.05);术后,两组患者上述指标均呈现出先降低后升高的趋势(P<0.05);组间比较,术后1 d观察组CD4+、CD8+水平均高于对照组,术后7 d CD3+、CD8+水平均高于对照组(P<0.05)(表3)。
表2 两组患者免疫球蛋白及补体水平比较( ±s)
±s)
注:1)与术前1 d比较,P<0.05;2)与对照组术后1 d比较,P<0.05;3)与对照组术后7 d比较,P<0.05
组别 时间点 IgG(g/L) IgA(g/L) C3(g/L) C4(g/L)观察组(n=62) 术前1 d 11.25±2.16 1.57±0.78 1.27±0.24 0.42±0.15术后1 d 9.17±1.751),2) 1.26±0.331),2) 0.85±0.251),2) 0.25±0.121),2)术后7 d 11.78±1.673) 1.52±0.973) 1.29±0.273) 0.41±0.573)对照组(n=55) 术前1 d 11.68±2.34 1.59±0.64 1.17±0.35 0.43±0.05术后1 d 8.52±1.361) 1.21±0.221) 0.81±0.231) 0.17±0.041)术后7 d 9.02±1.65 1.36±0.45 1.02±0.46 0.38±0.08
表3 两组患者T细胞表面标志物CD3+、CD4+、CD8+比较( ±s)
±s)
注:1)与术前1 d比较,P<0.05;2)与对照组术后1 d比较,P<0.05;3)与对照组术后7 d比较,P<0.05
组别 CD3+ CD4+ CD8+观察组(n=62)术前1 d 66.73±4.52 49.87±2.95 35.27±1.86术后1 d 30.19±3.311) 21.25±2.161),2) 19.45±4.331),2)术后7 d 56.88±7.233) 30.27±4.53 31.67±4.673)对照组(n=55)术前1 d 67.12±5.07 49.01±3.11 34.68±2.24术后1 d 31.11±4.261) 15.11±3.241) 11.97±2.121)术后7 d 41.23±3.45 29.77±5.24 24.38±5.11
3 讨论
直肠癌是消化系统常见的恶性肿瘤,且近年来,其发病率逐年上升[2]。随着新辅助化疗的不断发展和多学科治疗模式的普及,腹腔镜术前行新辅助放化疗作为一种新的治疗理念而得到重视,新辅助化疗联合腹腔镜根治术已成为直肠癌的标准治疗方案[14]。新辅助化疗可缩小肿瘤原发灶,降低区域淋巴结分期,降低切缘阳性率,提高保肛率,并降低局部复发率。但也有研究[15]认为,腹腔镜下直肠癌根治术前行新辅助化疗会增加术中出血量,严重影响术野清晰度,从而导致中转开腹率提高。同时,手术创伤会造成术后免疫功能抑制,其抑制程度与手术创伤严重程度相关,可见合理的手术方式对于保护肿瘤患者术后免疫功能非常重要。新辅助化疗对患者免疫系统的影响目前尚未明确,有研究[16]认为,术前化疗会对机体免疫系统产生较大的损伤,增加了术后并发症发生率以及肿瘤复发率。也有研究[17]认为,直肠癌患者腹腔镜手术治疗同步新辅助化疗不会对患者免疫系统造成影响。因此,对腹腔镜下直肠癌根治术前行新辅助化疗的可行性及安全性进行评估具有重要意义。
对于局部进展期直肠癌患者(术前临床分期T3期及以上,或伴有区域淋巴结转移),术前先行新辅助化疗可使肿瘤缩小、区域淋巴结降期,并降低局部复发率、提高保肛率[18]。本研究中,观察组患者接受新辅助化疗联合腹腔镜根治术,对照组患者直接行腹腔镜根治术。结果显示,观察组患者手术时间、术中出血量、下床时间、排气时间、进半流食时间及住院时间等手术指标与对照组相比均无明显差异(P>0.05),可见,术前行新辅助化疗未对相关手术指标产生明显影响,同时可见,观察组手术时间略短于对照组,但差异无统计学意义(P>0.05),可能与术前行新辅助化疗可缩小癌灶、减少手术范围有关。是否保留肛门括约肌会直接影响患者术后的生活质量,而根治率则影响患者的预后及生存率[19]。观察组保肛率(80.65% vs.65.45%)、根治率(83.87% vs.70.91%)均高于对照组(均P<0.05),可见,新辅助化疗联合腹腔镜根治术有利于改善患者预后及提高患者生活质量。观察组与对照组中转开腹率(6.45% vs.5.45%)无统计学差异(P>0.05),可见腹腔镜根治术前行新辅助化疗对手术操作无明显影响。外科医生多选择回肠末端造口作为一种对肠管吻合口的保护措施,3 个月左右将其回纳[20]。观察组患者回肠末端造口率明显高于对照组(61.29% vs.23.64%),观察组发生吻合口瘘3例,对照组仅1例。其可能原因是术前行新辅助化疗后患者的肠壁出现水肿,直接将切除后的肠管吻合增加了吻合口瘘的发生率。
机体在遭受创伤后,血清免疫球蛋白浓度会降低,其降低幅度与创伤的严重程度密切相关[21]。IgA是机体黏膜防护的重要因素,IgG可以固定补体,增强其他细胞对靶细胞的杀伤作用[22]。补体C3、C4是判断机体免疫功能的非特异性辅助指标,具有杀伤肿瘤细胞的作用,还可协助抗体和免疫细胞杀伤肿瘤细胞。有研究[7,23]表明,抗肿瘤治疗可降低患者机体免疫球蛋白和补体水平,且其含量与临床疗效及预后相关。本研究结果显示,术前1 d,两组患者IgG、IgA、C3及C4水平间无统计学差异(P>0.05)。术后1 d,两组患者上述指标水平均降低且均低于术前1 d,但观察组高于对照组(P<0.05)。术后观察组上述指标恢复较快,且于术后7 d基本恢复至术前水平,而对照组恢复较慢,与观察组相比差异明显(P<0.05)。由此我们推测,新辅助化疗对腹腔镜根治术直肠癌患者免疫功能的恢复有利。治疗早期,新辅助化疗对机体免疫功能会产生抑制作用,但随着治疗时间的延长,肿瘤负荷减轻,体液免疫也逐渐得到恢复,为腹腔镜根治术后直肠癌患者免疫功能的恢复提供了条件,从而可提高临床疗效[24]。
T淋巴细胞介导的细胞免疫是机体抗击肿瘤的重要方式[25-26]。恶性肿瘤患者均存在一定程度的免疫功能异常,CD3+、CD4+、CD8+水平可反映评价机体细胞免疫功能状态。本研究中,术前1 d,两组患者CD3+、CD4+、CD8+等指标比较无统计学差异(P>0.05);术后,两组患者上述指标均呈现出先降低后升高的趋势(P<0.05),组间比较,术后1 d,观察组CD4+、CD8+水平均高于对照组(P<0.05),术后7 d,观察组CD3+、CD8+水平均高于对照组(P<0.05),提示腹腔镜根治术联合新辅助化疗不会对机体细胞免疫功能产生较大影响,其术后免疫系统恢复快,远期疗效好,安全性高[27]。新辅助化疗使机体近期处于免疫低下状态,但间隔一段时间后免疫功能可逐步恢复,加之腹腔镜根治术属于微创技术,对患者机体功能损伤小,故有助于免疫系统的恢复[28-29]。
综上所述,新辅助化疗后行腹腔镜根治术与单纯腹腔镜下直肠癌根治术相比,两者手术指标相当,但前者保肛率及根治率高于后者,免疫球蛋白(IgG、IgA)、补体(C3、C4)恢复速度高于后者。新辅助化疗后行腹腔镜根治术明显促进直肠癌患者围手术期机体细胞免疫和体液免疫功能的恢复,故对于直肠癌患者,推荐腹腔镜根治术前行新辅助化疗。
[1]Araujo RO,Valadão M,Borges D,et al.Nonoperative management of rectal cancer after chemoradiation opposed to resection after complete clinical response.A comparative study[J].Eur J Surg Oncol,2015,41(11):1456-1463.doi:10.1016/j.ejso.2015.08.156.
[2]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.doi:10.3322/caac.21338.
[3]Martínez-Pérez A,Carra MC,Brunetti F,et al.Pathologic Outcomes of Laparoscopic vs Open Mesorectal Excision for Rectal Cancer:A Systematic Review and Meta-analysis[J].JAMA Surg,2017,152(4):e165665.doi:10.1001/jamasurg.2016.5665.
[4]Martínez-Pérez A,Carra MC,Brunetti F,et al.Short-term clinical outcomes of laparoscopic vs open rectal excision for rectal cancer:A systematic review and meta-analysis[J].World J Gastroenterol,2017,23(44):7906-7916.doi:10.3748/wjg.v23.i44.7906.
[5]Stevenson AR.The future for laparoscopic rectal cancer surgery[J].Br J Surg,2017,104(6):643-645.doi:10.1002/bjs.10503.
[6]Seshadri RA,Swaminathan R,Srinivasan A.Laparoscopic versus open surgery for rectal cancer after neoadjuvant chemoradiation:Long-term outcomes of a propensity score matched study[J].J Surg Oncol,2018,117(3):506-513.doi:10.1002/jso.24868.
[7]史磊.腹腔镜直肠癌根治术在新辅助放化疗患者临床意义的研究[D].北京:中国医学科学院北京协和医学院肿瘤医院,2017.Shi L.The effect and clinical significance analysis of local advanced rectal cancer to neoadjuvant chemoradiotherapy combined with laparoscopic TME surgery[D].Beijing:Chinese Academy of Medical Sciences,Peking Union Medical College Tumor Hospital,2017.
[8]Lim DR,Bae SU,Hur H,et al.Long-term oncological outcomes of robotic versus laparoscopic total mesorectal excision of midlow rectal cancer following neoadjuvant chemoradiation therapy[J].Surg Endosc,2017,31(4):1728-1737.doi:10.1007/s00464-016-5165-6.
[9]Petrucciani N,Martínez-Pérez A,Bianchi G,et al.The use of laparoscopy for locally advanced rectal cancer[J].Minerva Chir,2018,73(1):77-92.doi:10.23736/S0026-4733.17.07568-X.
[10]Aisu Y,Kato S,Kadokawa Y,et al.Feasibility of extended dissection of lateral pelvic lymph nodes during laparoscopic total mesorectal excision in patients with locally advanced lower rectal cancer:a single-center pilot study after neoadjuvant chemotherapy[J].Med Sci Monit,2018,24:3966-3977.doi:10.12659/MSM.909163.
[11]Sinukumar S,Mehta S,Ostwal V,et al.Impact of type of surgery(laparoscopic versus open)on the time to initiation of adjuvant chemotherapy in operable rectal cancers[J].Indian J Gastroenterol,2015,34(4):310-313.doi:10.1007/s12664-015-0579-y.
[12]Lu Y,Peng L,Ma Y,et al.Comparison between laparoscopic and open resection following neoadjuvant chemoradiotherapy for midlow rectal cancer patients:a meta-analysis[J].J Laparoendosc Adv Surg Tech A,2019,29(3):316-322.doi:10.1089/lap.2018.0409.
[13]Wu X,Lin G,Qiu H,et al.Loop ostomy following laparoscopic low anterior resection for rectal cancer after neoadjuvant chemoradiotherapy[J].Eur J Med Res,2018,23(1):24.doi:10.1186/s40001-018-0325-x.
[14]Okuyama T,Sameshima S,Takeshita E,et al.Therapeutic effects of oxaliplatin-based neoadjuvant chemotherapy and chemoradiotherapy in patients with locally advanced rectal cancer:a single-center,retrospective cohort study[J].World J Surg Oncol,2018,16(1):105.doi:10.1186/s12957-018-1403-9.
[15]Persiani R,Biondi A,Pennestrì F,et al.Transanal total mesorectal excision vs laparoscopic total mesorectal excision in the treatment of low and middle rectal cancer:a propensity score matching analysis[J].Dis Colon Rectum,2018,61(7):809-816.doi:10.1097/DCR.0000000000001063.
[16]李新,程晓磊,王志光,等.新辅助放化疗后行腹腔镜手术与单纯腹腔镜手术治疗直肠癌效果比较[J].肿瘤研究与临床,2017,29(11):749-752.doi:10.3760/cma.j.issn.1006-9801.2017.11.007.Li X,Cheng XL,Wang ZG,et al.Efficacy comparison of laparoscope radical surgery after neoadjuvant chemoradiotherapy and traditional surgery alone for treatment of rectal cancer[J].Cancer Research and Clinic,2017,29(11):749-752.doi:10.3760/cma.j.issn.1006-9801.2017.11.007.
[17]张海洋,任武.新辅助放化疗对腹腔镜直肠癌患者免疫系统的影响及研究[J].中国现代药物应用,2014,8(8):55-56.Zhang HY,Ren W.Research and influence of neoadjuvant chemotherapy on immune system of laparoscopic rectal cancer patients[J].Chinese Journal of Modern Drug Application,2014,8(8):55-56.
[18]Fleming FJ,Påhlman L,Monson JR.Neoadjuvant Therapy in Rectal Cancer[J].Dis Colon Rectum,2011,54(7):901-912.doi:10.1007/dcr.0b013e31820eeb37.
[19]Allen SK,Schwab KE,Rockall TA.Surgical steps for standard laparoscopic low anterior resection[J].Minerva Chir,2018,73(2):227-238.doi:10.23736/S0026-4733.18.07572-7.
[20]国家卫生计生委医政医管局,中华医学会肿瘤学分会.中国结直肠癌诊疗规范(2017年版)[J].中华胃肠外科杂志,2018,21(1):92-106.doi:10.3760/j.issn.1671-0274.2018.01.022.The Chinese diagnosis and treatment standard of colorectal cancer(2017 edition),by Tumor branch of Chinese medical association,the state administration of medical health committee[J].Chinese Journal of Gastrointestinal Surgery,2018,21(1):92-106.doi:10.3760/j.issn.1671-0274.2018.01.022.
[21]杨国华,秦长江,刘培杰.腹腔镜联合同步新辅助放化疗治疗中低位局部进展期直肠癌的疗效观察[J].腹腔镜外科杂志,2018,23(5):353-356.doi:10.13499/j.cnki.fqjwkzz.2018.05.353.Yang GH,Qin CJ,Liu PJ.Clinical observation of laparoscopy combined with neoadjuvant chemoradiotherapy for middle and low locally advanced rectal cancer[J].Journal of Laparoscopic Surgery,2018,23(5):353-356.doi:10.13499/j.cnki.fqjwkzz.2018.05.353.
[22]陈校力,罗庆伟,周志军,等.腹腔镜手术联合新辅助化疗在结直肠癌治疗中的作用[J].川北医学院学报,2018,33(2):261-263.doi:10.3969/j.issn.1005-3697.2018.02.032.Chen XL,Luo QW,Zhou ZJ,et al.Effect of laparoscopic surgery combined with neoadjuvant chemotherapy in treatment of colorectal cancer[J].Journal of North Sichuan Medical College,2018,33(2):261-263.doi:10.3969/j.issn.1005-3697.2018.02.032.
[23]何丽琳.新辅助放化疗与手术间隔时间对中晚期直肠癌患者疗效和生存的影响[J].实用肿瘤杂志,2019,34(1):78-81.doi:10.13267/j.cnki.syzlzz.2019.01.018.He LL.Effect of time interval between neoadjuvant chemoradiotherapy and surgery on efficacy and survival of patients with advanced rectal cancer[J].Journal of Practical Oncology,2019,34(1):78-81.doi:10.13267/j.cnki.syzlzz.2019.01.018.
[24]刘中元.腹腔镜辅助直肠癌根治术对机体功能恢复的优势研究[D].济南:山东大学,2012.Liu ZY.The advantages of research after laparoscopic-assisted radical resection for rectal cancer on the recovery of the body object:function in the patients[D].Jinan:Shandong University,2012.
[25]张庆彤,刘亚莉,张旭,等.3D与2D腹腔镜手术治疗新辅助放化疗后直肠癌的疗效分析[J].中华消化外科杂志,2017,16(8):850-855.doi:10.3760/cma.j.issn.1673-9752.2017.08.018.Zhang QT,Liu YL,Zhang X,et al.Effects of three-dimensional and two-dimensional laparoscopic surgeries for rectal cancer after neoadjuvant chemoradiation therapy[J].Chinese Journal of Digestive Surgery,2017,16(8):850-855.doi:10.3760/cma.j.issn.1673-9752.2017.08.018.
[26]王俊伟,金心富,卢凯.腹腔镜切除术配合FOLFOX4新辅助化疗对直肠癌患者血清FAS、Tu M2-PK及T细胞亚群的影响[J].临床和实验医学杂志,2019,18(9):981-985.doi:10.3969/j.issn.1671-4695.2019.09.026.Wang JW,Jin XF,Lu K.The influence of laparoscopic resection combined with FOLFOX4 neoadjuvant chemotherapy on serum FAS,Tu M2-PK and T cell subsets in patients with rectal cancer[J].Journal of Clinical and Experimental Medicine,2019,18(9):981-985.doi:10.3969/j.issn.1671-4695.2019.09.026.
[27]李军,吴文凯.奥沙利铂联合卡培他滨在低位进展期直肠癌患者术前新辅助治疗中的应用价值研究[J].结直肠肛门外科,2018,24(5):459-463.Li J,Wu WK.Oxaliplatin combined with capecitabine as preoperative neoadjuvant treatment in advanced low rectal cancer[J].Journal of Colorectal&Anal Surgery,2018,24(5):459-463.
[28]张海洋.新辅助放化疗对腹腔镜直肠癌根治术患者的免疫功能的影响[D].新乡:新乡医学院,2014.Zhang HY.Effects ofimmune function of patients carried out laparoscopic rectal cancer operation by neoadjuvant chemoradiotherapy[D].Xinxiang:Xinxiang Medical University,2014.
[29]罗丽丹,陈海冰,许进勇,等.新辅助放化疗对局部进展期直肠癌保肛术后排便功能的影响[J].现代肿瘤医学,2018,26(8):1232-1236.doi:10.3969/j.issn.1672-4992.2018.08.021.Luo LD,Chen HB,Xu JY,et al.Effect of neoadjuvant radiochemotherapy on defecation function after sphincter preserving surgery for locally advanced rectal cancer[J].Journal of Modern Oncology,2018,26(8):1232-1236.doi:10.3969/j.issn.1672-4992.2018.08.021.
