加速康复外科(enhanced recovery after surgery, ERAS)理念最初由Kehlet等学者提出,旨在整合快速康复元素、维持机体平衡、减少外科应激而促进患者手术后快速康复[1-2]。ERAS的基本原则包括术前宣教、术前禁食、术后早期肠内营养、减少阿片类药物镇痛和静脉输液的使用、减少外科引流管[3]。既往诸多文献[4-5]已证实ERAS可有效缩短成人外科住院时间、减少术后并发症及医疗费用。尽管ERAS在成人外科手术中有积极效果,而ERAS在儿科患儿中应用的安全性、可行性仍有待探讨。2016年Shinnick等[6]回顾了ERAS在儿童中应用的文献,发现目前缺乏儿童ERAS应用的高质量文献,且儿童ERAS的平均干预措施小于 5.6项,远远小于成人的20项。虽然既往研究表明ERAS在儿科患儿中安全有效,但有可能并非全部有效。成人方案中的元素可能适用于儿童,也可能不适合。基于上述考虑,我们制定了儿科特定的ERAS,并探讨其在择期性结直肠手术患儿中的应用效果。
1 资料与方法
1.1 研究对象
回顾分析2012年1月1—2017年5月31日来我院接受择期结肠或直肠手术的9 2 例5 ~1 6 岁儿童的临床资料。其中2012年1月1日—2014年12月31日期间50例患儿未接受ERAS方案为对照组; 2015年1月1日—2017年5月31日42例接受ERAS方案为ERAS组。记录两组患儿的一般临床情况包括年龄、性别、ASA分级,疾病诊断、手术方式、麻醉方式等。
1.2 ERAS 方案
成立儿童结直肠手术ERAS多科协作组,包括外科医生、麻醉师、疼痛专科医师、围手术期责任护士及手术护士在内的多学科团队。坚持以“减少手术应激和并发症,促进患儿手术后快速康复”为ERAS原则,针对儿童结肠手术的特点,利用成人ERAS为模板,参考ERAS在其他外科的成功经验与案例,筛选相关的循证医学证据,制定了“儿童结直肠手术ERAS临床试验知情同意书”、“儿童结直肠手术ERAS临床试验方案”(表1)、“儿童结直肠手术ERAS康复记录单”,建立了儿童结直肠手术ERAS流程规范及评价指标,包括门诊、术前、术中、术后护理、镇痛、麻醉、营养、术后管理等的标准化流程。儿童结直肠手术ERAS旨在解决接受手术治疗的患儿特殊的围手术期需求。
表1 儿童结直肠手术ERAS 临床试验方案

项目 方案门诊或入院初期 告知家长患儿出院标准肠道准备 抗菌素(无口服泻药或机械灌肠):新霉素10 mg/kg,口服3 次/ d,甲硝唑250~500 mg术前禁食与药物 术前2 h 禁食,2 h 前可服用部分含糖饮料 术前3 h 加巴喷丁15 mg/kg 术中 切口前1 h 预防性应用抗生素 腹腔镜技术 不置鼻胃管和吻合口周围引流管 区域麻醉:结肠回肠切除术,结肠切除术,回肠造口还纳术 硬膜外麻醉:J 型袋 最小计量阿片类药物 维持正常体温 维持体液出入量平衡,限制晶体入量,不超过3~4 mg/(kg·h)术后(病房) 术后当天尽早动员患儿活动 麻醉复苏室中早期口服食物并逐步恢复规律饮食 维持液体平衡,限制不必要的药丸 弱阿片类药物镇痛方案 酮咯酸(0.5 mg/kg,最大剂量30 mg)静脉注射,1 次/6 h×72 h 加巴喷丁(10 mg/kg,最大剂量600 mg)口服,1 次/8 h×72 h 对乙酰氨基酚(10 mg/kg,最大剂量650 mg)口服,1 次/6 h 吗啡(0.05 mg/kg 或0.1 mg/kg)静脉注射,1 次/4 h,爆发性疼痛时 氢吗啡酮(0.005 mg/kg 或0.01 mg/kg)静脉注射,1 次/4 h,爆发性疼痛时预防恶心呕吐 恩丹西酮(0.1 mg/kg 或0.15 mg/kg)静脉注射,1 次/8 h肺部锻炼 术后当天鼓励肺活量锻炼
1.3 观察指标
首要观察指标为住院时间,出院标准:⑴ 正常饮食;⑵ 独立运动;⑶ 口服药物可充分镇痛。次要观察指标包括:⑴ 术中液体量;⑵ 麻醉药品用量;⑶ 恢复规律饮食时间;⑷ 并发症发生率;⑸ 30 d再住院率。并发症定义为延长住院时间、需要再次手术、再次入院。本项研究得到了我院伦理委员会批准。
1.4 统计学处理
统计分析采用SPSS 20.0软件包。计量资料以均数±标准差形式(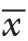 ±s)表示,组间比较采用t检验;计数资料采用率(%)表示,组间比较采用χ2检验。P<0.05认为差异有统计学意义。
±s)表示,组间比较采用t检验;计数资料采用率(%)表示,组间比较采用χ2检验。P<0.05认为差异有统计学意义。
2 结 果
2.1 两组患儿一般临床资料比较
两组在年龄、性别、ASA分级,疾病诊断、手术方式、麻醉方式等方面比较,无统计学差异(P>0.05),两组具有可比性(表2)。
2.2 两组患者临床结果比较
应用ERPS后,ERAS组平均住院天数为(3.26±0.20)d,对照组(4.40±0.35)d,组间差异显著(P=0.000)。次要指标中,ERAS组 术中液体量[(7.59±1.50)m L/(k g·h)v s.(9.15±1.68)mL/(kg·h)]、术中麻醉药量[(0.34±0.06)mg/kg vs.(0.49±0.11)mg/kg]、 术后麻醉药量[(0.1 8±0.0 5)m g/k g v s. (1.2 1±0.1 9)m g/k g]、恢复正常饮食时间[(25.65±3.90)h vs.(51.09±2.51)h]均优于较对照组,组间差异均有统计学意义(均P=0.000);ERAS组并发症发生率为1 9.0%(8/42),包括3例吻合口漏,3 例脱水,1例腹腔内脓肿和1例长期性肠梗阻;对照组并发症发生率为26%(13/50),包括回肠出血3例,6例吻合口漏,2例持续性肠梗阻及2例感染性并发症;并发症发生率和30d再住院率比较,组间差异无统计学意义(P>0.05)(表3)。
表2 两组患儿一般临床资料
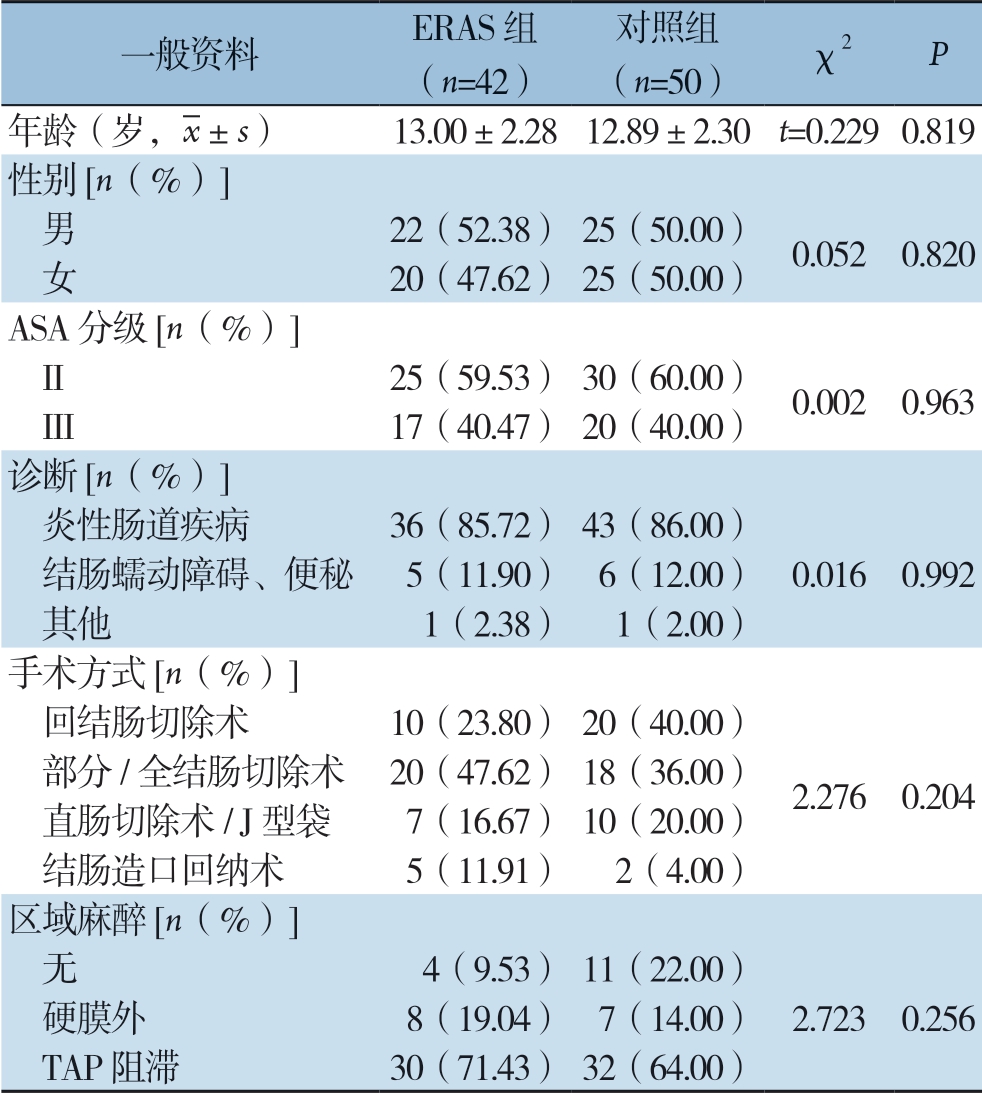
注:SAS:美国麻醉医师协会,TAP:超声引导下腹横肌平面
一般资料 ERAS 组(n=42)对照组(n=50) χ2 P年龄(岁,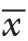 ±s) 13.00±2.28 12.89±2.30 t=0.229 0.819性别[n(%)] 男 22(52.38) 25(50.00) 0.052 0.820 女 20(47.62) 25(50.00)ASA 分级[n(%)] II 25(59.53) 30(60.00) 0.002 0.963 III 17(40.47) 20(40.00)诊断[n(%)] 炎性肠道疾病 36(85.72) 43(86.00) 结肠蠕动障碍、便秘 5(11.90) 6(12.00) 0.016 0.992 其他 1(2.38) 1(2.00)手术方式[n(%)] 回结肠切除术 10(23.80) 20(40.00) 部分/全结肠切除术 20(47.62) 18(36.00) 2.276 0.204 直肠切除术/ J 型袋 7(16.67) 10(20.00) 结肠造口回纳术 5(11.91) 2(4.00)区域麻醉[n(%)] 无 4(9.53) 11(22.00) 硬膜外 8(19.04) 7(14.00) 2.723 0.256 TAP 阻滞 30(71.43) 32(64.00)
±s) 13.00±2.28 12.89±2.30 t=0.229 0.819性别[n(%)] 男 22(52.38) 25(50.00) 0.052 0.820 女 20(47.62) 25(50.00)ASA 分级[n(%)] II 25(59.53) 30(60.00) 0.002 0.963 III 17(40.47) 20(40.00)诊断[n(%)] 炎性肠道疾病 36(85.72) 43(86.00) 结肠蠕动障碍、便秘 5(11.90) 6(12.00) 0.016 0.992 其他 1(2.38) 1(2.00)手术方式[n(%)] 回结肠切除术 10(23.80) 20(40.00) 部分/全结肠切除术 20(47.62) 18(36.00) 2.276 0.204 直肠切除术/ J 型袋 7(16.67) 10(20.00) 结肠造口回纳术 5(11.91) 2(4.00)区域麻醉[n(%)] 无 4(9.53) 11(22.00) 硬膜外 8(19.04) 7(14.00) 2.723 0.256 TAP 阻滞 30(71.43) 32(64.00)
表3 两组临床结果比较
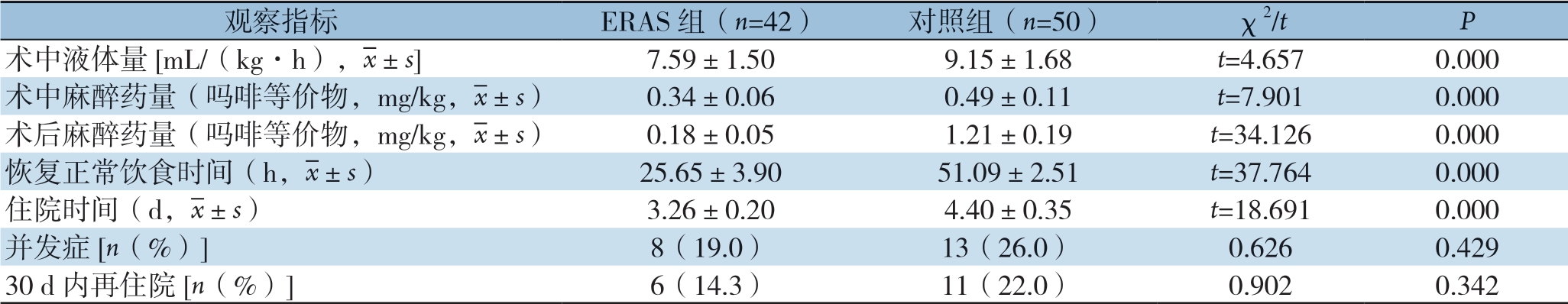
观察指标 ERAS 组(n=42) 对照组(n=50) χ2/t P术中液体量[mL/(kg·h),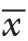 ±s] 7.59±1.50 9.15±1.68 t=4.657 0.000术中麻醉药量(吗啡等价物,mg/kg,
±s] 7.59±1.50 9.15±1.68 t=4.657 0.000术中麻醉药量(吗啡等价物,mg/kg,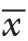 ±s) 0.34±0.06 0.49±0.11 t=7.901 0.000术后麻醉药量(吗啡等价物,mg/kg,
±s) 0.34±0.06 0.49±0.11 t=7.901 0.000术后麻醉药量(吗啡等价物,mg/kg,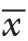 ±s) 0.18±0.05 1.21±0.19 t=34.126 0.000恢复正常饮食时间(h,
±s) 0.18±0.05 1.21±0.19 t=34.126 0.000恢复正常饮食时间(h,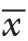 ±s) 25.65±3.90 51.09±2.51 t=37.764 0.000住院时间(d,
±s) 25.65±3.90 51.09±2.51 t=37.764 0.000住院时间(d, ±s) 3.26±0.20 4.40±0.35 t=18.691 0.000并发症[n(%)] 8(19.0) 13(26.0) 0.626 0.429 30 d 内再住院[n(%)] 6(14.3) 11(22.0) 0.902 0.342
±s) 3.26±0.20 4.40±0.35 t=18.691 0.000并发症[n(%)] 8(19.0) 13(26.0) 0.626 0.429 30 d 内再住院[n(%)] 6(14.3) 11(22.0) 0.902 0.342
3 讨 论
通过ERAS标准化围手术期干预措施尽可能的减少了外科手术对机体的压力,成功地促进成人患者术后各项指标更快地恢复到基线水平。笔者制定ERAS方案并在小儿选择性结直肠手术中进行应用,通过回顾性分析发现在实施ERAS后,患儿平均住院日缩短约1 d,且并没有增加术后并发症发生率及再次住院次数。患儿静脉输液、麻醉药品用量、恢复正常饮食时间均比传统围手术期管理更具优势。
ERAS的目标是减少外科手术对机体造成的生理压力,进而降低并发症、促进快速康复,从而达到缩短住院周期的目的。通过缩短住院周期可同步增加床位利用率、减少医疗费用的支出[7-8]。然而缩短住院周期理论上可能会导致再次入院率的增加,因为提早出院可能会导致患者在家中出现并发症。但成人ERAS证实结果并非如理论所预测[2]。本研究结果也表明,不管是术后并发症发生率还是再次入院次数,实施ERAS后患儿此两项指标值均未较传统管理有增加趋势。同时该结果也表明了我们ERAS方案的可行性、安全性。
截止目前,仍然缺乏全面的研究儿童ERAS的实施方案,但现有文献综述中的几个单独元素的安全性和有效性已被小儿外科证实,包括局部和非阿片类镇痛药的使用、不使用机械性肠道准备、使用地塞米松或昂丹司琼预防术后恶心呕吐、早期活动、早期肠内营养、不留置尿管[9-15]。此外,围手术期液体负荷也被认为是增加机体应激的一个因素[16]。其他ERAS元素,包括消除常规鼻饲管、预防术中体温过低。总的来说,我们的方案纳入了上述元素,其理论基础是可以被普遍接受的。
研究[17-20]认为,在小儿加速康复外科诊疗中,术前医护人员与患儿及家属的充分交流沟通,包括对诊疗程序、可能出现的围手术期不适和术后并发症进行充分告知,并取得患儿及家属的理解与信任,有助于患儿家属主动积极的参与配合护理,从而对患儿康复有利。通过实践,我们发现在进行了充分沟通后ERAS的实施过程中患儿及家属的配合度
虽然本研究结果显示ERAS方案在儿童结直肠手术中的积极性,但限于样本量,进一步的研究是必要的。我们希望未来能够在有多家机构参与下,以前瞻性研究的方式制定更为精细的儿童ERAS方案。未来的小儿加速康复,需要类似于成人成熟的ERAS方案,因此这也是我们以后探究的方向。另外,我们ERAS的方案是否能够延续到低龄儿童,甚至婴儿或新生儿仍是未知数,有待今后进一步深入研究。
[1] 汤建燕, 邬叶锋, 程邦君, 等. 加速康复外科在胃肠外科围手术期应用进展[J]. 中国普通外科杂志, 2013, 22(4):498-501. doi:10.7659/j.issn.1005-6947.2013.04.023. Tang JY, Wu YF, Cheng BJ, et al. Use of fast track surgery concept in perioperative management in gastrointestinal surgery[J]. Chinese Journal of General Surgery, 22(4):498-501. doi:10.7659/j.issn.1005-6947.2013.04.023.
[2] Nelson G, Kiyang LN, Crumley ET, et al. Implementation of Enhanced Recovery After Surgery (ERAS) Across a Provincial Healthcare System: The ERAS Alberta Colorectal Surgery Experience[J]. World J Surg, 2016, 40(5):1092-1103. doi: 10.1007/s00268-016-3472-7.
[3] Kehlet H, Wilmore DW. Evidence-based surgical care and the evolution of fast-track surgery[J]. Ann Surg, 2008, 248(2):189-198. doi: 10.1097/SLA.0b013e31817f2c1a.
[4] 严莲, 宋美璇, 李飞, 等. 加速康复外科对结直肠癌患者围术期炎症反应与免疫功能影响的Meta分析[J]. 中国普通外科杂志, 2018, 27(4):474-487. doi:10.3978/j.issn.1005-6947.2018.04.013. Yan L, Song MX, Li F, et al. Impact of enhanced recovery after surgery on perioperative inflammatory responses and immune function in colorectal cancer patients: a Meta-analysis[J]. Chinese Journal of General Surgery, 2018, 27(4):474-487. doi:10.3978/j.issn.1005-6947.2018.04.013.
[5] Thiele RH, Rea KM, Turrentine FE, et al. Standardization of care: impact of an enhanced recovery protocol on length of stay, complications, and direct costs after colorectal surgery[J]. J Am Coll Surg, 2015, 220(4):430-443. doi: 10.1016/j.jamcollsurg.2014.12.042.
[6] Shinnick JK, Short HL, Heiss KF, et al. Enhancing recovery in pediatric surgery: a review of the literature[J]. J Surg Res, 2016, 202(1):165-176. doi: 10.1016/j.jss.2015.12.051.
[7] Adamina M, Kehlet H, Tomlinson GA, et al. Enhanced recovery pathways optimize health outcomes and resource utilization: a metaanalysis of randomized controlled trials in colorectal surgery[J]. Surgery, 2011, 149(6):830-840. doi: 10.1016/j.surg.2010.11.003.
[8] Roulin D, Donadini A, Gander S, et al. Cost-effectiveness of the implementation of an enhanced recovery protocol for colorectal surgery[J]. Br J Surg, 2013, 100(8):1108-1114. doi: 10.1002/bjs.9184.
[9] Goeller JK, Bhalla T, Tobias JD. Combined use of neuraxial and general anesthesia during major abdominal procedures in neonates and infants[J]. Paediatr Anaesth, 2014, 24(6):553-560. doi: 10.1111/pan.12384.
[10] Solanki NM, Engineer SR, Jansari DB, et al. Comparison of caudal tramadol versus caudal fentanyl with bupivacaine for prolongation of postoperative analgesia in pediatric patients[J]. Saudi J Anaesth, 2016, 10(2):154-160. doi: 10.4103/1658-354X.168807.
[11] Serrurier K, Liu J, Breckler F, et al. A multicenter evaluation of the role of mechanical bowel preparation in pediatric colostomy takedown[J]. J Pediatr Surg, 2012, 47(1):190-193. doi: 10.1016/j.jpedsurg.2011.10.044.
[12] Leys CM, Austin MT, Pietsch JB, et al. Elective intestinal operations in infants and children without mechanical bowel preparation: a pilot study[J]. J Pediatr Surg, 2005, 40(6):978-981. doi: 10.1016/j.jpedsurg.2005.03.013.
[13] Patel RI, Verghese ST, Hannallah RS, et al. Fast-tracking children after ambulatory surgery[J]. Anesth Analg, 2001, 92(4):918-922.
[14] Thomas P, Knott EM, Sharp NE, et al. Implications of Foley catheterization in children with perforated appendicitis[J]. J Surg Res, 2013, 184(1):337-340. doi: 10.1016/j.jss.2013.05.026.
[15] Phillips RS, Gopaul S, Gibson F, et al. Antiemetic medication for prevention and treatment of chemotherapy-induced nausea and vomiting in childhood[J]. Cochrane Database Syst Rev, 2010, (9):CD007786. doi: 10.1002/14651858.CD007786.
[16] Hassinger AB, Wald EL, Goodman DM. Early postoperative fluid overload precedes acute kidney injury and is associated with higher morbidity in pediatric cardiac surgery patients[J]. Pediatr Crit Care Med, 2014, 15(2):131-138. doi: 10.1097/PCC.0000000000000043.
[17] Pearson KL, Hall NJ. What is the role of enhanced recovery after surgery in children? A scoping review[J]. Pediatr Surg Int, 2017, 33(1):43-51. doi: 10.1007/s00383-016-3986-y.
[18] Williams G, Bell G, Buys J, et al. The prevalence of pain at home and its consequences in children following two types of short stay surgery: a multicenter observational cohort study[J]. Paediatr Anaesth, 2015, 25(12):1254-1263. doi: 10.1111/pan.12749.
[19] Sunitha Suresh BS, De Oliveira GS Jr, Suresh S. The effect of audio therapy to treat postoperative pain in children undergoing major surgery: a randomized controlled trial[J]. Pediatr Surg Int, 2015, 31(2):197-201. doi: 10.1007/s00383-014-3649-9.
[20] Fortier MA, Kain ZN. Treating perioperative anxiety and pain in children: a tailored and innovative approach[J]. Paediatr Anaesth, 2015, 25(1):27-35. doi: 10.1111/pan.12546.
