中国在2016年发布的统计数据显示,2009—2011年我国胃癌的发病率为679.1(1/10万),男性高于女性,居恶性肿瘤发病率第2位[1-2]。大多胃癌的患者早期症状不明显,一经确诊大都处于中晚期。对于II期及III期的患者,即使经过D2手术切除及辅助治疗后,复发转移风险依然很高[3-5]。
纳武利尤单抗是一种人IgG4单克隆抗体,可以阻断PD-1与其配体PD-L1结合,恢复T细胞活化及产生细胞因子的功能,进而达到抗肿瘤的作用[6],已被证实在非小细胞肺癌、肾癌、头颈部鳞癌、黑色素瘤等多种癌症中有良好效果[7-12]。近期,纳武利尤单抗对比安慰剂在化疗失败后的晚期进展期胃癌患者中的随机双盲III期临床试验ATTRACTION-2数据证实,与安慰剂(生理盐水)相比,纳武利尤单抗的中位总生存(OS)时间延长1.12个月、中位无进展生存(PFS)时间延长0.16个月,均优于安慰剂组[13]。基于这项实验的结果,纳武利尤单抗在日本被批准用于化疗后进展的、不可切除的晚期复发性胃癌。
2018年6月15日,纳武利尤单抗在中国获得了国家食品药品监督总局(CFDA)的批准上市,然而,尽管纳武利尤单抗为晚期胃癌患者带来更长的生存获益,其高昂的价格也对患者家庭及社会造成了极大的经济负担,如何合理有效地使用有限的医疗卫生资源是纳武利尤单抗上市后亟待解决的问题。对其进行药物经济学评价将成为上市后续患者援助项目(Patient Assistance Program,PAP)、医疗决策等参考的重要手段[14-15]。因此,本研究将从中国医疗保障角度出发,以经济学为理论基础,构建Markov模型评价纳武利尤单抗在化疗失败的进展期晚期胃癌患者中的成本效果性。
1 资料与方法
1.1 患者及分组
患者来源于以亚洲人群为主要研究对象的ATTRACTION-2临床试验[13]。试验随机将符合条件的493例患者随机分为两组,分别接受纳武利尤单抗治疗和安慰剂(生理盐水)治疗(纳武利尤单抗组330例,安慰剂组163例):每2周接受3 mg/kg的纳武利尤单抗或相同剂量的安慰剂治疗,每6周视为1个治疗周期,直至病情进展。根据RECIST 1.1标准在每个治疗周期进行1次CT或MRI检查进行疗效评估。两种组进展后的治疗方案根据ATTRACTION-2临床试验数据进行模拟,疗效及不良反应的评估是按照每两个治疗周期进行1次CT或MRI检查。
1.2 模型结构
运用TreeAge Pro 2011软件建立Markov模型,用来模拟晚期胃癌患者的疾病发展过程。模型分为纳武利尤单抗及安慰剂两个治疗组,并根据PD-L1的表达分亚组进行分析:PD-L1表达≥1%的患者定义为PD-L1阳性组;PD-L1表达<1%的患者定义为PD-L1阴性组。分析每组的总成本值,生命年(life years,LY)以及质量调整寿命年(quality adjusted life years,QALY),计算出组间的成本差异(ΔC)以及效用值的差异ΔE,从而根据公式最终计算得到增量成本效果比值(incremental cost-effectiveness ratio,ICER,ICER=ΔC/ΔE)。
根据晚期胃癌的疾病进展规律,将患者的疾病划分为3个状态,分别为PFS状态,进展(PD)状态以及死亡状态(图1)。综合考虑给药时间、治疗周期以及疗效评估的时间,将模型的周期定为6周,总模拟时间长度为10年,以确保所有患者在模型运行结束后大都处于死亡状态,从而模拟晚期胃癌疾病进展的全过程。
1.3 转移概率的计算
模拟各状态之间的转移概率所用的生存曲线来自ATTRACTION-2临床试验数据并通过数学模型拟合的方式对其进行模拟及扩展。首先,运用取点软件Get Data Graph Digitizer(Version 2.25)对临床试验中Kaplan-Meier生存曲线进行取点,然后将其运用于胃癌生存模型的模拟中。采用Weibull分布对晚期胃癌患者进行生存模拟,因为其具有灵活性,被广泛的应用于癌症的生存模型的模拟中。参考Hoyle等[16]的研究,运用R软件来实现对临床试验中所有生存曲线的Weibull拟合,得到两个参数Shape(γ)和Scale(λ)(表1),并基于这两个参数得到转移概率。具体方法如下:如果将t周期的OS设为S(t),那么可将特定的t周期的死亡转移概率(M)表示为:![]() 那么,S(t)又可以表示为:S(t)=exp(-λtγ)(λ>0;γ>0)。最终,可以在Markov模型中将每个周期的死亡转移概率表示为:1-exp[Scale*(_stage)^Shape-Scale*(_stage+1)^Shape](_stage表示Markov周期)。用同样的方法,可以分别对两治疗组的PFS曲线进行Weibull拟合。
那么,S(t)又可以表示为:S(t)=exp(-λtγ)(λ>0;γ>0)。最终,可以在Markov模型中将每个周期的死亡转移概率表示为:1-exp[Scale*(_stage)^Shape-Scale*(_stage+1)^Shape](_stage表示Markov周期)。用同样的方法,可以分别对两治疗组的PFS曲线进行Weibull拟合。
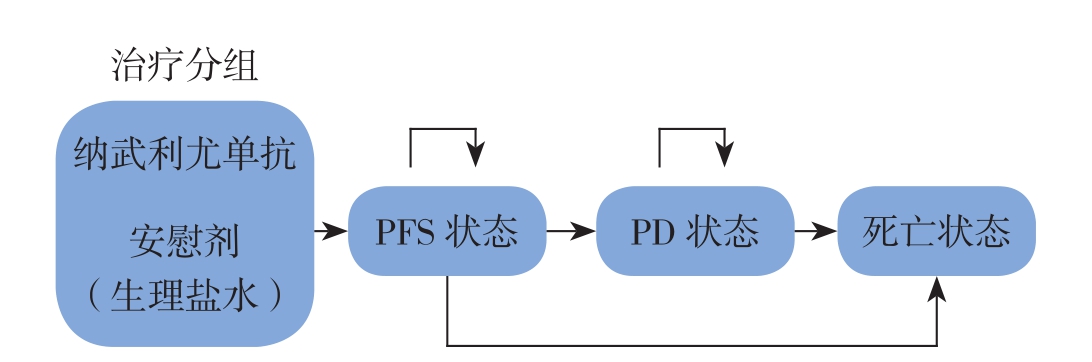
图1 模拟晚期胃癌的疾病进展过程的Markov模型
Figure1 Markov model illustrating the development process of advanced gastric cancer
表1 两种治疗方式PFS曲线以及OS曲线Weibull模拟的参数
Table1 Parameters of Weibull simulation for PSF and OS curves of the two treatment methods

参数 Shape(γ)[均值(标准误)]Scale(λ)[均值(标准误)]调整系数PFS纳武利尤单抗 0.74549(0.04571) 0.57724(0.03623) 0.9915248安慰剂 0.96599(0.06695) 0.80375(0.04080) 0.9959020 OS(PD-L1阳性)纳武利尤单抗 1.55567(0.17189) 0.09382(0.02450) 0.9761401安慰剂 1.59670(0.25196) 0.17079(0.05012) 0.9818404 OS(PD-L1阴性)纳武利尤单抗 0.96877(0.05530) 0.15368(0.01685) 0.9850142安慰剂 0.87869(0.05137) 0.25470(0.02386) 0.9878451
1.4 成本和效用值
本研究中国医疗保障的角度出发,计算直接医疗成本。直接医疗成本主要包括药品的费用、给药成本、不良反应的处理以及相关检查的成本。给药的方案参考临床试验数据,参照中国人的平均体质量60 kg来计算给药的剂量。纳武利尤单抗的价格采用在中国上市的价格。不良反应的成本引用自Chongqing等[17]发表的基于中国角度出发的成本效果分析的文章。不良反应的发生率引用临床试验的数据,且仅计算了3级以及3级以上的严重的需要住院处理的不良反应(表2)[18]。随访的费用包括CT或MRI及实验室检查的费用,随访的方案为每6周进行1次CT或MRI检查,共10次,之后每12周进行1次检查直至病情进展。实验室检查为每个给药周期1次。其费用均来源于国内大型三甲医院。进展后的用药方案及随访方案均引用临床试验的数据。
晚期胃癌PFS及PD状态的效用值分别为0.797和0.577,数据参考Chen等[19]已经发表的文章(表2)。根据中国药物经济学指南采用3%的贴现率;意愿支付值(WTP)为3倍的人均国内生产总值(GDP)值(178980元),人均GDP的值来自国家统计局发表的2017年的数据为59660元(8836美元)[20]。
表2 成本、效用值以及不良反应发生率的参数值及其分布
Table2 Values and distributions of costs,utilities and risks of adverse events

注:1)假设范围波动在均值±20%;2)假设范围波动在均值±50%
Note:1) Assumed vary in range ±20%; 2) Assumed vary in range±50%
参数 平均值 范围 分布单位成本(元/周期)纳武利尤单抗1) 5532644260.8~66391.2对数正态分布生理盐水 15 9~21 对数正态分布给药及住院费 402 321~495 对数正态分布支持治疗 29385 21234~41967 对数正态分布实验室检查1) 1410 1128~1692 对数正态分布影像学检查2) 800 400~1200 γ分布主要不良反应成本(3、4级)(元)乏力、食欲下降 767 690~844 对数正态分布腹泻 295 190~363 对数正态分布纳武利尤单抗组不良反应发生率(3、4级)(元)乏力、食欲下降 0.02 0.016~0.024 β分布腹泻 0.01 0.008~0.012 β分布安慰剂组不良反应发生率(3、4级)(元)乏力、食欲下降 0.02 0.016~0.024 β分布腹泻 0 0 β分布效用值PFS状态 0.797 0.638~0.956 β分布PD状态 0.577 0.462~0.692 β分布
1.5 敏感度分析
模型的稳定性通过一元敏感度和概率敏感度来检验。一元敏感度分析比较13个参数,其结果用龙卷风图表示。概率敏感度分析将各参数在所建立的模型中以蒙托卡罗模拟的方法将模型运行1000次。结果以散点图和成本效果可接受曲线的形式表示。敏感度分析所用到的参数变化范围及特征分布见表2。
2 结 果
2.1 基线结果
在Markov模型运行10年后显示,纳武利尤单抗组以及安慰剂组患者几乎全部处于死亡状态。在基线结果中统计并展示了两种治疗方案及根据PD-L1的表达状态分类的亚组在无进展及进展状态的成本、总成本、LY、QALY、增量成本值、增量效果值以及ICER,结果显示在表格中(表3)。对于PD-L1阳性的患者,接受纳武利尤单抗治疗总体的健康产出值为0.357 QALY(0.526 LY),总成本为221171元;接受安慰剂治疗的患者总体的健康产值为0.251 QALY(0.368 LY),总成本为40866元,由此得到纳武利尤单抗组相比安慰剂组的ICER值为1700991元/QALY。对于PD-L1阴性的患者,接受纳武利尤单抗治疗总体的健康产出值为0.545 QALY(0.845 LY),总成本为333195元;接受安慰剂治疗的患者总体的健康产出值为0.403 QALY(0.63 LY),总成本为90285元,由此得到纳武利尤单抗组相比安慰剂组的ICER值为1710634元/QALY。
表3 基线结果
Table3 Baseline results

参数 PD-L1阳性组 PD-L1阴性组纳武利尤单抗 安慰剂 纳武利尤单抗 安慰剂每周期PFS状态的成本(元) 57594 2641 57594 2641每周期PD状态的成本(元) 39537 21678 39537 21678总成本(元) 221171 40866 333195 90285总LY 0.526 0.368 0.845 0.630 QALY 0.357 0.251 0.545 0.403增量成本值(元) 180305 — 242,910 —增量LY 0.158 — 0.215 —增量QALY 0.106 — 0.142 —ICER(元/LY) 1141170 — 1129814 ICER(元/QALY) 1700991 — 1710634
2.2 敏感度分析结果
一元敏感度分析的结果用龙卷风图的形式表示(图2)。从图中可以看出,纳武利尤单抗的价格是对结果ICER值影响最大的变量;PD-L1阳性组中(图2A),当使用纳武利尤单抗治疗2周的价格在14753.6~22130.4元范围变化时,ICER值随之在1388949~2018025元/QALY的范围变化;同时PD-L1阴性组中(图2B),当使用纳武利尤单抗治疗2周的价格在14753.6~22130.4元范围变化时,ICER值随之在1388204~2033049元/QALY的范围变化。此外,PD状态的效用值、PFS状态的效用值均为对结果影响较大的参数。但各项参数在规定的范围内波动时,其ICER值始终大于WTP(178980元)。

图2 一元敏感度分析龙卷风图 A:PD-L1阳性组;B:PD-L1阴性组
Figure2 Tornado diagram of one-way sensitivity analysis A: PD-L1 positive group; B: PD-L1 negative group
概率敏感度分析散点图显示,所有的点所代表的ICER值均高于WTP值,无论对于PD-L1阳性还是PD-L1阴性的患者,使用纳武利尤单抗治疗均不具有成本效果性(图3)。从概率敏感度分析可接受曲线图中可以看出,PD-L1阳性组中,当WTP>1691500元时,纳武利尤单抗相比安慰剂是更具有成本效果性的(图4A);在PD-L1阴性组中,当WTP>1789800元时,纳武利尤单抗相比安慰剂更具有成本效果性(图4B)。
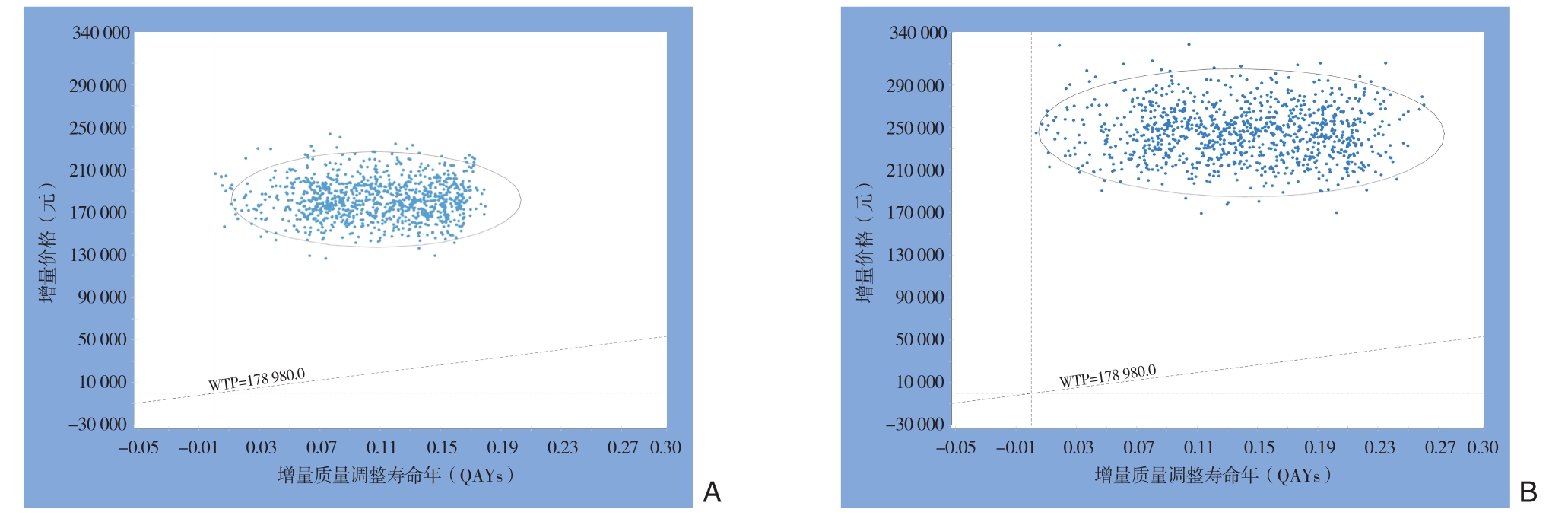
图3 概率敏感度分析结果图(斜虚线代表中国的WTP值;椭圆表示95%的范围) A:PD-L1阳性组;B:PD-L1阴性组
Figure3 The results of probabilistic sensitivity analysis (the diagonal dotted line representing the WTP threshold in China; the ellipses representing the range of 95% distribution) A: PD-L1 positive group; B: PD-L1 negative group

图4 成本效果的可接受曲线图,在不同的WTP值下的优势策略 A:PD-L1阳性组;B:PD-L1阴性组
Figure4 Acceptability curves of cost-effectiveness,and dominant strategy at different WTP thresholds A: PD-L1 positive group;B: PD-L1 negative group
3 讨 论
胃癌在我国发病率高,目前胃癌的早期诊断率平均只有10%左右,致使我国进展期、晚期胃癌患者比例大[21-23]。然而由于晚期胃癌预后相对较差,疗效欠佳,加之高昂的医疗费用,已发表的文献显示许多新药物在没有医保报销和慈善援助的情况下几乎没有成本效果性[24-25]。Chen等[19]结合中国的国情进行了阿帕替尼在晚期胃癌患者中的成本效果分析研究,结果显示阿帕替尼不具有成本效果性:ICER=90154美元/QALY;WTP=23700美元/QALY。随即,阿帕替尼在中国开展了相应的PAP,Bai等[26]考虑了阿帕替尼的援助计划后研究结果表明阿帕替尼具有成本效果性:ICER=21132美元/QALY;WTP=22200美元/QALY。
今年,纳武利尤单抗率先通过了CFDA的批准成为中国大陆地区第一个获批的免疫治疗药物,上市后的售价也是远远低于美国、香港及日本地区。然而,结合中国的国情,免疫治疗仍然给患者及社会资源带来了一定的负担。为了提高纳武利尤单抗在中国上市后的可及性、公平性,使其发挥更大的社会价值,改善医药卫生资源的配置效率,为临床医生的决策提供参考,笔者规范的使用药物经济学评价的方法,从中国的国情出发来评价纳武利尤单抗的成本效果性。
本研究建立了一个基于ATTRACTION-2临床实验数据的Markov模型来模拟晚期胃癌患者疾病的整个过程,通过输入成本、效果等参数运算得出纳武利尤单抗对比安慰剂的成本效果性。根据临床试验的设计及PD-L1表达量对其进行亚组分析。从模型运行的基线结果看,PD-L1阳性患者中,纳武利尤单抗的治疗增加了0.106 QALY的健康产出,但同时增加了180305元的经济负担;PD-L1阴性患者中,纳武利尤单抗的治疗增加了0.142 QALY的健康产出,同时增加242910元的经济负担,得出两个亚组的ICER值差别并不大。换句话说,PD-L1是否阳性并不是影响其成本效果性的主要原因。此外,基线结果提示PD-L1阳性的两组患者的健康产出均低于PD-L1阴性组,且与临床试验数据相吻合,进一步验证了模型的准确性。结合临床试验的结果可以得出PD-L1的高表达可能提示预后相对较差,但对于纳武利尤单抗疗效的影响较小,因此FDA批准纳武利尤单抗应用于化疗失败的进展期晚期胃癌患者时,没有限定PD-L1阳性的条件。
一元敏感度分析的结果表明,两个亚组中,影响模型运算结果的最主要的因素是纳武利尤单抗药物的价格。但是在每一个变量的变化范围内,ICER值均高于WTP值,对最终的结论并没有影响,这也证明了本研究模型的稳定性。纳武利尤单抗药物的成本远远高于安慰剂,是导致其不具有成本效果性的主要原因。既往研究[26]表明阿帕替尼的PAP使患者所负担的药物成本降低,从而使其具有了一定的经济性优势。同样的,纳武利尤单抗在中国上市后也可以通过积极实施PAP,纳入医保报销等措施来降低患者的经济负担,从而增加纳武利尤单抗的推广率及经济性。概率敏感度分析得到的可接受曲线提示基于当前的中国基本国情即WTP值为178980元时,纳武利尤单抗是没有成本效果性的。但是,少数经济发达的地区以及少数高收入人群的意愿支付值高于平均水平,为了获得更佳的治疗疗效,也推荐其使用纳武利尤单抗进行治疗。
本研究也存在一些局限性。首先,与大多数的成本效果研究一样,本研究基于已经发表的临床试验数据进行建模,而不是前瞻性的收集数据,然而,这种方法的好处是数据量大且规范性适用性更优。第二,本模型中应用的健康效用估计虽然来源于以前发表的晚期胃癌药物经济模型,但仍有可能无法准确的反映当前模型中的假设人群。第三,虽然尽可能准确的模拟真实的临床情况,但仍无法全面的模拟。免疫治疗的疗效评估也存在一定特殊性,假性进展、新发病灶、延期效应等都是免疫治疗的特殊现象,而ATTRACTION-2试验采用的仍是实体瘤常用的RECIST标准,或许会对结果有一定的影响。最后,在本研究中没有纳入肿瘤突变负荷(TMB)、微卫星不稳定性(MSI)的状态和检测,主要是因为缺乏相关的研究数据,而且对于这类检测以及状态对纳武利尤单抗疗效的影响缺乏统一的标准。随着相关研究的深入,后续的研究也会将更多影响因素纳入构建模型。
[1]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.doi:10.3322/caac.21338.
[2]Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide: Sources,methods and major patterns in globocan 2012[J].Int J Cancer,2015,136(5):E359-386.doi:10.1002/ijc.29210.
[3]Noh SH,Park SR,Yang HK,et al.Adjuvant capecitabine plus oxaliplatin for gastric cancer after d2 gastrectomy (classic):5-year follow-up of an open-label,randomised phase 3 trial[J].Lancet Oncol,2014,15(12):1389-1396.doi:10.1016/S1470-2045(14)70473-5.
[4]阴法文,尚磊,张传宝,等.进展期胃癌患者全胃切除D2淋巴结清扫微创手术效果研究[J].中国普通外科杂志,2015,24(11):1636-1639.doi:10.3978/j.issn.1005-6947.2015.11.029.Yin FW,Shang L,Zhang CB.Effect of minimally invasive total gastrectomy and D2 lymph nodes dissection for advanced gastric cancer[J].Chinese Journal of General Surgery,2015,24(11):1636-1639.doi:10.3978/j.issn.1005-6947.2015.11.029.
[5]Cunningham SC,Kamangar F,Kim MP,et al.Survival after gastric adenocarcinoma resection: eighteen-year experience at a single institution[J].J Gastrointest Surg,2005,9(5):718-725.doi:10.1016/j.gassur.2004.12.002.
[6]Sharma P,Allison JP.Immune checkpoint targeting in cancer therapy: Toward combination strategies with curative potential[J].Cell,2015,161(2):205-214.doi:10.1016/j.cell.2015.03.030.
[7]Motzer RJ,Escudier B,McDermott DF,et al.Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma[J].N Engl J Med,2015,373(19):1803-1813.doi:10.1056/NEJMoa1510665.
[8]Janjigian YY,Bendell J,Calvo E,et al.CheckMate-032 Study:Efficacy and Safety of Nivolumab and Nivolumab Plus Ipilimumab in Patients With Metastatic Esophagogastric Cancer[J].J Clin Oncol,2018,36(28):2836-2844.doi:10.1200/JCO.2017.76.6212.
[9]Shitara K,Ozguroglu M,Bang YJ,et al.Pembrolizumab versus paclitaxel for previously treated,advanced gastric or gastrooesophageal junction cancer (keynote-061): A randomised,openlabel,controlled,phase 3 trial[J].Lancet,2018,392(10142):123-133.doi:10.1016/S0140-6736(18)31257-1.
[10]Ferris RL,Blumenschein G Jr,Fayette J,et al.Nivolumab for Recurrent Squamous-Cell Carcinoma of the Head and Neck[J].N Engl J Med,2016,375(19):1856-1867.doi:10.1056/NEJMoa1602252.
[11]Larkin J,Chiarion-Sileni V,Gonzalez R,et al.Combined Nivolumab and Ipilimumab or Monotherapy in Untreated Melanoma[J].N Engl J Med,2015,373(1):23-34.doi:10.1056/NEJMoa1504030.
[12]Borghaei H,Paz-Ares L,Horn L,et al.Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer[J].N Engl J Med,2015,373(17):1627-1639.doi:10.1056/NEJMoa1507643.
[13]Kang YK,Boku N,Satoh T,et al.Nivolumab in patients with advanced gastric or gastro-oesophageal junction cancer refractory to,or intolerant of,at least two previous chemotherapy regimens(ono-4538-12,attraction-2): A randomised,double-blind,placebocontrolled,phase 3 trial[J].Lancet,2017,390(10111):2461-2471.doi:10.1016/S0140-6736(17)31827-5.
[14]Cho SK,Hay JW,Barzi A.Cost-effectiveness analysis of regorafenib and tas-102 in refractory metastatic colorectal cancer in the united states[J].Clin Colorectal Cancer,2018,17(4):e751-761.doi:10.1016/j.clcc.2018.08.003.
[15]Shah-Manek B,Galanto JS,Nguyen H,et al.Value Frameworks for the Patient-Provider Interaction: A Comparison of the ASCO Value Framework Versus NCCN Evidence Blocks in Determining Value in Oncology[J].J Manag Care Spec Pharm,2017,23(6-a Suppl):S13-20.doi:10.18553/jmcp.2017.23.6-a.s13.
[16]Hoyle MW,Henley W.Improved curve fits to summary survival data: Application to economic evaluation of health technologies[J].BMC Med Res Methodol,2011,11:139.doi:10.1186/1471-2288-11-139.
[17]Chongqing T,Liubao P,Xiaohui Z,et al.Cost-utility analysis of the newly recommended adjuvant chemotherapy for resectable gastric cancer patients in the 2011 chinese national comprehensive cancer network (nccn) clinical practice guidelines in oncology: Gastric cancer[J].Pharmacoeconomics,2014,32(3):235-243.doi:10.1007/s40273-013-0065-2.
[18]Carlson JJ,Garrison LP,Ramsey SD,et al.The potential clinical and economic outcomes of pharmacogenomic approaches to egfr-tyrosine kinase inhibitor therapy in non-small-cell lung cancer[J].Value Health,2009,12(1):20-27.doi:10.1111/j.1524-4733.2008.00415.x.
[19]Chen HD,Zhou J,Wen F,et al.Cost-effectiveness analysis of apatinib treatment for chemotherapy-refractory advanced gastric cancer[J].J Cancer Res Clin Oncol,2017,143(2):361-368.doi:10.1007/s00432-016-2296-z.
[20]中华人民共和国国家统计局.中华人民共和国2017年国民经济和社会发展统计公报[EB].2018-2-28,http://www.stats.gov.cn/tjsj/zxfb/201802/t20180228_1585631.html.National Bureau of statistics of the People's Republic of China.Statistical bulletin of national economic and social development in China (2017)[EB].2018-2-28,http://www.stats.gov.cn/tjsj/zxfb/201802/t20180228_1585631.html.
[21]陈冠阳,陈子华,袁伟杰,等.肝X受体α与蛋白酶体激活因子28γ在胃癌中的表达及其对胃癌细胞生长的影响[J].中国普通外科杂志,2018,27(10):1295-1303.doi:10.7659/j.issn.1005-6947.2018.10.012.Chen GY,Chen ZH,Yuan WJ,et al.Expressions of liver X receptor α and proteasome activator 28γ in gastric cancer and their effects on growth of gastric cancer cells[J].Chinese Journal of General Surgery,2018,27(10):1295-1303.doi:10.7659/j.issn.1005-6947.2018.10.012.
[22]徐宏智,曾家耀,吴卫.胃癌肝转移的外科治疗研究新进展[J].中国普通外科杂志,2016,25(10):1500-1505.doi:10.3978/j.issn.1005-6947.2016.10.022.Xu HZ,Zeng JY,Wu W.Surgical treatment of gastric cancer liver metastasis: recent research progress[J].Chinese Journal of General Surgery,2016,25(10):1500-1505.doi:10.3978/j.issn.1005-6947.2016.10.022
[23]沈华,黄进,胡华斌,等.改良DCF方案一线治疗晚期胃癌患者的临床观察[J].中国普通外科杂志,2013,22(10):1266-1270.doi:10.7659/j.issn.1005-6947.2013.10.007.Shen H,Huang J,Hu HB,et al.Clinical observation of modif ed DCF regimen for f rst-line treatment of advanced stomach cancer[J].Chinese Journal of General Surgery,2013,22(10):1266-1270.doi:10.7659/j.issn.1005-6947.2013.10.007.
[24]Wu B,Gu X,Zhang Q.Cost-effectiveness of osimertinib for EGFR mutation-positive non-small cell lung cancer after progression following first-line EGFR tki therapy[J].J Thorac Oncol,2018,13(2):184-193.doi:10.1016/j.jtho.2017.10.012.
[25]Wan XM,Peng LB,Ma JA,et al.Economic evaluation of nivolumab as a second-line treatment for advanced renal cell carcinoma from us and chinese perspectives[J].Cancer,2017,123(14):2634-2641.doi:10.1002/cncr.30666.
[26]Bai Y,Xu Y,Wu B.Cost-effectiveness and budget impact analysis of apatinib for advanced metastatic gastric cancer from the perspective of health insurance system[J].Gastroenterol Res Pract,2017,2017:2816737.doi: 10.1155/2017/2816737.
