直肠癌是一种发病率和病死率都很高的恶性疾病。目前治疗直肠癌首选的方式仍然是外科手术,微创手术则是更为普遍的手术方式。治疗直肠癌的微创手术主要包括机器人辅助直肠癌手术(robot-assisted proctectomy,RP)和传统的腹腔镜直肠癌手术(laparoscopic proctectomy,LP)。
自腹腔镜技术引入结直肠外科领域以后就得到广泛的应用[1]。 但近年来研究表明腹腔镜技术也有一些不足:腹腔镜的镜头不稳定、二维平面视野、手术器材转换角度受限制、触觉反馈消失等[2-3]。这些不足在狭窄的盆腔手术中显得较为突出。机器人辅助系统的引入克服了传统腹腔镜的一些缺点,尤其是在低位直肠切除术中体现的更加明显。机器人手术具有良好的手眼协调性,更高的精准度,三维视野以及活动范围广泛等优势[4-6]。这些优势 使机器人在直肠癌手术中的操作更灵活、更稳定[7-9]。近年来,RP在直肠癌手术中越来越普及。
已有部分Meta分析[10-11]对RP与LP的围手术期疗效和安全性进行了比较,其中一个纳入的是非随机对照研究,另一个纳入的随机对照试验但样本量较小。由于各种偏倚风险的存在,其检验效能不足,对结果的解释存在差异。机器人辅助技术在直肠癌中的应用仍存争议。因此,本研究通过纳入机器人辅助腔镜对比传统腹腔镜治疗直肠癌患者的随机对照试验,系统评价RP的围手术期及预后的疗效和安全性,得出可靠的结论,为临床实践提供可靠的依据。
1 资料与方法
1.1 检索策略
计算机检索Pubmed、Cochrane Library(2018年3期)、EMBASE、CBM、CNKI及万方数据库。搜索关于比较RP与LP的安全性和有效性的随机对照试验。中文检索词包括:直肠肿瘤、直肠癌、机器人、机器人辅助、直肠切除术、腹腔镜;英文检索词包括:Rectal Carcinoma,Rectal Cancer,Rectal Neoplasms,Proctectomy,Robotic,Robotic-assisted Surgery,Laparoscopic Proctectomy。所有检索采取主题词和自由词相结合方式进行检索,检索年限为各数据库建库至2018年3月28日。对获得的文献进一步追踪检索。
1.2 纳入与排除标准
纳入标准:⑴ 所有患者术前均经肠镜检查后证实是直肠癌患者并行直肠癌根治术,患者的性别、年龄、种族、国别不限;⑵ 所有研究是随机对照试验且比较了机器人辅助与腹腔镜直肠癌手术的有效性和安全性;⑶ 对重复发表的文献,选质量最高的纳入。排除标准:⑴ 直肠良性肿瘤患者;⑵ 包含急性肠梗阻的,肠破裂等需要急诊手术患者病例的文献;⑶ 没有比较两组临床疗效的数据可供提取;⑷ 综述、病例报道、摘要或专家意见。
1.3 资料提取
由2名研究员独立筛选文献、提取资料并交叉核对,若遇分歧,则讨论解决或与第三方讨论解决。提取内容主要包括:⑴ 基本信息,包括作者、年份、国家等;⑵ 研究对象的基线特征、包括各组的样本量、患者的年龄、性别及体质量指数(BMI)等;⑶ 主要结局指标,包括术中中转开腹率、术后并发症、围手术期病死率、肿瘤距远端切缘的距离;次要结局指标,包括手术时间、术中失血量、住院时间、淋巴结获取数目、肠功能恢复时间、近端切缘距离等。
1.4 质量评价
纳入的随 机对照试验采用Cochrane偏倚风险评估工具[12]进行质量评估。
1.5 统计分析处理
采用R 3.4.2软件进行Meta分析。计量资料采用均数差(mean difference,MD)为效应分析统计量,计数资料采用相对危险度(risk ratio,RR)为效应分析统计量,各效应量均给出其点估计值和95% CI。通过χ2检验对纳入研究进行异质性检验,同时结合I2值定量判断异质性的大小。若各研究结果间无明显异质性(P>0.1,I2≤50%),则采用固定效应模型(fixed effects model)进行Meta分析;反之若各研究结果间存在异质性(P≤0.1,I2>50%),分析异质性来源,进行敏感性分析判别,如果异质性仍存在则采用随机效应模型(random effects model)进行Meta分析。采用漏斗图分析其发表偏倚。
2 结 果
2.1 纳入文献情况
根据制定的纳入和排除标准,共纳入7个随机对照试验[13-19]。Meta分析的流程图如图1所示。
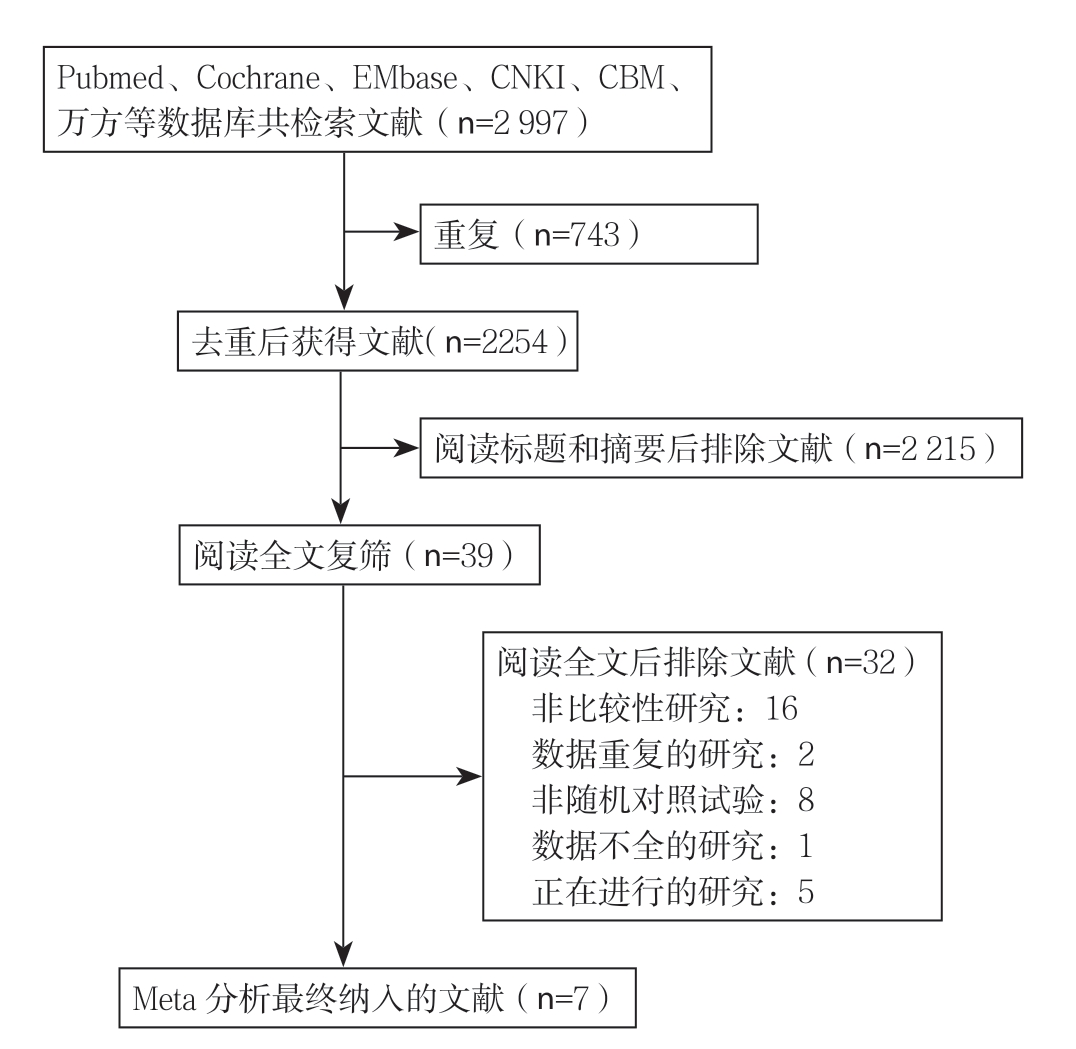
图1 文献筛选流程图
Figure 1 Literature screening process
2.2 纳入研究的基本特征及其偏倚风险评价结果
纳入的7个研究[13-19]共包含956例患者,其中RP组474例,LP组482例,各研究的纳入样本量在18~237例之间,两组之间的样本量、性别、年龄、BMI、肿瘤分级以及ASA评分均无统计学差异。纳入研究的基本特征详见表1。偏倚风险评价结果见表2。
2.3 纳入研究的Meta分析结果
2.3.1 主要结局 指标 ⑴ 术后并发症:纳入的7个研究[13-19]均报道了两组术后总体并发症的发生率。 固定效应模型Meta分析的结果显示,RP组与LP组的总体并发症发生率无差异(RR=1.12,95% CI=0.92~1.36,P=0.25)。而其中一些具体的并发症如吻合口漏、伤口感染、伤口出血、伤口裂开、肠梗阻、静脉血栓、泌尿系统并发症、呼吸系统并发症在两组之间均无的统计学差异(均P>0.05)(表3)。⑵ 围手术期病死率:纳入的研究中有3个[14-15, 17]报道了两组的围术期死亡情况,其中2个研究[14-15]报道的两组的死亡发生率均为0,只有Jayne等[17]报道了RP组与LP组的30 d病死率分别为0.8%和0.9%,就目前数据分析得出两组的围术期病死率无统计学差异(RR=0.97,95% CI=0.14~6.86,P=0.98)(图2A)。⑶ 中转开腹发生率:纳入的6个研究[13-15, 17-19]报道了两组的中转开腹情况。固定效应模型Meta分析的结果显示,RP组的中转开腹率低于LP组(RR=0.49,95% CI= 0.31~0.78,P=0.003(图2B)。⑷ 远端切缘距离比较:纳入的4个研究[13-15, 18]报道了两组远端切缘的距离。随机效应模型Meta分析的结果显示,RP组与LP组的远端切缘距离无统计学差异(MD=0.52,95% CI=-0.13~1.16,P=0.12)(图2C)。
表1 纳入研究的基本特征
Table 1 Characteristics of included studies
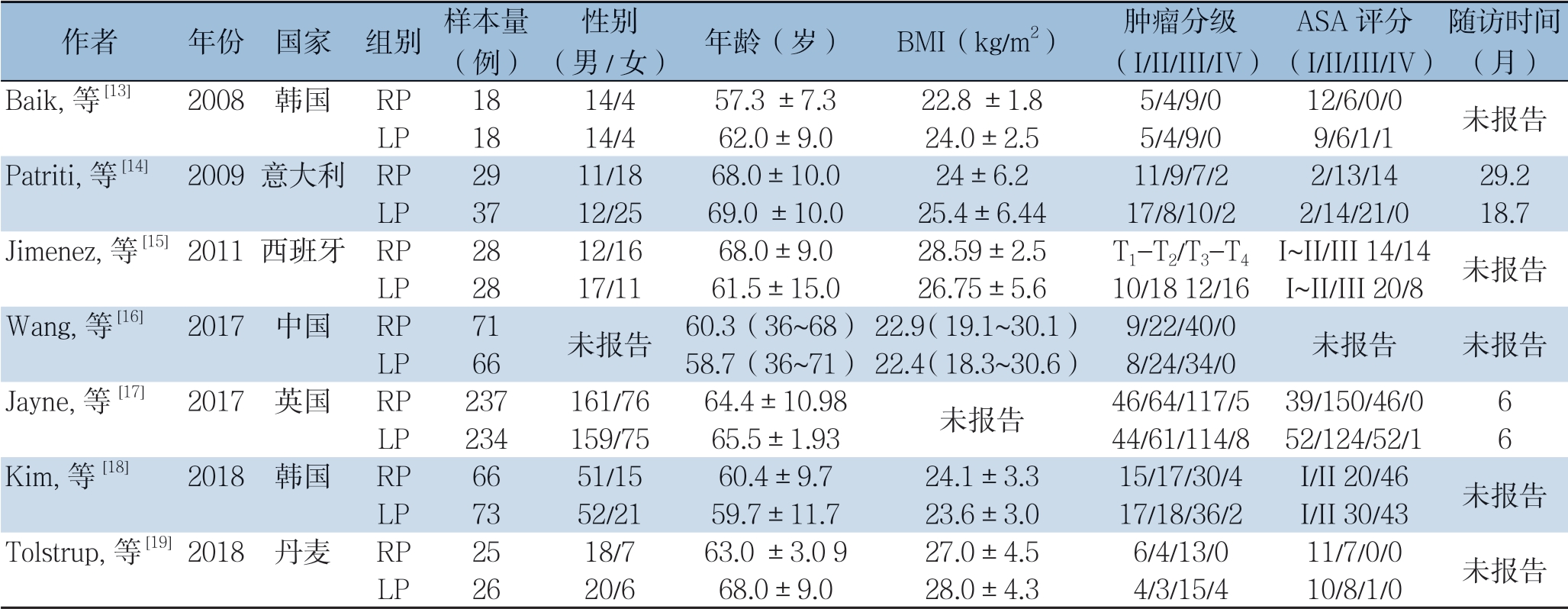
作者 年份 国家 组别 样本量(例)性别(男/女) 年龄(岁) BMI(kg/m2) 肿瘤分级(I/II/III/IV)ASA评分(I/II/III/IV)随访时间(月)Baik,等 [13] 2008 韩国 RP 18 14/4 57.3 ±7.3 22.8 ±1.8 5/4/9/0 12/6/0/0 未报告LP 18 14/4 62.0±9.0 24.0±2.5 5/4/9/0 9/6/1/1 Patriti,等 [14] 2009意大利 RP 29 11/18 68.0±10.0 24±6.2 11/9/7/2 2/13/14 29.2 LP 37 12/25 69.0 ±10.0 25.4±6.44 17/8/10/2 2/14/21/0 18.7 Jimenez,等 [15]2011西班牙 RP 28 12/16 68.0±9.0 28.59±2.5 T1-T2/T3-T4 I~II/III 14/14 未报告LP 28 17/11 61.5±15.0 26.75±5.6 10/18 12/16 I~II/III 20/8 Wang,等 [16] 2017 中国 RP 71 未报告 60.3(36~68)22.9(19.1~30.1) 9/22/40/0 未报告 未报告LP 66 58.7(36~71)22.4(18.3~30.6) 8/24/34/0 Jayne,等 [17] 2017 英国 RP 237 161/76 64.4±10.98 未报告 46/64/117/5 39/150/46/0 6 LP 234 159/75 65.5±1.93 44/61/114/8 52/124/52/1 6 Kim,等 [18] 2018 韩国 RP 66 51/15 60.4±9.7 24.1±3.3 15/17/30/4 I/II 20/46 未报告LP 73 52/21 59.7±11.7 23.6±3.0 17/18/36/2 I/II 30/43 Tolstrup,等 [19]2018 丹麦 RP 25 18/7 63.0 ±3.0 9 27.0±4.5 6/4/13/0 11/7/0/0 未报告LP 26 20/6 68.0±9.0 28.0±4.3 4/3/15/4 10/8/1/0
表2 纳入随机对照试验的质量评价表
Table 2 Quality assessment of the include RCTs
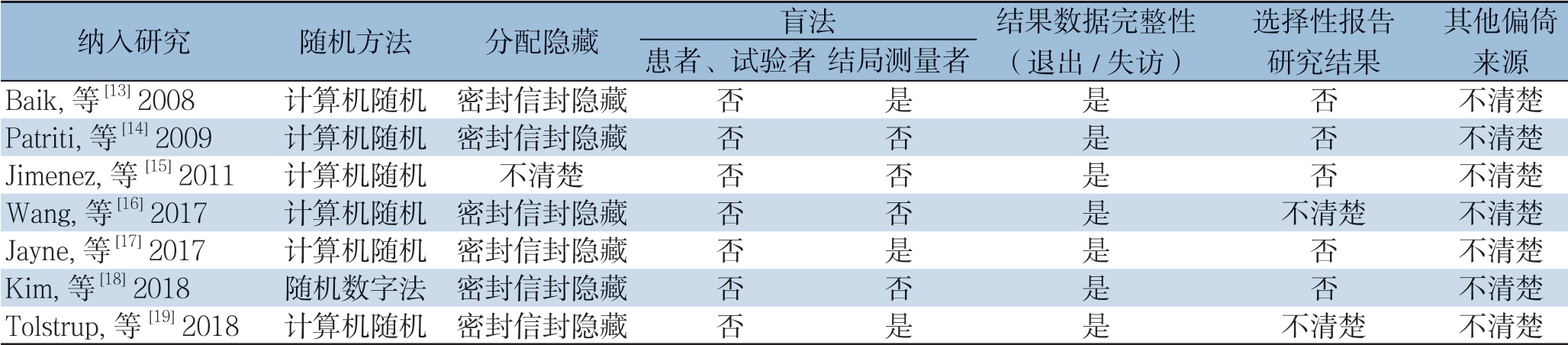
纳入研究 随机方法 分配隐藏 盲法 结果数据完整性(退出/失访)选择性报告研究结果其他偏倚来源患者、试验者 结局测量者Baik, 等 [13] 2008 计算机随机 密封信封隐藏 否 是 是 否 不清楚Patriti, 等 [14] 2009 计算机随机 密封信封隐藏 否 否 是 否 不清楚Jimenez, 等 [15] 2011 计算机随机 不清楚 否 否 是 否 不清楚Wang, 等 [16] 2017 计算机随机 密封信封隐藏 否 否 是 不清楚 不清楚Jayne, 等 [17] 2017 计算机随机 密封信封隐藏 否 是 是 否 不清楚Kim, 等 [18] 2018 随机数字法 密封信封隐藏 否 否 是 否 不清楚Tolstrup,等[19] 2018 计算机随机 密封信封隐藏 否 是 是 不清楚 不清楚
表3 RP与LP组术后并发症的比较
Table 3 Comparison of postoperative complications between RP group and LP group
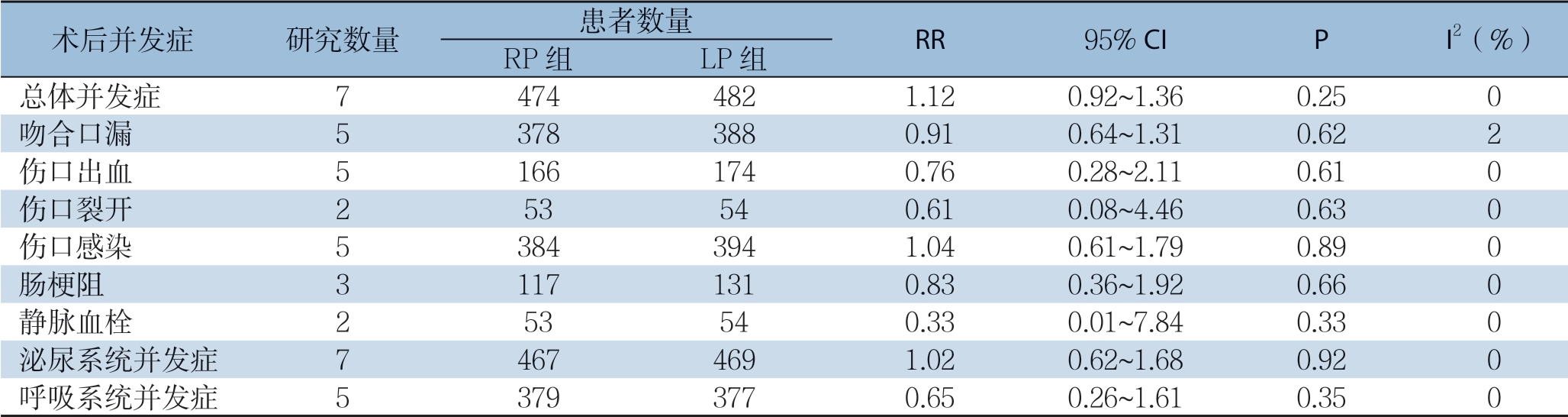
术后并发症 研究数量 患者数量 RR 95% CI P I2(%)RP组 LP组总体并发症 7 474 482 1.12 0.92~1.36 0.25 0吻合口漏 5 378 388 0.91 0.64~1.31 0.62 2伤口出血 5 166 174 0.76 0.28~2.11 0.61 0伤口裂开 2 53 54 0.61 0.08~4.46 0.63 0伤口感染 5 384 394 1.04 0.61~1.79 0.89 0肠梗阻 3 117 131 0.83 0.36~1.92 0.66 0静脉血栓 2 53 54 0.33 0.01~7.84 0.33 0泌尿系统并发症 7 467 469 1.02 0.62~1.68 0.92 0呼吸系统并发症 5 379 377 0.65 0.26~1.61 0.35 0
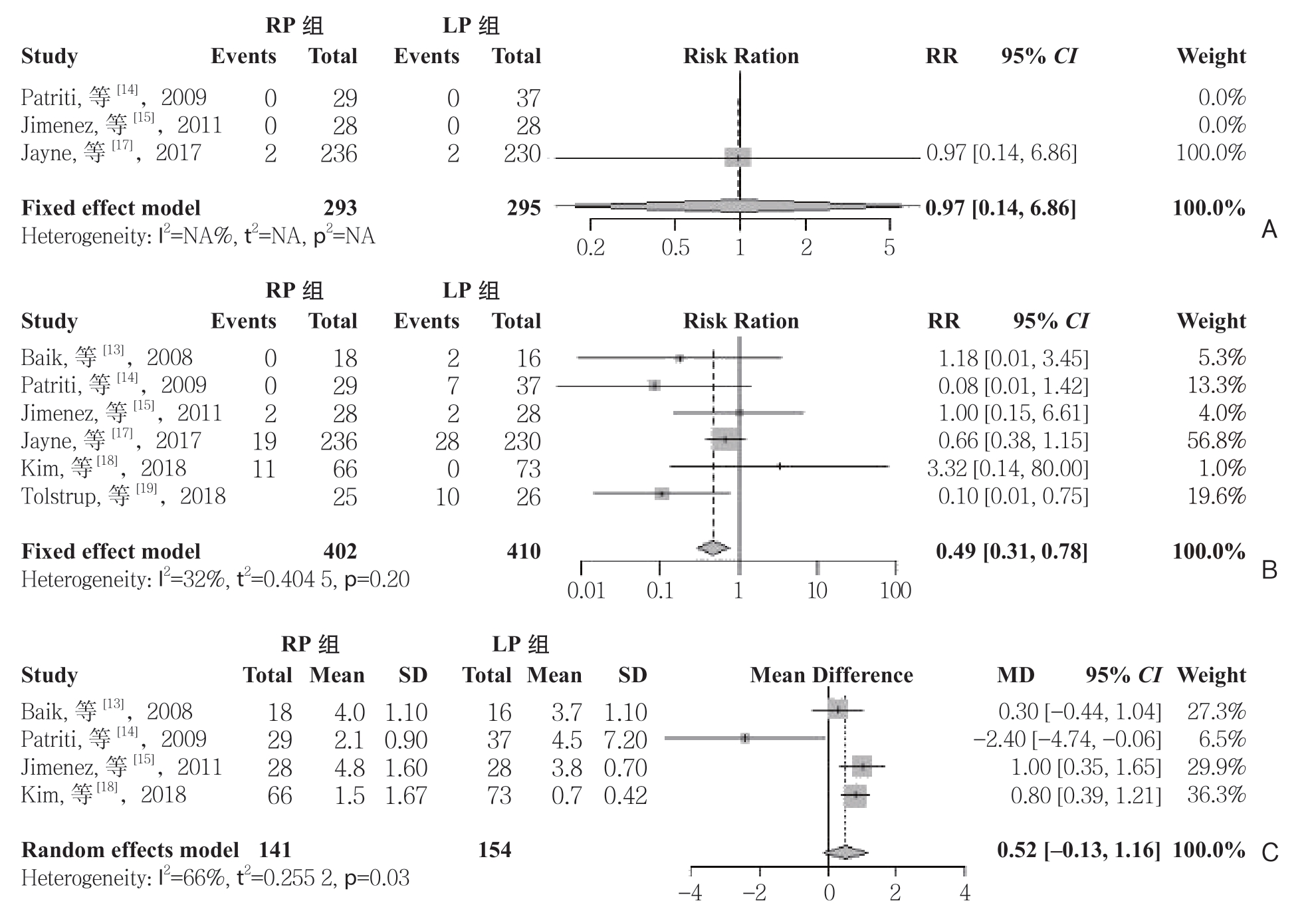
图2 RP组和LP组主要结局指标比较
Figure 2 Comparison of the major outcome variables between RP group and LP group
A:围术期病死率;B:中转开腹率;C:远端切缘距离
A: Perioperative mortality; B: Conversion rates; C: Distal margin distance
2.3.2 次要结局指标 纳入的7个研究[13-19]均报道了两组的手术时间,6个研究[13-15, 17-19]报道了两组的术后住院时间。随机效应模型Meta分析的结果显示,RP组的手术时间明显长于LP组(MD=28.88,95% CI=3.20~54.55,P=0.028);RP组的术后住院时间较LP组短(MD=-0.95,95% CI= -1.84~-0.06,P=0.037)。纳 入 的2个 研究[13-14]报道了两组的术中失血量,6个研究[13-18]报道了两组的淋巴结获取数目,2个研究[13, 18]报道了两组近端切缘的距离,3个研究[13, 16, 18]报道了两组的术后肠功能恢复的时间,2个研究[15, 18]报道了两组的术后开始流质饮食的时间。固定效应模型Meta分析的结果显示,RP组的术后肠功能恢复时间较LP组短(MD=-0.43,95% CI=-0.74~0.13,P=0.006);两组的术中失血量(MD=-10.29,95% CI=-54.75~34.16,P=0.65)、淋巴结获取数目(MD=0.12,95% CI=-1.02~1.25,P= 0.838)、近端切缘距离(MD=-0.1,95% CI=-1.51~1.31,P=0.889)、术后流质饮食时间(MD=-0.17,95% CI=-0.62~0.27,P=0.443)均无统计学差异(表4)。
表4 RP与LP组次要结局指标的比较
Table 4 The compassion of secondary outcome variables between RP group and LP group
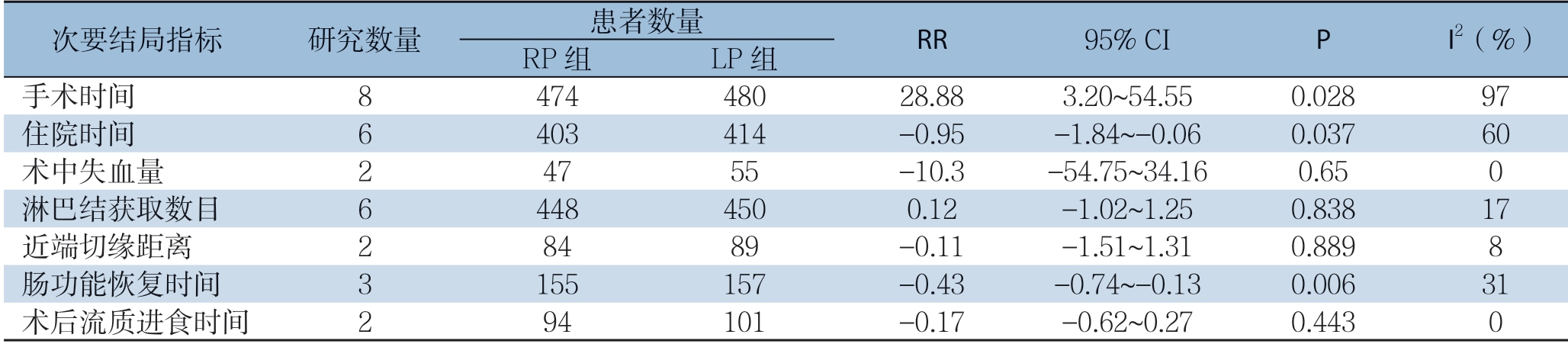
次要结局指标 研究数量 患者数量 RR 95% CI P I2(%)RP组 LP组手术时间 8 474 480 28.88 3.20~54.55 0.028 97住院时间 6 403 414 -0.95 -1.84~-0.06 0.037 60术中失血量 2 47 55 -10.3 -54.75~34.16 0.65 0淋巴结获取数目 6 448 450 0.12 -1.02~1.25 0.838 17近端切缘距离 2 84 89 -0.11 -1.51~1.31 0.889 8肠功能恢复时间 3 155 157 -0.43 -0.74~-0.13 0.006 31术后流质进食时间 2 94 101 -0.17 -0.62~0.27 0.443 0
2.4 敏感度分析
对有高度异质性的结局指标(住院时间、远端切缘距离、手术时间)进行敏感度分析,逐一剔除权重最轻、最重或者标准差变化较大的研究,以检验相关结果的稳定性。对于住院时间去除Jayne等[17]文献后(I2=45%,P=0.12),Meta分析结果显示两组技术 间仍有差异(MD=-1.58,95% CI=-2.10~-1.06,P<0.001);对于远端切缘距离去除Patriti等[14]文献后(I2=2%,P=0.36),Meta分析结果显示RP组的平均远端切缘距离小LP组(MD=0.76,95% CI= 0.44~1.07,P<0.001);而手术时间我们去除权重变化较大的研究后,I2值的变化不明显,说明各研究数据的稳定性较好。
2.5 发表偏倚
对两组的术后总体并发症做漏斗图来分析发表偏倚,发现所纳入的7个研究全部在95% CI内,且分布基本对称,图形基本成倒置的漏斗状分布,表明各研究间无明显的发表偏倚存在(图3)。
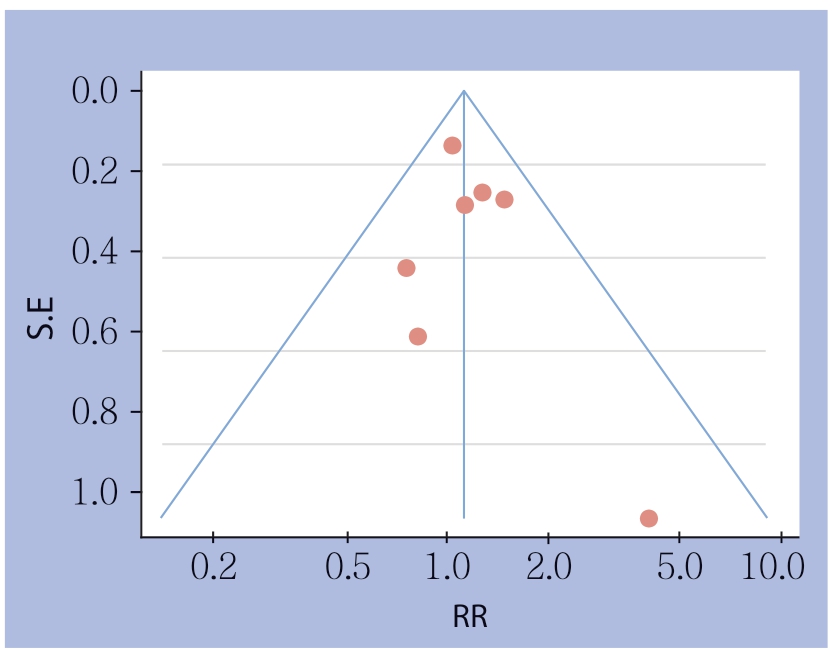
图3 术后并发症漏斗图
Figure 3 Funnel plot for postoperative complications
3 讨 论
本Meta分析表明,与LP组相比,RP组中转开腹率的发生风险降低51%,术后肠道功能恢 复时间快0.43 d、住院时间少0.95 d,但手术时间长28.88 min。而在围术期病死率、并发症、术中失血量、近端及远端切缘距离、淋巴结清扫数目、术后开始流质饮食时间方面两组之间没有明显差异。
中转开腹 率能较好的反映出RP在直肠癌手术中的优势,本研究表明RP组的中转开腹率明显低于LP组,该结论与以前Meta的结果一致[10-11]。常见影响中转开腹的原因是骨盆狭窄、血管粘连、血管损伤导致的大出血、肥胖、器械故障等[20-22]。而机器人辅助系统的优势之一就是在狭窄的盆腔中仍能灵 活、稳定的操作, 并且在高清的术野中较好的显露神经和血管,这可能是RP组中转开腹率较低的原因。盆腔自主神经损伤是术后男性性功能障碍的重要原因,机器人系统的铰接式单极电钩能更好的控制电凝和电切,从而减少对骨盆中神经的损伤[23-24],Wang等[16]和Jayne等[17]指出RP组在男性直肠癌术后勃起功能障碍发生率方面明显低于LP组。因此,机器人辅助技术对盆腔神经的保护意义重大。
本研究还表明RP组的平均手术时间比LP组长28.88 min。造成RP组的手术时间较长的可能原因如下:⑴ 机器人程序更复杂,需要更多的时间进行安装和对接以及更换术中器械;⑵ 机器人手术开展较晚且费用昂贵,因此大多数医生的经验相对不足;⑶ Jiménez Rodríguez等[15]报道机器人系统可能在术中需要改变位置来多角度进行切除。此外,手术时间的异质性很高 ,可能原因有以下两点:⑴ 每个研究对手术时间的定义不一致,部分研究包括了机器人安装的时间;⑵ 不同手术团队的技术经验以及机器人的学习曲线不同,也是造成手术时间异质性高的原因之一。虽然目前来看,RP组的手术时间较长,但这不一定具有临床意义,Bokhari等[25]指出随着外科医生经验与技术的累积、机器人学习曲线的缩短,机器人组的手术时间会明显减少。
关于住院时间,本研究表明RP组略短,该结果同以前Meta分析结果不一致[10-11]。这表明随着证据质量的提高,两组的住院时间是有差异的。本研究中住院时间的异质性较高,可能原因有:⑴ 住院时间长短可能受到研究人群、地理位置的影响;⑵ 不同的医院对住院时间的定义以及出院的标准不同[26]。此外,远端切缘距离的异质性也较高,可能是由于不同单位使用的机器人类型不同以及外科医生在技术方面的差异所导致的。有研究表明,机器人辅助系统能够在狭窄的盆腔中提供清晰的视野,更加精确的显示解剖结构,从而使术者容易辨认血管走形而减少不必要的出血[7]。但本研究中由于数据缺失并没表明RP组的失血量更少。
机器人辅助手术作为一种新兴的技术,目前正广泛应用于外科领域[4]。相比腹腔镜下胃切除、肝切除、胆囊切除等手术,腹腔镜下直肠癌手术更具有挑战性,尤其是在狭窄的盆腔中进行的低位直肠切除术。而且机器人系统对手震颤有较好的过滤效果,使其保障了手术操作的稳定性和精确性,对血管周围的脂肪与淋巴结组织的清扫更为彻底、安全性更高。相比腹腔镜,机器人辅助系统能更好的暴露手术视野,术者能更准确地进行解剖结构的分离,从而更好的保护盆腔中的重要神经和血管[7,27]。笔者认为,机器人辅助腔镜手术在男性低位直肠癌手术中优势较为明显。有研究[28]表明机器人辅助技术还 能在手术中让术者处于自然放松的姿势,这点与传统腔镜相比明显减轻了术者的疲劳和压力,这就是先进技术为医学的发展带来的益处。然而,机器人辅助系统目前也存在一些不足:如高昂的费用和触觉反馈的消失等。关于触觉反馈的消失,Baik等[13]提出应该通过不断的积累经验来增加视觉上的分析从而克服这一不足。
本Meta分析的优点是:⑴ 纳入了的文献为随机对照研究,其中包括最新的多中心、大样本的研究;⑵ 对围术期病死率及术后并发症详细的进行了分析。本Meta分析不足之处为:⑴ 由于缺少远期预后的数据,不能有效的评价机器人辅助技术在直肠癌手术中的远期疗效;⑵ 由于缺少有效数据,无法对不同手术方式的结果进行亚组分析。
综上所述,RP组的围手术期疗效和安全性优于LP组。此外在 保护盆底神经功能方面RP组更有优势。但就其远期疗效和安全性目前缺少数据来论证,未来尚需要多中心、大 样本的随机对照试验来论证,为临床工作提供更有力的证据。
志谢:感谢达芬奇外科手术系统数据库(DSSD,SD,www.davincisurgerydatabase.com)在方法学和数据分析过程中提供的帮助和支持。
[1]王伟, 马利林, 朱建伟, 等. 结直肠肿瘤的腹腔镜微创治疗临床分析[J]. 中国普通外科杂志, 2013, 22(10):1341-1344. doi:10.7659/j.issn.1005-6947.2013.10.022.Wang W, Ma LL, Zhu JW, et al. Clinical analysis of laparoscopic colorectal radical resection[J]. Chinese Journal of General Surgery, 2013, 22(10):1341-1344. doi:10.7659/j.issn.1005-6947.2013.10.022.
[2]Kim HJ, Choi GS, Park JS, et al. Comparison of surgical skills in laparoscopic and robotic tasks between experienced surgeons and novices in laparoscopic surgery: an experimental study[J]. Ann Coloproctol, 2014, 30(2):71-76. doi: 10.3393/ac.2014.30.2.71.
[3]Shearer R, Gale M, Aly OE, et al. Have early postoperative complications from laparoscopic rectal cancer surgery improved over the past 20 years?[J]. Colorectal Dis, 2013, 15(10):1211-1226. doi: 10.1111/codi.12302.
[4]Maeso S, Reza M, Mayol JA, et al. Efficacy of the Da Vinci surgical system in abdominal surgery compared with that of laparoscopy: a systematic review and meta-analysis[J]. Ann Surg, 2010, 252(2):254-262. doi: 10.1097/SLA.0b013e3181e6239e.
[5]Velayutham V, Fuks D, Nomi T, et al. 3D visualization reduces operating time when compared to high-definition 2D in laparoscopic liver resection: a case-matched study[J]. Surg Endosc, 2016, 30(1):147-153. doi: 10.1007/s00464-015-4174-1.
[6]韩彩文, 姚亮, 闫沛静, 等. 机器人辅助与传统腹腔镜胆囊切除术治疗良性胆囊疾病疗效比较的Meta分析[J]. 中国普通外科杂志, 2018, 27(8):955-967. doi:10.3978/j.issn.1005-6947.2018.08.003.Han CW, Yao L, Yan PJ, et al. Meta-analysis of robotic-assisted versus conventional laparoscopic cholecystectomy for benign gallbladder diseases[J]. Chinese Journal of General Surgery, 2018, 27(8):955-967. doi:10.3978/j.issn.1005-6947.2018.08.003.
[7]Moghadamyeghaneh Z, Hanna MH, Carmichael JC, et al. Comparison of open, laparoscopic, and robotic approaches for total abdominal colectomy[J]. Surg Endosc, 2016, 30(7):2792-2798. doi: 10.1007/s00464-015-4552-8.
[8]刘江, 王刚, 赵健, 等. 达芬奇机器人联合折刀位行经腹会阴直肠癌根治术[J]. 中华腔镜外科杂志: 电子版, 2018, 10(1):39-42.Liu G, Wang G, Zhao J, et al. Robot combined with prone jackknife position for abdominoperineal resection of rectal cancer[J]. Chinese Journal of Laparoscopic Surgery: Electronic Edition, 2018, 10(1):39-42.
[9]余佩武, 罗华星. 达芬奇机器人手术系统在消化外科的应用与展望[J]. 中华消化外科杂志, 2016, 15(9):861-867. doi:10.3760/cma.j.issn.1673-9752.2016.09.003.Yu PW, Luo HX. Application and prospects of Da Vinci robotic surgical system in digestive surgery[J]. Chinese Journal of Digestive Surgery, 2016, 15(9):861-867. doi:10.3760/cma.j.issn.1673-9752.2016.09.003.
[10]Trastulli S, Farinella E, Cirocchi R, et al. Robotic resection compared with laparoscopic rectal resection for cancer: systematic review and meta-analysis of short-term outcome[J]. Colorectal Dis, 2012, 14(4):e134-156. doi: 10.1111/j.1463-1318.2011.02907.x.
[11]Prete FP, Pezzolla A, Prete F, et al. Robotic Versus Laparoscopic Minimally Invasive Surgery for Rectal Cancer: A Systematic Review and Meta-analysis of Randomized Controlled Trials[J]. Ann Surg, 2018, 267(6):1034-1046. doi: 10.1097/SLA.0000000000002523.
[12]Higgins JP, Altman DG, Gotzsche PC, et al. The Cochrane Collaboration's tool for assessing risk of bias in randomised trials[J]. BMJ, 2011, 343:d5928. doi: 10.1136/bmj.d5928.
[13]Baik SH, Ko YT, Kang CM, et al. Robotic tumor-specific mesorectal excision of rectal cancer: short-term outcome of a pilot randomized trial[J]. Surg Endosc, 2008, 22(7):1601-1608. doi: 10.1007/s00464-008-9752-z.
[14]Patriti A, Ceccarelli G, Bartoli A, et al. Short- and medium-term outcome of robot-assisted and traditional laparoscopic rectal resection[J]. JSLS, 2009, 13(2):176-183.
[15]Jiménez Rodríguez RM, Díaz Pavón JM, de La Portilla de Juan F, et al. Prospective randomised study: robotic-assisted versus conventional laparoscopic surgery in colorectal cancer resection[J]. Cir Esp, 2011, 89(7):432-438. doi: 10.1016/j.ciresp.2011.01.017.
[16]Wang G, Wang Z, Jiang Z, et al. Male urinary and sexual function after robotic pelvic autonomic nerve-preserving surgery for rectal cancer[J]. Int J Med Robot, 2017, 13(1). doi: 10.1002/rcs.1725.
[17]Jayne D, Pigazzi A, Marshall H, et al. Effect of Robotic-Assisted vs Conventional Laparoscopic Surgery on Risk of Conversion to Open Laparotomy Among Patients Undergoing Resection for Rectal Cancer: The ROLARR Randomized Clinical Trial[J]. JAMA, 2017, 318(16):1569-1580. doi: 10.1001/jama.2017.7219.
[18]Kim MJ, Park SC, Park JW, et al. Robot-assisted Versus Laparoscopic Surgery for Rectal Cancer: A Phase II Open Label Prospective Randomized Controlled Trial[J]. Ann Surg, 2018, 267(2):243-251. doi: 10.1097/SLA.0000000000002321.
[19]Tolstrup R, Funder JA, Lundbech L, et al. Perioperative pain after robot-assisted versus laparoscopic rectal resection[J]. Int J Colorectal Dis, 2018, 33(3):285-289. doi: 10.1007/s00384-017-2943-0.
[20]Guillou PJ, Quirke P, Thorpe H, et al. Short-term endpoints of conventional versus laparoscopic-assisted surgery in patients with colorectal cancer (MRC CLASICC trial): multicentre, randomised controlled trial[J]. Lancet, 2005, 365(9472):1718-1726. doi: 10.1016/S0140-6736(05)66545-2.
[21]Li X, Wang T, Yao L, et al. The safety and effectiveness of robot-assisted versus laparoscopic TME in patients with rectal cancer[J]. Medicine (Baltimore), 2017, 96(29):e7585. doi: 10.1097/MD.0000000000007585.
[22]叶枫, 赵任. 机器人在结直肠癌手术中的应用[J]. 中国普通外科杂志, 2017, 26(4):401-405. doi:10.3978/j.issn.1005-6947.2017.04.001.Ye F, Zhao R. Application of robotic surgery for colorectal cancer[J]. Chinese Journal of General Surgery, 2017, 26(4):401-405. doi:10.3978/j.issn.1005-6947.2017.04.001.
[23]D'Annibale A, Pernazza G, Monsellato I, et al. Total mesorectal excision: a comparison of oncological and functional outcomes between robotic and laparoscopic surgery for rectal cancer[J]. Surg Endosc, 2013, 27(6):1887-1895. doi: 10.1007/s00464-012-2731-4.
[24]曾冬竹, 余佩武, 雷晓, 等. 达芬奇机器人手术系统在直肠癌根治术中的应用[J]. 中华消化外科杂志, 2011, 10(6):436-438. doi:10.3760/cma.j.issn.1673-9752.2011.06.008.Zeng DZ, Yu PW, Lei X, et al. Application of da Vinci robotic surgical system in radical resection of rectal cancer[J]. Chinese Journal of Digestive Surgery, 2011, 10(6):436-438. doi:10.3760/cma.j.issn.1673-9752.2011.06.008.
[25]Bokhari MB, Patel CB, Ramos-Valadez DI, et al. Learning curve for robotic-assisted laparoscopic colorectal surgery[J]. Surg Endosc, 2011, 25(3):855-860. doi: 10.1007/s00464-010-1281-x.
[26]季新强, 刘晶. 大肠癌手术患者住院日异常的影响因素分析[J]. 医院管理论坛, 2018, 35(4):31-35. doi:10.3969/j.issn.1671-9069.2018.04.010.Ji XQ, Liu J. Analysis of Influencing Factors of Abnormal Hospitalization Day in Patients with Colorectal Cancer Surgery[J]. Hospital Management Forum, 2018, 35(4):31-35. doi:10.3969/j.issn.1671-9069.2018.04.010.
[27]池畔, 陈致奋. 机器人与腹腔镜全直肠系膜切除术的比较[J]. 中华胃肠外科杂志, 2017, 20(6):610-613. doi:10.3760/cma.j.issn.1671-0274.2017.06.003.Chi P, Chen ZF. Comparison of robotic and laparoscopic total mesorectal excision[J]. Chinese Journal of Gastrointestinal Surgery, 2017, 20(6):610-613. doi:10.3760/cma.j.issn.1671-0274.2017.06.003.
[28]Uhrich ML, Underwood RA, Standeven JW, et al. Assessment of fatigue, monitor placement, and surgical experience during simulated laparoscopic surgery[J]. Surg Endosc, 2002, 16(4):635-644. doi: 10.1007/s00464-001-8151-5.
