胃癌的发病率和病死率均位居我国恶性肿瘤的前列,其在男性中的发病率位居第二,病死率位居第三,在女性中发病率位列第五,病死率位居第二。胃癌已成为严重威胁我国人民群众生命健康的重大疾病[1-4]。因此,继续深入研究胃癌的发病机制,鉴定和筛选胃癌发病相关的关键基因,评价其作为胃癌早期诊断和治疗的靶标的潜能,具有重要的理论价值和临床意义。
肿瘤细胞外基质等微环境的重塑,是肿瘤发生发展的必要步骤[5-6]。细胞外基质是由多聚糖、蛋白聚糖、糖蛋白、胶原蛋白及纤黏连蛋白等多种大分子物质组成。胶原蛋白作为细胞外基质中最重要的结构类蛋白,在肿瘤微环境的整体调控中发挥了重要作用[7-8]。目前,已经鉴定发现28种已知的胶原蛋白,根据其分子结构及装配方式,可分为纤维胶原、非纤维状胶原及微纤维胶原等三大类型。目前,已证实多种类型的胶原蛋白在肿瘤的发生发展中发挥了重要作用[9-11]。在胃癌中,已证实COL1A1、COL1A2、COL4A1及COL11A1等多种胶原蛋白与胃癌的发生发展相关,部分可以作为其诊断和预后的分子靶标[12-16]。因此,进一步筛选和鉴定与胃癌发生发展相关的胶原蛋白基因,对于提高胃癌的早期诊断水平和临床治疗疗效具有积极意义。
本研究利用Oncomine等在线肿瘤基因表达数据库,分析了多种类胶原蛋白在胃癌和正常胃黏膜组织中的表达差异,以期鉴定与胃癌相关的新的胶原蛋白基因,结果显示XII型胶原蛋白编码基因COL12A1在胃癌中显著升高,提示其可能与胃癌发生发展相关;随后利用免疫组化、细胞生物学和分子生物学实验首次证实,COL12A1在胃癌组织中高表达,其高表达可以促进胃癌细胞的增殖和侵袭。
1 材料与方法
1.1 细胞及主要试剂
人胃癌细胞SGC7901系购自中南大学细胞中心。RPIM-1640培养基、胎牛血清及0.25%胰蛋白酶均购自于以色列BI(Biological Industries)公司。RNA提取试剂盒(RC101),逆转录试剂盒(R233),SYBR Green qPCR Master Mix(Q511)均购自南京诺维赞生物科技有限公司。COL12A1抗体购买于上海生工生物工程有限公司。SP Rabbit HRP Kit免疫组化试剂盒购自北京康为世纪生物技术有限公司。COL12A1 siRNA序列和对照序列,配套的转染试剂购于广州锐博生物科技有限公司。蛋白裂解液RIPA、5×蛋白上样缓冲液、BCA蛋白浓度检测试剂盒和CCK-8等试剂购自碧云天生物科技有限公司。
1.2 临床标本
58对胃癌标本及癌旁标本收集于2016年12月—2018年6月期间在本院普通外科住院的胃癌手术患者,其中男30例,女28例;年龄30~65岁,平均年龄(51.41±10.23)岁。标本收集时,同一份标本一分为二,一部分立即于液氮中冻存,一部分于福尔马林中固定,用于石蜡切片制作。所有标本均经病理确认的胃癌初诊患者,且收集时均未接受放疗和化疗等治疗。所有标本收集前,均已同患者签署了知情同意 书,并获本院医学伦理委员会批准。
1.3 方法
1.3.1 数据库分析 利用Oncomine肿瘤数据库(https://www.oncomine.org),注册账号后,选择筛选条件如下:Analysis Type:Cancer vs Normal Analysis,Cancer Type:Gastric Cancer。根据P<0.05值筛选在胃癌中表达升高的胶原蛋白 基因,经PubMed(https://www.ncbi.nlm.nih.gov/pubmed)进一步检索,排除已被报道与胃癌相关的胶原蛋白基因,最终选定COL12A1。利用GEPIA(http://gepia.cancer-pku.cn)基因表达分析工具验证COL12A1在胃癌中的表达及其与胃癌预后的关系。
1.3.2 免疫组织化学分析 石蜡标本经60 ℃烤片熔蜡1 h后,置于二甲苯中脱蜡2次,每次5 min;随后进行梯度酒精脱水(100%→100%→95%→85%→75%),每次5 min;最后经蒸馏水中水化5 min。利用柠檬酸缓冲液进行高压修复后,滴加内源性过氧化物酶封闭液孵育10 min,PBS洗3次,每次3 min;加入养血清工作液,室温孵育10 min,甩干后滴加COL12A1(1:50)抗体稀释液,放置于湿盒内,4 ℃过夜孵育;PBS洗3次,每次3 min;滴加生物素标记二抗工作液,室温孵育10 min,PBS洗3次,每次3 min;滴加HRP标记的链霉亲和素,室温孵育10 min,PBS洗3次后,进行DAB显色;显色经复染,脱水透明后,滴加中性树胶,用盖玻片封片,随后镜下观察。根据染色强度和染色面积进行定量分析,染色强度无着色为0分,黄色为1分,棕黄色为2分;阳性细胞比例≤25%为1分,26%~ 50%为2分,51%~75%为3分,>75%为4分;两者得分之积为最终得分,分数≥4分为高表达,<4分为低表达[17]。
1.3.3 细胞培养 利用含10%胎牛血清的RPIM-1640培养基,于5%CO2 37 ℃的细胞培养箱内,培养SGC7901细胞。
1.3.4 siRNA转染 转染前24 h,将细胞用胰酶消化,按1.5×105/孔的密度接种于6孔板中,保证转染前细胞汇合度在30%~40%左右。根据广州市锐博生物科技有限公司提供的siRNA转染说明书,利用不含血清的RPIM-1640配制siRNA脂质体复合物,转染SGC7901细胞,转染后6 h更换成含血清的新鲜培养基。
1.3.5 总RNA抽提及qPCR检测 根据RNA抽提试剂盒的说明,抽提组织和细胞总RNA。随后,根据逆转录试剂盒说明,将RNA逆转录成cDNA;最后,根据SYBR Green qPCR Master Mix说明,配制qPCR体系,检测COL12A1在组织和细胞中的相对表达水平。所用qPCR引物如下:COL12A1上游引物5'-GGA GTG GAG CTG TTT GCT ATT-3', COL12A1下游引物5'-GAG AGT GAC TCA AAA TCT GCC A-3';GAPDH上游引物5'-CTG GGC TAC ACT GAG CAC C-3',GAPDH下游引物5'-AAG TGG TCG TTG AGG GCA ATG-3'[18]。
1.3.6 蛋白提取及Western blot检测 RIPA冰上裂解COL12A1敲低的SGC7901和对照细胞,持续15 min,经离心,取蛋白上清保存。一部分利用BCA蛋白浓度试剂检测试剂盒确定浓度,步骤参照说明书。剩余部分按比例加入5×蛋白上样缓冲液,100 ℃煮沸5 min,冷却后以30 μg/孔上样,经10%的SDS-PAGE电泳分离后,转印至PVDF膜后,经封闭,一抗孵育,TBST洗涤,二抗孵育,TBST洗涤后,进行化学发光显影。
1.3.7 CCK-8实验 参照文献中的方法,利用 CCK-8检测COL12A1对胃癌细胞生长的影响[19]。siRNA敲低COL12A1表达水平的SGC7901细胞和对照细胞,经胰酶消化离心收集细胞后,用新鲜培养基重悬细胞并接种于96孔板,每种细胞各接种20个孔,每孔1 000个细胞,每隔24 h(进行4次共96 h),取5个孔,每孔加入10 μL CCK-8试剂,于培养箱孵育1 h后,利用酶标仪,于450 nm波长下,测量各孔的吸光值,扣除空白本底后,绘制生长曲线。
1.3.8 平板克隆形成实验 siRNA敲低COL12A1表达水平的SGC7901细胞和对照细胞,经消化离心后,接种于6孔板,每孔1000个细胞,每种细胞各接种3个孔。细胞于培养箱内,连续培养8 d后,取出细胞,PBS洗涤1次,甲醇固定15 min后,利用0.5%结晶紫染色15 min,经自来水漂洗后,计算各孔的克隆数目,与镜下观察,>50个细胞的克隆,计算为一个有效克隆。
1.3.9 Transwell侵袭实验 siRNA敲低COL12A1表达水平的SGC7901细胞和对照细胞,经胰酶消化离心后,利用无血清的RPIM-1640培养基重悬,调整细胞密度至50 000细胞/mL,于预铺有Matrigel的Transwell上室中加入500 μL细胞悬液,下室中加入750 μL含5%FBS的RPMI-1640培养基,于培养箱中培养24 h后,利用甲醇固定15 min,0.5%结晶紫染色15 min,经自来水漂洗后,利用棉签小心刮除Transwell小室上层的细胞,于显微镜下观察,细胞穿过的情况,随机选取5个视野,计算穿过细胞的平均数。
1.4 统计学处理
利用SPSS statistics 20.0和Graphpad prism 6.0进行统计学分析和作图。计量资料以均数±标准差( ±s)表示,两组数据间采用t检验进行统计分析;计数资料利用χ2检验或Fisher (n<5)精确检验。P<0.05为差异有统计学差异。
±s)表示,两组数据间采用t检验进行统计分析;计数资料利用χ2检验或Fisher (n<5)精确检验。P<0.05为差异有统计学差异。
2 结 果
2.1 胃癌组织中COL12A1表达的数据库分析
基于Oncomine数据库分析了不同数据集中,COL12A1在正常胃黏膜和胃癌组织中的表达水平。所有数据集均显示,COL12A1在胃癌中的表达水平明显升高,并选择了具有代表性的一组数据展示[20](图1A)。基于TCGA数据库中的数据,利用GEPIA工具进一步验证COL12A1在胃癌中的表达,结果同样显示,COL12A1在胃癌组织中表达明显升高(图1B),但其表达水平在不同病理分期的胃癌组织中没有明显差异(图1C)。随后,利用GEPIA进一步分析COL12A1表达水平与胃癌患者总生存期的关系,结果显示,COL12A1高表达胃癌患者总生存期降低(图1D)。
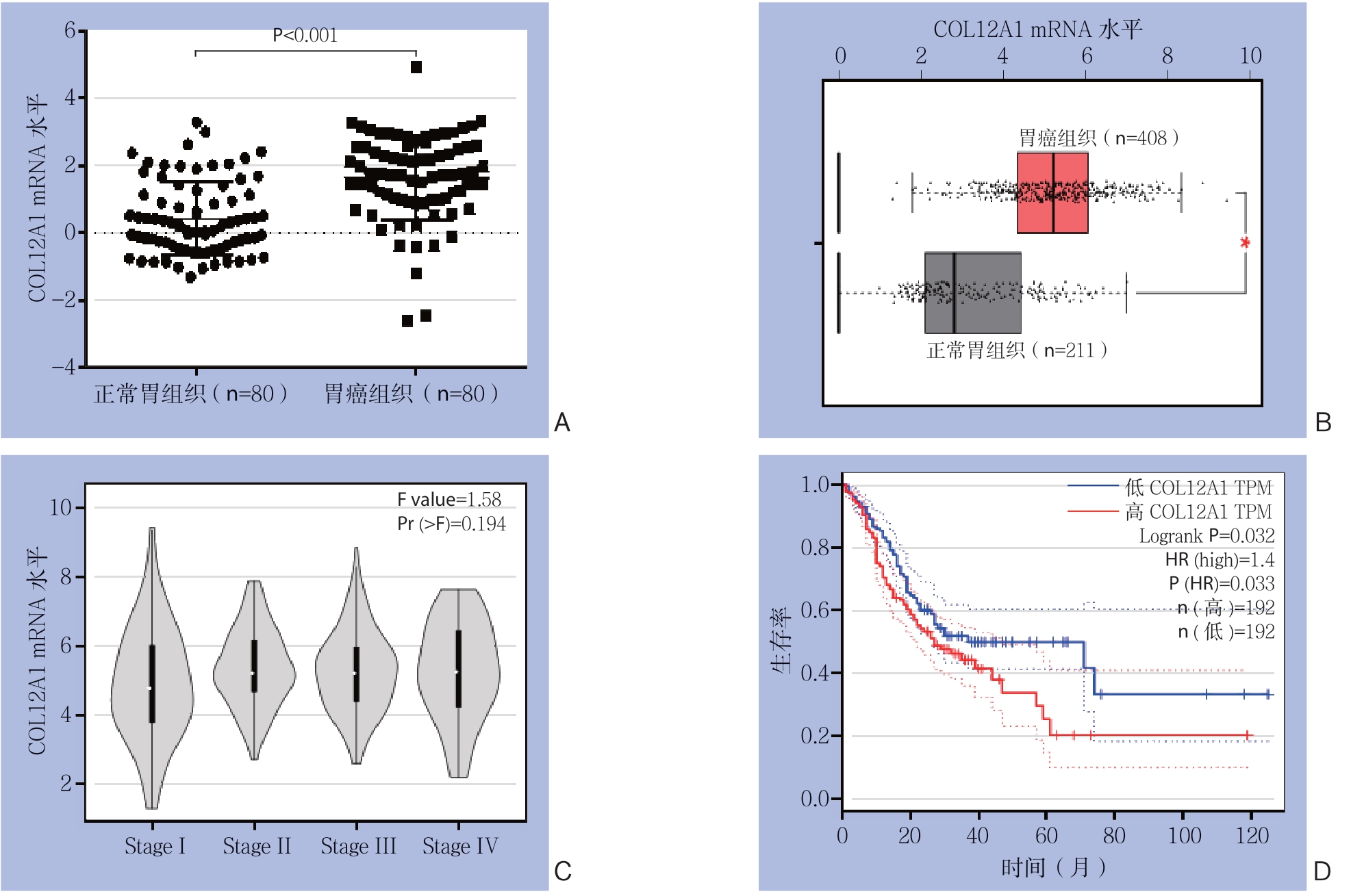
图1 基于Oncomine与GEPIA数据库分析
Figure 1 Oncomine- and GEPIA-based database analysis
A:Oncomine数据集显示COL12A1在胃癌中高表达;B:基于GEPIA分析TCGA数据集显示,COL12A1在胃癌中高表达;C:COL12A1表达水平与病理分期无关;D:COL12A1高表达胃癌患者总生存期降低
A: Oncomine dataset showing high COL12A1 expression in gastric cancer; B: TCGA dataset from GEPIA showing high COL12A1 expression in gastric cancer; C: No significant relationship between COL12A1 expression and pathological stage of gastric cancer; D: High COL12A1 expression significantly related to reduced overall survival rate of gastric cancer patients
2.2 COL12A1蛋白在临床标本中的表达
为了验证数据库的分析结果,进一步利用qPCR及免疫组化检测COL12A1在胃癌组织和癌旁组织中的表达和蛋白水平。qPCR结果显示,COL12A1在癌组织中的表达水平明显高于其在癌旁组织中的表达水平(P<0.001)(图2);免疫组化结果显示,COL12A1在胃癌组织细胞中呈阳性或强阳性染色;在癌旁组织细胞中呈弱阳性或阴性表达(图3),COL12A1蛋白在胃癌组织中的高表达率明显高于癌旁组织(表1)。
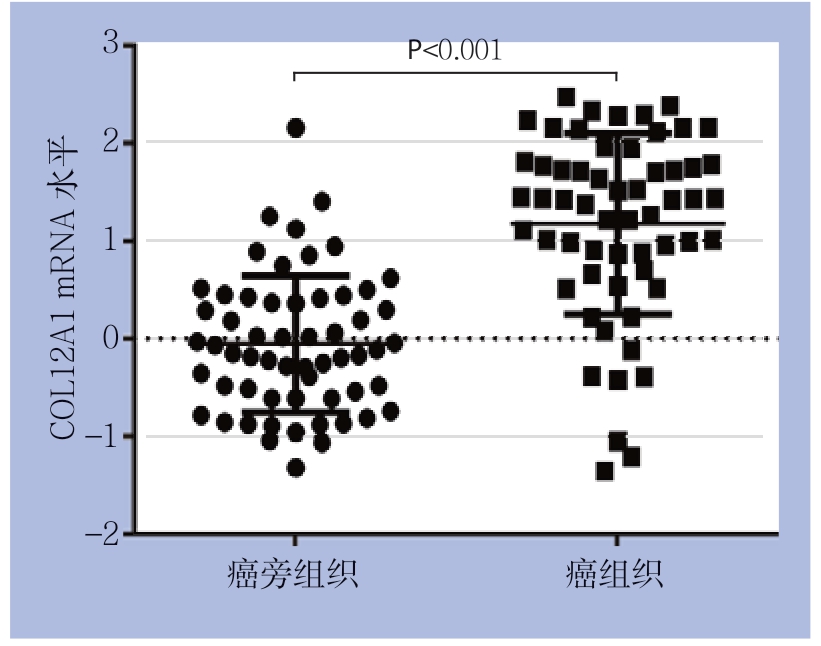
图2 qPCR检测COL12A1基因表达
Figure 2 Detection of COL12A1 gene expression by qPCR
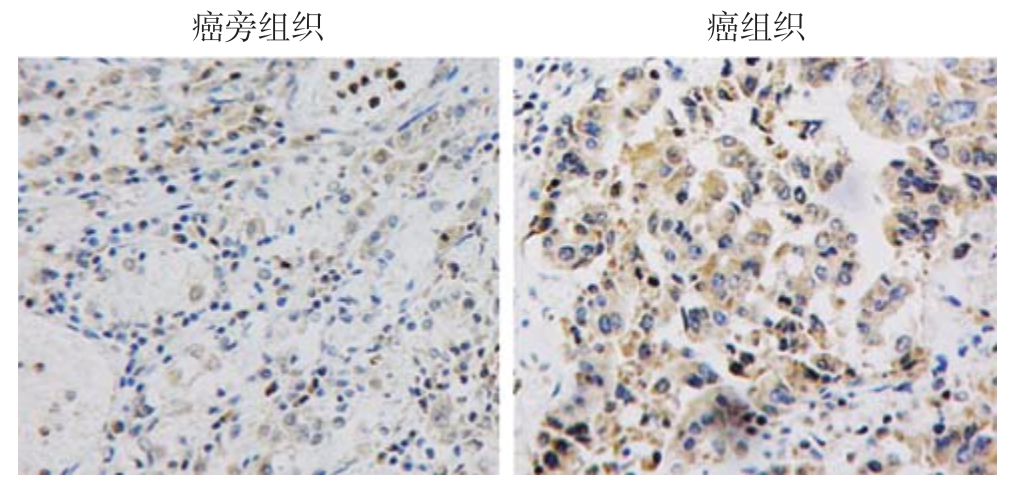
图3 免疫组化检测COL12A1蛋白表达(×200)
Figure 3 Immunohistochemical staining for COL12A1 protein expression (×200)
表1 胃癌组织和癌旁组织中COL12A1的表达比较[n=58,n(%)]
Table 1 Comparison of COL12A1 expressions between gastric and adjacent tissues [n=58, n (%)]

组织 高表达 低表达癌旁组织 10(17.2) 48(82.2)癌组织 46(79.3) 12(20.7)χ2 44.74 P 0.001
2.3 敲低COL12A1的表达对胃癌细胞的生长、增殖和侵袭的影响
为了分析COL12A1在胃癌中的功能,进一步利用脂质体转染特异性靶向COL12A1的siRNA进入胃癌细胞SGC7901,敲低COL12A1的表达水平。经qPCR结果及Western blot验证效果,结果显示,转染后SGC7901中COL12A1的基因与蛋白水平明显降低(图4),利用CCK-8、平板克隆实验和Transwell小室实验,检测了COL12A1对胃癌细胞生长、增殖和侵袭能力的影响。结果显示,敲低COL12A1表达后,SGC7901的生长速度显著减慢(图5A)、克隆形成能力明显降低(图5B)、细胞侵袭能力被明显抑制(图5C)。

图4 COL12A1干扰效率检测
Figure 4 Determination of COL12A1 interfering effi cacy
A:qPCR检测;B:Western blot检测
A: qPCR; B: Western blot
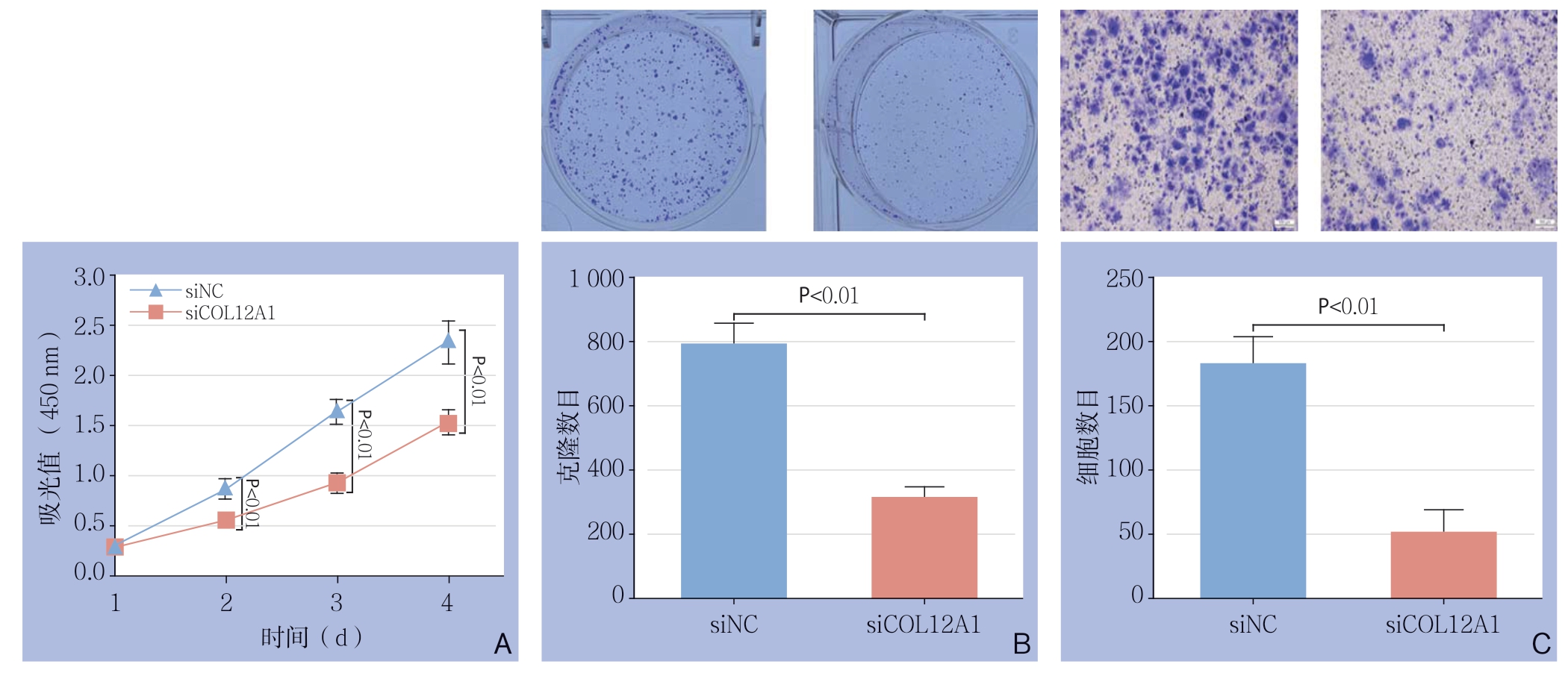
图5 COL12A1对SGC7901生长、增值和侵袭能力的影响
Figure 5 Infl uences of COL12A1 in growth, proliferative and invasion abilities of SGC7901 cells
A:细胞生长曲线;B:克隆形成能力检测;C:细胞侵袭能力检测
A: Cell growth curves; B: Clone formation ability examination; C: Cell invasion ability examination
3 讨 论
不管在全世界范围,还是在我国,胃癌都是发病率和病死率位居前列的恶性肿瘤[1-2]。随着胃癌流行病学特征研究地深入、胃镜等内镜技术的发展以及临床治疗手段的进步,胃癌患者的早诊率有较大提升,预后水平相应有所提升。但是鉴于胃癌阶段症状与慢性胃炎等疾病的症状相似,患者本人健康意识及鉴别能力又相对缺乏,以及现有诊断筛查靶标的局限性,仍导致大多数患者确诊时已处于伴有淋巴结浸润和远处转移的中晚期,严重限制了现有的临床治疗手段的疗效和患者的预后质量[21-22]。因此,在建立和推广早期筛查意识的同时,着力开发新的更有效的胃癌早期诊断标志物兼具理论意义、临床应用价值及社会经济价值。
胶原蛋白作为细胞外基质的主要组成成分,其种类和表达量的稳定是维持细胞和组织功能正常所必须。反之,胶原蛋白表达异常与多种病理过程相关,尤其是恶性肿瘤[6-7]。目前关于胶原蛋白与肿瘤关系的文献报道,几乎涉及了所有组织来源的实体瘤和所有类型的胶原蛋白编码基因或蛋白。同样在胃癌中,多种胶原蛋白被证实与胃癌的发生发展及预后相关。比如,Li等[12]证实,与正常组织相比,COL1A2和COL1A1的表述水平在胃癌组织中显著上调,进一步分析证实,COL1A2和COL1A1表达水平与肿瘤大小及浸润程度正相关,与预后总生存期负相关。随后,研究[14, 23]进一步验证了COL1A2与胃癌预后的关系。另外,COL18A1[24],COL11A1[25]等胶原蛋白也被证实在胃癌中显著升高,且与转移正相关,与预后负相关。同时,IV型胶原蛋白水平被证实在胃癌患者血清中显著升高,且与胃癌的腹膜转移正相关[26]。本研究基于已有的胃癌测序数据,结合临床样本验证,进一步证实了VII胶原蛋白COL12A1在胃癌中同样存在高表达,且与胃癌恶性生物学特征及预后明显有关,进一步证实胶原蛋白与胃癌的发生发展相关,可以作为胃癌早期诊断和预后疗效判断的潜在标志物。
对细胞外基质的重塑,是为肿瘤细胞生长和侵袭的首要步骤。通过改变细胞外基质的组成成分和堆积方式,形成一个细胞极性改变、细胞间黏着连接更疏松的肿瘤微环境,从而促进肿瘤的生长、侵袭和转移等恶性进展[27-29]。因此,作为细胞外基质的主要成分,胶原蛋白在肿瘤的恶性进展中发挥了重要作用。在胃癌中,miR-129-5p可以通过靶向抑制COL1A1的表达,进而抑制胃癌细胞SGC-7901的生长和侵袭[13]。同样,敲低COL11A1的表达,能显著抑制胃癌细胞HGC-27的生长、迁移和侵袭[16]。本研究同样证实,敲低胃癌细胞SGC-7901中COL12A1的表达水平后,细胞的生长和增殖能力被显著抑制,细胞的侵袭能力也显著降低,表明COL12A1同上述胶原蛋白一样,具有促进细胞生长和侵袭能力的效应,提示其可能在胃癌的生长和侵袭转移中发挥了重要作用。
综合已有研究和本研究结果显示,在胃癌中胶原蛋白主要呈集群式上升趋势。那么是否这种集群式的上升,是否存在内在联系?在临床应用潜能评价时,是否多个胶原蛋白的联合应用具有更大的精确性?这些问题都值得进一步深入研究。
[1]Venerito M, Vasapolli R, Rokkas T, et al. Gastric cancer: epidemiology, prevention, and therapy[J]. Helicobacter, 2018, 23(Suppl 1):e12518. doi: 10.1111/hel.12518.
[2]Figueiredo C, Camargo M C, Leite M, et al. Pathogenesis of Gastric Cancer: Genetics and Molecular Classification[J]. Curr Top Microbiol Immunol, 2017, 400:277-304. doi: 10.1007/978-3-319-50520-6_12.
[3]肖磊, 黄昌浩, 袁伟杰, 等. 胃癌组织YAP1、E-cadherin、N-cadherin表达及临床意义[J]. 中国普通外科杂志, 2018, 27(4):442-448. doi:10.3978/j.issn.1005-6947.2018.04.009.Xiao L, Huang CH, Yuan WJ, et al. Expressions of YAP1, E-cadherin and N-cadherin in gastric cancer tissue and their clinical significance[J]. Chinese Journal of General Surgery, 2018, 27(4):442-448. doi:10.3978/j.issn.1005-6947.2018.04.009.
[4]左婷婷, 郑荣寿, 曾红梅, 等. 中国胃癌流行病学现状[J]. 中国肿瘤临床, 2017, 44(1):52-58. doi:10.3969/j.issn.1000-8179. 2017.01.881. Zuo TT, Zheng RS, Zeng HM, et al. Epidemiology of stomach cancer in China[J]. Chinese Journal of Clinical Oncology, 2017, 44(1):52-58. doi:10.3969/j.issn.1000-8179.2017.01.881.
[5]Oudart JB, Monboisse JC, Maquart FX, et al. Type XIX collagen: A new partner in the interactions between tumor cells and their microenvironment[J]. Matrix Biol, 2016, 57/58:169-177. doi: 10.1016/j.matbio.2016.07.010.
[6]Pickup MW, Mouw JK, Weaver VM. The extracellular matrix modulates the hallmarks of cancer[J]. EMBO Rep, 2014, 15(12):1243-1253. doi: 10.15252/embr.201439246.
[7]樊江浩, 刘揆亮, 吴静. 蛋白多糖在肿瘤血管生成中的作用[J]. 临床与病理杂志, 2016, 36(4):515-519. doi:10.3978/j.issn.2095- 6959.2016.04.032.Fan JH, Liu KL, Wu J. The roles of proteoglycans in tumor angiogenesis[J]. International Journal of Pathology and Clinical Medicine, 2016, 36(4):515-519. doi:10.3978/j.issn.2095-6959.2016.04.032.
[8]Raglow Z, Thomas SM. Tumor matrix protein collagen XIα1 in cancer[J]. Cancer Lett, 2015, 357(2):448-453. doi: 10.1016/j.canlet.2014.12.011.
[9]Chen P, Cescon M, Bonaldo P. Collagen VI in cancer and its biological mechanisms[J]. Trends Mol Med, 2013, 19(7):410-417. doi: 10.1016/j.molmed.2013.04.001.
[10]Fang M, Yuan J, Peng C, et al. Collagen as a double-edged sword in tumor progression[J]. Tumour Biol, 2014, 35(4):2871-2882. doi: 10.1007/s13277-013-1511-7.
[11]杨程显, 李戈, 张立颖. 胶原蛋白Ⅳ在肿瘤领域的研究进展[J]. 重庆医学, 2015, 44(32):4586-4588. doi:10.3969/j.issn.1671- 8348.2015.32.044.Yang CX, Li G, Zhang LY. Research progress of Collagen Ⅳ in tumors[J]. Chongqing Medicine, 2015, 44(32):4586-4588. doi:10.3969/j.issn.1671-8348.2015.32.044.
[12]Li J, Ding Y, Li A. Identification of COL1A1 and COL1A2 as candidate prognostic factors in gastric cancer[J]. World J Surg Oncol, 2016, 14(1):297. doi: 10.1186/s12957-016-1056-5.
[13]Wang Q, Yu J. MiR-129-5p suppresses gastric cancer cell invasion and proliferation by inhibiting COL1A1[J]. Biochem Cell Biol, 2018, 96(1):19-25. doi: 10.1139/bcb-2016-0254.
[14]Rong L, Huang W, Tian S, et al. COL1A2 is a Novel Biomarker to Improve Clinical Prediction in Human Gastric Cancer: Integrating Bioinformatics and Meta-Analysis[J]. Pathol Oncol Res, 2018, 24(1):129-134. doi: 10.1007/s12253-017-0223-5.
[15]Huang R, Gu W, Sun B, et al. Identification of COL4A1 as a potential gene conferring trastuzumab resistance in gastric cancer based on bioinformatics analysis[J]. Mol Med Rep, 2018, 17(5):6387-6396. doi: 10.3892/mmr.2018.8664.
[16]Li A, Li J, Lin J, et al. COL11A1 is overexpressed in gastric cancer tissues and regulates proliferation, migration and invasion of HGC-27 gastric cancer cells in vitro[J]. Oncol Rep, 2017, 37(1):333-340. doi: 10.3892/or.2016.5276.
[17]李艳, 黄祥, 伊航, 等. Smad4和NF-κBp65蛋白在肝癌组织中的表达及意义[J]. 中国普通外科杂志, 2018, 27(7):934-938. doi:10.3978/j.issn.1005-6947.2018.07.019.Li Y, Huang X, Yi H, et al. Expressions of Smad4 and NF-κBp65 proteins in liver cancer tissue and their significance[J]. Chinese Journal of General Surgery, 2018, 27(7):934-938. doi:10.3978/j.issn.1005-6947.2018.07.019.
[18]Lei H, Gao Y, Xu X. LncRNA TUG1 inf l uences papillary thyroid cancer cell proliferation, migration and EMT formation through targeting miR-145[J]. Acta Biochim Biophys Sin (Shanghai), 2017, 49(7):588-597. doi: 10.1093/abbs/gmx047.
[19]吴至佛, 姚晓艺, 汪灵, 等. 紫杉醇诱导三阴性乳腺癌细胞自噬相关蛋白LC3的表达及其作用[J]. 中国普通外科杂志, 2018, 27(6):732-739. doi:10.3978/j.issn.1005-6947.2018.06.012.Wu ZF, Yao XY, Wang L, et al. Paclitaxel induced expression of autophagy-associated protein LC3 in triple negative breast cancer cells and its action[J]. Chinese Journal of General Surgery, 2018, 27(6):732-739. doi:10.3978/j.issn.1005-6947.2018.06.012.
[20]Cui J, Chen Y, Chou WC, et al. An integrated transcriptomic and computational analysis for biomarker identification in gastric cancer[J]. Nucleic Acids Res, 2011, 39(4):1197-1207. doi: 10.1093/nar/gkq960.
[21]Kawakami H, Okamoto I. MET-targeted therapy for gastric cancer: the importance of a biomarker-based strategy[J]. Gastric Cancer, 2016, 19(3):687-695. doi: 10.1007/s10120-015-0585-x.
[22]Song Z, Wu Y, Yang J, et al. Progress in the treatment of advanced gastric cancer[J]. Tumour Biol, 2017, 39(7):1010428317714626. doi: 10.1177/1010428317714626.
[23]Zhuo C, Li X, Zhuang H, et al. Elevated THBS2, COL1A2, and SPP1 Expression Levels as Predictors of Gastric Cancer Prognosis[J]. Cell Physiol Biochem, 2016, 40(6):1316-1324. doi: 10.1159/000453184.
[24]Lee KS, Park GS, Hong SH , et al. Prognostic relevance of collagen XVIII expression in metastatic gastric carcinoma[J]. Tumour Biol, 2010, 31(3):165-170. doi: 10.1007/s13277-010-0022-z.
[25]Dabiri A, Baghaei K, Hashemi M, et al. Identification of differentially-expressed of Olfactomedin-related proteins 4 and COL11A1 in Iranian patients with intestinal gastric cancer[J]. Gastroenterol Hepatol Bed Bench, 2017, 10(Suppl1):S62-69.
[26]Ruan HL, Hong RT, Xie HJ, et al. Significance of elevated levels of collagen type IV and hyaluronic acid in gastric juice and serum in gastric cancer and precancerous lesion[J]. Dig Dis Sci, 2011, 56(7):2001-2008. doi: 10.1007/s10620-011-1571-8.
[27]Malik R, Lelkes PI, Cukierman E. Biomechanical and biochemical remodeling of stromal extracellular matrix in cancer[J]. Trends Biotechnol, 2015, 33(4):230-236. doi: 10.1016/j.tibtech.2015.01.004.
[28]Sangaletti S, Chiodoni C, Tripodo C, et al. The good and bad of targeting cancer-associated extracellular matrix[J]. Curr Opin Pharmacol, 2017, 35:75-82. doi: 10.1016/j.coph.2017.06.003.
[29]Jang M, Koh I, Lee JE, et al. Increased extracellular matrix density disrupts E-cadherin/β-catenin complex in gastric cancer cells[J]. Biomater Sci, 2018, 6(10):2704-2713. doi: 10.1039/c8bm00843d.
