新生儿坏死性小肠结肠炎属于严重的新生儿疾病,容易导致肠穿孔,严重者甚至造成早产儿死亡,近年来发病率呈现逐年升高的趋势[1],目前对于该类疾病发生的原因尚不完全明确,考虑和喂养、炎症反应等多种因素有关,有研究[2]指出出生体质量低于1 500 g早产儿中出现坏死性小肠结肠炎的发病率在5%~10%,因此需要积极的开展治疗。近年来小肠造瘘手术是临床治疗坏死性小肠结肠炎的重要方法,但是有报道指出在患儿在失去回盲瓣阻隔和结肠辅助吸收作用会存在相关并发症,患儿肠道黏膜屏障功能减弱,因此术后容易发生细菌移位及营养不良等,因此如何选择手术方法、时机、适应症以及后期开展积极干预治疗对改善患儿预后至关重要[3]。本研究观察了坏死肠道切除及肠道造瘘术对新生儿坏死性小肠结肠炎且出现腹膜炎或内科保守治疗病情加重患者的临床疗效及对于炎症、体液免疫功能的影响,以期为临床提供指导和依据,现汇报如下。
1 资料与方法
1.1 一般资料
选取2014年1月—2018年10月在我院接受治疗的82例新生儿坏死性小肠结肠炎且出现腹膜炎或内科保守治疗病情加重的患者为研究对象。纳入标准:⑴ 在我院分娩的新生儿;⑵ 无其他先天性疾病;⑶ 患儿家属知情同意;排除标准:⑴ 合并其他致死性疾病;⑵ 患儿家属拒绝接受治疗者。根据纳入与排除标准共纳入病例数82例,其中26+5周至36+3周胎龄早产儿59例,38~41周胎龄足月儿23例,男44例,女38例;患儿出生后10~16d。选择同期入院的健康新生儿60例。本项研究经医院伦理委员会评审通过,且患儿家属均知情同意。
1.2 方法
所有患儿麻醉满意后取平卧位,进入腹腔后进行探查,术中依据孤立病变、多段病变和全肠病变选择相应手术及适当的切除范围。对患儿坏死的肠道进行切除,将穿孔肠管两侧5 cm进行切除,将近端的肠管固定在造瘘口外侧,将远端的肠管进行缝扎并置入腹腔。术后转入新生儿科,给予禁食、胃肠减压等常规操作,同时纠正患儿酸碱失衡,补充电解质,术后继续给予抗菌药物进行支持治疗,营养支持方法采取静脉营养,同时补充血浆及白蛋白等。
1.3 评价指标
⑴ 观察82例患儿的疾病转归情况;⑵ 比较患儿手术前后白细胞介素6(IL-6)、降钙素原(PCT)、IgG、IgA等炎症因子和体液免疫指标水平的差异。抽取患儿各时间段和健康新生儿空腹静脉血2~3 mL离心后分离血清,采用酶联免疫吸附法测定其IL-6、PCT、IgG、IgA变化,所有试剂均由德国罗氏公司生产提供,严格按照试剂盒说明书进行操作。其中IL-6正常参考值<7 pg/mL;PCT正常参考值:<0.05 ng/mL。IgA正常值为0~22 mg/L;IgG正常值为7.0~14.8 g/L。⑶ 患儿均随访至术后6个月,追踪患者远期不良反应发生情况。
1.4 统计学处理
数据录入后,采用SPSS 11.5软件进行分析。计数资料采用率(%)表示,组间比较采用χ2检验;计量资料采用均数±标准差( ±s)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
±s)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 患儿疾病转归的观察
82例患儿中,单纯肠穿孔修补术+腹腔冲洗引流术28例,肠切除肠吻合术+腹腔冲洗引流术21例,肠外置或切除坏死肠管后行肠造瘘26例,病情危重仅能行腹腔冲洗引流术7例。
术后因病情危重,家属签字放弃治疗21例(肠切除肠吻合术+腹腔冲洗引流术后1例,肠外置或切除坏死肠管后行肠造瘘术后13例,病情危重仅能行腹腔冲洗引流术7例)。回访均死亡,其中男14例,女7例;早产儿14例,足月儿7例;主要原因为严重肠坏死及肠穿孔导致严重腹腔感染,进而出现败血症、弥漫性血管内凝血(eminated intravascular coagulation,DIC)或多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)。
其余61例患儿胃肠道功能恢复时间为8~15 d,平均(10.35±2.04)d;住院时间15~38天,平均(22.38±3.46)d,住院花费0.99~18.99万,平均(12.35±2.06)万。
2.2 患儿手术前后炎症因子和免疫指标水平的比较
手术前坏死性小肠结肠炎患儿炎症因子指标显著升高,体液免疫因子水平较低,术后1~7 d,IL-6、PCT水平逐渐降低,而IgG、IgA水平出现回升态势,至出院前1天,坏死性小肠结肠炎患儿IL-6、PCT水平较手术前显著降低,IgG、IgA水平较手术前明显升高,差异有统计学意义(t=97.577、71.782、-20.020、-18.216,P<0.001);出院前1天,患儿的IL-6、PCT、IgG和IgA水平与正常新生儿比较,无统计学差异(t=-0.315、-0.903、-0.089、-0.053,P=0.377、0.184、0.465、0.479)(表1)。
表1 患儿手术前后炎症因子和免疫指标水平变化态势
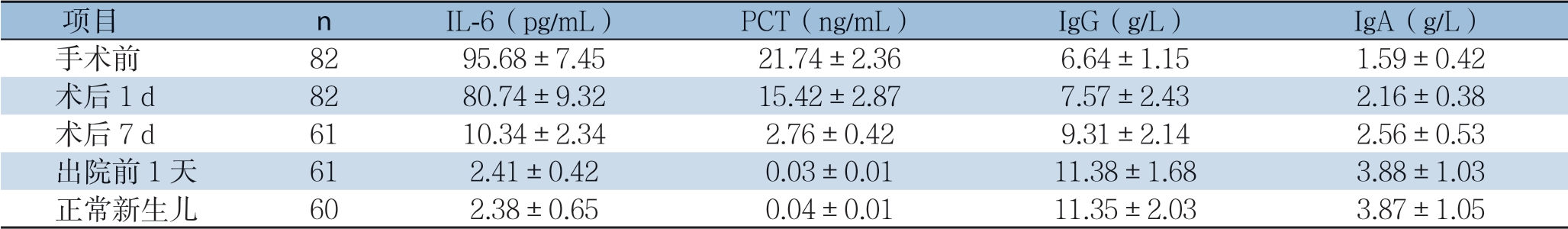
项目 n IL-6(pg/mL) PCT(ng/mL) IgG(g/L) IgA(g/L)手术前 82 95.68±7.45 21.74±2.36 6.64±1.15 1.59±0.42术后1 d 82 80.74±9.32 15.42±2.87 7.57±2.43 2.16±0.38术后7 d 61 10.34±2.34 2.76±0.42 9.31±2.14 2.56±0.53出院前1天 61 2.41±0.42 0.03±0.01 11.38±1.68 3.88±1.03正常新生儿 60 2.38±0.65 0.04±0.01 11.35±2.03 3.87±1.05
2.3 患儿术后并发症发生情况
本组患儿术后未见近期不良反应发生,无继发感染,胃肠道功能均恢复良好,随访6个月也均未发生肠狭窄或肠粘连所致的肠梗阻情况。
3 讨 论
新生儿坏死性小肠结肠炎属于临床严重的新生儿疾病,也是造成新生儿死亡的重要原因之一,有研究[3]指出国内新生儿病房中该病发病率在5.6‰,近年来发病率呈现逐年升高趋势。有学者[4]指出对于胎龄低于30周为新生儿坏死性小肠结肠炎发生的高危因素,由于早产儿胃肠道功能较差,血液循环不稳定,极易造成胃肠黏膜受损,同时早期胃肠道免疫机能缺陷也是导致疾病发生重要原因,因此早期开展诊断并积极进行治疗是改善预后的关键。研究[5]显示由于新生儿的胃肠道发育不成熟,消化吸收功能不佳或者胃肠道蠕动较差均会造成肠道损伤,而肠道为人体最大的免疫器官,出现肠上皮淋巴结功能障碍以及多种细胞因子缺乏会导致胃肠道形成过度的炎症反应,增加了疾病发生率。多数新生儿坏死性小肠结肠炎患儿由于无法早期接受母乳喂养,体内缺乏有益菌定植,肠道菌群建立延迟,患儿体内容易发生肠道细菌移位引发的炎症反应,还有研究指出配方奶喂养数量和频率、乳液渗透性、细菌发酵产物等均对早产儿胃肠道功能有影响,增加早产儿发生肠道疾病的可能性[6]。此外在患儿中还存在缺氧和组织灌注不足,各种因素形成的缺氧状态会诱发患儿出现缺氧低灌注损伤,而且与胎龄、出生体质量呈负相关,一旦发生低灌注后机体对心、脑、肾进行选择性灌注,继而引发胃肠道低灌注和肠道黏膜低氧缺血,诱发肠道坏死[7]。发病后患儿出现小肠结肠广泛性的出血坏死,临床体征可见喂养不耐受、便血等症状,严重的还会发生感染性休克以及呼吸停止,危及患儿生命安全[8]。目前临床主要采取综合性治疗,非手术治疗包括采取胃肠减压、抗炎等对症支持治疗,但是多数患儿需要采取手术治疗。
目前临床常用的手术方法为坏死肠道切除与肠道造瘘手术,该术式为外科最为常用的手术方法,通过将肠管开口并切除病死肠管,将肠管开口同腹壁相通以排泄胃肠道的废物、降低胃肠道压力,目前认为该术式主要适用于新生儿出现肠穿孔并伴有休克通过抢救无效、切除坏死肠管无法确定剩余肠管的血供是否良好以及腹腔感染较为严重的患儿[9-11]。在手术过程中选取的造瘘口位置应尽量远离皮肤的褶皱部位,同时要将结肠和结肠旁沟进行缝合以避免发生内疝,造瘘口处的肠管还要和周围的皮肤进行紧密缝合,避免肠管脱出形成肠坏死进展[12]。笔者在手术过程中总结了以下注意事项,一方面手术中对于造瘘口的肠管要确保有动脉搏动,同时观察有无扭转,避免肠管出现坏死与造口的回缩,手术过程中应注意患儿的保暖,必要时可以将新生儿放置在循环保温毯开展手术,手术过程中也要将肠道全部检查,对于存在先天性巨结肠病变的患儿,单纯修补穿孔往往无法达到理想的治疗效果,同时术中要常规对腹腔积液抽取并进行细菌培养以助于术后抗菌药物的使用[13]。另一方面手术过后要对患儿加强巡视和观察,了解造瘘肠管颜色与肠管内排出物的性状,强化对造瘘口的护理,避免肠液与胆汁造成造瘘口周围皮肤的腐蚀[14]。此外还应注意术后并发症发生,对于肠管脱出主要是造瘘口护理不当造成皮肤破坏或者患儿啼哭造成腹压升高造瘘口近端肠管的活动性升高,因此可以选择性使用镇静药物让患者在安静状况下对脱垂的肠管进行整复并利用碟形胶布将造瘘口切口周围拉紧、固定[15]。造瘘口肠管发生坏死则主要是肠系膜损伤未发现或者肠管系膜损伤导致肠管扭转造成,对于这种情况则要加强观察,一旦发生应立即开展再次造瘘手术[16]。
本组84例患儿的研究中,单纯肠穿孔修补术+腹腔冲洗引流术28例,肠切除肠吻合术+腹腔冲洗引流术21例(术后死亡1例),肠外置或切除坏死肠管后行肠造瘘26例(术后死亡13例),病情危重仅能行腹腔冲洗引流术7例(术后患儿均死亡)。术后因病情危重,家属签字放弃治疗21例,回访均死亡,其中男14例,女7例;早产儿14例,足月儿7例。主要原因为严重肠坏死及肠穿孔导致严重腹腔感染,进而出现败血症、DIC或MOD。
本研究结果显示治疗后,手术前坏死性小肠结肠炎患儿炎症因子指标显著升高,体液免疫因子水平较低,术后1~7 d,IL-6、PCT水平逐渐降低,而IgG、IgA水平出现回升态势,至出院前1天,坏死性小肠结肠炎患儿IL-6、PCT水平较手术前显著降低,IgG、IgA水平较手术前明显升高,差异有统计学意义(t=97.577、71.782、-20.020、-18.216,P<0.001)。说明坏死肠道切除及肠道造瘘术可以降低新生儿坏死性小肠结肠炎炎症反应程度,改善患儿机体免疫机能。出院前1天,患儿的IL-6、PCT、IgG和IgA水平与正常新生儿相当,无统计学差异(t=-0.315、-0.903、-0.089、-0.053,P=0.377、0.184、0.465、0.479),说明经过坏死肠道切除及肠道造瘘术治疗新生儿坏死性小肠结肠炎患儿术后体液免疫功能恢复较快,可以达到正常新生儿状态。本组患儿术后未见近期不良反应发生,胃肠道功能均恢复良好,随访6个月也均未发生肠狭窄或肠粘连所致的肠梗阻情况。可见手术成功患儿的预后相对较好。与既往研究[17-21]结果基本一致。本研究优势在于证实了坏死肠道切除及肠道造瘘术治疗新生儿坏死性小肠结肠炎临床治疗效果,为临床合理治疗新生儿坏死性小肠结肠炎提供了更为可靠的方法,但是本研究纳入患儿数量有限,也未能进行随机分组对比观察,因此还需要进一步开展多中心、随机性试验、长期随访观察深入论证。
综上所述,坏死肠道切除及肠道造瘘术对新生儿坏死性小肠结肠炎且出现腹膜炎或内科保守治疗病情加重的的治疗效果较好,手术成功患者的预后较好,可能与术后IL-6、PCT、IgG、IgA等炎症和体液免疫因子的恢复较快有关。术前综合评定患儿整体情况,采取恰当的手术方式,紧密观察围手术期的不良情况并及时纠正,可提高患儿生存率,改善远期预后。
[1]刘斌. 新生儿坏死性小肠结肠炎外科诊疗进展[J]. 中国普通外科杂志, 2015, 24(10):1463-1467. doi:10.3978/j.issn.1005-6947.2015.10.022.Liu B. Progress in diagnosis and surgical treatment for neonatal necrotizing enterocolitis [J]. Chinese Journal of General Surgery, 2015, 24(10):1463-1467. doi:10.3978/j.issn.1005-6947.2015.10.022.
[2]Schönherr-Hellec S, Aires J. Clostridia and necrotizing enterocolitis in preterm neonates[J]. Anaerobe, 2019, pii: S1075-9964(19)30072-1. doi: 10.1016/j.anaerobe.2019.04.005. [Epub ahead of print]
[3]Gómez-Rodríguez G, Amador-Licona N, Daza-Benítez L, et al. Single strain versus multispecies probiotic on necrotizing enterocolitis and faecal IgA levels in very low birth weight preterm neonates: A randomized clinical trial[J]. Pediatr Neonatol, 2019, pii: S1875-9572(18)30433-9. doi: 10.1016/j.pedneo.2019.02.005. [Epub ahead of print]
[4]Hansen ML, Jensen IV, Gregersen R, et al. Gastrointestinal sequelae and growth impairment at school age following necrotising enterocolitis in the newborn period[J]. Acta Paediatr, 2019, doi: 10.1111/apa.14789. [Epub ahead of print]
[5]Overman RE Jr, Criss CN, Gadepalli SK. Necrotizing enterocolitis in term neonates: A different disease process?[J]. J Pediatr Surg, 2019, pii: S0022-3468(19)30187-3. doi: 10.1016/j.jpedsurg.2019.02.046. [Epub ahead of print]
[6]Babu S, Prasad M, Miller M, et al. Use of serum citrulline concentrations from routine newborn screen as a biomarker for necrotizing enterocolitis[J]. Pediatr Surg Int, 2019. doi: 10.1007/s00383-019-04470-9. [Epub ahead of print]
[7]Malek AJ, Mrdutt MM, Scrushy MG, et al. Long-term growth outcomes in neonates diagnosed with necrotizing enterocolitis: a 20-year analysis[J]. J Pediatr Surg, 2019. pii: S0022-3468(19)30065-X. doi: 10.1016/j.jpedsurg.2019.01.028. [Epub ahead of print]
[8]Alganabi M, Lee C, Bindi E, et al. Recent advances in understanding necrotizing enterocolitis [J]. F1000Res, 2019, pii: F1000 Faculty Rev-107. doi: 10.12688/f1000research.17228.1. eCollection 2019.
[9]Baranowski JR, Claud EC. Necrotizing enterocolitis and the preterm infant microbiome[J]. Adv Exp Med Biol, 2019. doi: 10.1007/5584_2018_313. [Epub ahead of print]
[10]Samuels N, van de Graaf RA, de Jonge RCJ, et al. Risk factors for necrotizing enterocolitis in neonates: a systematic review of prognostic studies[J]. BMC Pediatr, 2017, 17(1):105. doi: 10.1186/s12887-017-0847-3.
[11]徐丰, 巩艳霞, 景登攀. 新生儿坏死性小肠结肠炎的早期诊断及治疗[J]. 河南外科学杂志, 2017, 23(1):80-81.Xu F, Gong YX, Jing DP. Early diagnosis and treatment of neonatal necrotizing enterocolitis[J]. Henan Journal of Surgery, 2017, 23(1): 80-81.
[12]Al-Zaiem M, Al-Garni AF, Al-Maghrebi A, et al. Use of T-tube enterostomy in neonatal gastro-intestinal surgery[J]. J Neonatal Surg, 2016, 5(4):46. doi: 10.21699/jns.v5i4.456.
[13]Koike Y, Uchida K, Nagano Y, et al. Enteral refeeding is useful for promoting growth in neonates with enterostomy before stoma closure[J]. J Pediatr Surg, 2016, 51(3):390-394. doi: 10.1016/j.jpedsurg.2015.08.058.
[14]李秋宇, 安瑶, 刘利, 等. 早发型与晚发型足月新生儿坏死性小肠结肠炎临床对比分析[J]. 临床儿科杂志, 2017, 35(3):161-165. doi:10.3969/j.issn.1000-3606.2017.03.001. Li QY, An Y, Liu L, et al. Clinical comparison between earlyonset and late-onset necrotizing enterocolitis in full-term infants[J]. Journal of Clinical Pediatrics, 2017, 35(3):161-165. doi:10.3969/j.issn.1000-3606.2017.03.001.
[15]中华医学会小儿外科学分会新生儿学组. 新生儿坏死性小肠结肠炎小肠造瘘术后临床治疗专家共识[J]. 中华小儿外科杂志, 2016, 37(8):563-567. doi:10.3760/cma.j.issn.0253-3006.2016.08. 002.Expert consensus of neonatal group of pediatric surgery branch of Chinese medical association on postoperative clinical treatment of neonatal necrozing enterocolitis after enterostomy[J]. Chinese Journal of Pediatric Surgery, 2016, 37(8):563-567. doi:10.3760/cma.j.issn.0253-3006.2016.08.002.
[16]陈发玲, 徐伟珏, 李龙至, 等. 不同病变范围新生儿坏死性小肠结肠炎手术干预效果分析[J]. 中华实用儿科临床杂志, 2016, 31(23):1783-1786. doi:10.3760/cma.j.issn.2095-428X.2016. 23.006.Chen FL, Xu WY, Li LZ, et al. Outcomes of surgical intervention for necrotizing enterocolitis within different pathological range[J]. Chinese Journal of Applied Clinical Pediatrics, 2016, 31(23):1783-1786. doi:10.3760/cma.j.issn.2095-428X.2016.23.006.
[17]Zhu XL, Tang XG, Qu F, et al. Bifidobacterium may benefit the prevention of necrotizing enterocolitis in preterm infants: A systematic review and meta-analysis [J]. Int J Surg, 2019, 61:17-25. doi: 10.1016/j.ijsu.2018.11.026.
[18]姬响华, 王文华, 郭凯娜. 肠内置管外引流术治疗新生儿坏死性小肠结肠炎的疗效分析[J]. 东南大学学报:医学版, 2017, 36(4):542-546. doi:10.3969/j.issn.1671-6264.2017.04.008.Ji XH, Wang WH, Guo KN. Analysis of therapeutic effect of insertion of enteral tube for external drainage in treatment of neonatal necrotizing enterocolitis[J]. Journal of Southeast University: Medical Edition, 2017, 36(4):542-546. doi:10.3969/j.issn.1671-6264.2017.04.008.
[19]杜俊鹏. 回肠造瘘术在新生儿重症坏死性小肠结肠炎肠穿孔治疗中的应用体会[J].中华解剖与临床杂志, 2018, 23(3):261-262. doi:10.3760/cma.j.issn.2095-7041.2018.03.017.Du JP. Clinical application of ileostomy in the treatment of severe necrotizing enterocolitis[J]. Chinese Journal of Anatomy and Clinical, 2018, 23(3):261-262. doi:10.3760/cma.j.issn.2095-7041.2018.03.017.
[20]林慧佳, 施丽萍, 杜立中. 新生儿坏死性小肠结肠炎患儿的远期预后[J]. 中国当代儿科杂志, 2018, 20(12):985-989. doi:10.7499/j.issn.1008-8830.2018.12.002.Lin HJ, Shi LP, Du LZ. Long-term prognosis of neonates with necrotizing enterocolitis [J]. Chinese Journal of Contemporary Pediatrics, 2018, 20(12):985-989. doi: 10.7499/j.issn.1008-8830.2018.12.002.
[21]王雪秋, 陈师, 郭露, 等. 新生儿坏死性小肠结肠炎与自发性肠穿孔临床对比分析[J]. 临床儿科杂志, 2018, 36(11):871-874. doi:10.3969/j.issn.1000-3606.2018.11.017.Wang XQ, Chen S, Guo L, et al. Comparison of clinical features of necrotizing enterocolitis with spontaneous intestinal perforation in infants [J]. Journal of Clinical Pediatrics, 2018, 36(11):871-874. doi:10.3969/j.issn.1000-3606.2018.11.017.
