肝移植是治疗肝细胞肝癌(以下简称肝癌)的重要手段,与肝切除术相比,肝移植术后肝癌复发率低,患者的长期生存更具优势[1]。然而多个移植中心的大样本数据表明,肝移植术后肝癌的5年累计复发率为10%~20%,平均复发时间为移植术后1~2年内,复发后中位生存时间仅约1年[2-9]。2018年Mazzaferro等[10]的一项回顾分析发现,肝移植术后肝癌复发相关的5年累计病死率为8.1%,占受者总体死亡的1/3,严重影响了移植疗效;而根据中国肝移植注册中心数据[11],中国近5年来肝癌肝移植占肝移植总例数的36.8%,高于欧洲的12.1%,形势更为严峻。与肝切除术后肝癌复发主要为肝内转移不同,肝移植术后的转移部位以肝外为主。《中国肝癌肝移植临床实践指南(2 0 1 8版)》指出,肝移植后常见转移部位依次为肺(3 7.2%~5 5.7%)、移植肝(37.8%~47.9%)、腹腔(27.3%~37.7%)和骨(22.3%~25.5%)[11],故肺转移是防治肝移植术后肝癌复发的重点。肺转移早期循环肿瘤细胞可定植于肺泡血管床,无明显临床表现。肝移植术后免疫抑制剂的使用导致受者处于长期免疫抑制状态,转移灶进展迅速,往往表现多发转移灶,增加了治疗难度[12]。因此,研究肝移植术后肝癌复发的影响因素(主要包括术前、术中、术后3个方面),筛选高危人群,早期预警,是防治肝移植术后肝癌复发的主要目标。
1 肝移植术前影响因素
1.1 肝癌肝移植受者选择标准
移植受者选择标准直接决定了肝癌肝移植适用人群,超出移植标准的患者在接受肝移植术后的复发率远高于符合移植标准患者。世界各地移植中心依据肿瘤生物学或血清学检查,先后提出了不同的肝癌肝移植受者选择标准(表1)。1996年Mazzaferro等[2]最早提出了米兰标准,即单个肿瘤直径≤5 cm,或肿瘤数目≤3个、最大直径≤3 cm且不伴有血管侵犯(VI)。米兰标准的提出对世界肝移植发展具有划时代意义,但米兰标准十分苛刻,使大量肝癌患者失去了肝移植机会。后续多个中心先后提出了不同的移植标准。2001年来自美国加州大学旧金山分校的Yao等[3]提出了超越米兰标准的UCSF标准,即单个肿瘤直径≤6.5 cm,或肿瘤数目≤3个、最大直径≤4.5 cm、总肿瘤直径≤8 cm且无VI。UCSF标准扩大了肝移植的适用人群,使更多的肝癌患者能接受肝移植治疗。
米兰标准与UCSF标准的提出主要依据肿瘤形态学特征,以肿瘤的大小、数量、有无VI为标准,但是肿瘤生物学特征不可忽视。2008年杭州标准应运而生[4],提出:⑴ 无门静脉癌栓;⑵ 肿瘤累计直径≤8 cm或肿瘤累计直径>8 cm、术前甲胎蛋白≤400 ng/mL且组织学分级为高/中分化。杭州标准不局限于肿瘤的形态特征,并引入病理学分级与血清标志物的检测,更为科学地扩大了肝移植适用人群,且在防治肿瘤复发率上亦有优秀的表现。2016年Xu等[5]在杭州标准原有基础上,将杭州标准分为A组(肿瘤直径≤8 cm肿瘤累计直径>8 cm、术前甲胎蛋白≤100 ng/mL)与B组(肿瘤累计直径>8 cm、术前甲胎蛋白>100~400 ng/mL)。其中A组的1、3、5年无瘤生存期(3 827例,8 6.1%、7 4.4%、6 9.5%)优于B组(1 5 1例71.3%、47.8%、38.8%),进一步丰富了杭州标准的内涵。
自杭州标准以后,更多移植中心开始推出AFP与肿瘤生物学结合的肝癌肝移植标准,术前便可通过肿瘤生物特征与AFP的检测,对肝移植术后肝癌复发患者进行筛选,有目的地针对肝癌复发高危患者进行防治。Toso等[6]表明术前AFP>400 ng/mL或肿瘤总体积(TTV)>115 cm3的患者术后3年生存率不足50%;哥伦比亚大学医学中心提出的Combo-MORAL评分[7](共26分)包涵了AFP>200 ng/mL(记4分)、中性粒/淋巴细胞比NLR>5(记6分)、最大单个肿瘤直径>3 cm(记3分)、术后病理最大单个肿瘤直径>3 cm(记3分)、术后病理肿瘤个数>3个(记2分)、VI(记2分)、组织学分级G4(记6分)7项危险因素。Combo-MORAL评分低危组与中危组(评分0~2分、3~6分)的5年无复发生存率均高于80%,而高危组(7~10分)不足50%,极高危组(评分>10分)5年无复发生存率仅20%。但是NLR易受到感染、类固醇使用等因素的影响发生假性升高,故在使用NLR作为危险因素时应当结合受者的实际情况进行判断。
在AFP之外,也有中心提出以维生素K缺乏诱导蛋白(PIVKA-II)/凝血酶原(DCP)为新标准的方案。2007年日本Takada等[8]提出了DCP结合肿瘤生物学的京都标准,即肿瘤数目≤10,肿瘤直径≤5 cm,DCP≤400 mAU/mL。京都标准内的5年累计肝癌复发率与5年生存率远优于超京都标准组(5% vs.61%,87% vs.37%)。2014年Shindoh等[9]将AFP、DCP、肿瘤生物学三者结合,研究并发现:肿瘤最大直径>5 cm(1分),AFP>200 ng/mL(1分),DCP>450 mAU/mL(1分),三者均是影响肝移植术后肝癌复发的危险因素。低危险组(0~1分)的5年无病生存率显著优于高危组(2~3分)(97.9% vs.20%)。
目前全世界的移植标准百家争鸣,杭州标准起了重要的引领作用。随着新的生物标志物的开发,在未来可能涌现更科学的标准,指导肝癌肝移植与肝移植术后肝癌复发的防治。
表1 国际常用肝癌肝移植受体选择标准
Table1 The commonly used selection criteria for recipient of liver transplantation for HCC
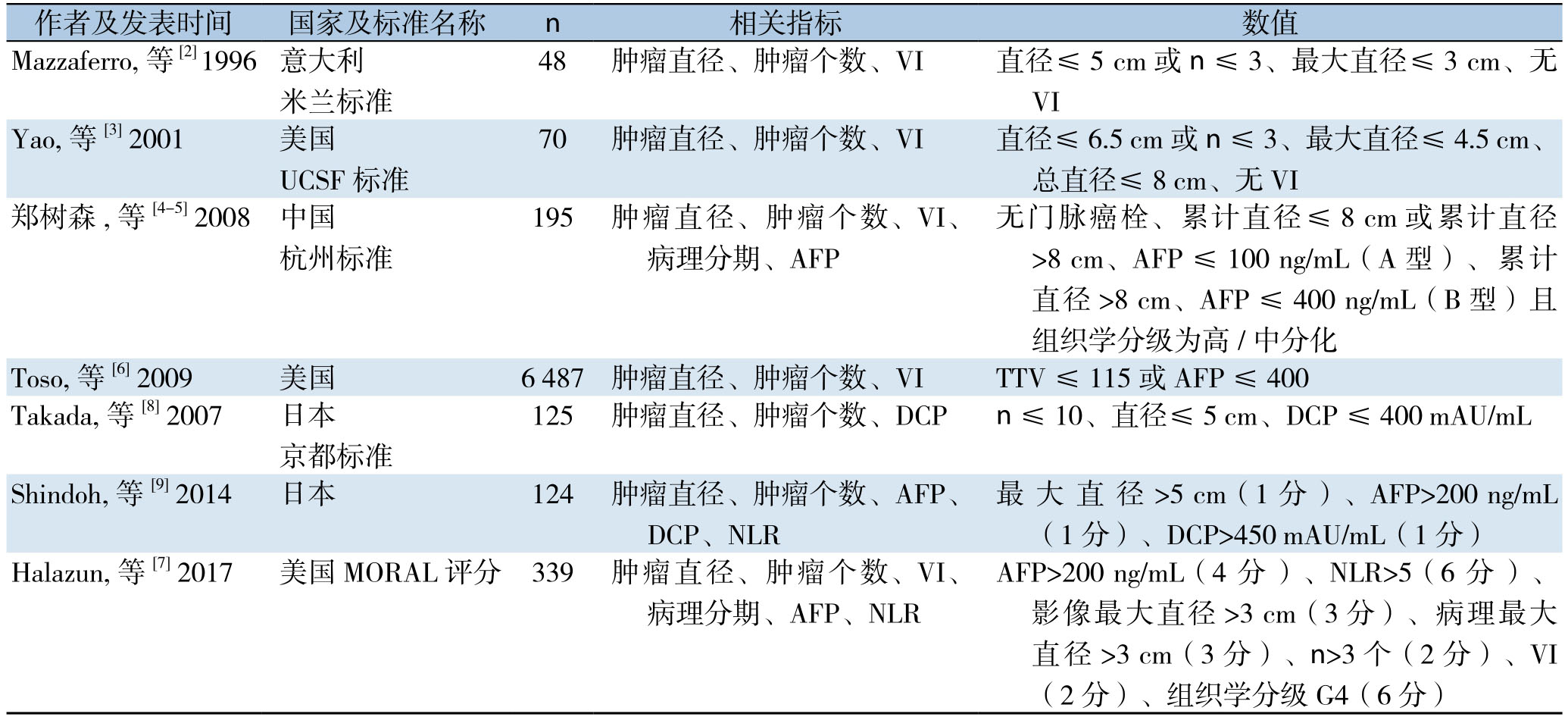
作者及发表时间 国家及标准名称 n 相关指标 数值Mazzaferro,等 [2] 1996 意大利米兰标准48 肿瘤直径、肿瘤个数、VI 直径≤5 cm或n≤3、最大直径≤3 cm、无VI Yao,等 [3] 2001 美国UCSF标准无门脉癌栓、累计直径≤8 cm或累计直径>8 cm、AFP ≤ 100 ng/mL(A 型)、累计直径 >8 cm、AFP ≤ 400 ng/mL(B 型)且组织学分级为高/中分化Toso,等[6] 2009 美国 6 487 肿瘤直径、肿瘤个数、VI TTV≤115或AFP≤400 Takada,等 [8] 2007 日本京都标准70 肿瘤直径、肿瘤个数、VI 直径≤6.5 cm或n≤3、最大直径≤4.5 cm、总直径≤8 cm、无VI郑树森 ,等 [4-5] 2008 中国杭州标准195 肿瘤直径、肿瘤个数、VI、病理分期、AFP 125 肿瘤直径、肿瘤个数、DCP n≤10、直径≤5 cm、DCP≤400 mAU/mL Shindoh,等[9] 2014 日本 124 肿瘤直径、肿瘤个数、AFP、DCP、NLR最 大 直 径 >5 cm(1 分 )、AFP>200 ng/mL(1 分)、DCP>450 mAU/mL(1 分)Halazun,等[7] 2017 美国MORAL评分 339 肿瘤直径、肿瘤个数、VI、病理分期、AFP、NLR AFP>200 ng/mL(4 分 )、NLR>5(6 分 )、影像最大直径>3 cm(3分)、病理最大直径 >3 cm(3分)、n>3个(2分)、VI(2分)、组织学分级G4(6分)
1.2 术前降期治疗
在肝移植前部分受者会处于移植标准临界状态,在等待供肝期间肝癌进展可能超过移植标准,或已超出部分移植标准,错失移植机会。为了在移植前控制肝癌进展,患者需接受TACE术、射频消融术(RFA)、经皮酒精消融术(PEA)为代表的局部治疗(LRT),达到术前降期目的,顺利过渡到肝移植术。而这些以局部治疗为主的降期治疗也影响了肝移植术后肝癌复发。有学者提出在移植前因降期治疗需要接受LRT的患者,移植术后肝癌复发更少,生存更优。来自UCSF Yao等[13]通过RFA、TACE等LRT对61例患者降期,成功率75%。其中35例接受肝移植术的患者4年内均无肝癌复发。2017年匹兹堡大学Oligane等[14]通过研究美国器官分配网络(UNOS)中2 794例肝移植数据,其中因降期治疗接受LRT的患者复发率为8.6%,低于总体复发率11.5%。LRT组的中位生存期也显著优于non-LRT组(75.9个月vs.53.1个月)。
尽管以上研究表明术前降期治疗可使等待供肝的患者生存受益,减少了肝移植术后肝癌复发的风险,但也有学者提出不同观点。2017年华盛顿大学的团队报道了384例肝癌患者,其中2 6 8例移植术前因降期需要,接受过T A C E、RFA、PEA等局部治疗。研究发现LRT组与non-LRT组肝癌复发率无统计学差异(P=0.934)。接受局部治疗后肿瘤发生完全坏死、部分坏死、无坏死的患者分别为5 8例(2 1.6%)、70例(26.1%)、140例(52.2%)。其中完全坏死组的5年复发率(6.1%)显著低于部分坏死组(22.6%)。然而无坏死组的5年复发率与完全坏死组基本相同(5.2%)[15]。2017年,UCLA的Agopian等[16]研究了美国多中心3 601例肝移植前接受桥接LRT的患者,发现LRT组(n=2 854)与non-LRT组(n=747)两者5年复发率无统计学差异(11.2% vs.10.1%,P=0.474),5年无复发生存相同(68% vs.68%)。然而LRT组中,702例发生完全缓解的患者肝癌复发率为5%,显著低于non-LRT组的10.1%;而2 152例发生部分缓解或无缓解的患者移植术后肝癌复发率约13%。
这些研究提示了,发生完全缓解的术前降期治疗,可减少肝移植术后肝癌复发,但发生部分缓解的患者复发率反而可能升高。因此,进一步提高降期治疗的有效率和成功率,将是今后研究的重点。
1.3 生物标志物
生物标志物在肝癌组织的异常表达可影响肝移植术后肝癌复发。这些生物标志物包括:长链非编码RNA(lncRNA)、微小RNA(micro R N A)、蛋白质、单核苷酸多态性(SNP)等,它们通过复杂的生物学途径调控肝癌的增殖、迁移能力,最终影响肝移植术后肝癌复发。lncRNA HOTTIP在肝癌组织中通过调节Wnt通路关键蛋白Wnt-5α,导致肝癌的增值、凋亡与侵袭相关通路的改变,增强肝癌转移能力[17];在体内外实验敲除miR-424,均可显著减少肝癌生长[18]。来自受者的生物标志物的也不局限于肝癌组织,近年来无创检测的发展使得仅凭借受者外周血即可获得生物标志物。日本学者Sugimachi等[19]率先通过分离术前外周血中外泌体,寻找生物标志物,并发现miR-718低表达组的5年复发率为14.3%(6/42),而高表达组则无一复发(0/11)。移植术后发生肝癌复发的病人miR-718显著下调。
此外,来自供肝组织的生物标志物也可影响肝癌在肝移植术后的复发,尤其是供肝组织的生物标志物的单核苷酸多态性。供肝组织一碳代谢通路中MTRR rs1801394 SNP AA基因型的无复发生存期[(1 097±155)d]显著低于AG/GG型[(1 657±173)d][20];Xu等[21]的一项关于中国汉族人口肝移植的研究表明:汉族人口供肝组织中miR-196a-2 rs11614913 SNP的CC基因型,肝癌复发率(41.7%)远高于TT/CT型(18.4%)。这一系列基于供肝的创新研究发现了供肝在肝移植术后肝癌复发中的重要性,为肝移植术后肝癌复发预测生物标志物的研究提供了新思路。
以上影响肝癌肝移植术后肝癌复发的生物标志物的样本来源、采集方式、分子机制均有不同(表2)。通过检测生物标志物有助于筛选肝癌肝移植术后肿瘤复发的高危患者,从而进一步降低肝癌复发率。
表2 影响肝癌肝移植术后复发相关生物标志物
Table2 The relevant biomarkers affecting post-transplant HCC recurrence
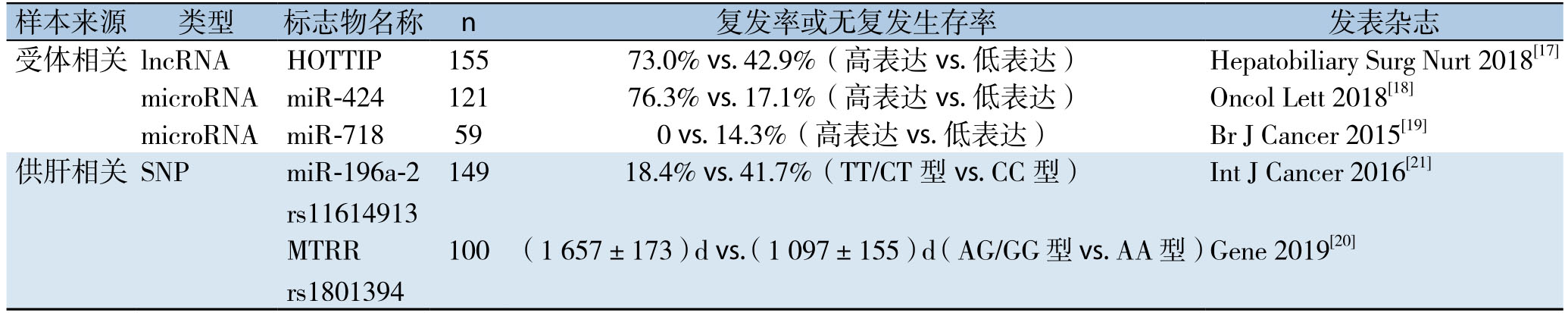
样本来源 类型 标志物名称 n 复发率或无复发生存率 发表杂志受体相关 lncRNA HOTTIP 155 73.0% vs.42.9%(高表达 vs.低表达) Hepatobiliary Surg Nurt 2018[17]microRNA miR-424 121 76.3% vs.17.1%(高表达 vs.低表达) Oncol Lett 2018[18]microRNA miR-718 59 0 vs.14.3%(高表达 vs.低表达) Br J Cancer 2015[19]供肝相关 SNP miR-196a-2 rs11614913 149 18.4% vs.41.7%(TT/CT 型 vs.CC 型) Int J Cancer 2016[21]MTRR rs1801394 100 (1 657±173)d vs.(1 097±155)d(AG/GG 型 vs.AA 型)Gene 2019[20]
2 肝移植术中影响因素
2.1 手术操作
肝癌细胞迁移能力强,易进入血液循环发生肝内转移与肝外转移,因此尽量避免肿瘤细胞的播散是手术中防治复发的关键因素之一。肝移植术中操作应当轻柔,减少对肝癌组织不必要的挤压,提倡“no-touch”技术[22]。笔者所在团队长期以来一直倡导“直奔第一肝门、快速下肝”的non-touch手术理念,最大限度降低因手术操作导致肝癌细胞播散的可能。
2.2 出血量
肝移植术中失血量(IBL)越多,移植术后肝癌复发的风险越大。Liu等[23]研究了479例肝移植,发现肝移植IBL<1 L、IBL 1~<2 L、IBL2~<3 L、IBL3~<4 L、IBL≥4 L的患者,术后的3年复发率分别为44.7%、37.3%、48.4%、43.0%、62.8%,IBL>4 L与肝癌肝移植术后复发显著相关。中国肝移植注册中心数据显示2015年我国肝移植受者平均IBL为2 034 mL,2016年下降至1 853 mL,2018年已降至1 423 mL,总体而言我国肝移植平均IBL呈逐年下降趋势。随着肝移植技术的进一步推广与成熟,未来中国肝移植的平均IBL有望继续下降,这对减少肝癌肝移植术后肿瘤复发有积极的作用。
2.3 供肝缺血时间
供肝缺血时间亦可影响肝癌的复发与转移。Recanati/Miller移植中心通过研究391例肝移植病例发现,冷缺血时间(CIT)>10 h与热缺血时间(WIT)>50 min,是肝移植术后肝癌复发的2项独立危险因素[24]。在该研究中CIT<4 h组的3年无复发生存率为92%,而CIT>10 h组则为74.1%;WIT<30min组的3年无复发生存率为87%,而WIT>50 min组则为76.5%。无论CIT或WIT的延长均可导致术后肝癌高复发率,影响患者术后长期生存。因此,肝脏获取时最大限度的减少冷/热缺血时间,不仅是对移植肝质量的有效保障,对防治肿瘤复发也有一定效果。
3 肝移植术后影响因素
3.1 免疫抑制剂方案
肝移植术后长期使用免疫抑制剂使患者处于的免疫抑制状态,降低了人体清除残留在血液循环中肿瘤细胞的能力,增加患者感染和肿瘤复发的风险。目前以钙调素抑制剂(CNI)他克莫司为基础的免疫抑制方案使肝移植术后肝癌复发的风险大大提高。意大利学者Vivarelli等[25]研究发现肝移植术后,使用他克莫司的患者中,肝癌复发组他克莫司使用剂量高于未复发组[复发组(11.6±1.5)ng/mL vs.无复发组(8.6±1.7)ng/mL]。笔者团队提倡术后早期撤除糖皮质激素或应用无激素方案,应用低剂量他克莫司,可有效减少肝癌复发。
此外,应用mTORi免疫抑制方案可显著减少肝移植术后肝癌复发。Cholongitas等[26]一项系统性评价显示使用肝移植术后应用mTORi的患者,肝癌复发率显著低于使用他克莫司的患者(8% vs.13.8%),其中mTORi依维莫司使用组的复发率最低(4.1%)[26];此外西班牙学者Gomez-Martin等[27]一项关于mTORi研究显示,术后应用mTORi联用他克莫司组的肝癌复发率(3.2%)较他克莫司单用组(58.1%)显著下降。
3.2 全身治疗
全身化疗对肝移植术后肝癌复发的防治效果不尽人意。早年一项多中心研究表明:多柔比星对预防肝移植术后肝癌复发无显著影响,多柔比星使用组与对照组的3年无复发生存率无统计学差异[28]。其他药物如顺铂、阿霉素等近年来也缺乏相关研究。目前,索拉非尼作为肝癌分子靶向药物治疗一线用药,与mTORi联用可对肝移植术后肝癌复发有防治作用。Gomez-Martin等[27]研究发现,索拉非尼与mTORi联用可有效延长患者生存(复发后中位生存期19.3个月)。全身辅助新疗法,包括免疫靶向药物PD-1/PD-L1单抗、多靶点受体酪氨酸激酶抑制剂仑伐替尼等分子靶向药物以及CAR-T疗法等,在肝癌治疗中有潜在的应用前景。笔者团队牵头组织的“十三五”国家科技重大专项正通过加强多中心合作,探索肝癌肝移植诊疗新体系,推进相关临床研究。
4 展 望
随着大数据分析在医疗领域的进展,多组学分析在肿瘤发生发展和肿瘤转移分子机制中的深入应用,未来有望开发出更灵敏更精确的生物标志物,指导建立更科学的肝癌肝移植标准。提高术前降期治疗缓解率,降低免疫抑制剂副作用,开发新靶向药物,探索肝移植新术式,将是未来重要研究方向。积极开展更多基于新技术、新方案的多中心、大样本研究,推进肝癌肝移植精准医疗体系的建设,更准确地把控肝癌肝移植术后复发的影响因素,才能实现肝移植治疗效果质的飞跃。
[1]de'Angelis N,Landi F,Carra MC,et al.Managements of recurrent hepatocellular carcinoma after liver transplantation:A systematic review[J].World J Gastroenterol,2015,21(39):11185-11198.doi:10.3748/wjg.v21.i39.11185.
[2]Mazzaferro V,Regalia E,Doci R,et al.Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis[J].N Engl J Med,1996,334(11):693-699.doi:10.1056/NEJM199603143341104.
[3]Yao FY,Ferrell L,Bass NM,et al.Liver transplantation for hepatocellular carcinoma:Expansion of the tumor size limits does not adversely impact survival[J].Hepatology,2001,33(6):1394-1403.doi:10.1053/jhep.2001.24563.
[4]Zheng SS,Xu X,Wu J,et al.Liver transplantation for hepatocellular carcinoma:Hangzhou experiences[J].Transplantation,2008,85(12):1726-1732.doi:10.1097/TP.0b013e31816b67e4.
[5]Xu X,Lu D,Ling Q,et al.Liver transplantation for hepatocellular carcinoma beyond the Milan criteria[J].Gut,2016.65(6):1035-1041.doi:10.1136/gutjnl-2014-308513.
[6]Toso C,Asthana S,Bigam DL,et al.Reassessing Selection Criteria Prior to Liver Transplantation for Hepatocellular Carcinoma Utilizing the Scientific Registry of Transplant Recipients Database[J].Hepatology,2009,49(3):832-838.doi:10.1002/hep.22693.
[7]Halazun KJ,Najjar M,Abdelmessih RM,et al.Recurrence After Liver Transplantation for Hepatocellular Carcinoma A New MORAL to the Story[J].Ann Surg,2017,265(3):557-564.doi:10.1097/SLA.0000000000001966.
[8]Takada Y,Ito T,Ueda M,et al.Living donor liver transplantation for patients with HCC exceeding the Milan criteria:a proposal of expanded criteria[J].Dig Dis,2007,25(4):299-302.doi:10.1159/000106908.
[9]Shindoh J,Sugawara Y,Nagata R,et al.Evaluation methods for pretransplant oncologic markers and their prognostic impacts in patient undergoing living donor liver transplantation for hepatocellular carcinoma[J].Transpl Int,2014,27(4):391-398.doi:10.1111/tri.12274.
[10]Mazzaferro V,Sposito C,Zhou J,et al.Metroticket 2.0 Model for Analysis of Competing Risks of Death After Liver Transplantation for Hepatocellular Carcinoma[J].Gastroenterology,2018,154(1):128-139.doi:10.1053/j.gastro.2017.09.025.
[11]中国医师协会器官移植医师分会,中华医学会器官移植学分会.中国肝癌肝移植临床实践指南(2018版)[J].临床肝胆病杂志,2019,35(2):275-280.doi:10.3969/j.issn.1001-5256.2019.02.008.Organ Transplantation Branch of Chinese Medical Doctor Association,Chinese Society of Organ Transplantation of Chinese Medical Association.The Chinese clinical practice guideline on liver transplantation for hepatocellular carcinoma (2018)[J].Journal of Clinical Hepatology,2019,35(2):275-280.doi:10.3969/j.issn.1001-5256.2019.02.008.
[12]Xiang ZW,Sun L,Li GH,et al.Progress in the treatment of pulmonary metastases after liver transplantation for hepatocellular carcinoma[J].World J Hepatol,2015,7(20):2309-2314.doi:10.4254/wjh.v7.i20.2309.
[13]Yao FY,Mehta N,Flemming J,et al.Downstaging of hepatocellular cancer before liver transplant:Long-term outcome compared to tumors within Milan criteria[J].Hepatology,2015,61(6):1968-1977.doi:10.1002/hep.27752.
[14]Oligane HC,Xing MZ,Kim HS.Effect of Bridging Local-Regional Therapy on Recurrence of Hepatocellular Carcinoma and Survival after Orthotopic Liver Transplantation[J].Radiology,2017,282(3):869-879.doi:10.1148/radiol.2016160288.
[15]Xu M,Doyle M,Banan B,et al.Neoadjuvant Locoregional Therapy and Recurrent Hepatocellular Carcinoma after Liver Transplantation[J].J Am Coll Surg,2017,225(1):28-40.doi:10.1016/j.jamcollsurg.2017.03.015.
[16]Agopian VG,Harlander-Locke MP,Ruiz RM,et al.Impact of Pretransplant Bridging Locoregional Therapy for Patients With Hepatocellular Carcinoma Within Milan Criteria Undergoing Liver Transplantation Analysis of 3601 Patients From the US Multicenter HCC Transplant Consortium[J].Ann Surg,2017,266(3):525-535.doi:10.1097/SLA.0000000000002381.
[17]Wu LM,Yang Z,Zhang J,et al.Long noncoding RNA HOTTIP expression predicts tumor recurrence in hepatocellular carcinoma patients following liver transplantation[J].Hepatobiliary Surg Nutr,2018,7(6):429-439.doi:10.21037/hbsn.2018.10.07.
[18]Wu LM,Yang FB,Lin B,et al.MicroRNA-424 expression predicts tumor recurrence in patients with hepatocellular carcinoma following liver transplantation[J].Oncol Lett,2018,15(6):9126-9132.doi:10.3892/ol.2018.8539.
[19]Sugimachi K,Matsumura T,Hirata H,et al.Identification of a bona fide microRNA biomarker in serum exosomes that predicts hepatocellular carcinoma recurrence after liver transplantation[J].Br J Cancer,2015,112(3):532-538.doi:10.1038/bjc.2014.621.
[20]Wang C,Lu D,Ling Q,et al.Donor one-carbon metabolism gene single nucleotide polymorphisms predict the susceptibility of cancer recurrence after liver transplantation[J].Gene,2019,689:97-101.doi:10.1016/j.gene.2018.11.035.
[21]Xu X,Ling Q,Wang J,et al.Donor miR-196a-2 polymorphism is associated with hepatocellular carcinoma recurrence after liver transplantation in a Han Chinese population[J].Int J Cancer,2016,138(3):620-629.doi:10.1002/ijc.29821.
[22]Moon DB,Lee SG,Hwang S,et al.No-Touch En Bloc Right Lobe Living-Donor Liver Transplantation with Inferior Vena Cava Replacement for Hepatocellular Carcinoma Close to Retrohepatic Inferior Vena Cava:Case Report[J].Transplant Proc,2013,45(8):3135-3139.doi:10.1016/j.transproceed.2013.08.052.
[23]Liu B,Teng F,Fu H,et al.Excessive intraoperative blood loss independently predicts recurrence of hepatocellular carcinoma after liver transplantation[J].BMC Gastroenterol,2015,15:138.doi:10.1186/s12876-015-0364-5.
[24]Nagai S,Yoshida A,Facciuto M,et al.Ischemia Time Impacts Recurrence of Hepatocellular Carcinoma After Liver Transplantation[J].Hepatology,2015,61(3):895-904.doi:10.1002/hep.27358.
[25]Vivarelli M,Cucchetti A,La Barba G,et al.Liver Transplantation for Hepatocellular Carcinoma Under Calcineurin Inhibitors Reassessment of Risk Factors for Tumor Recurrence[J].Ann Surg,2008,248(5):857-862.doi:10.1097/SLA.0b013e3181896278.
[26]Cholongitas E,Mamou C,Rodriguez-Catro KI,et al.Mammalian target of rapamycin inhibitors are associated with lower rates of hepatocellular carcinoma recurrence after liver transplantation:a systematic review[J].Transpl Int,2014,27(10):1039-1049.doi:10.1111/tri.12372.
[27]Gomez-Martin C,Bustamante J,Castroagudin JF,et al.Efficacy and safety of sorafenib in combination with mammalian target of rapamycin inhibitors for recurrent hepatocellular carcinoma after liver transplantation[J].Liver Transpl,2012,18(1):45-52.doi:10.1002/lt.22434.
[28]Söderdahl G,Bäckman L,Isoniemi H,et al.A prospective,randomized,multi-centre trial of systemic adjuvant chemotherapy versus no additional treatment in liver transplantation for hepatocellular carcinoma[J].Transpl Int,2006,19(4):288-294.doi:10.1111/j.1432-2277.2006.00279.x.

