肝癌是世界上发病率最高的恶性肿瘤之一,是与癌症死亡有关的第二大原因,每年报告的肝癌病例中约有75%~80%发生在亚洲国家,仅我国就占了全世界肝癌病例和死亡人数的50%以上,每年有超过30万人死于肝癌[1-2]。由于肝癌起病隐匿、症状非特异性,确诊时已为中期或晚期[3]。对于晚期和无法手术切除的肝癌患者经导管肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)和酪氨酸激酶抑制剂被认为是标准的治疗方法,能有效地抑制肿瘤的进展[4]。然而,TACE已被证明能在残留的肝癌组织中引起缺氧并升高血管内皮生长因子(vascular endothelial growth factor,VEGF)的水平,从而引起明显的新生血管生成反应,使肿瘤组织侵袭和转移增强[5]。因此,抑制TACE术后诱导的肿瘤细胞VEGF的过度表达,对提高TACE的远期疗效具有重要意义。血管生成促进肿瘤细胞的氧和营养供应,在肿瘤的生长、发展和转移中起着关键的作用[6]。近年来,小分子酪氨酸激酶抑制剂在多种恶性肿瘤上(胃癌,非小细胞肺癌,乳腺癌,肝细胞癌和肉瘤等)治疗效果令人鼓舞[7]。阿帕替尼作为新型口服抗血管生成药物之一,显示出了良好的应用前景,有研究[2,8-10]认为血管生成抑制剂阿帕替尼和TACE联合应用可有效抑制肿瘤的外周血管生成,延缓肿瘤的进展。但大多都为单中心研究,病例数少,说服力不足,有关其疗效和安全性的结果也不尽相同。因此,本Meta分析的目的在于评价阿帕替尼联合TACE治疗中晚期肝癌的疗效和安全性。
1 资料与方法
1.1 纳入标准与排除标准
纳入标准:⑴ 研究对象诊断为中晚期肝癌(BCLC B级或C级)的患者,未行手术或不愿手术治疗;⑵ 文献类型为随机对照试验;⑶ 纳入文献应涉及阿帕替尼联合TACE治疗与TACE单独治疗效果的对比;⑷ 纳入的文献中的有疾病控制情况、近远期生存率、相关不良反应等结局指标数据,且可计算分析。排除标准:⑴ 除阿帕替尼联合TACE及单独TACE治疗方法外,存在其他治疗方法,如手术、放疗、联合其他抗肿瘤药物等;⑵ 个案报道、摘要、Meta分析、综述,动物实验等研究;⑶ 回顾性研究;⑷ 同一作者,同一单位发表的重复性研究。
1.2 文献检索策略
通过计算机对公开发表在PubMed、Embase、Cochrane、万方、知网、维普等数据库中有关阿帕替尼联合T A C E与单独T A C E治疗中晚期肝癌的临床疗效相比较的临床文献进行检索,时间从建库至2019年3月。中文检索词包括:经动脉化疗栓塞术、阿帕替尼、肝细胞癌、肝肿瘤、肝癌;英文检索词包括:Transcatheter Arterial Chemoembolization、TACE,S-TACE、Apatinib、Hepatocellular Carcinoma、Liver Cancer、HCC、Liver Neoplasm。
1.3 资料的提取与方法学质量评价
由2名研究人员各自检索文献,并由第三人对难以确定是否该纳入的文献进行分析。提取筛选出文献的资料,主要包括:第一作者、发表时间、是否随机对照实验等基础资料;研究对象的性别、年龄、肝癌分期、肝功能等基本研究特征;以及客观缓解率(objective remission rate,ORR)=完全缓解+部分缓解、疾病控制率(disease control rate,DCR)=完全缓解+部分缓解+疾病稳定、生存率、相关不良反应(发热、恶心呕吐、腹泻、骨髓抑制、高血压、蛋白尿、手足综合症)等结局指标。2名研究者依据Cochrane系统评价手册5.0.1对纳入的文献进行严格质量评价,主要包括:⑴ 是否随机分配;⑵ 是否分配方案隐藏;⑶ 是否盲法;⑶ 结果数据是否完整;⑸ 是否选择性报告研究结果;⑹ 是否存在其他偏倚等6个方面。
1.4 统计学处理
采用Cochrane系统评价软件RevMan 5.3进行Meta分析。本次研究指标均为计数资料,用比值比(odds ratio,OR)表示,取95%可信区间(confidence interval,CI)。若各试验间无统计学异质性(I2≤50%),采用固定效应模型分析,若存在统计学异质性时(I2≥50%),则使用随机效应模型。发表偏倚使用漏斗图进行评价偏倚程度。
2 结 果
2.1 纳入文献基本情况
经检索获得78篇相关文献(其中知网25篇、万方18篇、维普9篇、PubMed 7篇、EMbase 12篇和Cochrane 7篇),剔除重复文献40篇后,初步获得38篇文献,通过阅读文题及摘要后纳入23篇文献,进一步阅读全文后,剔除同一作者相同探究,未设置对照组,回顾性研究后,最终纳入8篇文献进行Meta分析,总共486例中晚期肝癌患者,其中试验组243例,对照组243例。文献筛选流程见图1,Cochrane文献质量评价见图2,纳入的文献的基本特征见表1。
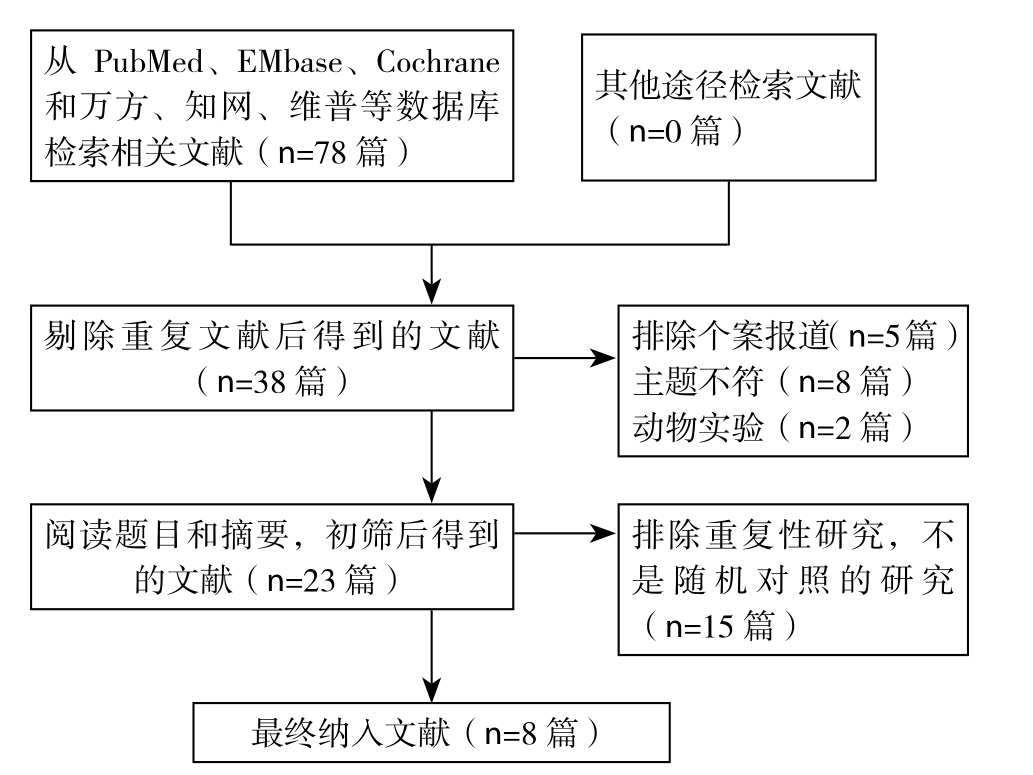
图1 文献筛选流程图
Figure1 The literature screening process

图2 文献质量评价图
Figure2 The framework for quality evaluation of the literature
表1 研究及患者基本特征
Table1 The general characteristics of the included studies
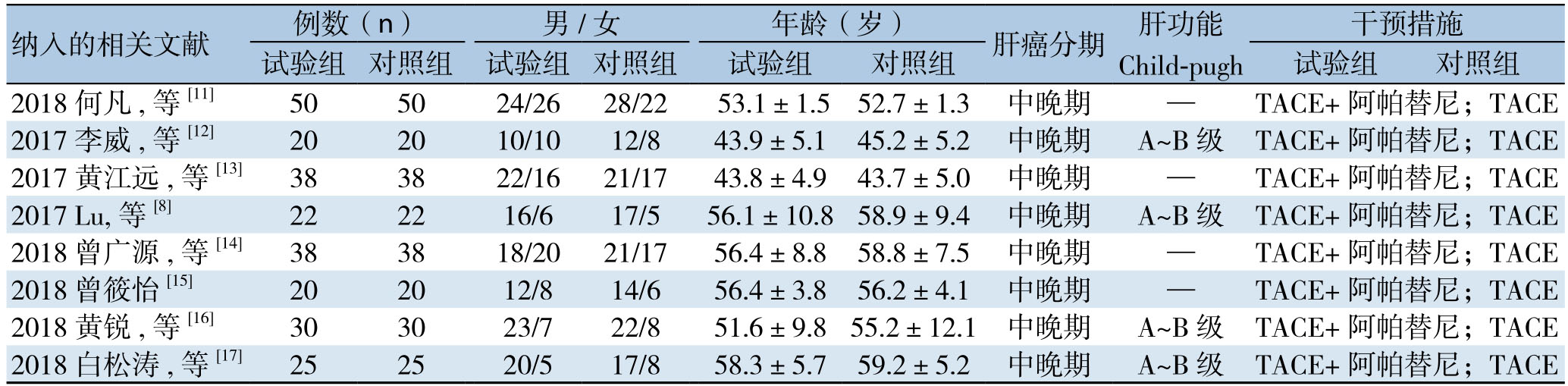
纳入的相关文献 例数(n) 男/女 年龄(岁) 肝癌分期 肝功能Child-pugh干预措施试验组 对照组 试验组 对照组 试验组 对照组 试验组 对照组2018何凡,等[11] 50 50 24/26 28/22 53.1±1.5 52.7±1.3 中晚期 — TACE+阿帕替尼;TACE 2017李威,等[12] 20 20 10/10 12/8 43.9±5.1 45.2±5.2 中晚期 A~B级 TACE+阿帕替尼;TACE 2017黄江远,等[13] 38 38 22/16 21/17 43.8±4.9 43.7±5.0 中晚期 — TACE+阿帕替尼;TACE 2017 Lu,等[8] 22 22 16/6 17/5 56.1±10.858.9±9.4 中晚期 A~B级 TACE+阿帕替尼;TACE 2018曾广源,等[14] 38 38 18/20 21/17 56.4±8.8 58.8±7.5 中晚期 — TACE+阿帕替尼;TACE 2018曾筱怡[15] 20 20 12/8 14/6 56.4±3.8 56.2±4.1 中晚期 — TACE+阿帕替尼;TACE 2018黄锐,等[16] 30 30 23/7 22/8 51.6±9.855.2±12.1 中晚期 A~B级 TACE+阿帕替尼;TACE 2018白松涛,等[17] 25 25 20/5 17/8 58.3±5.7 59.2±5.2 中晚期 A~B级 TACE+阿帕替尼;TACE
2.2 近期疗效(ORR与DCR)
有7篇文献[8,12-17]报道了阿帕替尼联合TACE与单独TACE治疗中晚癌患者的ORR与DCR的数据。根据异质性检验结果,采用固定效应模型对ORR及DCR数据进行分析。Meta分析结果显示:阿帕替尼联合TACE治疗中晚期肝癌的ORR与DCR明显优于单独应用TACE单独治疗(ORR:OR=2.88,95% CI=1.80~4.62,P<0.000 1;DCR:OR=3.29,95% CI=1.96~5.53,P<0.0000 1)(图3)。
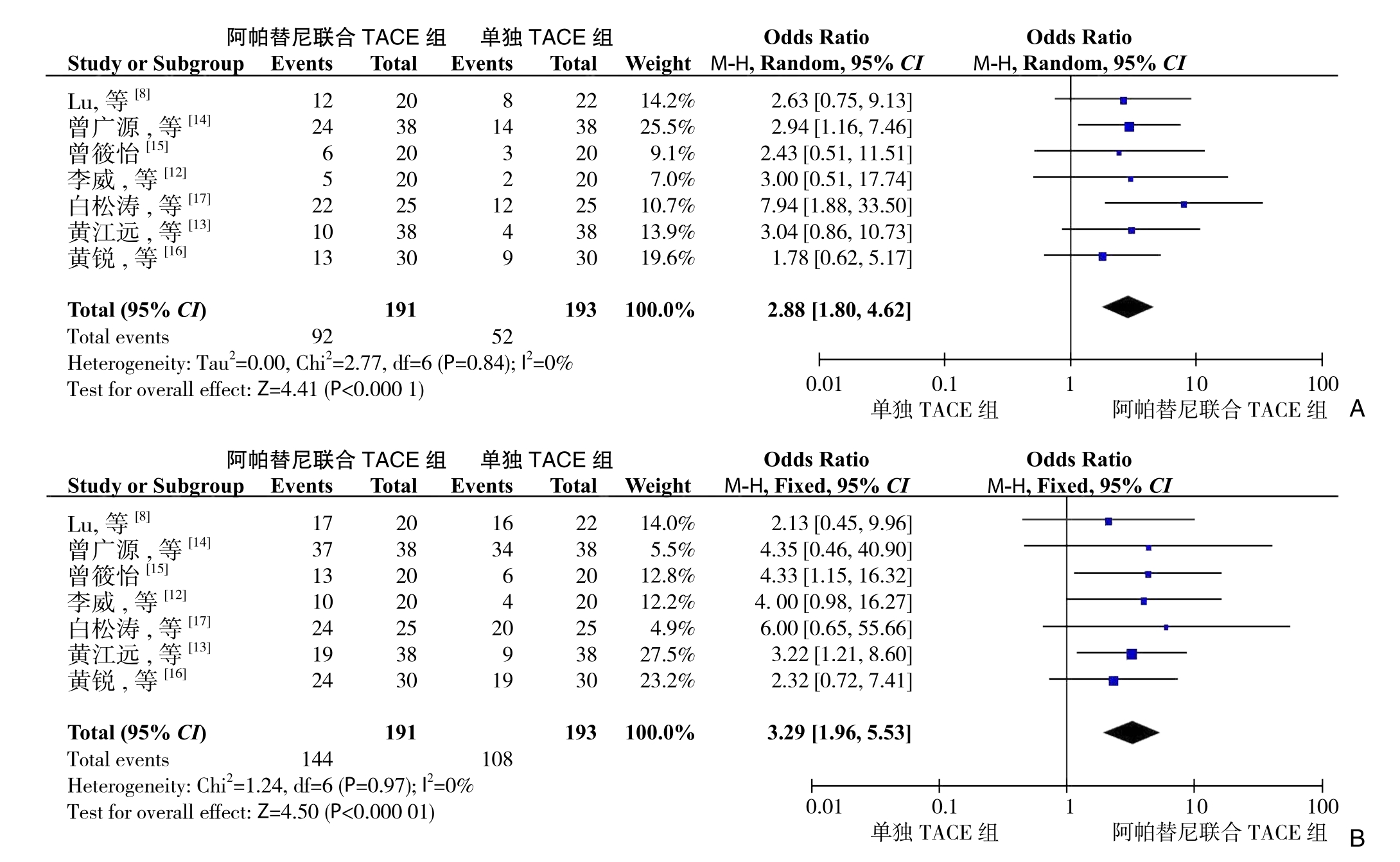
图3 近期疗效比较 A:ORR;B:DCR
Figure3 Comparison of short-term efficacy A:ORR;B:DCR
2.3 远期疗效
纳入的文献中分别有6篇[8,11-13,15-16]、6篇[8,11-14,16]、3篇[11,14,16]报道了试验组与对照组比较的6、12、24个月总体生存率的数据,各研究之间无明显异质性(I2<50%),采用固定效应模型。结果显示:治疗组6、12、24个月试验组的总体生存率均优于对照组,且3组间差异有统计学意义(6个月:OR=2.89,95% CI=1.74~4.80,P<0.000 1;12个月:OR=2.37,95% CI=1.46~3.83,P=0.000 5;24个月:OR=2.67,95% CI=1.41~5.04,P=0.002)(图4)。
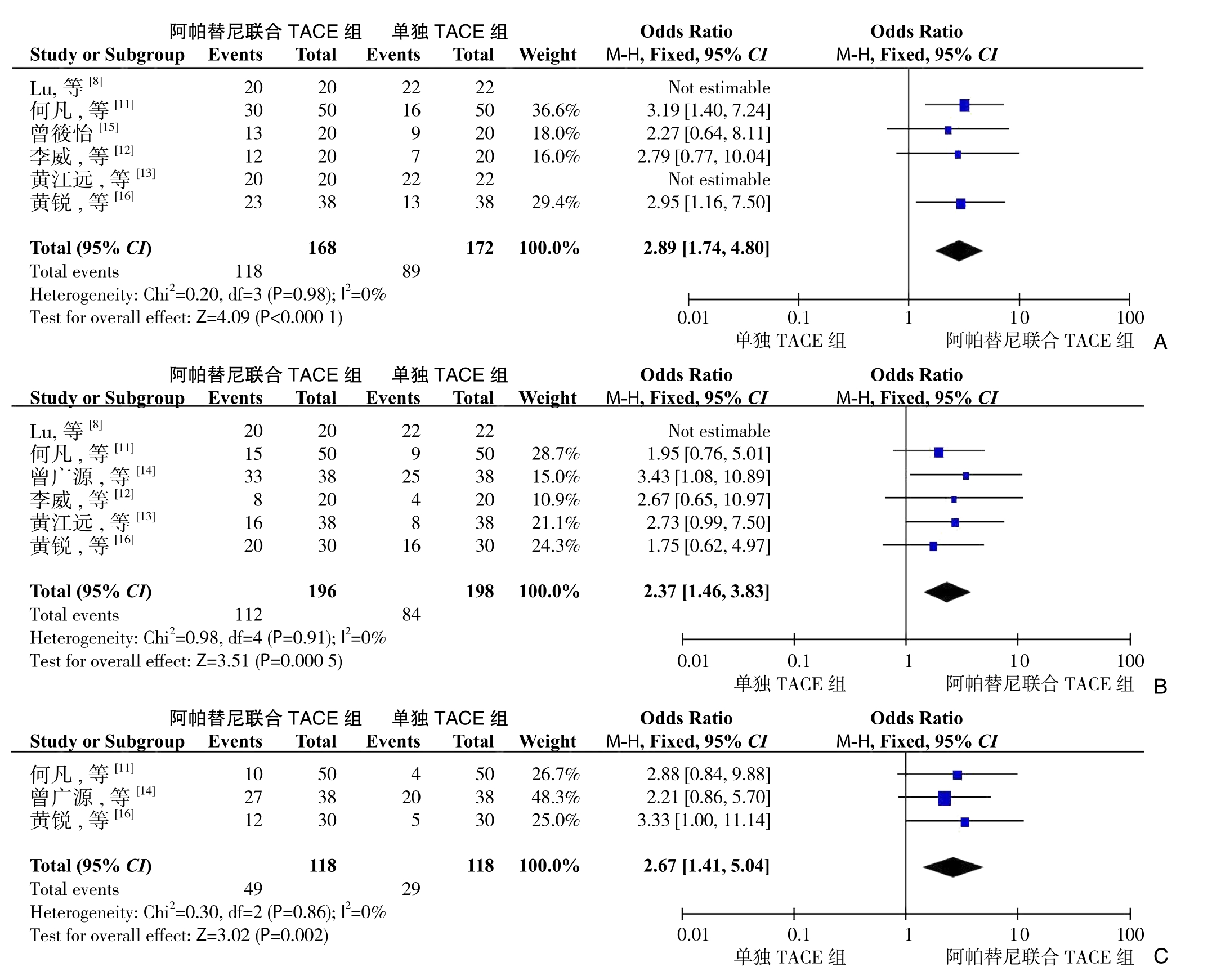
图4 远期疗效比较 A:6个月生存率;B:12个月生存率;C:24个月生存率
Figure4 Comparison of long-term efficacy A:6-month survival rates;B:12-month survival rates;C:24-month survival rates
2.4 不良反应发生率分析
2.4.1 发热 5篇文献[8,11,13,16-17]报道了该结局指标,各研究之间无明显异质性(I2=40%),采用固定效应模型。Meta分析结果显示:两组发热发生率的差异无统计学意义(OR=0.67,95% CI=0.42~1.05,P=0.08)(图5A)。
2.4.2 恶心呕吐 共纳入5项研究[8,11,14,16-17],328例患者,各研究之间无明显异质性(I2=32%),采用固定效应模型。Meta分析结果显示:两组恶心呕吐情况无统计学意义(OR=0.66,95% CI=0.41~1.08,P=0.10)(图5B)。
2.4.3 腹泻 5篇文献[8,11,13,15-16]记录了腹泻情况,各研究之间有异质性(I2=69%),采用随机效应模型。Meta分析结果显示:两组恶心呕吐情况无统计学意义(OR=2.00,95% CI=0.52~7.72,P=0.32)(图5C)。
2.4.4 骨髓抑制 共纳入 5 项研究 [8,11,14-16],318 例患者,组间无异质性(I2=0%),采用固定效应模型。Meta分析结果显示:两组骨髓抑制情况无统计学差 异(OR=0.80,95% CI=0.43~1.47,P=0.47)(图5D)。
2.4.5 蛋白尿 4篇文献 [8,14-16]记录了蛋白尿情况,经异质性检验,组间无异质性(I2=0%),采用固定效应模型。Meta分析结果显示:阿帕替尼加TACE治疗组蛋白尿的发生率较单独TACE明显增高,有统计学差异(OR=19.71,95% CI=5.27~73.71,P<0.000 01)(图5E)。
2.4.6 高血压 6篇文献 [8,11,13-16] 记录了高血压情况,经异质性检验,组间存在异质性(I2=93%),采用随机效应模型。Meta分析结果显示:两组间无统计学差异(OR=6.61,95% CI=0.39~111.02,P=0.19)(图5F)。
2.4.7 手足综合征 5篇文献[8,14-17]报道了该结局指标,组间无异质性(I2=0%),采用固定效应模型。Meta分析结果显示:阿帕替尼组手足综合征发生率较单独TACE组明显增高,有统计学差异(OR=27.05,95% CI=9.37~78.13,P<0.000 01)(图5G)。

图5 不良反应发生率比较 A:发热发生率;B:恶心呕吐发生率;C:腹泻发生率;D:骨髓抑制发生率;E:蛋白尿发生率;F:高血压发生率;G:手足综合征发生率
Figure5 Comparison of incidence of adverse reactions A:Incidence of fever;B:Incidence of nausea and vomiting;C:Incidence of diarrhea;D:Incidence of myelosuppression;E:Incidence of proteinuria;F:Incidence of hypertension;G:Incidence of hand-foot syndrome
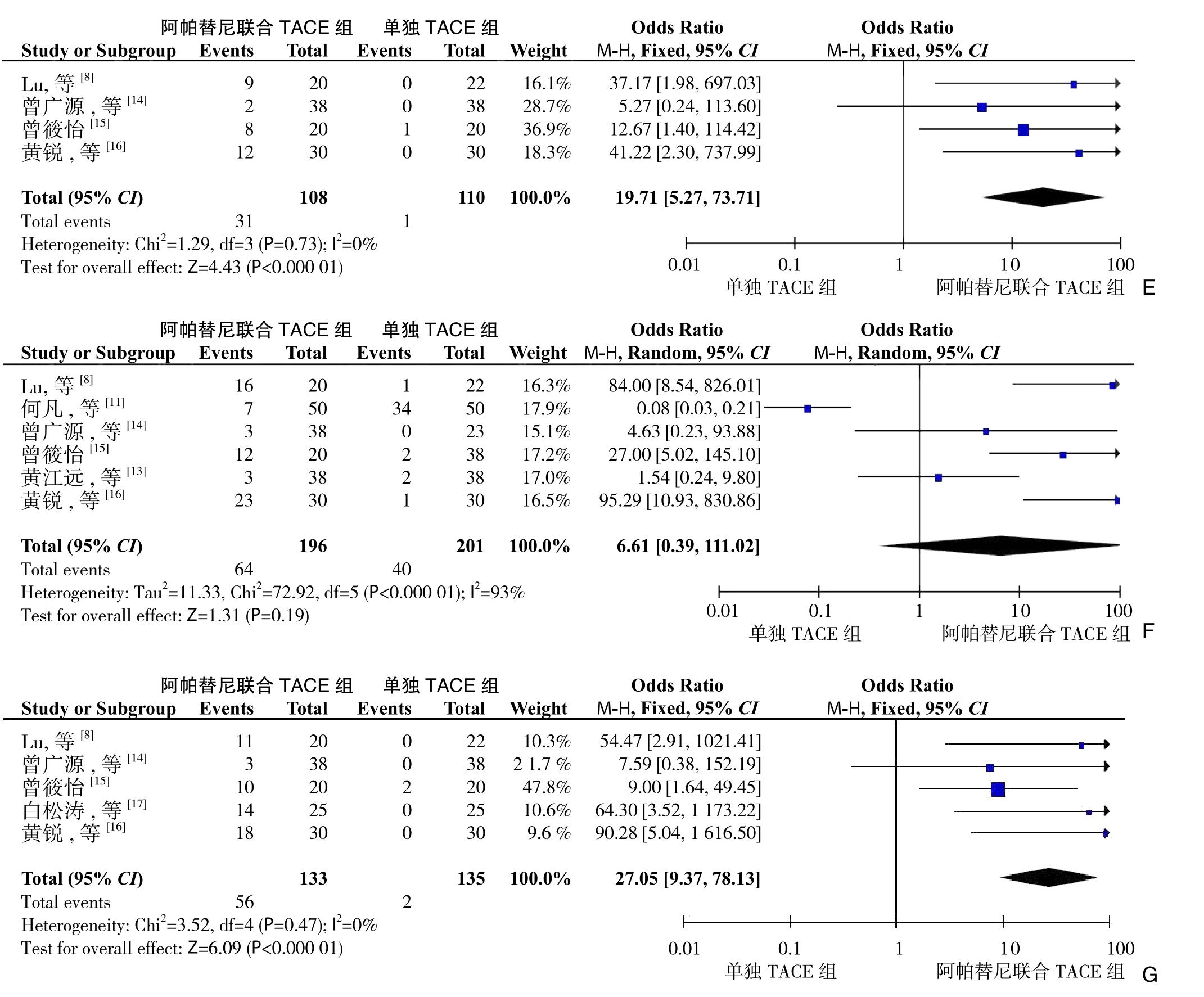
图5 不良反应发生率比较(续) A:发热发生率;B:恶心呕吐发生率;C:腹泻发生率;D:骨髓抑制发生率;E:蛋白尿发生率;F:高血压发生率;G:手足综合征发生率
Figure5 Comparison of incidence of adverse reactions (continued) A:Incidence of fever;B:Incidence of nausea and vomiting;C:Incidence of diarrhea;D:Incidence of myelosuppression;E:Incidence of proteinuria;F:Incidence of hypertension;G:Incidence of hand-foot syndrome
2.5 敏感度分析及异质性检验
使用Revman软件对纳入文献进行敏感度分析,评估纳入文献的稳健性并分析异质性来源。以比较副反应腹泻、高血压为例,结果显示均去除研究[11]后,腹泻发生率比较:异质性I2由69%降为0%,高血压发生率比较:I2由93%降低为66%,说明此项研究为异质性来源的原因,敏感度分析前后合并的OR腹泻值由2.00变为3.53,OR高血压值由6.61变为17.57,均发生了有意义的改变。从单个的研究对合并效应量的影响来看,不良反应腹泻、高血压的Meta分析结果可信度差。
2.6 发表偏倚的分析
在本研究纳入文献报道ORR及DCR的指标较其他多,均为7篇,故能反映此研究发表偏倚的情况,以ORR及DCR指标对纳入文献进行漏斗图分析,结果示:两者漏斗图分布大致对称,表明本研究受发表偏倚影响的可能性小(图6)。
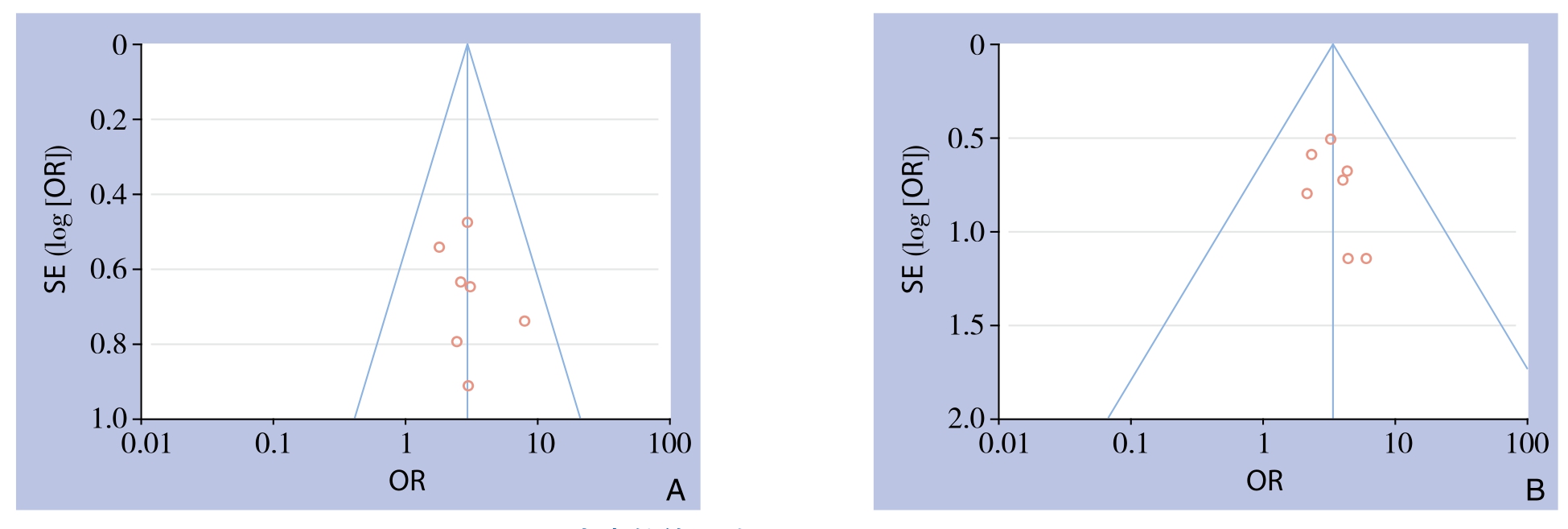
图6 发表偏倚漏斗图 A:ORR;B:DCR
Figure6 Funnel plots for detecting publication bias A:ORR;B:DCR
3 讨 论
肝癌是常见的预后较差的消化系统恶性肿瘤,2012年我国的肝癌新发病例数约占全球的50%[18]。 由于其早期无明显症状,确诊时往往已为晚期,预后较差。肝癌巴塞罗那(BCLC)分期系统在临床上被广泛接受,而且已应用治疗肝癌的许多临床实践和临床药物试验中[19]。美国肝病研究学会和欧洲肝病研究学会推荐使用索拉非尼治疗BCLC C期的晚期肝癌[20-21]。我国指南则建议采用TACE、全身治疗(索拉非尼或FOLFOX4化疗)和放疗治疗晚期肝癌[22]。索拉非尼和TACE是治疗BCLC C期肝癌的常用治疗方案,但目前各个国家和地区尚无通用的标准治疗方案。索拉非尼是目前被批准用于治疗晚期肝癌的靶向口服药物,具有良好的耐受性,然而,价格昂贵和高耐药性限制了其在晚期肝癌中的应用。阿帕替尼是一种新型VEGF-2抑制剂,它与VEGF-2的亲和力是索拉非尼的10倍[23]。作为我国自主研发的新型抗血管生成药物,在许多临床试验中,阿帕替尼在治疗多种实体肿瘤方面显示出良好的疗效和可控的副作用。Li等[24]开展了阿帕替尼治疗晚期肝癌的II期临床试验。结果提示:阿帕替尼单药治疗晚期肝癌有效且安全。Chen等[23]的研究表明:TACE联合阿帕替尼治疗中晚期肝癌的能有效延长患者的总生存期和无进展生存期。于俊岩等[25]研究表明:对于没有手术指征的晚期肝癌患者,阿帕替尼联合TACE的联合疗法安全有效,且阿帕替尼的药物不良反应能通过调整药物剂量控制,患者可耐受治疗,此次II期的临床试验结果为以后的研究提供了良好基础。动物实验方面,姚琪等[26]研究表明:阿帕替尼联合TACE可降低肝癌荷瘤兔的肿瘤生长速度,抑制TACE术后肿瘤新生血管的生成,具有较好的抑制肿瘤生长的效果。为抗肿瘤药物同传统TACE结合提供理论创新。因此,探讨阿帕替尼联合TACE治疗中晚期肝癌并降低其不良反应的联合治疗方法是极具意义。
本文通过Meta分析方法,收集了阿帕替尼联合TACE与单独TACE治疗的中晚期肝癌的随机对照试验,并总结了阿帕替尼联合TACE治疗中晚期肝癌的疗效及不良反应。本研究最终纳入8个随机对照试验,共486例患者。结果表明:阿帕替尼联合TACE与单独TACE治疗中晚期肝癌的相比,能提高患者的客观缓解率及疾病控制率,一定程度上提高了患者6、12、24个月的生存率。但在不良反应上,阿帕替尼相关的副作用如手足综合征、蛋白尿试验组比对照组中更常见。在异质性分析后,不良反应腹泻、高血压在试验组更常见,而在发热、恶心呕吐、骨髓抑制不良反应上,两组无统计学差异。虽然可以通过减药或者停药来改善阿帕替尼的对人体副作用,但这降低了阿帕替尼的抗肿瘤效应,王硕等[27]研究发现载阿帕替尼纳米胶束具有良好的生物安全性以及缓释作用,能缓慢释放阿帕替尼,增加其利用效率。载阿帕替尼纳米胶束缓慢释放治疗策略可能为未来抗血管生成药物治疗肝癌提供了新思路。
本研究纳入的8篇文献中,有4篇文献[8,12-13,16]报道了具体的随机方法,为随机数字表法,1篇文献[15]报道了盲法,为双盲,其余均未说明失访、分配方案隐藏及意向性分析情况,纳入文献总体质量稍低。这可能与以下原因有关:⑴ 阿帕替尼作为我国首个完全自主研制的小分子抗血管生成药物,历经10年研制成功,于2014年由我国食品药品监督管理总局批准上市[28],目前在我国有较多应用,国外报道不多见,因此缺少一些国外的高质量的随机对照研究。⑵ 阿帕替尼批准上市时主要用于晚期胃癌三线或以上治疗,近年来随着研究的深入,应用于中晚期肝癌的治疗较晚,因而总体证据级别高的临床试验不多。⑶ 国内有关阿帕替尼治疗中晚期的肝癌尚未在指南上推荐使用,以及国内大多数临床医生对阿帕替尼认识不够,使得阿帕替尼联合TACE治疗中晚期肝癌的临床试验较少。⑷ 一些研究者在进行临床试验时,没有将数据的详细性呈现出来,比如在入组的标准、分配的详细方案、不良反应的监测、预后的判断、随访的及时性上数据缺乏严谨性。因而此次纳入的文献包括1篇英文文献及7篇中文文献,且均为单中心、小样本研究,说服力有限。在进行Meta分析时也提示了各研究存在了一定的异质性。所以本研究可能有不同程度的偏倚 。
综上所述,本研究结果表明阿帕替尼联合TACE治疗中晚期肝癌较单独TACE疗效好,可提高TACE对中晚期肝癌的近期与远期生存率,但阿帕替尼相关的副反应发生率较单独TACE组高,且多数不良反应可控,严重的副反应少见。本研究为临床上治疗中晚期肝癌提供了有利的循证医学证据,未来仍需要进行国内外更多的多中心、前瞻性随机对照研究以证实TACE联合阿帕替尼治疗中晚期肝癌的疗效和安全性,用于指导临床治疗。
[1]Yang C,Qin S.Apatinib targets both tumor and endothelial cells in hepatocellular carcinoma[J].Cancer Med,2018,7(9):4570-4583.doi:10.1002/cam4.1664.
[2]Liu C,Xing W,Si T,et al.Efficacy and safety of apatinib combined with transarterial chemoembolization for hepatocellular carcinoma with portal venous tumor thrombus:a retrospective study[J].Oncotarget,2017,8(59):100734-100745.doi:10.18632/oncotarget.20140.
[3]Meyer T,Palmer DH,Cheng AL,et al.mRECIST to predict survival in advanced hepatocellular carcinoma:Analysis of two randomised phase II trials comparing nintedanib vs sorafenib[J].Liver Int,2017,37(7):1047-1055.doi:10.1111/liv.13359.
[4]Zhang J,Li H,Gao D,et al.A prognosis and impact factor analysis of DC-CIK cell therapy for patients with hepatocellular carcinoma undergoing postoperative TACE[J].Cancer Biol Ther,2018,19(6):475-483.doi:10.1080/15384047.2018.1433501.
[5]Chung GE,Lee JH,Kim HY,et al.Transarterial chemoembolization can be safely performed in patients with hepatocellular carcinoma invading the main portal vein and may improve the overall survival[J].Radiology,2011,258(2):627-634.doi:10.1148/radiol.10101058.
[6]Du H,Zhao J,Hai L,et al.The roles of vasohibin and its family members:Beyond angiogenesis modulators[J].Cancer Biol Ther,2017,18(11):827-832.doi:10.1080/15384047.2017.1373217.
[7]Li F,Liao Z,Zhang C,et al.Apatinib as targeted therapy for sarcoma[J].Oncotarget,2018,9(36):24548-24560.doi:10.18632/oncotarget.24647.
[8]Lu W,Jin XL,Yang C,et al.Comparison of efficacy between TACE combined with apatinib and TACE alone in the treatment of intermediate and advanced hepatocellular carcinoma:A singlecenter randomized controlled trial[J].Cancer Biol Ther,2017,18(6):433-438.doi:10.1080/15384047.2017.1323589.
[9]Yang Z,Chen G,Cui Y,et al.The safety and efficacy of TACE combined with apatinib on patients with advanced hepatocellular carcinoma:a retrospective study[J].Cancer Biol Ther,2019,20(3):321-327.doi:10.1080/15384047.2018.1529099.
[10]Kong Y,Sun L,Hou Z,et al.Apatinib is effective for treatment of advanced hepatocellular carcinoma[J].Oncotarget,2017,8(62):105596-105605.doi:10.18632/oncotarget.22337.
[11]何凡,陈旭东,林振文,等.中晚期肝癌患者应用经导管肝动脉化疗栓塞(TACE)联合阿帕替尼治疗的效果分析[J].肿瘤药学,2018,8(3):383-386.doi:10.3969/j.issn.2095-1264.2018.03.19.
He F,Chen XD,Lin ZW,et al.Effects of with Hepatic Artery Chemoembolization (TACE) Combined with Apatinib in Patients with Hepatocellular Carcinoma[J].Anti-Tumor Pharmacy,2018,8(3):383-386.doi:10.3969/j.issn.2095-1264.2018.03.19.
[12]李威,满文玲,郭欢庆,等.TACE联合甲磺酸阿帕替尼治疗中晚期肝癌的临床研究[J].肿瘤药学,2017,7(1):74-78.doi:10.3969/j.issn.2095-1264.2017.01.15.
Li W,Man WL,Guo HQ,et al.Clinical Research of Apatinib with Transcatheter Arterial Chemoembolization in Treatment of Advanced Hepatocellular Carcinoma[J].Anti-Tumor Pharmacy,2017,7(1):74-78.doi:10.3969/j.issn.2095-1264.2017.01.15.
[13]黄江远,黄维,朱桥华.经导管肝动脉化疗栓塞联合甲磺酸阿帕替尼在中晚期肝细胞癌中的应用[J].中国肝脏病杂志:电子版,2017,9(4):78-81.doi:10.3969/j.issn.1674-7380.2017.04.014.
Huang JY,Huang W,Zhu QH.Transcatheter arterial chemoembolization combined with mesylate apatinib in the treatment of advanced hepatocellular carcinoma[J].Chinese Journal of Liver Diseases:Electronic Version,2017,9(4):78-81.doi:10.3969/j.issn.1674-7380.2017.04.014.
[14]曾广源,吴龚丽莉,郑文,等.阿帕替尼片联合肝动脉化疗栓塞术治疗中晚期原发性肝癌的临床研究[J].中国临床药理学杂志,2018,34(23):2693-2696.doi:10.13699/j.cnki.1001-6821.2018.23.004.
Zeng GY,Wu GLL,Zheng W,et al.Clinical trial of apatinib tablets combined with transcatheter arterial chemoembolization in the treatment of advanced primary liver cancer[J].The Chinese Journal of Clinical Pharmacology,2018,34(23):2693-2696.doi:10.13699/j.cnki.1001-6821.2018.23.004.
[15]曾筱怡.阿帕替尼联合TACE治疗原发性肝癌的临床研究[J].基层医学论坛,2018,22(11):1442-1444.doi:10.19435/j.1672-1721.2018.11.002.
Zeng XY.Apatinib combined with TACE in the treatment of primary liver cancer[J].Medical Forums in Basic,2018,22(11):1442-1444.doi:10.19435/j.1672-1721.2018.11.002.
[16]黄锐,姚立正,李文会,等.肝动脉化疗栓塞术联合甲磺酸阿帕替尼片治疗中晚期肝癌的疗效及安全性评价[J].肿瘤,2018,38(10):965-972.doi:10.3781/j.issn.1000-7431.2018.33.373.
Huang R,Yao LZ,Li WH,et al.Efficacy and safety of TACE combined with apatinib mesylate tablets in the treatment of intermediate and advanced hepatoma[J].Tumor,2018,38(10):965-972.doi:10.3781/j.issn.1000-7431.2018.33.373.
[17]白松涛,张月蒙.TACE联合阿帕替尼对晚期肝癌的临床疗效[J].中国现代医生,2018,56(22):90-92.
Bai ST,Zhang YM.Clinical effect of TACE combined with apatinib on advanced liver cancer[J].China Modern Doctor,2018,56(22):90-92.
[18]陈世发,赵礼金.肝癌发生发展机制的研究进展及其治疗现状[J].中国普通外科杂志,2018,27(7):910-923.doi:10.3978/j.issn.1005-6947.2018.07.016.
Chen SF,Zhao LJ.Research progress on mechanisms for occurrence of liver cancer and its treatment status[J].Chinese Journal of General Surgery,2018,27(7):910-923.doi:10.3978/j.issn.1005-6947.2018.07.016.
[19]Bruix J,Sherman M,American Association for the Study of Liver Diseases.Management of hepatocellular carcinoma:an update[J].Hepatology,2011,53(3):1020-1022.doi:10.1002/hep.24199.
[20]郑可心,韩冰,祁兴顺,等.《2018年美国肝病学会实践指导:肝细胞癌的诊断、分期和管理》摘译[J].临床肝胆病杂志,2018,34(6):1181-1182.doi:10.3969/j.issn.1001-5256.2018.06.009.
Zheng KX,Han B,Qi XS,et al.An excerpt of diagnosis,staging and management of hepatocellular carcinoma:2018 practice guidance by the American Association for the Study of Liver Diseases[J].Journal of Clinical Hepatology,2018,34(6):1181-1182.doi:10.3969/j.issn.1001-5256.2018.06.009.
[21]葛宁灵,薛同春,叶胜龙.《2018年欧洲肝病学会临床实践指南:肝细胞癌的管理》解读[J].临床肝胆病杂志,2018,34(6):1187-1190.doi:10.3969/j.issn.1001-5256.2018.06.011.
Ge NL,Xue TC,Ye SL.Interpretation of EASL Clinical Practice Guidelines:Management of hepatocellular carcinoma (2018)[J].Journal of Clinical Hepatology,2018,34(6):1187-1190.doi:10.3969/j.issn.1001-5256.2018.06.011.
[22]中华人民共和国卫生和计划生育委员会医政医管局.原发性肝癌诊疗规范(2017年版)[J].中华肝脏病杂志,2017,25(12):886-895.doi:10.3760/cma.j.issn.1007-3418.2017.12.002.
National Health and Family Planning Commission of the People's Republic of China.Diagnosis,management,and treatment of hepatocellular carcinoma (V2017)[J].Chinese Journal of Hepatology,2017,25(12):886-895.doi:10.3760/cma.j.issn.1007-3418.2017.12.002.
[23]Chen S,Yu W,Zhang K,et al.Comparison of the efficacy and safety of Transarterial chemoembolization with and without Apatinib for the treatment of BCLC stage C hepatocellular carcinoma[J].BMC Cancer,2018,18(1):1131.doi:10.1186/s12885-018-5081-3.
[24]Li J,Qin S,Xu J,et al.Randomized,Double-Blind,Placebo-Controlled Phase III Trial of Apatinib in Patients With Chemotherapy-Refractory Advanced or Metastatic Adenocarcinoma of the Stomach or Gastroesophageal Junction[J].J Clin Oncol,2016,34(13):1448-1454.doi:10.1200/JCO.2015.63.5995.
[25]于俊岩,郭红亮,田向阳,等.甲磺酸阿帕替尼联合经导管动脉化疗栓塞治疗肝细胞肝癌的Ⅱ期临床试验[J].东南大学学报:医学版,2018,37(1):74-77.doi:10.3969/j.issn.1671-6264.2018.01.016.
Yu JY,Guo HL,Tian XY,et al.Phase Ⅱ trial of apatinib mesylate tablets combined with transarterial chemoembolization for advanced hepatocellular carcinoma[J].Journal of Southeast University:Medical Science Edition,2018,37(1):74-77.doi:10.3969/j.issn.1671-6264.2018.01.016.
[26]姚琦.碘化油载阿帕替尼经肝动脉栓塞治疗兔VX2肝癌及抑制栓塞后肝癌血管新生的实验研究[D].武汉:华中科技大学,2017.
Yao Q.Experimental study of transarterial chemoembolization with apatinib-bearing iodinated oil in treatment VX2 liver cancer and inhibition of angiogenesis[D].Wuhan:Huazhong University of Science and Technology,2017.
[27]王硕,李永盛,边睿,等.载阿帕替尼纳米胶束对脐静脉内皮细胞的抑制作用研究[J].中国普通外科杂志,2017,26(5):597-606.doi:10.3978/j.issn.1005-6947.2017.05.011.
Wang S,Li YS,Bian R,et al.Inhibitory effect of apatinib-loaded nanomicelles on human umbilical vein endothelial cells[J].Chinese Journal of General Surgery,2017,26(5):597-606.doi:10.3978/j.issn.1005-6947.2017.05.011.
[28]Roviello G,Ravelli A,Polom K,et al.Apatinib:A novel receptor tyrosine kinase inhibitor for the treatment of gastric cancer[J].Cancer Lett,2016,372(2):187-191.doi:10.1016/j.canlet.2016.01.014 .
