胃癌是世界范围内癌症相关死亡的第二大原因[1]。对于不可手术的局部进展期或转移性胃癌患者,以化疗为主的多学科综合治疗是公认的治疗方式,在治疗前对患者进行准确的预后评估有利于为患者制定最佳的个体化治疗方案,因此寻找简单、准确的预后因素至关重要。近年来,肿瘤标志物在胃癌的筛查、诊断、监测及预后判断中发挥着越来越重要的作用。既往很多研究显示可手术切除的胃癌患者围手术期血液肿瘤标志物的水平与患者预后明显相关[2-9]。但关于血液肿瘤标志物在晚期胃癌患者预后中的价值的研究较少。因此,本研究回顾性分析了于本中心行一线化疗的不可手术切除的局部进展期或转移性胃癌患者化疗前外周血中CEA、CA19-9、CA72.4及CA125的水平与患者临床病理学特征的关系及其预后价值。
1 资料与方法
1.1 一般资料
2013年7月—2015年5月于北京大学肿瘤医院消化道肿瘤VIP2病区行一线化疗的109例不可手术切除的局部进展期或转移性胃癌患者入选本研究。所有患者治疗前均经内镜病理证实为原发性胃癌;患者无合并其他器官功能衰竭,3个月内未经历急性心脑血管疾病、急性感染及严重创伤。
1.2 检测方法
采用电化学发光法(E170,Roche,瑞士)测定CEA、CA19-9、CA72.4和CA125。4项血清肿瘤标志物检测的正常参考值为:CEA 5.0 ng/mL,CA19-9 37.0 U/mL,CA72.4 6.7U/mL,CA125 35.0 U/mL。超过参考值上限者为阳性。联合检测多种肿瘤标志物时至少1种为阳性则定义结果为阳性。
1.3 统计学处理
采用SPSS 16.0软件进行统计学分析。应用χ2检验分析肿标与患者临床病理学因素的相关性。定义无进展生存期(progression-free survival,PFS)为患者开始化疗至疾病进展或死亡的时间,总生存期(overall survival,OS)为患者开始化疗至死亡或末次随访时间。采用Kaplan-Meier方法进行单因素生存分析。应用Cox回归法行多因素分析。P<0.05表示差异具有统计学意义。
2 结 果
2.1 患者基本资料
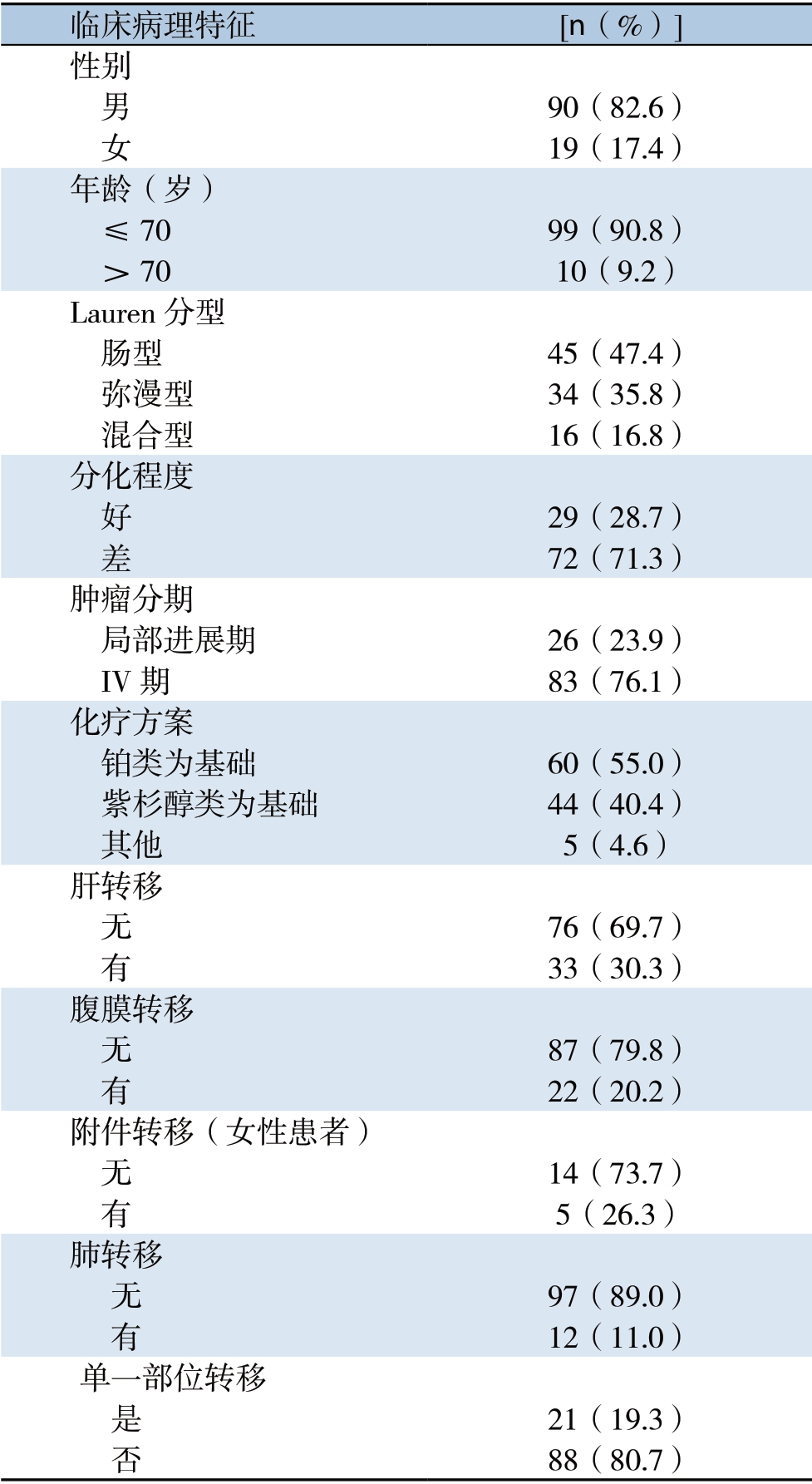
纳入的109例患者中,不可手术切除的局部进展期患者26例,IV期患者83例;男90例,女19例(男女比例4.7:1);中位年龄58(25~77)岁;Lauren肠型者45例,弥漫型者34例,混合型者 16例,14例Lauren分型不详;分化好者29例,分化差者72例,8例分化程度不详;体质量下降>5%者40例,≤5%者47例,22例体质量情况不详。
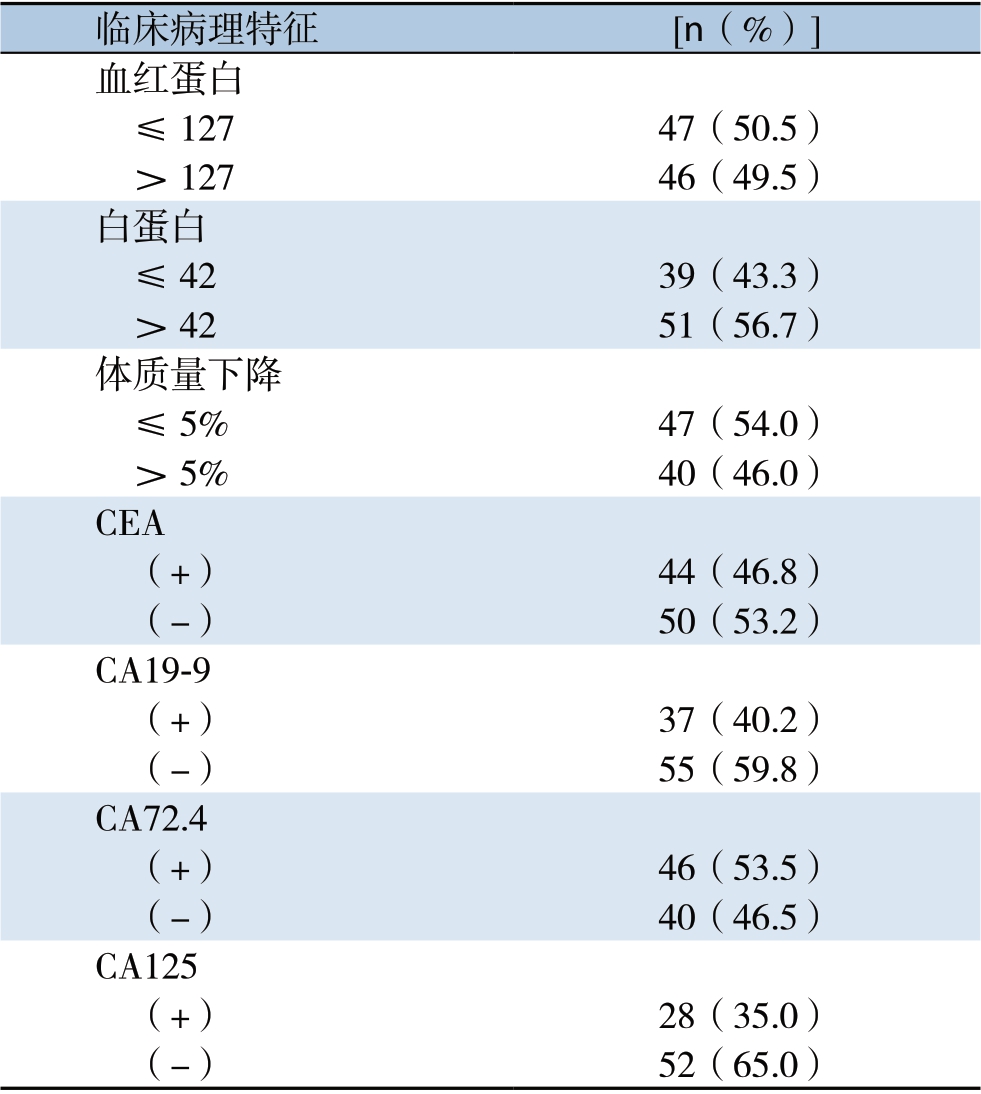
化疗方案以草酸铂为基础联合方案60例,以紫杉醇类为基础联合方案44例,其他方案5例。在109例患者中,21例患者仅为单一脏器转移,88例患者为2个以上脏器转移。其中有肝转移者33例,腹膜转移22例,肺转移12例,腹腔淋巴结转移 84例,盆腔软组织转移7例,胸膜转移3例,颈部或锁骨上淋巴结转移19例,纵膈淋巴结转移 18例,吻合口复发4例,肾上腺转移8例,脑转移 1例,骨转移者7例。19例女性患者中,有附件转移者5例(26.3%) (表1)。收集患者化疗前血红蛋白、白蛋白、CEA、CA19-9、CA72.4及CA125的检测结果。少数患者检测项目不全,故对应检测数值缺失。其中血红蛋白数值缺失16例,白蛋白数值缺失19例;CEA数值缺失15例,CA19-9数值缺失17例,CA72.4数值缺失23例,CA125数值缺失29例。在数据统计分析时将数值不详者按缺失值处理。
表1 患者基本资料
注:分化程度好包括高、中分化腺癌;分化程度差包括低分化腺癌、印戒细胞癌、黏液腺癌
临床病理特征 [n(%)]性别 男 90(82.6) 女 19(17.4)年龄(岁) ≤70 99(90.8) >70 10(9.2)Lauren分型 肠型 45(47.4) 弥漫型 34(35.8) 混合型 16(16.8)分化程度 好 29(28.7) 差 72(71.3)肿瘤分期 局部进展期 26(23.9) IV期 83(76.1)化疗方案 铂类为基础 60(55.0) 紫杉醇类为基础 44(40.4) 其他 5(4.6)肝转移 无 76(69.7) 有 33(30.3)腹膜转移 无 87(79.8) 有 22(20.2)附件转移(女性患者) 无 14(73.7) 有 5(26.3)肺转移 无 97(89.0) 有 12(11.0)单一部位转移 是 21(19.3) 否 88(80.7)
表1 患者基本资料(续)
注:分化程度好包括高、中分化腺癌;分化程度差包括低分化腺癌、印戒细胞癌、黏液腺癌
临床病理特征 [n(%)]血红蛋白 ≤127 47(50.5) >127 46(49.5)白蛋白 ≤42 39(43.3) >42 51(56.7)体质量下降 ≤5% 47(54.0) >5% 40(46.0)CEA (+) 44(46.8) (-) 50(53.2)CA19-9 (+) 37(40.2) (-) 55(59.8)CA72.4 (+) 46(53.5) (-) 40(46.5)CA125 (+) 28(35.0) (-) 52(65.0)
2.2 肿标与临床病理学参数的关系
109例患者中,CEA、CA19-9、CA72.4、CA125的阳性率分别为46.8%、40.2%、53.5%和35.0%。其中女性患者CA72.4阳性率为75.0%,显著高于男性患者的48.6%(P=0.049),而CEA、CA19-9、CA125的阳性率与性别无关(P>0.05);患者的年龄、肿瘤Lauren分型、分化程度、肿瘤分期(局部进展期或IV期)与4种肿瘤标志物阳性率均无明显关系(表2)。
与无肝转移的患者相比,肝转移患者的CEA阳性率明显增高(65.5% vs.38.5%,P=0.014),而两者的CA19-9、CA72.4、CA125均无统计学差异(P>0.05);与无腹膜转移的患者相比,腹膜转移患者的CA125阳性率明显增高(64.7% vs.27.0%,P=0.005);而两者的CEA、CA19-9、CA72.4比较,均无统计学差异(均P>0.05);附件转移、肺转移与4种肿瘤标志物阳性率均无明显关系(均P>0.05)(表2)。
表2 血清肿瘤标志物阳性率与胃癌患者临床病理学参数的关系[%(阳性例数/检测例数)]
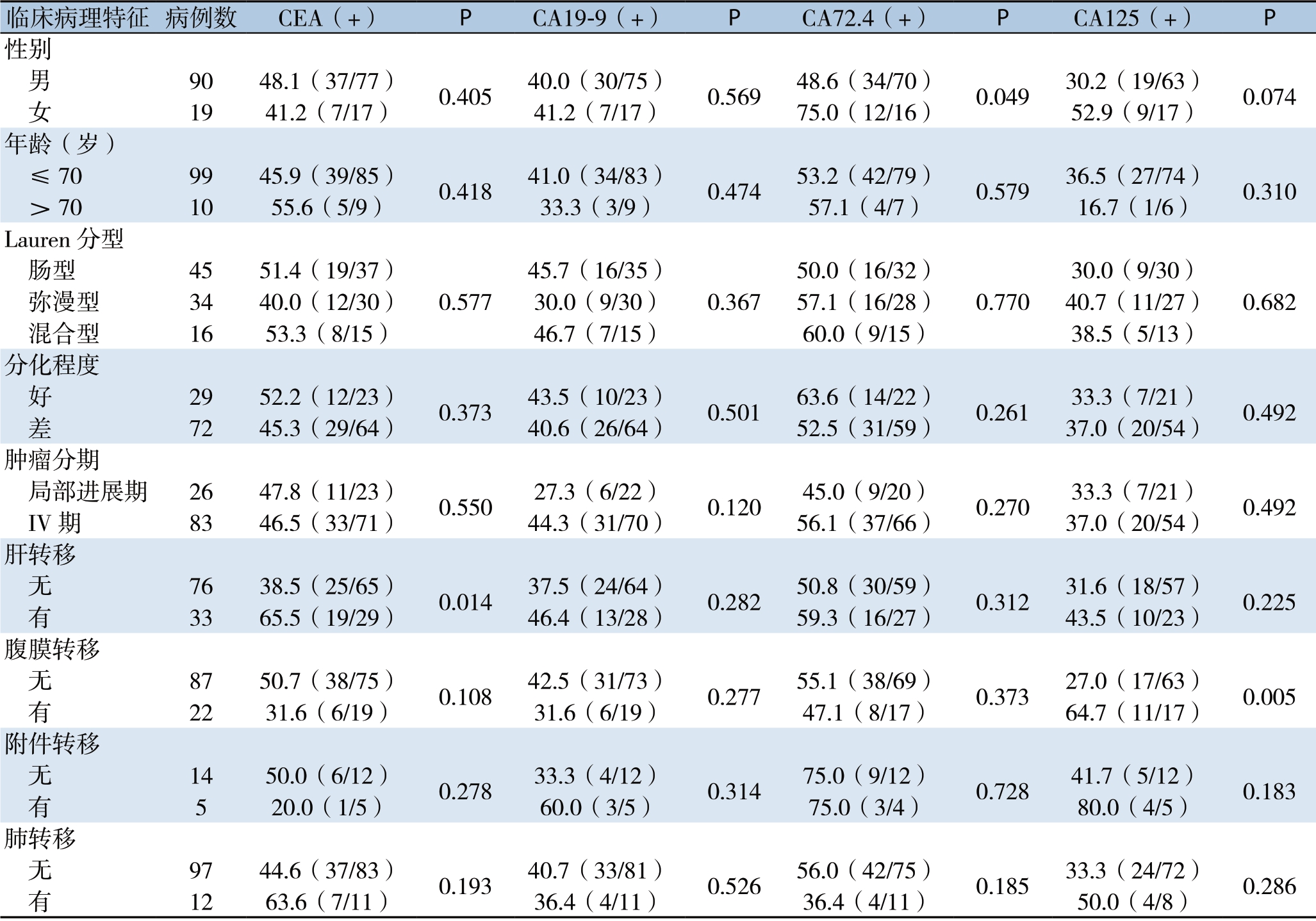
临床病理特征 病例数 CEA(+) P CA19-9(+) P CA72.4(+) P CA125(+) P性别 男 90 48.1(37/77) 0.405 40.0(30/75) 0.569 48.6(34/70) 0.049 30.2(19/63) 0.074 女 19 41.2(7/17) 41.2(7/17) 75.0(12/16) 52.9(9/17)年龄(岁) ≤70 99 45.9(39/85) 0.418 41.0(34/83) 0.474 53.2(42/79) 0.579 36.5(27/74) 0.310 >70 10 55.6(5/9) 33.3(3/9) 57.1(4/7) 16.7(1/6)Lauren分型 肠型 45 51.4(19/37)0.577 45.7(16/35)50.0(16/32)30.0(9/30) 弥漫型 34 40.0(12/30) 30.0(9/30) 57.1(16/28) 40.7(11/27) 混合型 16 53.3(8/15) 46.7(7/15) 60.0(9/15) 38.5(5/13)分化程度 好 29 52.2(12/23) 0.373 43.5(10/23) 0.501 63.6(14/22) 0.261 33.3(7/21) 0.492 差 72 45.3(29/64) 40.6(26/64) 52.5(31/59) 37.0(20/54)肿瘤分期 局部进展期 26 47.8(11/23) 0.550 27.3(6/22) 0.120 45.0(9/20) 0.270 33.3(7/21) 0.492 IV期 83 46.5(33/71) 44.3(31/70) 56.1(37/66) 37.0(20/54)肝转移 无 76 38.5(25/65) 0.014 37.5(24/64) 0.282 50.8(30/59) 0.312 31.6(18/57) 0.225 有 33 65.5(19/29) 46.4(13/28) 59.3(16/27) 43.5(10/23)腹膜转移 无 87 50.7(38/75) 0.108 42.5(31/73) 0.277 55.1(38/69) 0.373 27.0(17/63) 0.005 有 22 31.6(6/19) 31.6(6/19) 47.1(8/17) 64.7(11/17)附件转移 无 14 50.0(6/12) 0.278 33.3(4/12) 0.314 75.0(9/12) 0.728 41.7(5/12) 0.183 有 5 20.0(1/5) 60.0(3/5) 75.0(3/4) 80.0(4/5)肺转移 无 97 44.6(37/83) 0.193 40.7(33/81) 0.526 56.0(42/75) 0.185 33.3(24/72) 0.286 有 12 63.6(7/11) 36.4(4/11) 36.4(4/11) 50.0(4/8)0.367 0.770 0.682
2.3 单因素生存分析
截止到末次随访时间2016年3月11日,在纳入的109例患者中,共计死亡患者69例,失访患者 9例,31例患者在末次随访时间仍存活。
单因素生存分析中,CA72.4阳性者比阴性者的中位PFS(6.3个月vs.11.1个月,P=0.020)及中位OS(9.9个月vs.16.9个月,P=0.007)均明显缩短;CA125阳性者比阴性者的中位PFS (6.2个月vs.7.8个月,P=0.002)及中位OS (9.8个月vs.15.6个月,P=0.009)也明显缩短(表3)。
联合检测多种肿瘤标志物时至少1种为阳性则定义结果为阳性。如表3所示,CA19-9(+)/ CA72.4(+)、CA19-9(+)/CA125(+)、CA72.4(+)/CA125(+)、CA19-9(+)/CA72.4(+)/CA125(+)组的患者与各自对照组相比PFS(P=0.057、0.016、0.002和0.014)及OS(P=0.014、0.004、0.002、0.009)均缩短。
2.4 多因素生存分析
多因素分析中,患者的独立预后因素有肿瘤分化差(RR=42.282,95% CI=3.385~528.159,P=0.004)、腹膜转移(RR=8.736,95% CI= 1.314~58.097,P=0.025)、CA72.4>6.7 U/mL(RR=6.718,95% CI=1.643~27.466,P=0.008)和CA125>35.0 U/mL(RR=5.483,95% CI= 1.016~29.601,P=0.048)(表4)。
2.5 建立预后模型
多因素分析中,肿瘤分化程度、腹膜转移、CA72.4、CA125是患者的独立预后因素(表4)。定义肿瘤分化差、腹膜转移、CA72.4(+)、CA125(+)为4种危险因素。无危险因素或仅1种危险因素者为低危人群,有1种以上危险因素者为高危人群。高危人群和低危人群的中位生存期分别为9.9个月和18.5个月(P=0.001)(图1)。
表3 单因素分析肿瘤标志物与无进展生存期和总生存期的关系
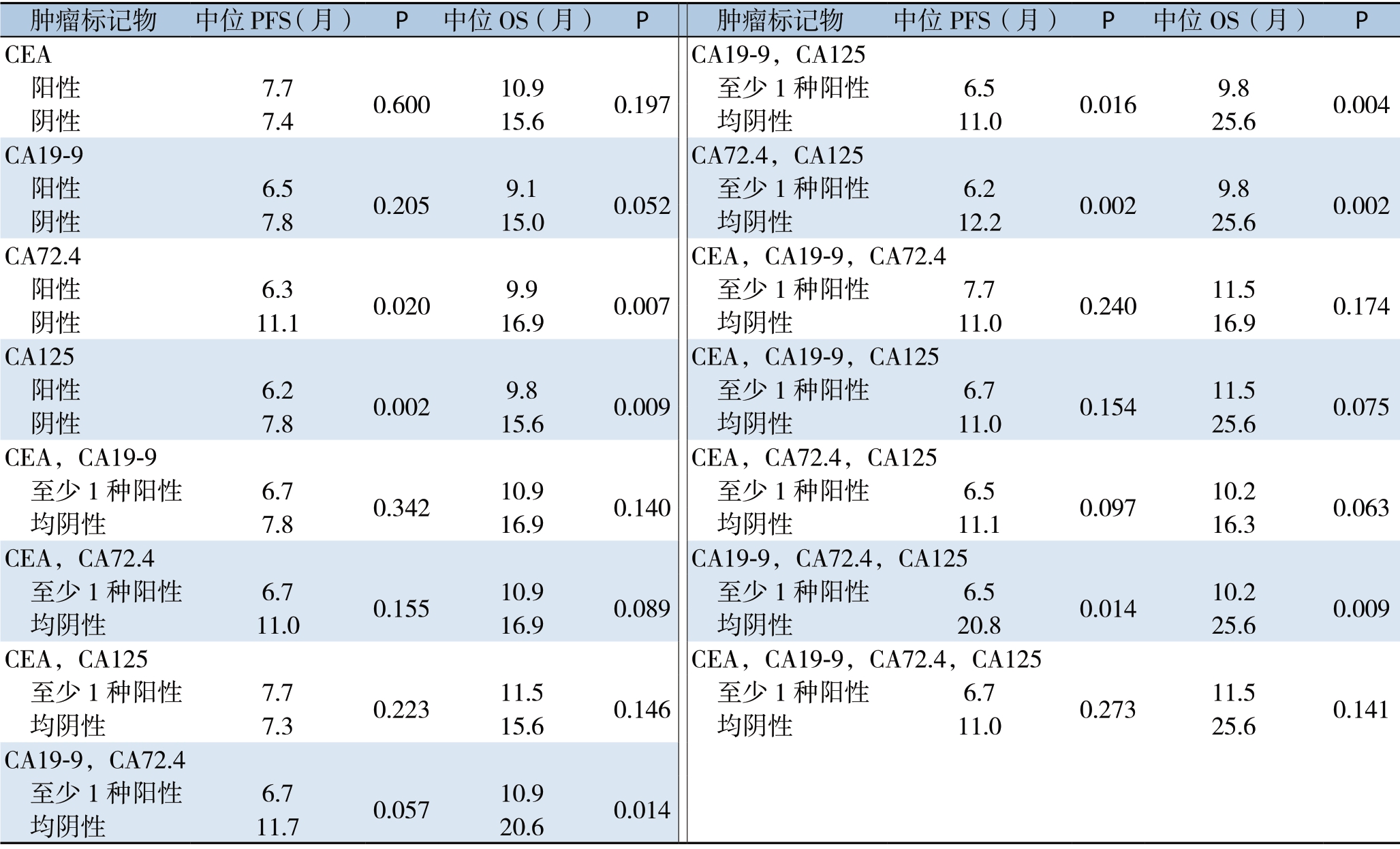
肿瘤标记物 中位PFS(月) P 中位OS(月) P 肿瘤标记物 中位PFS(月) P 中位OS(月) P CEA CA19-9,CA125 阳性 7.7 0.600 10.9 0.197 至少1种阳性 6.5 0.016 9.8 0.004 阴性 7.4 15.6 均阴性 11.0 25.6 CA19-9 CA72.4,CA125 阳性 6.5 0.205 9.1 0.052 至少1种阳性 6.2 0.002 9.8 0.002 阴性 7.8 15.0 均阴性 12.2 25.6 CA72.4 CEA,CA19-9,CA72.4 阳性 6.3 0.020 9.9 0.007 至少1种阳性 7.7 0.240 11.5 0.174 阴性 11.1 16.9 均阴性 11.0 16.9 CA125 CEA,CA19-9,CA125 阳性 6.2 0.002 9.8 0.009 至少1种阳性 6.7 0.154 11.5 0.075 阴性 7.8 15.6 均阴性 11.0 25.6 CEA,CA19-9 CEA,CA72.4,CA125 至少1种阳性 6.7 0.342 10.9 0.140 至少1种阳性 6.5 0.097 10.2 0.063 均阴性 7.8 16.9 均阴性 11.1 16.3 CEA,CA72.4 CA19-9,CA72.4,CA125 至少1种阳性 6.7 0.155 10.9 0.089 至少1种阳性 6.5 0.014 10.2 0.009 均阴性 11.0 16.9 均阴性 20.8 25.6 CEA,CA125 CEA,CA19-9,CA72.4,CA125 至少1种阳性 7.7 0.223 11.5 0.146 至少1种阳性 6.7 0.273 11.5 0.141 均阴性 7.3 15.6 均阴性 11.0 25.6 CA19-9,CA72.4 至少1种阳性 6.7 0.057 10.9 0.014 均阴性 11.7 20.6
表4 多因素分析肿标与无进展生存期和总生存期的相关性
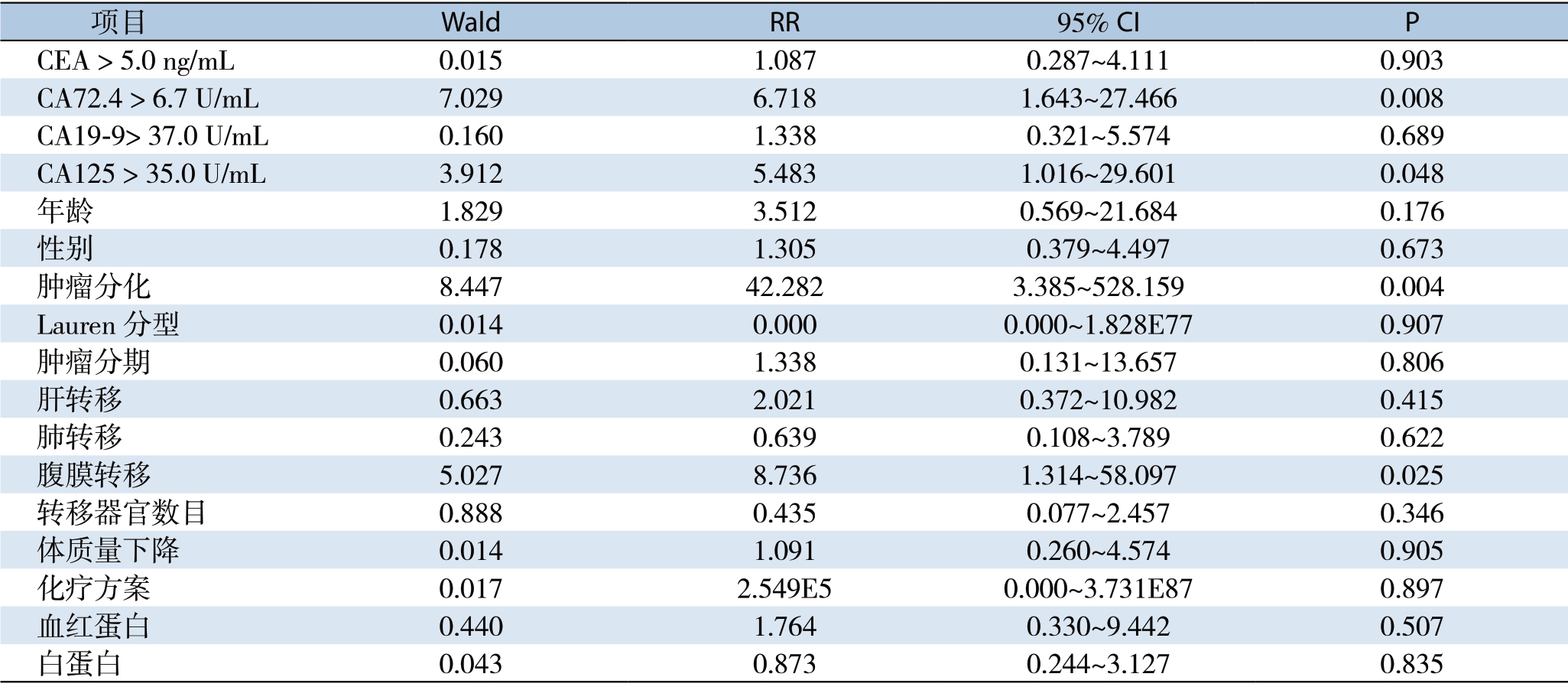
项目 Wald RR 95% CI P CEA > 5.0 ng/mL 0.015 1.087 0.287~4.111 0.903 CA72.4 > 6.7 U/mL 7.029 6.718 1.643~27.466 0.008 CA19-9> 37.0 U/mL 0.160 1.338 0.321~5.574 0.689 CA125 > 35.0 U/mL 3.912 5.483 1.016~29.601 0.048年龄 1.829 3.512 0.569~21.684 0.176性别 0.178 1.305 0.379~4.497 0.673肿瘤分化 8.447 42.282 3.385~528.159 0.004 Lauren分型 0.014 0.000 0.000~1.828E77 0.907肿瘤分期 0.060 1.338 0.131~13.657 0.806肝转移 0.663 2.021 0.372~10.982 0.415肺转移 0.243 0.639 0.108~3.789 0.622腹膜转移 5.027 8.736 1.314~58.097 0.025转移器官数目 0.888 0.435 0.077~2.457 0.346体质量下降 0.014 1.091 0.260~4.574 0.905化疗方案 0.017 2.549E5 0.000~3.731E87 0.897血红蛋白 0.440 1.764 0.330~9.442 0.507白蛋白 0.043 0.873 0.244~3.127 0.835
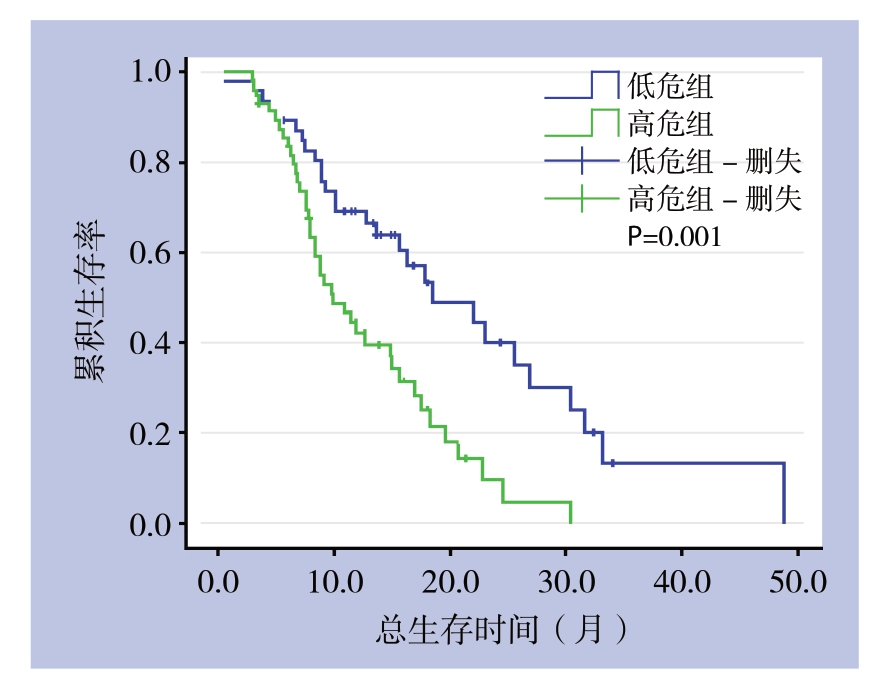
图1 高危组和低危组患者总生存期曲线
3 讨 论
血液肿瘤标志物已广泛应用于临床实践中,在中国胃癌最常用的肿瘤标志物有CEA、CA19-9、CA72.4和CA125。本研究检测CEA、CA19-9、CA72.4、CA125的阳性率分别为46.8%、40.2%、53.5%和35.0%,这与既往研究结果基本一致[10-15]。
既往有研究显示在胃癌患者中CEA与肝转移[16]、CA125与腹膜转移[17-20]有关。本研究结果显示,与无肝转移的患者相比,肝转移患者的CEA阳性率明显增高(65.5% vs.38.5%,P=0.014);与无腹膜转移的患者相比,腹膜转移者CA125的阳性率也明显提高(64.7% vs.27.0%,P=0.005),进一步验证了上述结论。此外本研究中女性患者CA72.4阳性率(75.0%)显著高于男性患者(48.6%)(P=0.049),既往研究并无此报道,是否因本项研究中女性患者较少(19例),导致结果有偏倚,有待进一步研究结果佐证。
既往很多研究显示CEA、CA19-9、CA72.4与胃癌患者预后有关[2-9,21]。如Song等[21]做的荟萃分析纳入了38项研究分析CA19-9与胃癌患者预后的关系,结果发现术前CA19-9阳性的患者生存期明显缩短(HR=1.85,95% CI=1.16~2.95)。但这方面研究多着眼于胃癌根治术前肿标与患者预后的相关性,关于肿标在晚期胃癌患者预后中的价值的研究较少。Catalano等[22]曾研究CEA与接受二线化疗的胃癌患者预后的相关性,结果显示CEA >50 ng/mL者的生存期较≤50 ng/mL者明显缩短(5.0个月vs.7.0个月,P=0.002),且在多因素分析中CEA>50 ng/mL也是独立预后因素(HR=1.86,95% CI=1.21~2.88)。本研究分析了肿标与一线化疗胃癌患者生存期的相关性。单因素分析显示CA72.4阳性者及CA125阳性者分别较CA72.4阴性者及CA125阴性者的PFS和OS均明显缩短(P<0.05),而多因素分析也证实CA72.4、CA125是患者的独立预后因素。
关于腹膜转移在胃癌患者预后方面的价值,很多学者早有研究,有结果显示腹膜转移或腹水是胃癌患者的独立预后因素,有腹膜转移者预后差[23-25]。Lee等[25]的研究中,有腹膜或腹水的胃癌患者1年生存率为26.1%,而无腹膜转移者为42.1%,两者有显著的统计学差异(P<0.001)。同样,在本项研究的多因素分析中,腹膜转移也是胃癌患者的独立预后因素(RR=8.736,95% CI= 1.314~58.097),再次证实了之前的研究。
此外,既往很多研究分析了胃癌患者的病理分化程度与预后的相关性,结论不一,有的显示分化差者预后差[26],而有的显示肿瘤分化程度虽与其他临床病理学因素如肿瘤浸润深度、淋巴结受侵、肿瘤分期等有关,但与患者预后却无明显相关[27]。而且我们发现这类研究也是多局限于分析在手术切除的胃癌患者中分化程度与预后的相关性,而分析分化程度在晚期胃癌患者中预后价值的研究很少,只有个别研究,其结果也是阴性的。如Lee等[25]的研究中分化好与分化差的胃癌患者的1年生存率分别为39.5%和37.7%(P=0.949),差异无统计学意义;Catalano等[22]在75例接受二线化疗的胃癌患者中分析了肿瘤分化程度的预后价值,结果显示分化好与分化差者1年生存率也无统计学差异(18.4个月vs.22.2个月,P=0.447)。本研究中分析的是在接受一线化疗的不可手术切除的局部进展期及晚期胃癌患者中肿瘤分化程度与生存的相关性,多因素分析显示肿瘤分化程度是患者的独立预后因素。
联合多种预后因素创建预后模型可更好地评估患者的预后。之前已有学者[24-25,28-29]试图创建晚期胃癌患者的预后模型。Chau等[24]分析了1 080例 局部进展期和转移性食管-胃癌患者的预后因素,多因素分析得到4种独立预后因素PS≥2、肝转移、腹膜转移和碱性磷酸酶ALP≥100 U/L,根据危险因素个数将所有患者分至好(无风险因素)、中(1至2种风险因素)、差(3至4种风险因素)3组,3组的1年生存率分别为48.5%、25.7%和11%(P<0.0001)。而Lee[25]的研究显示预后差的因素有胃切除史、白蛋白<36 g/L、ALP>85 U/L、ECOG≥2、骨转移、腹水,风险低(0或1种风险因素)、中(2至4种风险因素)、高(5至6种风险因素)3组患者的中位生存期分别为12.5、7.0、2.7个月。本项研究中,多因素分析显示患者的独立预后因素有4种:肿瘤分化程度(RR=42.282,95% CI=3.385~528.159,P=0.004)腹膜转移(RR=8.736;95% CI=1.314~58.097,P=0.025)、CA72.4>6.7 U/mL(RR=6.718,95% CI=1.643~27.466,P=0.008)和CA125 >35.0 U/mL(RR=5.483,95% CI=1.016~29.601,P=0.048)。定义肿瘤分化差、腹膜转移、CA72.4(+)、CA125(+)为4种危险因素,无危险因素或仅1种危险因素者为低危人群,有 1种以上危险因素者为高危人群,结果显示高危人群和低危人群的中位生存期分别为9.9个月和 18.5个月(P=0.001),差异有统计学意义。由此看来,可根据这些因素很好地评估患者的预后,并据此为患者制定个体化的治疗方案。
总之,本研究分析了不可手术切除的局部进展期胃癌及转移性胃癌患者中CEA、CA19-9、CA72.4、CA125 4种肿瘤标记物的表达情况及其预后价值。CEA、CA19-9、CA72.4、CA125的阳性率分别为46.8%、40.2%、53.5%和35.0%。CEA与肝转移、CA125与腹膜转移有关。单因素分析中CA72.4阳性者及CA125阳性者分别较CA72.4阴性者及CA125阴性者的PFS和OS均明显缩短,而多因素分析也证实CA72.4、CA125是患者的独立预后因素。此外多因素分析中肿瘤分化程度、腹膜转移也是患者的独立预后因素。定义肿瘤分化差、腹膜转移、CA72.4(+)、CA125(+)为4种危险因素,根据危险因素个数将患者分成高危人群和低危人群,高危者的生存期明显缩短。这种预后模型可帮助临床更好地将患者分层,并据此为患者制定更适合的个体化治疗方案。
[1] Goto O,Shimoda M,Sasaki M,et al.Potential for peritoneal cancer cell seeding in endoscopic full-thickness resection for early gastric cancer[J].Gastrointest Endosc,2018,87(2):450-456.doi:10.1016/j.gie.2017.08.036.
[2] Suenaga Y,Kanda M,Ito S,et al.Prognostic significance of perioperative tumor marker levels in stage II/III gastric cancer[J].World J Gastrointest Oncol,2019,11(1):17-27.doi:10.4251/wjgo.v11.i1.17.
[3] Huang ZB,Zhou X,Xu J,et al.Prognostic value of preoperative serum tumor markers in gastric cancer [J].World J Clin Oncol,2014,5(2):170-176.doi:10.5306/wjco.v5.i2.170.
[4] Wang W,Chen XL,Zhao SY,et al.Prognostic significance of preoperative serum CA125,CA19-9 and CEA in gastric carcinoma[J].Oncotarget,2016,7(23):35423-35436.doi:10.18632/oncotarget.8770.
[5] Lin JX,Wang W,Lin JP,et al.Preoperative Tumor Markers Independently Predict Survival in Stage III Gastric Cancer Patients:Should We Include Tumor Markers in AJCC Staging?[J].Ann Surg Oncol,2018,25(9):2703-2712.doi:10.1245/s10434-018-6634-z.
[6] Zhang Q,Qu H,Sun G,et al.Early postoperative tumor marker responses provide a robust prognostic indicator for N3 stage gastric cancer[J].Medicine (Baltimore),2017,96(32):e7560.doi:10.1097/MD.0000000000007560.
[7] Feng F,Sun L,Liu Z,et al.Prognostic values of normal preoperative serum cancer markers for gastric cancer[J].Oncotarget,2016,7(36):58459-58469.doi:10.18632/oncotarget.11248.
[8] Uda H,Kanda M,Tanaka C,et al.Perioperative Serum Carcinoembryonic Antigen Levels Predict Recurrence and Survival of Patients with Pathological T2-4 Gastric Cancer Treated with Curative Gastrectomy[J].Dig Surg,2018,35(1):55-63.doi:10.1159/000471931.
[9] Feng F,Tian Y,Xu G,et al.Diagnostic and prognostic value of CEA,CA19-9,AFP and CA125 for early gastric cancer[J].BMC Cancer,2017,17(1):737.doi:10.1186/s12885-017-3738-y.
[10] Shimada H,Noie T,Ohashi M,et al.Clinical significance of serum tumor markers for gastric cancer:a systematic review of literature by the Task Force of the Japanese Gastric Cancer Association[J].Gastric Cancer,2014,17(1):26-33.doi:10.1007/s10120-013-0259-5.
[11] Yang AP,Liu J,Lei HY,et al.CA72-4 combined with CEA,CA125 and CAl9-9 improves the sensitivity for the early diagnosis of gastric cancer[J].Clin Chim Acta,2014,437:183-186.doi:10.1016/j.cca.2014.07.034.
[12] Kim JH,Jun KH,Jung H,et al.Prognostic Value of Preoperative Serum Levels of Five Tumor Markers (Carcinoembryonic Antigen,CA19-9,Alpha-fetoprotein,CA72-4,and CA125) in Gastric Cancer[J].Hepatogastroenterology,2014,61(131):863-869.
[13] Liang Y,Wang W,Fang C,et al.Clinical significance and diagnostic value of serum CEA,CA19-9 and CA72-4 in patients with gastric cancer [J].Oncotarget,2016,7(31):49565-49573.doi:10.18632/oncotarget.10391.
[14] 杨朝美,杨晏.PGR与血清肿瘤标记物联合检测在胃癌诊断的临床意义[J].中国普通外科杂志,2018,27(4):523-527.doi:10.3978/j.issn.1005-6947.2018.04.020.
Yang CM,Yang Y.Clinical significance of combined detection of PGR and serum tumor markers in diagnosis of gastric cancer[J].Chinese Journal of General Surgery,2018,27(4):523-527.doi:10.3978/j.issn.1005-6947.2018.04.020.
[15] Chen C,Chen Q,Zhao Q,et al.Value of Combined Detection of Serum CEA,CA72-4,CA19-9,CA15-3 and CA12-5 in the Diagnosis of Gastric Cancer[J].Ann Clin Lab Sci,2017,47(3):260-263.
[16] Song JC,Ding XL,Zhang Y,et al.Prospective and prognostic factors for hepatic metastasis of gastric carcinoma:A retrospective analysis[J].J Cancer Res Ther,2019,15(2):298-304..doi:10.4103/jcrt.JCRT_576_17.
[17] 周鹏,曲辉,史惠文,等.血清糖类抗原125对胃癌腹膜转移及其预后的预测价值[J].中华胃肠外科杂志,2014,17(10):1027-1030.doi:10.3760/cma.j.issn.1671-0274.2014.10.017.
Zhou P,Qu H,Shi HW,et al.Predictive value of CA125 in peritoneal metastasis and prognosis of patients with gastric carcinoma[J].Chinese Journal of Gastrointestinal Surgery,2014,17(10):1027-1030.doi:10.3760/cma.j.issn.1671-0274.2014.10.017.
[18] Luo T,Chen W,Wang L,et al.CA125 is a potential biomarker to predict surgically incurable gastric and cardia cancer:A retrospective study[J].Medicine (Baltimore),2016,95(51):e5297.doi:10.1097/MD.0000000000005297.
[19] Lai H,Jin Q,Lin Y,et al.Combined use of lysyl oxidase,carcinoembryonic antigen,and carbohydrate antigens improves the sensitivity of biomarkers in predicting lymph node metastasis and peritoneal metastasis in gastric cancer[J].Tumour Biol,2014,35(10):10547-10554.doi:10.1007/s13277-014-2355-5.
[20] 赵骏杰,周荣健,张启,等.胃癌腹膜转移风险评估模型的建立及其预测价值[J].中华胃肠外科杂志,2017,20(1):47-52.doi:10.3760/cma.j.issn.1671-0274.2017.01.010.
Zhao JJ,Zhou RJ,Zhang Q,et al.Establishment of risk evaluation model of peritoneal metastasis in gastric cancer and its predictive value[J].Chinese Journal of Gastrointestinal Surgery,2017,20(1):47-52.doi:10.3760/cma.j.issn.1671-0274.2017.01.010.
[21] Song YX,Huang XZ,Gao P,et al.Clinicopathologic and Prognostic Value of Serum Carbohydrate Antigen 19-9 in Gastric Cancer:A Meta-Analysis[J].Dis Markers,2015:549843.doi:10.1155/2015/549843.
[22] Catalano V,Graziano F,Santini D,et al.Second-line chemotherapy for patients with advanced gastric cancer:who may benefit? [J].Br J Cancer,2008,99(9):1402-1407.doi:10.1038/sj.bjc.6604732.
[23] Yarema R,Mielko J,Fetsych T,et al.Hyperthermic intraperitoneal chemotherapy (HIPEC) in combined treatment of locally advanced and intraperitonealy disseminated gastric cancer:A retrospective cooperative Central-Eastern European study[J].Cancer Med,2019,8(6):2877-2885.doi:10.1002/cam4.2204.
[24] Chau I,Norman AR,Cunningham D,et al.Multivariate prognostic factor analysis in locally advanced and metastatic esophagogastric cancer pooled analysis from three multicenter,randomized,controlled trials using individual patient data [J].J Clin Oncol,2004,22:2395-2403.doi:10.1200/JCO.2004.08.154.
[25] Lee J,Lim T,Uhm JE,et al.Prognostic model to predict survival following first-line chemotherapy in patients with metastatic gastric adenocarcinoma [J].Ann Oncol,2007,18(5):886-891.doi:10.1093/annonc/mdl501.
[26] Shiraishi N,Sato K,Yasuda K,et a1.Multivariate prognostic study on large gastric cancer [J].J Surg Oncol,2007,96(1):14-18.doi:10.1002/jso.20631.
[27] Feng F,Liu J,Wang F,et al.Prognostic value of differentiation status in gastric cancer [J].BMC Cancer,2018,18(1):865.doi:10.1186/s12885-018-4780-0.
[28] Custodio A,Carmona-Bayonas A,Jiménez-Fonseca P,et al.Nomogram-based prediction of survival in patients with advanced oesophagogastric adenocarcinoma receiving firstline chemotherapy:a multicenter prospective study in the era of trastuzumab[J].Br J Cancer,2017,116(12):1526-1535.doi:10.1038/bjc.2017.122.
[29] Hsieh MC,Wang SH,Chuah SK,et al.A Prognostic Model Using Inflammation- and Nutrition-Based Scores in Patients With Metastatic Gastric Adenocarcinoma Treated With Chemotherapy[J].Medicine (Baltimore),2016,95(17):e3504.doi:10.1097/MD.0000000000003504.
