胰腺癌是发达国家癌症死亡的主要原因之一,也是世界上最致命的恶性肿瘤之一[1]。根据GLOBOCAN 2012年的估计,胰腺癌每年导致33.1万人死亡,是男女癌症死亡的第七大主要原因[2]。胰腺癌的病因尚不清楚,已知的危险因素有吸烟、肥胖、遗传、糖尿病、饮食、不运动等[3]。全世界胰腺癌的发病率和病死率与年龄增长有关,男性比女性略为常见[4]。总体5年生存率约为6%(2%~9%)[5]。近三分之二的胰腺癌患者病变位于胰头,此类患者唯一可能的治疗选择是胰十二指肠切除术,通常与辅助化疗结合使用[6-10]。然而,只有20%的患者在诊断时可以接受胰十二指肠切除术,即使胰腺切除成功,预后也很差,5年生存率约为4%~30%,中位生存期为18~29个月[11-13]。降钙素原可预测疾病严重程度;C-反应蛋白不仅是一种灵敏的炎症因子,而且对临床病情的变化有敏感的反应;发病时血清乳酸脱氢酶水平与预后有关。鉴于此,在胰头癌患者行胰十二指肠切除术后监测患者并发症发生情况有望降低围手术期病死率,对预后至关重要,本研究旨在探讨血清降钙素原、C-反应蛋白及乳酸脱氢酶在胰头癌行胰十二指肠切除术后并发症患者中的变化及临床意义。
1 资料与方法
1.1 一般资料
前瞻性选择2016年10月—2019年5月于我院行胰十二指肠切除术治疗的胰头癌患者236例。纳入标准:⑴ 患者年龄18~80岁;⑵ 符合胰头癌诊断标准[14],病变位于胰头,肿瘤-淋巴结-转移(tumor-node-metastasis,TNM)分期为I~III期;⑶ 行胰十二指肠切除术;⑷ Karn of sky 体力状况(Karnofskyperformance status,KPS)评分>80分。排除标准:⑴ <18岁;⑵ 有远处转移者;⑶ 术前感染;⑷ 伴有全身炎症性疾病;⑸ 合并其他重要脏器疾病。所有患者均对本研究知情,且签署了知情同意书。236例患者中男142例,女94例;年龄30~80岁,平均(56.43±7.64)岁;肿瘤直径1~6 cm,平均(3.24±0.81)cm;I期32例,II期149例,III期55例。根据术后是否发生并发症分为并发症组(n=98)和无并发症组(n=138)。并发症包括胰瘘44例,腹腔感染22例,胃排空障碍18例,出血8例,胆瘘3例,切口感染3例。
1.2 手术方法
手术由我院胰腺肿瘤科同一组医师团队实施,对胰头癌患者实施标准的胰十二指肠切除术[15-17]。
1.3 观察指标
⑴ 收集患者病例资料,包括:性别、年龄、体质量、病史、生化指标、肿瘤标志物等资料,统计患者手术时间、术中出血量、肿瘤直径、TNM分期、住院天数等,观察患者并发症发生情况,包括胰瘘、腹腔感染、胃排空障碍、出血、胆瘘、切口感染。⑵ 检测血清降钙素原、C-反应蛋白及乳酸脱氢酶水平。采集患者入院后及术后第1、4、7天空腹静脉血3~5 mL,3000 r/min离心10 min后收集上清液,采用免疫荧光法检测降钙素原水平,采用生化分析仪检测C-反应蛋白水平,采用Modular(罗氏)分析仪检测乳酸脱氢酶水平,各试剂盒均购自罗氏诊断产品(上海)有限公司,操作均按相关说明书进行。⑶ 在不同时间点对患者急性生理与慢性健康状况评分(Acute Physiology and Chronic Health Evaluation,APACHE)-Ⅱ评分进行评估。
1.4 统计学处理
采用SPSS 20.0进行数据分析,相关数据呈正态分布,计量资料采用均数±标准差(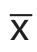 ±s)表示,组间比较采用t检验;计数资料采用率(%)表示,组间比较采用χ2检验;相关性采用Person相关分析,P<0.05为差异有统计学意义。
±s)表示,组间比较采用t检验;计数资料采用率(%)表示,组间比较采用χ2检验;相关性采用Person相关分析,P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者术前一般资料比较
两组患者性别、年龄、体质量指数、病史、生化指标及肿瘤标志物水平均无统计学差异(P>0.05)(表1)。
表1 两组患者术前一般资料比较
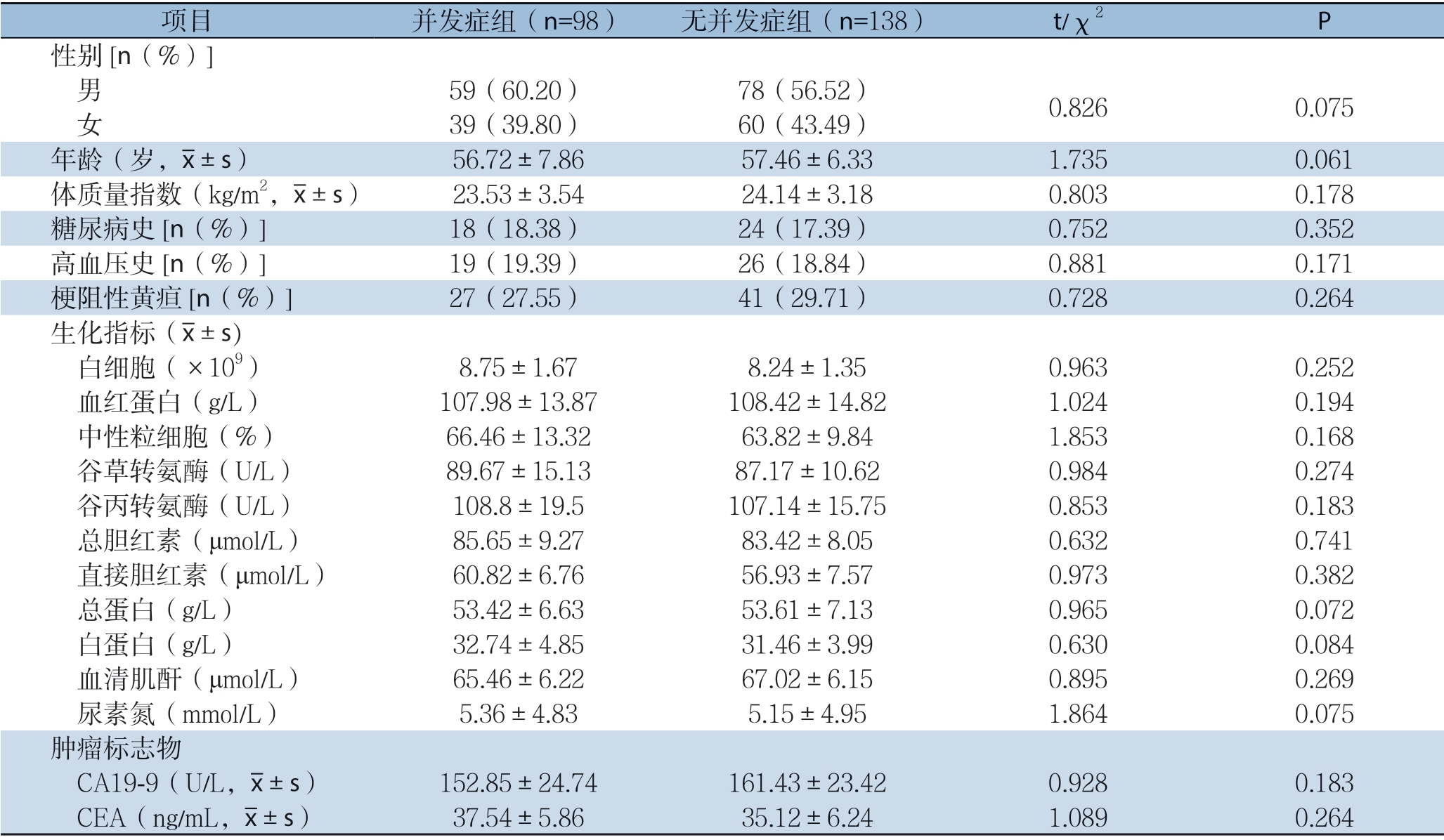
项目 并发症组(n=98) 无并发症组(n=138) t/χ2 P性别[n(%)]男 59(60.20) 78(56.52) 0.8260.075 女 39(39.80) 60(43.49)年龄(岁,images/BZ_67_1816_1175_1853_1225.png±s) 56.72±7.8657.46±6.331.7350.061体质量指数(kg/m2,images/BZ_67_1816_1175_1853_1225.png±s) 23.53±3.5424.14±3.180.8030.178糖尿病史[n(%)]18(18.38) 24(17.39) 0.7520.352高血压史[n(%)]19(19.39) 26(18.84) 0.8810.171梗阻性黄疸[n(%)]27(27.55) 41(29.71) 0.7280.264生化指标(images/BZ_67_1816_1175_1853_1225.png±s) 白细胞(×109) 8.75±1.678.24±1.350.9630.252 血红蛋白(g/L) 107.98±13.87108.42±14.821.0240.194 中性粒细胞(%) 66.46±13.3263.82±9.841.8530.168 谷草转氨酶(U/L) 89.67±15.1387.17±10.620.9840.274 谷丙转氨酶(U/L) 108.8±19.5107.14±15.750.8530.183 总胆红素(μmol/L) 85.65±9.2783.42±8.050.6320.741 直接胆红素(μmol/L) 60.82±6.7656.93±7.570.9730.382 总蛋白(g/L) 53.42±6.6353.61±7.130.9650.072 白蛋白(g/L) 32.74±4.8531.46±3.990.6300.084 血清肌酐(μmol/L) 65.46±6.2267.02±6.150.8950.269 尿素氮(mmol/L) 5.36±4.835.15±4.951.8640.075肿瘤标志物 CA19-9(U/L,images/BZ_67_1816_1175_1853_1225.png±s) 152.85±24.74161.43±23.420.9280.183 CEA(ng/mL,images/BZ_67_1816_1175_1853_1225.png±s) 37.54±5.8635.12±6.241.0890.264
2.2 两组手术及术后资料比较
两组间手术时间、术中出血量、肿瘤直径及TNM分期均无统计学差异(P>0.05);住院天数术后并发症组显著长于无并发症组,组间差异有统计学意义(P<0.05)(表2)。
表2 两组患者术前一般资料比较
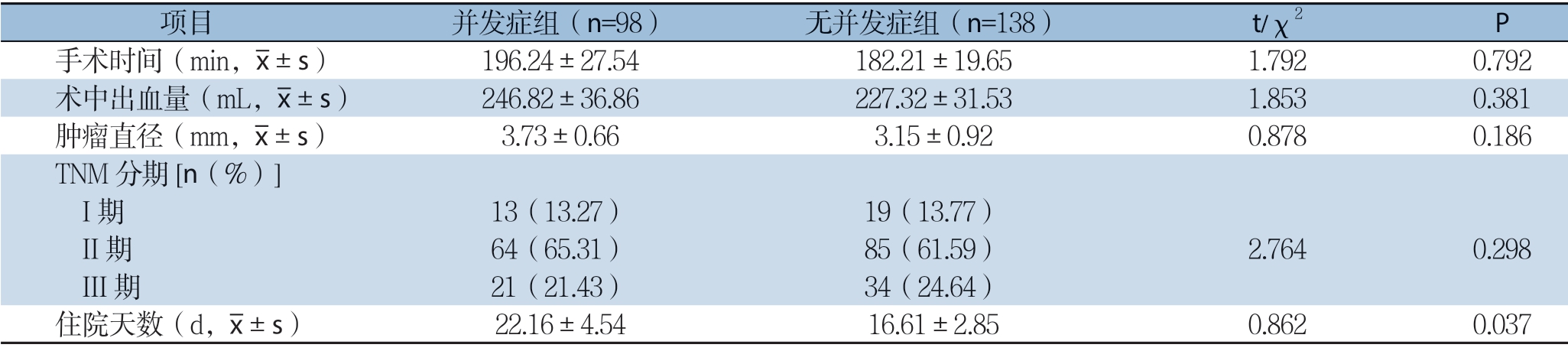
项目 并发症组(n=98) 无并发症组(n=138) t/χ2 P手术时间(min,images/BZ_67_1816_1175_1853_1225.png±s) 196.24±27.54182.21±19.651.7920.792术中出血量(mL,images/BZ_67_1816_1175_1853_1225.png±s) 246.82±36.86227.32±31.531.8530.381肿瘤直径(mm,images/BZ_67_1816_1175_1853_1225.png±s) 3.73±0.663.15±0.920.8780.186 TNM 分期[n(%)]I 期 13(13.27) 19(13.77) II 期 64(65.31) 85(61.59) 2.7640.298 III 期 21(21.43) 34(24.64)住院天数(d,images/BZ_67_1816_1175_1853_1225.png±s) 22.16±4.5416.61±2.850.8620.037
2.3 两组患者血清降钙素原、C-反应蛋白及乳酸脱氢酶水平比较
两组患者术前血清降钙素原、C-反应蛋白及乳酸脱氢酶水平均无统计学差异(P>0.05),在术后第1、4、7 天两组血清降钙素原、C-反应蛋白及乳酸脱氢酶水平较术前均明显升高(P<0.05),且并发症组患者升高较无并发症组更明显(P<0.05);随着时间的推移,无并发症组患者的各项指标水平逐渐恢复,并发症组患者在对症处理后各指标也渐进性得以恢复,但仍较无并发症组高(表3-5)。
表3 两组患者血清降钙素原水平比较(μg/L,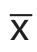 ±s)
±s)
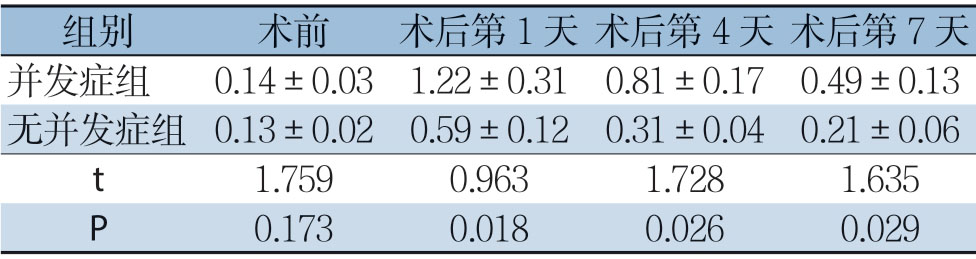
组别 术前 术后第1 天 术后第4 天 术后第7 天并发症组 0.14±0.031.22±0.310.81±0.170.49±0.13无并发症组 0.13±0.020.59±0.120.31±0.040.21±0.06 t 1.7590.9631.7281.635 P 0.1730.0180.0260.029
表4 两组患者血清C-反应蛋白水平比较(μg/L, ±s)
±s)
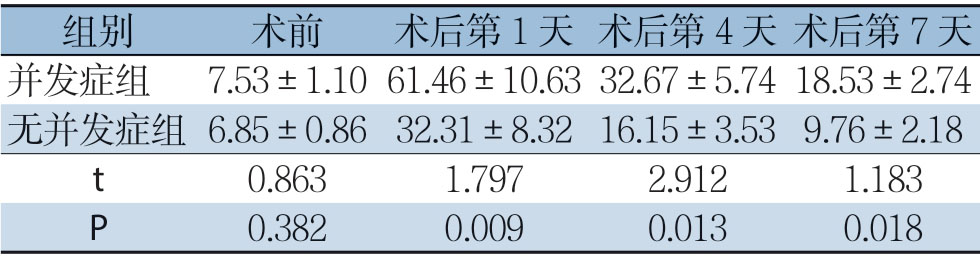
组别 术前 术后第1 天 术后第4 天 术后第7 天并发症组 7.53±1.1061.46±10.6332.67±5.7418.53±2.74无并发症组6.85±0.8632.31±8.3216.15±3.539.76±2.18 t 0.8631.7972.9121.183 P 0.3820.0090.0130.018
表5 两组患者血清乳酸脱氢酶水平比较(μg/L, ±s)
±s)
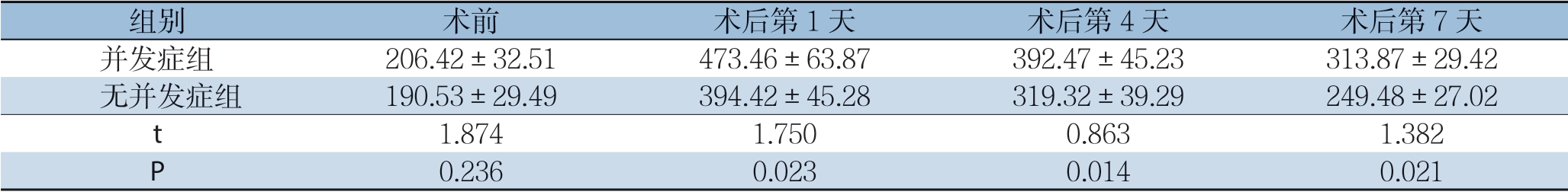
组别 术前 术后第1 天 术后第4 天 术后第7 天并发症组 206.42±32.51473.46±63.87392.47±45.23313.87±29.42无并发症组 190.53±29.49394.42±45.28319.32±39.29249.48±27.02 t 1.8741.7500.8631.382 P 0.2360.0230.0140.021
2.4 两组患者APACHE-II 评分比较
术前两组患者APACHE-II评分无统计学差异(P>0.05),术后第1天两组APACHE-II评分急剧上升,且并发症组上升更显著,随后在第4天和第7天,两组的评分均逐渐下降,并发症组依然较无并发症组高,有统计学差异(P<0.05)(表6)。
表6 两组患者APACHE-II 评分比较(分, ±s)
±s)

组别 术前 术后第1 天 术后第4 天 术后第7 天并发症组 7.12±2.1218.21±3.8416.21±3.1811.21±2.19无并发症组7.01±1.8214.83±3.1811.46±3.449.21±2.18 t 0.8980.7200.8321.183 P 0.3180.0360.0190.038
2.5 血清降钙素原、C-反应蛋白及乳酸脱氢酶水平与APACHE-II 评分的相关性分析
血清降钙素原、C-反应蛋白及乳酸脱氢酶水平均与APACHE-II评分呈正相关关系,相关系数分别为0.712、0.635、0.816(P<0.05)。
3 讨 论
胰腺癌是美国癌症相关死亡的第四大原因,仅次于结直肠癌,是消化道癌症相关死亡的主要原因[18]。手术切除是唯一可能的治疗方法。但遗憾的是,一般发现时间较晚,只有15%~20%的患者可以接受外科手术[19]。而且,即使在完全切除后,预后也很差。胰十二指肠切除术后5年生存率在淋巴结阴性患者为25%~30%,淋巴结阳性患者为10%[20]。这是因为胰十二指肠切除术治疗胰头癌的患者有较高的术后并发症发生风险,无疑会增加病死率,因此,建立胰头癌胰十二指肠切除术后并发症的监测指标对预后有重大意义。
降钙素原是由甲状腺C细胞产生的116个氨基酸的降钙素前体[21],在细菌感染中其合成上调,在病毒感染中下调[22]。降钙素原对疾病严重程度(如胰腺炎、腹部感染)和临床进展(如败血症)有预测价值[23]。C-反应蛋白长期以来被认为是一种有效的炎症标志物,其在宿主防御入侵病原体和炎症方面发挥着重要作用[24],较为敏感,对临床情况的变化反应较快[25]。乳酸脱氢酶在厌氧条件下催化丙酮酸和乳酸的可逆转化,乳酸诱导含氧恶性细胞增殖,血管生成,抑制先天性和适应性免疫反应[26]。基线血清乳酸脱氢酶升高与较短的生存期有关[27]。鉴于上述,本研究基于以上三项指标,探讨其在胰头癌行胰十二指肠切除术后并发症患者中的临床价值。
在过去的十年中,胰十二指肠切除术患者发生了一些重大变化,Cameron等[28]回顾了20世纪60年代至21世纪00年代由同一名外科医生进行的2000例胰十二指肠切除术资料,发现随着外科技术的进步和快速康复理念的进展,更好的围手术期管理使得术后短期病死率降低到5%以下。胰十二指肠切除术后并发症的发生主要是由于坏死组织或异物存留、胰液及毒素的吸收、引流不充分、合并症未得到良好控制等[29]。本研究中,术后发生胰瘘44 例,腹腔感染22 例,胃排空障碍18例,出血8例,胆瘘3例,切口感染3例,行针对性治疗,并发症组患者住院天数长于无并发症组患者,差异有统计学意义(P<0.05)。可见围手术期并发症的发生会延长病情恢复时间,因此完备的围手术期管理以及细致的术后并发症监测对患者康复意义重大。本研究中,术前两组血清降钙素原、C-反应蛋白及乳酸脱氢酶水平及APACHE-II评分均无统计学差异(P>0.05),术后第1、4、7天两组血清降钙素原、C-反应蛋白及乳酸脱氢酶水平及APACHE-II评分较术前均明显升高(P<0.05),且同一时间点并发症组患者升高较无并发症组更明显(P<0.05)。随着时间的推移,无并发症组患者的各项指标逐渐恢复,并发症组患者在对症处理后各指标也渐进性得以恢复,但仍较无并发症组高。白思嘉等[30]研究发现,血清降钙素原水平可以较好地预测胰十二指肠切除术后患者的腹腔感染及胰瘘发生情况;罗宝洋等[31]试验得出,C-反应蛋白/清蛋白在评估可切除胰头癌患者的预后中具有重要的临床价值,CRP/Alb高提示预后不良;吴海霞等[32]研究结果显示,乳酸脱氢酶是胰头癌的独立预后因素,以上研究证实血清降钙素原、C-反应蛋白及乳酸脱氢酶水平升高与术后并发症或预后不佳相关,本研究也发现在并发症组这三项指标均升高,由此可见,血清降钙素原、C-反应蛋白及乳酸脱氢酶水平的高低有助于预测患者并发症发生情况和预后,这也可能是因为该三种指标均为相关炎症指标,因此它们升高反映了患者感染程度较为严重,因此病情相对较差。提示炎症标志物可能成为客观评价结胰头癌患者并发症及预后的指标。APACHE-II评分可从多个方面反映危重症患者病情严重程度[33],本研究发现,血清降钙素原、C-反应蛋白及乳酸脱氢酶水平均与APACHE-II评分呈正相关关系,相关系数分别为0.712、0.635、0.816(P<0.05),表明降钙素原、C-反应蛋白及乳酸脱氢酶水平与疾病危重程度、进程和临床转归关系密切。
综上所述,对胰头癌行胰十二指肠切除术的患者,术后动态监测血清降钙素原、C-反应蛋白及乳酸脱氢酶及APACHE-II评分有助于判断并发症发生情况、病情改善状况,便于对病情进行检测,有助于及时采取治疗措施改善预后。在后续的研究中我们将纳入多中心大样本数据,建立多指标的监测评估,以便为胰头癌术后患者生活质量的提高提供切实可行的临床依据。
[1]Ilic M,Ilic I.Epidemiology of pancreatic cancer [J].World J Gastroenterol,2016,22(44):9694-9705.doi:10.3748/wjg.v22.i44.9694.
[2]Chu LC,Goggins MG,Fishman EK.Diagnosis and detection of pancreatic cancer[J].Cancer J,2017,23(6):333-342.doi:10.1097/PPO.0000000000000290.
[3]Yabar CS,Winter JM.Pancreatic cancer:a review[J].Gastroenterol Clin North Am,2016,45(3):429-445.doi:10.1016/j.gtc.2016.04.003.
[4]Goral V.Pancreatic cancer:pathogenesis and diagnosis[J].Asian Pac J Cancer Prev,2015,16(14):5619-5624.doi:10.7314/apjcp.2015.16.14.5619
[5]Cloyd JM,Nogueras-González GM,Prakash LR,et al.Anthropometric changes in patients with pancreatic cancer undergoing preoperative therapy and pancreatoduodenectomy[J].J Gastrointest Surg,2018,22(4):703-712.doi:10.1007/s11605-017-3618-4.
[6]van Dijk SM,Heerkens HD,Tseng DS,et al.Systematic review on the impact of pancreatoduodenectomy on quality of life in patients with pancreatic cancer[J].HPB (Oxford),2018,20(3):204-215.doi:10.1016/j.hpb.2017.11.002.
[7]Ryska M,Rudis J.Pancreatic fistula and postoperative pancreatitis after pancreatoduodenectomy for pancreatic cancer[J].Hepatobiliary Surg Nutr,2014,3(5):268-275.doi:10.3978/j.issn.2304-3881.2014.09.05.
[8]Ratnayake CBB,Shah N,Loveday B,et al.The impact of the depth of venous invasion on survival following pancreatoduodenectomy for pancreatic cancer:a meta-analysis of available evidence[J].J Gastrointest Cancer,2019.doi:10.1007/s12029-019-00248-3.[Epub ahead of print]
[9]Aoyama T,Kazama K,Murakawa M,et al.The surgical Apgar score is an independent prognostic factor in patients with pancreatic cancer undergoing pancreatoduodenectomy followed by adjuvant chemotherapy[J].Anticancer Res,2016,36(5):2497-2503.
[10]Lapshyn H,Bronsert P,Bolm L,et al.Prognostic factors after pancreatoduodenectomy with en bloc portal venous resection for pancreatic cancer[J].Langenbecks Arch Surg,2016,401(1):63-69.doi:10.1007/s00423-015-1363-2.
[11]Welsch T,Bork U,Distler M,et al.Top-down approach to the superior mesenteric artery and the mesopancreas during pancreatoduodenectomy for pancreatic cancer[J].J Surg Oncol,2016,113(6):668-671.doi:10.1002/jso.24204.
[12]Nagai M,Sho M,Akahori T,et al.Risk factors for late-onset gastrointestinal hemorrhage after pancreatoduodenectomy for pancreatic cancer[J].World J Surg,2019,43(2):626-633.doi:10.1007/s00268-018-4791-7.
[13]Liu C,Chen R,Chen Y,et al.Should a standard lymphadenectomy during pancreatoduodenectomy exclude para-aortic lymph nodes for all cases of resectable pancreatic head cancer? A consensus statement by the Chinese Study Group for Pancreatic Cancer (CSPAC)[J].Int J Oncol,2015,47(4):1512-1516.doi:10.3892/ijo.2015.3128.
[14]Kwon W,He J,Higuchi R,et al.Multinational validation of the American Joint Committee on Cancer 8th edition pancreatic cancer staging system in a pancreas head cancer cohort[J].J Hepatobiliary Pancreat Sci,2018,25(9):418-427.doi:10.1002/jhbp.577.
[15]周辉年,俞泽元,杨含腾,等.两种胰肠吻合术在胰十二指肠切除术中应用的对比研究[J].中国普通外科杂志,2018,27(9):1095-1101.doi:10.7659/j.issn.1005-6947.2018.09.003.
Zhou HN,Yu ZY,Yang HT,et al.Efficacy comparison of two different pancreaticojejunostomy methods in pancreaticoduodenectomy[J].Chinese Journal of General Surgery,2018,2018,27(9):1095-1101.doi:10.7659/j.issn.1005-6947.2018.09.003.
[16]黄涛,杨美文,张雷达.胰十二指肠切除术后早期胰瘘的影响及预测因素分析[J].中国普通外科杂志,2018,27(3):294-302.doi:10.3978/j.issn.1005-6947.2018.03.005.
Huang T,Yang MW,Zhang LD.Analysis of influential and predictive factors for early postoperative pancreatic fistula after pancreaticoduodenectomy[J].Chinese Journal of General Surgery,2018,27(3):294-302.doi:10.3978/j.issn.1005-6947.2018.03.005.
[17]陈博滔,朱朝庚,李国光,等.胰十二指肠切除术后胰肠吻合口狭窄的诊治分析[J].中国普通外科杂志,2018,27(3):303-309.doi:10.3978/j.issn.1005-6947.2018.03.006.
Chen BT,Zhu CG,Li GG,et al.Diagnosis and treatment of pancreatico-entericanastomotic stenosis after pancreaticoduodenectomy[J].Chinese Journal of General Surgery,2018,27(3):303-309.doi:10.3978/j.issn.1005-6947.2018.03.006.
[18]Siegel RL,Miller KD,Jemal A.Cancer statistics,2016[J].CA Cancer J Clin,2016,66(1):7-30.doi:10.3322/caac.21332.
[19]Fogel EL,Shahda S,Sandrasegaran K,et al.A multidisciplinary approach to pancreas cancer in 2016:a review[J].Am J Gastroenterol,2017,112(4):537-554.doi:10.1038/ajg.2016.610.
[20]Holt JM,Alsante MR.Advocacy and pancreas cancer:a new world[J].Chin Clin Oncol,2017,6(6):67.doi:10.21037/cco.2017.08.01.
[21]Davies J.Procalcitonin[J].J Clin Pathol,2015,68(9):675-679.doi:10.1136/jclinpath-2014-202807.
[22]Sager R,Kutz A,Mueller B,et al.Procalcitonin-guided diagnosis and antibiotic stewardship revisited[J].BMC Med,2017,15(1):15.doi:10.1186/s12916-017-0795-7.
[23]Wu Y,Potempa LA,El Kebir D,et al.C-reactive protein and inflammation:conformational changes affect function[J].Biol Chem,2015,396(11):1181-1197.doi:10.1515/hsz-2015-0149.
[24]Moutachakkir M,Lamrani Hanchi A,Baraou A,et al.Immunoanalytical characteristics of C-reactive protein and high sensitivity C-reactive protein[J].Ann Biol Clin (Paris),2017,75(2):225-229.doi:10.1684/abc.2017.1232.
[25]Ticinesi A,Lauretani F,Nouvenne A,et al.C-reactive protein (CRP) measurement in geriatric patients hospitalized for acute infection[J].Eur J Intern Med,2017,37:7-12.doi:10.1016/j.ejim.2016.08.026.
[26]Brisson L,Bański P,Sboarina M,et al.Lactate dehydrogenase b controls lysosome activity and autophagy in cancer[J].Cancer Cell,2016,30(3):418-431.doi:10.1016/j.ccell.2016.08.005.
[27]Zhang Y,Xu T,Wang Y,et al.Prognostic role of lactate dehydrogenase expression in urologic cancers:a systematic review and meta-analysis[J].Oncol Res Treat,2016,39(10):592-604.doi:10.1159/000449138.
[28]Cameron JL,He J.Tw o thousand consecutive pancreaticoduodenectomies[J].J Am Coll Surg,2015,220(4):530-536.doi:10.1016/j.jamcollsurg.2014.12.031.
[29]Joliat GR,Petermann D,Demartines N,et al.Prediction of complications after pancreaticoduodenectomy:validation of a postoperative complication score[J].Pancreas,2015,44(8):1323-1328.doi:10.1097/MPA.0000000000000399.
[30]白思嘉,沈力,郑楷炼,等.降钙素原对胰十二指肠切除术后并发症的预测价值[J].中华胰腺病杂志,2017,17(2):104-108.doi:10.3760/cma.j.issn.1674-1935.2017.02.008.
Bai SJ,Shen L,Zheng KL,et al.A prospective study on the predictive value of procalcitonin for postoperative complications after pancreaticoduodenectomy[J].Chinese Journal of Pancreatology,2017,17(2):104-108.doi:10.3760/cma.j.issn.1674-1935.2017.02.008.
[31]罗宝洋,杨勇,段云飞,等.术前C反应蛋白和清蛋白比值对可切除胰腺癌患者预后的影响[J].中华外科杂志,2018,56(9):712-717.doi:10.3760/cma.j.issn.0529-5815.2018.09.013.
Luo BY,Yang Y,Duan YF,et al.Preoperative C-reactive protein/albumin ratio predicts the prognosis of patients with resectable pancreatic cancer[J].Chinese Journal of Surgery,2018,56(9):712-717.doi:10.3760/cma.j.issn.0529-5815.2018.09.013.
[32]吴海霞,戴月娣,张德祥,等.乳酸脱氢酶及肿瘤标记物对胰腺癌的预后影响[J].现代肿瘤医学,2012,20(7):1392-1397.doi:10.3969/j.issn.1672-4992.2012.07.27.
Wu HX,Dai YD,Zhang DX,et al.The retafion of lactic dehydrogenase and tumor makers with pancreatic cancer[J].Journal of Modern Oncology,2012,20(7):1392-1397.doi:10.3969/j.issn.1672-4992.2012.07.27.
[33]Moreno RP,Nassar AP Jr.Is APACHE II a useful tool for clinical research?[J].Rev Bras Ter Intensiva,2017,29(3):264-267.doi:10.5935/0103-507X.20170046.
