术前新辅助放化疗(neoadjuvant chemoradiotherapy,nCRT)是治疗中低位局部进展期直肠癌的金标准,提高了保肛率、降低局部复发率[1]。与术前单独放疗相比,氟尿嘧啶联合术前放疗可增加肿瘤退缩,10%~15%患者nCRT后出现病理完全缓解(pathologic complete remission,pCR)[2],而pCR的患者可以获得更好的长期生存。尽管有新的分子生物学认识和治疗技术进展,但对nCRT前预测肿瘤病理退反应的潜在生物标志物了解甚少,每个患者和肿瘤又有不同的分子特征;因此,目前在分子水平的研究非常有限。
据估计15%的散发性结直肠患者存在错配修复(mismatch repair,MMR)基因的缺陷导致MMR蛋白表达缺失或功能异常,影响DNA复制过程中的保真性和遗传的稳定性,引起重复短小序列的核苷酸增加或缺失,这种现象被称为微卫星不稳定(microsatellite instability,MSI)[3]。MMR蛋白主要包括MLH1蛋白、MSH2蛋白、MSH6蛋白、PMS2蛋白,其中一种以上蛋白表达缺失称为MMR缺失(deficient MMR,dMMR),否则称为MMR完整(proficient MMR,pMMR)。根据美国国立综合癌症网络(NCCN)指南建议,推荐MSI或MMR蛋白检测用于所有结直肠癌患者[4]。目前,大多数中心通过免疫组化染色来检测MMR的表达情况,免疫组化染色和PCR检测方法在检测上几乎是同样有效[5]。现已证实dMMR/MSI对II期结肠癌术后氟尿嘧啶辅助化疗耐药[6],但是MMR蛋白对局部进展期直肠癌nCRT疗效不明,而评估MMR蛋白表达和nCRT敏感性、nCRT病理反应之间关系的研究较少。本研究通过观察肠镜初诊MMR蛋白的表达情况,评估MMR与nCRT的疗效关系,分析肿瘤退缩反应相关的临床病理因素和预测pCR的有效指标,更准确地评估对nCRT的疗效,从而筛选出对nCRT敏感的直肠癌患者,最终为个体化治疗提供依据。
1 资料与方法
1.1 病例资料
选取2014年1月—2019年12月在铜陵市人民医院胃肠外科住院治疗的直肠癌患者。入选标准:⑴ 原发性中低位直肠癌患者,且均经肠镜病理明确诊断;⑵ 肠镜活检组织标本符合免疫组化检测要求;⑶ 参照美国癌症联合委员会(AJCC)的TNM第8版分期标准[7],均为T3期以上或/N+患者,需行nCRT;⑷ 随访资料完整可靠。排除标准:⑴ 肠镜活检前接受过全身化疗或盆腔放疗;⑵ nCRT后未实施直肠癌根治术患者。共入选162例直肠癌患者,其中男109例,女53例;年龄45~71岁,中位年龄59岁;病灶下缘距肛门5 cm以内62例,超过5 cm以上100例;高/中分化腺癌共 130例,低分化腺癌/未分化共32例;黏液腺癌28例,非黏液腺癌134例;T2期29例,T3期78例,T4期55例;N0期50例,N1期78例,N2期34例;CEA<5 ng/mL 103例,≥5 ng/mL 59例,卡培他滨单药方案化疗32例,Capeox方案化疗130例。本研究获得铜陵市人民医院伦理委员会批准,且入组患者均签署知情同意书。
1.2 nCRT方案
采用长程分割放疗,放疗25~28次,每次剂量1.5~1.8 Gy,总剂量45~50.4 Gy;化疗方案采用以卡培他滨口服为基础的方案(同步化疗方案以口服卡培他滨825 mg/m2,每日2次/周5次;或Capeox方案);nCRT结束后间隔5~12周接受根治性手术。
1.3 免疫组化染色
初诊活检组织的免疫组化染色采用S-P染色按试剂盒说明书操作,主要操作步骤如下:所有组织均经10%甲醛固定、石蜡包埋后连续切片,贴于涂胶玻片上,经烤片、脱蜡、抗原修复、漂洗后,一抗4℃过夜,滴加二抗,37℃孵育30 min,PBS 冲洗3次,每次5 min,DAB显色,苏木精复染[8]。以细胞核出现棕黄色颗粒为MLH1、MSH2、MSH6、PMS2阳性细胞,MMR蛋白阴性为表达缺失或<10%核染色,阳性为≥10%核染色[9]。免疫组化结果评分由2名医师独立完成。
1.4 nCRT后疗效评估
采用改良后的实体瘤疗效评价标准(RECIST 1.1)进行疗效评估,分完全缓解(complete response,CR):所有目标病灶消失,维持至少4周;部分缓解(partial response,PR):基线病灶长径总和缩小30%以上,维持至少4 周;疾病进展(progressive disease,PD):基线病灶长径总和增加20%以上或出现新病灶;疾病稳定(stable disease,SD):靶病灶最大径之和缩小未达PR,或增大未达PD[10],有效率=(PR+CR)/(PR+CR+SD+PD)×100%。
1.5 nCRT后病理学评估
按照AJCC第8版推荐的肿瘤退缩分级(tumor regressive grading,TRG)评估方法:0完全退缩,无镜下可见的肿瘤细胞;1 接近完全退缩,镜下仅见单个或小灶肿瘤细胞;2部分退缩,有明显退缩,但残余肿瘤细胞多于单个或小灶肿瘤细胞;3 无退缩,残余肿瘤范围广泛,无明显退缩[7]。根据TRG评分将患者分为3组:无反应组(TRG 3分);中间反应组(TRG 1~2分);完全反应组(TRG 0分)。
1.6 统计学处理
应用SPSS 22 软件进行数据的统计学分析。计数资料的统计方法采用χ2检验;Logistic回归模型进行多因素分析。检验水准α=0.05。
2 结 果
2.1 MMR蛋白的表达情况
162例直肠癌患者中22例(13.4%)存在dMMR,其中MLH1蛋白缺失17例(10.5%)、MSH2蛋白缺失10例(6.2%),MSH6蛋白缺失 8例(4.9%),PMS2蛋白缺失11例(6.8%)(图1)。

图1 直肠癌患者肿瘤组织MMR蛋白免疫组化染色(×200)
Figure1 Immunohistochemical staining for MMR proteins in tumor tissue of the rectal cancer patients (×200)
2.2 患者MMR蛋白表达状态与患者临床资料及nCRT后疗效的关系
患者性别、年龄、肿瘤位置、分化程度、术前临床分期、CEA水平与dMMR均无明显关系(均P>0.05),而组织学类型、术前临床分期、TRG评分与dMMR有关(均P<0.05)。nCRT后RECIST 1.1评估dMMR组有效率高于pMMR组(59.1% vs.36.4%,P<0.05),表明nCRT后有效率与dMMR密切有关(表1)。
表1 dMMR 与pMMR 患者的临床资料及nCRT疗效的比较[n(%)]
Table1 Comparison of the clinicopathologic characteristics and nCRT efficacy between dMMR and pMMR patients [n (%)]
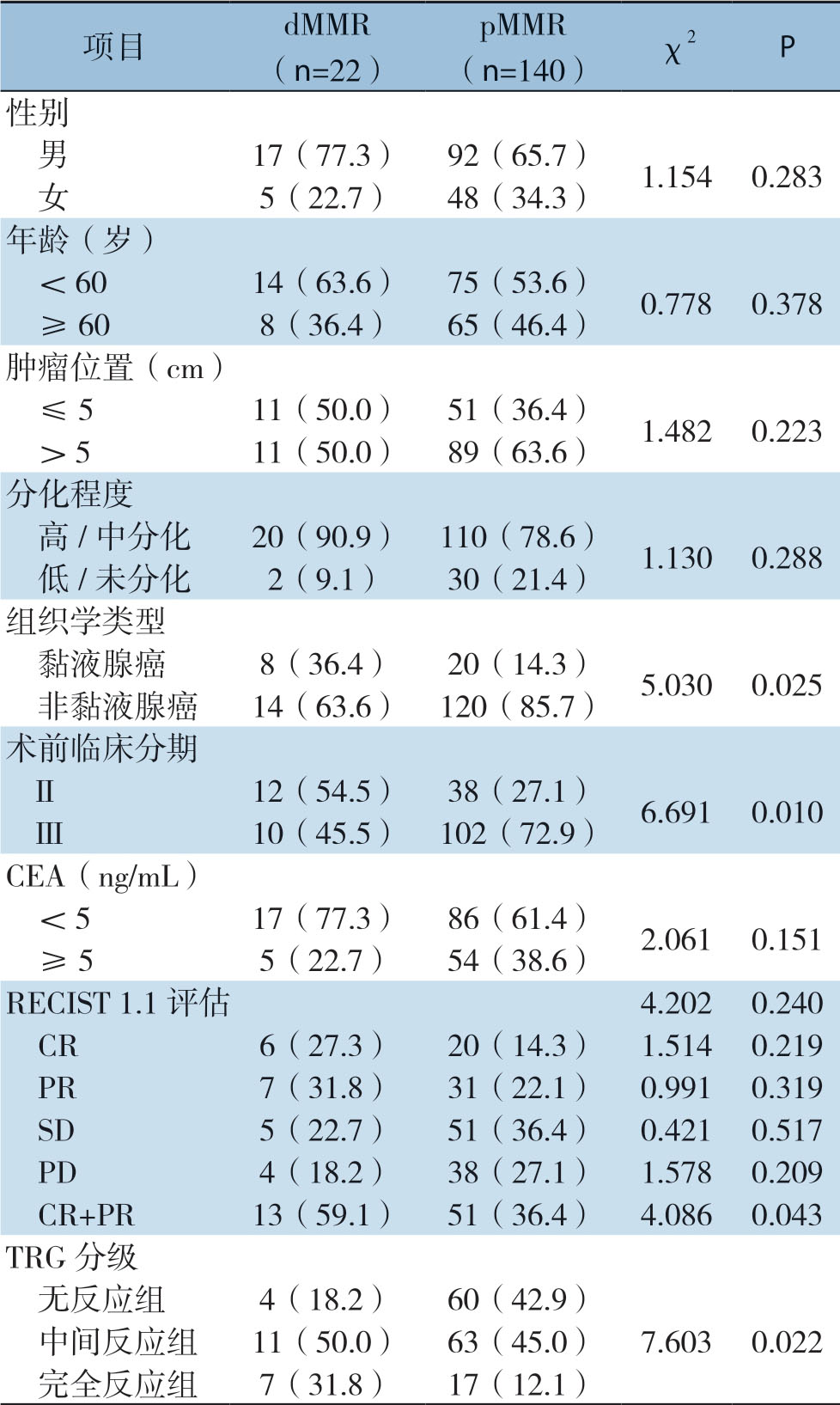
项目 dMMR(n=22)pMMR(n=140)χ2 P性别 男 17(77.3)92(65.7)1.154 0.283 女 5(22.7)48(34.3)年龄(岁)<60 14(63.6)75(53.6)0.778 0.378 ≥60 8(36.4)65(46.4)肿瘤位置(cm)≤5 11(50.0)51(36.4)1.482 0.223>5 11(50.0)89(63.6)分化程度 高/中分化 20(90.9)110(78.6)1.130 0.288 低/未分化 2(9.1)30(21.4)组织学类型 黏液腺癌 8(36.4)20(14.3)5.030 0.025 非黏液腺癌 14(63.6)120(85.7)术前临床分期 II 12(54.5)38(27.1)6.691 0.010 III 10(45.5)102(72.9)CEA(ng/mL)<5 17(77.3)86(61.4)2.061 0.151 ≥5 5(22.7)54(38.6)RECIST 1.1 评估 4.202 0.240 CR 6(27.3)20(14.3)1.514 0.219 PR 7(31.8)31(22.1)0.991 0.319 SD 5(22.7)51(36.4)0.421 0.517 PD 4(18.2)38(27.1)1.578 0.209 CR+PR 13(59.1)51(36.4)4.086 0.043 TRG分级 无反应组 4(18.2)60(42.9)中间反应组 11(50.0)63(45.0)7.603 0.022 完全反应组 7(31.8)17(12.1)
2.3 TRG 与患者临床病理特征的关系
根据TRG评分结果,无反应组64例、中间反应组74例、完全反应组24例。患者性别、年龄、肿瘤位置、分化程度、组织学类型、CEA水平、同步化疗方案、MLH1蛋白表达、MSH2蛋白表达、MSH6蛋白表达、PMS2蛋白表达与TRG无明显关系(均P>0.05);临床T分期、临床N分期、术前临床分期、MMR蛋白的表达状态(dMMR和pMMR)与TRG有关(均P<0.05)(表2)。
2.4 影响直肠癌患者pCR的多因素分析
对表2中与nCRT后TRG反应相关的临床T分期、临床N分期、术前临床分期及MMR蛋白表达状态,带入到Logistic回归模型进行多因素分析。结果发现dMMR是直肠癌患者pCR的独立影响因素(OR=0.327,95% CI=0.109~0.984,P=0.047)(表3)。
表2 TRG 不同分组患者临床病理特征的比较[n(%)]
Table2 Comparison of the clinicopathologic characteristics among groups of patients with different TRG scores [n (%)]
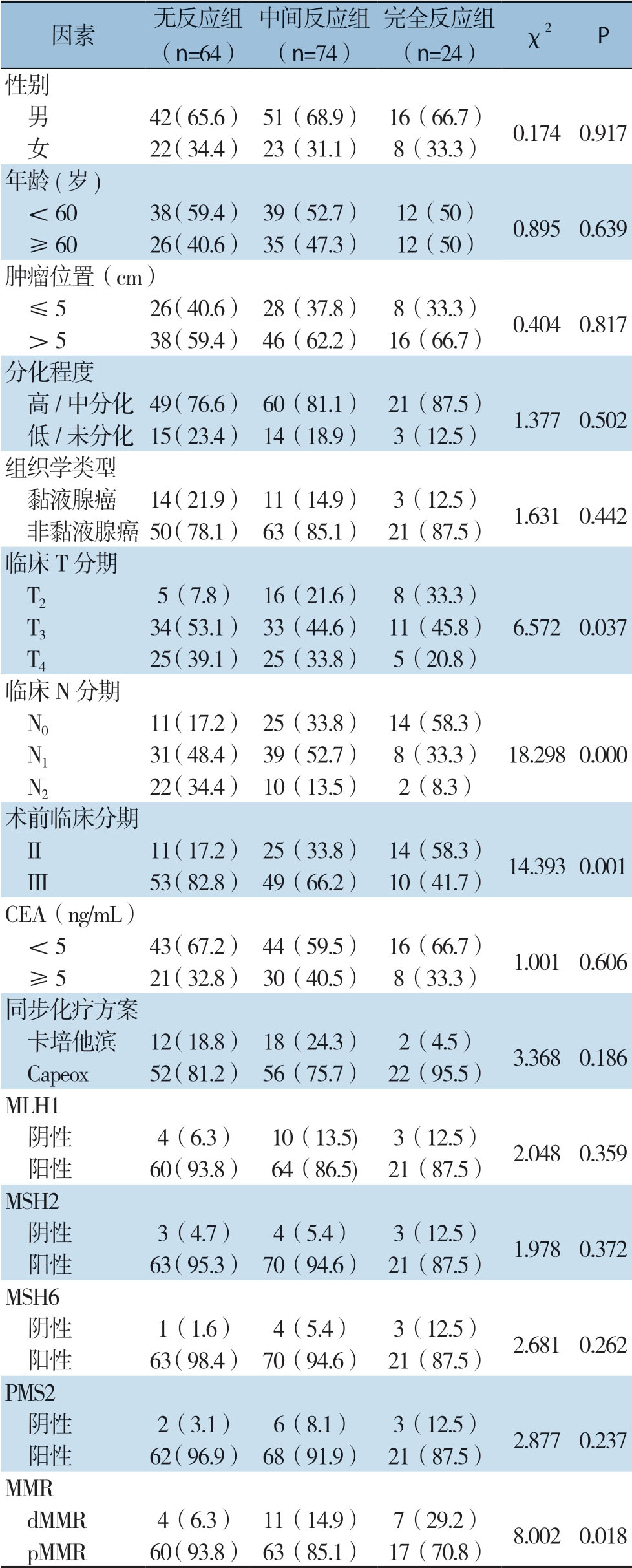
因素 无反应组(n=64)中间反应组(n=74)完全反应组(n=24)χ2 P性别 男 42(65.6)51(68.9)16(66.7)0.174 0.917 女 22(34.4)23(31.1)8(33.3)年龄(岁)<60 38(59.4)39(52.7)12(50)0.895 0.639 ≥60 26(40.6)35(47.3)12(50)肿瘤位置(cm)≤5 26(40.6)28(37.8)8(33.3)0.404 0.817>5 38(59.4)46(62.2)16(66.7)分化程度 高/中分化 49(76.6)60(81.1)21(87.5)1.377 0.502 低/未分化 15(23.4)14(18.9)3(12.5)组织学类型 黏液腺癌 14(21.9)11(14.9)3(12.5)1.631 0.442 非黏液腺癌50(78.1)63(85.1)21(87.5)临床T分期 T2 5(7.8)16(21.6)8(33.3)6.572 0.037 T3 34(53.1)33(44.6)11(45.8)T4 25(39.1)25(33.8)5(20.8)临床N分期 N0 11(17.2)25(33.8)14(58.3)N1 31(48.4)39(52.7)8(33.3)N2 22(34.4)10(13.5)2(8.3)术前临床分期 II 11(17.2)25(33.8)14(58.3)14.393 0.001 III 53(82.8)49(66.2)10(41.7)CEA(ng/mL)<5 43(67.2)44(59.5)16(66.7)1.001 0.606 ≥5 21(32.8)30(40.5)8(33.3)同步化疗方案 卡培他滨 12(18.8)18(24.3)2(4.5)3.368 0.186 Capeox 52(81.2)56(75.7)22(95.5)MLH1 阴性 4(6.3)10(13.5) 3(12.5)2.048 0.359 阳性 60(93.8)64(86.5) 21(87.5)MSH2 阴性 3(4.7)4(5.4)3(12.5)1.978 0.372 阳性 63(95.3)70(94.6)21(87.5)MSH6 阴性 1(1.6)4(5.4)3(12.5)2.681 0.262 阳性 63(98.4)70(94.6)21(87.5)PMS2 阴性 2(3.1)6(8.1)3(12.5)2.877 0.237 阳性 62(96.9)68(91.9)21(87.5)MMR dMMR 4(6.3)11(14.9)7(29.2)8.002 0.018 pMMR 60(93.8)63(85.1)17(70.8)18.298 0.000
表3 pCR 独立影响因素的多变量Logistic 回归分析
Table3 Multivariate Logistic regression analysis of independent influential factors for pCR
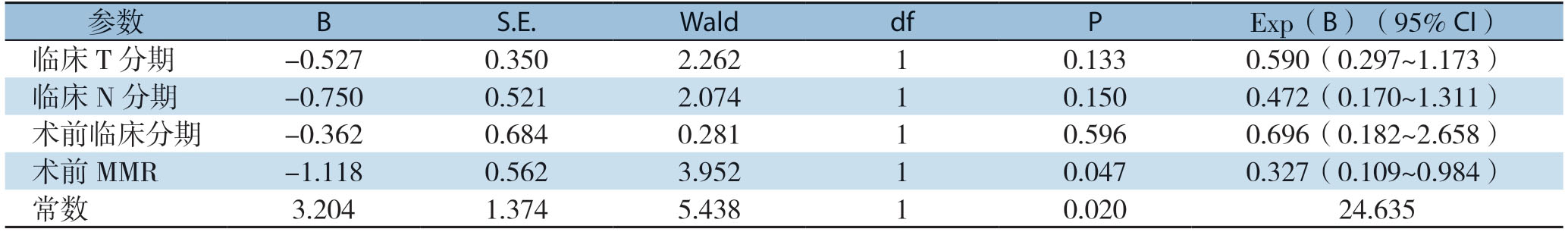
参数 B S.E.Wald df P Exp(B)(95% CI)临床T分期-0.527 0.350 2.262 1 0.133 0.590(0.297~1.173)临床N分期-0.750 0.5212.074 1 0.150 0.472(0.170~1.311)术前临床分期-0.362 0.684 0.281 1 0.596 0.696(0.182~2.658)术前MMR-1.118 0.562 3.952 1 0.047 0.327(0.109~0.984)常数 3.204 1.374 5.438 1 0.020 24.635
3 讨 论
结直肠癌是全球第三大最常见的癌症,也是导致男性和女性癌症相关死亡的第四大原因[11]。局部进展期直肠癌的标准治疗方法是nCRT,然后进行全直肠系膜切除,以提高根治性切除、肛门括约肌保留和肿瘤局部控制。考虑到部分直肠癌患者经过nCRT后可达到pCR的效果,并且手术可能会导致性功能、排尿排便功能的受损;因此,其它的替代治疗方法如“等待观察”策略或经肛门局部切除已被推荐[12]。另一方面,对nCRT不敏感的患者需要尽早更换有效的治疗方法。因此,早期预测对nCRT不敏感的生物标志物至关重要,这使受益于nCRT的直肠癌患者得到筛选,并避免无效nCRT相关的毒性,从而提供精准的个体化治疗方案。
本研究通过术前肠镜病理活检组织的免疫组化分析,发现162例直肠癌患者中共22例(13.4%)存在dMMR。目前国内关于大样本研究直肠癌中MMR表达情况较少,国外报道直肠癌中MMR缺失率约7.8%~13.4%[13-15]。Hasan等[14]分析了5 086例局部进展期直肠癌患者术后标本,其中4 450例(87%)MSI(-)、636例(13%)MSI(+)。本研究结果与目前报道的MMR蛋白总缺失比例基本一致,直肠癌组织标本中MMR蛋白缺失比例不一致,需考虑到免疫组化的技术水平、肿瘤组织异质性所致。关于直肠癌患者MMR蛋白缺失的具体类型,目前相关研究仍较少。国外有研究表明62例dMMR直肠癌患者中,最常见的MMR蛋白缺失是MSH2占33例(53%),其次是MSH6占14例(23%),最后是MLH1占10例(16%)和PMS2占5例(8%)[16]。Acar等[13]研究了341例接受nCRT后手术的直肠癌患者,IHC发现dMMR患者占76例(13.4%),其中主要是以MLH1蛋白、PMS2蛋白缺失为主;Meillan等[15]报道296例患者中,23例(7.8%)存在MMR缺失,MSH2缺失 8例,MLH1缺失6例,MSH6缺失3例,PMS2缺失1例,MLH1和MLH2都缺失2例,MSH2和MSH6都缺失2例。MLH1/PMS2结合形成异源二聚体可识别错配位点,参与错配修复[17];有研究[18]表明,MSH6蛋白在MSI结直肠癌中表达的缺失可能是由于MLH1/PMS2缺失,导致MSH6基因内编码多聚胞嘧啶发生继发性突变所致。因此,MMR蛋白之间缺失的关系仍需进一步研究。
根据MMR蛋白表达状态进行一般资料单因素分析,结果表明组织学类型中黏液腺癌更容易检测出dMMR,提示MMR蛋白与直肠癌组织学之间存在相关性,具体需进一步研究。而对于术前临床分期与dMMR相关性,考虑到直肠癌nCRT分期条件;因此,术前临床分期与MMR之间相关性可能存在选择偏倚。而dMMR组病理退缩反应更明显、RECIST 1.1评估有效率更高,均提示dMMR组对nCRT敏感性高。
TRG是评价nCRT治疗后反应的一种有效方法[19]。有研究[20-21]表明年龄对直肠癌患者nCRT后的TRG没有影响,但男性对nCRT有更好的反应,肿瘤分化程度高与nCRT反应良好相关。而本研究结果并未发现性别、年龄及肿瘤分化程度与TRG之间存在相关性,可能仍需进一步扩大样本量。CEA水平对TRG的影响仍存在争议,有研究[22]表明高CEA水平意味着较重的肿瘤负荷,可能需要较高的放疗剂量才能达到相同的肿瘤反应和预后;也有研究[18]表明CEA水平对TRG没有影响。黏液性直肠癌是指过量的细胞外黏液,组成超过50%肿瘤体积,研究[23]表明黏液组织是局部进展期直肠癌nCRT后反应差的可靠生物学标志物。一项供纳入6 555例直肠癌患者的回顾性研究表明:相比普通腺癌,黏液腺癌患者更难以达到pCR(OR=0.68,P=0.008)[24]。本研究结果亦未发现黏液性直肠癌与TRG之间存在关系,可能因病例样本量小导致结果偏倚。进展期临床T分期常与肿瘤大小有关,是局部进展期直肠癌nCRT后效果的重要预后因素;而影响肿瘤细胞的放疗生物学效果,取决于肿瘤大小,这可能部分解释了临床T分期与TRG之间的关系[13];既往研究还发现cN0是pCR的独立预测因子[25]。因此,临床分期与nCRT后的TRG相关。本研究通过评估患者nCRT后病理退缩反应进行分组,结果发现:完全病理缓解组中T2分期与 N0分期比例较多,而病理无反应组中T3、T4分期与N2分期患者较多;完全病理缓解组中II期患者比例较多,而病理无反应组中III期患者较多,上述差异均存在统计学意义(P<0.05)。进一步多因素分析发现临床T分期、临床N分期及临床分期与pCR之间无独立相关性。而Hosseini等[26]回顾性研究403例局部进展期直肠癌患者,通过单因素分析也发现更高的肿瘤分期可预测nCRT后较低的pCR发生率(P=0.049)。考虑病例资料的差异、肿瘤的异质性及相关混杂因素影响,目前关于临床分期与pCR之间关系仍需进一步分层研究。
本研究显示完全反应组中dMMR所占比例高,进一步通过Logistic回归模型进行多因素分析,证实dMMR是直肠癌患者pCR的独立影响因素;同时术前应用RECIST 1.1疗效评估表明dMMR组nCRT有效率亦高于pMMR组的(59.1% vs.36.4%,P<0.05)。以上结果提示dMMR 可以预测nCRT后肿瘤组织病理退缩反应良好。Meillan等[15]报道 296例接受nCRT的局部进展期直肠癌患者,dMMR患者有较高的病理降期率(P<0.0001)和肿瘤病理退缩程度(P=0.024),表明dMMR患者可能对放疗更敏感。de Rosa等[16]报道以氟尿嘧啶为基础nCRT的29例dMMR直肠癌患者,术后完全病理缓解率为27.6%(8/29),剩下的除1例患者外都出现nCRT后降期;因此,dMMR患者对nCRT的敏感性增高,肠镜检查中活检组织中MMR蛋白表达状态的评估,可以预测患者对nCRT的敏感性。
目前关于MMR蛋白表达状态对直肠癌nCRT的疗效预测存在争议,最近国外一项对3 7例接受nCRT的患者进行回顾性评价,IHC结果表明33例(89.2%)患者中MLH1和MSH2阳性,其中7例TRG评分为0分;4例(10.8%)患者为dMMR(MLH1和或MSH2缺失),均可见到肿瘤组织肉眼残留;统计学结果表明MLH1、MSH2蛋白表达状态对肿瘤退缩反应无差异(P=0.570)[27]。Demes等[28]也发现直肠癌中MMR缺失与以氟嘧啶为基础的nCRT疗效之间无相关性。以上研究均为直肠癌中MMR表达状态与nCRT疗效之间无关,但上述研究均为单中心小样本,其中Demes等[28]仅研究了2例MMR缺失直肠癌患者,研究结果均缺乏强有力依据。Hasan等[14]分析了5086例局部进展期直肠癌患者,MSI(-)患者pCR率为8.9%,MSI(+)患者pCR率为5.9%,差异有统计学意义(P=0.01);多因素分析提示MSI(+)患者是pCR一个独立的预测因子,可减少病理完全缓解(OR=0.65,P=0.03)。本研究结果与上述研究相反,进一步分析原因发现该研究中微卫星低度不稳定(MSI-L)组pCR率为4.3%(OR=0.46,P=0.02),微卫星高度不稳定(MSI-H)组pCR率为8.1%(OR=0.90,P=0.74),表明仅MSI-L可以降低pCR率;而本研究仅通过免疫组化分析MMR蛋白表达状态,并未进行基因检测来定义MSI-L,可能存在dMMR患者中MSI-L患者比例低;且dMMR组定义包括MMR蛋白表达<10%核染色患者,可能存在将部分微卫星稳定患者纳入dMMR组中。此外,上述研究对象大部分是白人和非裔美国人,种族差异及病例资料的异质性可能对研究结果有一定影响。
直肠癌对nCRT的病理退缩反应,是术前放疗和化疗的综合结果,而不仅仅是化疗的结果所致[20],放疗对nCRT的病理退缩反应至关重要。越来越多的证据表明,MMR蛋白可能影响和(或)直接参与辐射诱导的DNA损伤反应后的DNA双链断裂修复,相关研究[29]表明放疗损伤后,MLH1和MSH2可能直接或间接参与DNA损伤反应的多个步骤:识别DNA双链断裂到随后通过转导分子介导信号传导,诱导和维持细胞周期的阻滞;实时修复DNA双链断裂和暂时性抑制细胞凋亡;在恢复细胞周期之前保证修复后的DNA完整;如DNA双链断裂修复失败则让细胞转向死亡程序。MSH2主要是和MSH6形成复合物,负责修复DNA碱基错配[18]。因此,dMMR可促进直肠癌放疗敏感性,因为dMMR表型缺乏必要的机制来修复放疗诱导的DNA双链断裂。具有MSI表型的细胞系对放疗敏感性已得到证实,缺乏MSH2的原代人细胞对DNA链间交联剂没有反应,但对辐射却表现出细胞活力下降[30]。目前,关于MMR蛋白对nCRT的敏感性影响的机制仍需开展临床和基础研究。
综上所述,直肠癌肠镜检查活检组织中dMMR表型,提示该部分患者对nCRT敏感,肿瘤组织病理退缩反应良好,可以作为直肠癌nCRT有效的预测指标。考虑到本组资料中dMMR患者较少,且为回顾性研究,未来仍需开展大样本、前瞻性对照研究去证实。
[1]Deng Y,Chi P,Lan P,et al.Modifed FOLFOX6 with or without radiation versus fuorouracil and leucovorin with radiation in neoadjuvant treatment of locally advanced rectal cancer:initial results of the Chinese FOWARC multicenter,open label,randomized three-arm phase III trial[J].J Clin Oncol,2016,34(27):3300-3307.doi:10.1200/JCO.2016.66.6198.
[2]Bottarelli L,De' Angelis GL,Azzoni C,et al.Potential predictive biomarkers in locally advanced rectal cancer treated with preoperative chemo-radiotherapy[J].Acta Biomed,2018,89(9-S):102-106.doi:10.23750/abm.v89i9-S.7881.
[3]Zeinalian M,Hashemzadeh-Chaleshtori M,Salehi R,et al.Clinical Aspects of Microsatellite Instability Testing in Colorectal Cancer[J].Adv Biomed Res,2018,7:28.doi:10.4103/abr.abr_185_16.eCollection 2018.
[4]National Comprehensive Cancer network.NCCN Clinical Practice Guidelines in Oncology:Rectal Cancer.org;2018.Available at:https://www.nccn.org/professionals/physician_gls/pdf/rectal.pdf.Accessed May 14,2018.
[5]Lindor NM,Burgart LJ,Leontovich O,et al.Immunohistochemistry versus microsatellite instability testing in phenotyping colorectal tumors[J].J Clin Oncol,2002,20(4):1043-1048.doi:10.1200/JCO.2002.20.4.1043.
[6]Sargent DJ,Marsoni S,Monges G,et al.Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracilbased adjuvant therapy in colon cancer[J].J Clin Oncol,2010,28(20):3219-3226.doi:10.1200/JCO.2009.27.1825.
[7]Amin MB,Edge S,Greene F,et al.AJCC Cancer Staging Manual[M].Springer International Publishing,2017.
[8]彭俊玲,汤涛,叶祖禄,等.散发性结直肠癌微卫星不稳定状态与错配修复蛋白表达缺失及临床病理特征的相关性[J].中国肿瘤生物治疗杂志,2015,22(4):479-483.doi:10.3872/j.issn.1007-385X.2015.04.012.
Peng JL,Tang T,Ye ZL,et al.The relationship of microsatellite instability state with loss of mismatch repair proteins and clinical pathological characteristics in sporadic colorectal cancers[J].Chinese Journal of Cancer Biotherapy,2015,22(4):479-483.doi:10.3872/j.issn.1007-385X.2015.04.012.
[9]Kim HR,Kim HC,Yun HR,et al.An alternative pathway in colorectal carcinogenesis based on the mismatch repair system and p53 expression in Korean patients with sporadic colorectal cancer[J].Ann Surg Oncol,2013,20(12):4031-4040.doi:10.1245/s10434-012-2455-7.
[10]Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline (version 1.1)[J].Eur J Cancer,2009,45(2):228-247.doi:10.1016/j.ejca.2008.10.026.
[11]Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:Sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359-386.doi:10.1002/ijc.29210.
[12]Martens MH,Maas M,Heijnen LA,et al.Long-term Outcome of an Organ Preservation Program After Neoadjuvant Treatment for Rectal Cancer[J].J Natl Cancer Inst,2016,108(12):djw171.doi:10.1093/jnci/djw171.
[13]Acar T,Acar N,Kamer E,et al.Do microsatellite instability (MSI) and defcient mismatch repair (dMMR) affect the pathologic complete response (pCR) in patients with rectal cancer who received neoadjuvant treatment?[J].Updates Surg,2019,72(1):73-82.doi:10.1007/s13304-019-00697-2.
[14]Hasan S,Renz P,Wegner RE,et al.Microsatellite Instability (MSI) as an Independent Predictor of Pathologic Complete Response (PCR) in Locally Advanced Rectal Cancer A National Cancer Database (NCDB) Analysis[J].Ann Surg,2020,271(4):716-723.doi:10.1097/SLA.0000000000003051.
[15]Meillan N,Vernerey D,Lefèvre JH,et al.Mismatch Repair System Deficiency Is Associated With Response to Neoadjuvant Chemoradiation in Locally Advanced Rectal Cancer[J].Int J Radiat Oncol Biol Phys,2019,105(4):824-833.doi:10.1016/j.ijrobp.2019.07.057.
[16]de Rosa N,Rodriguez-Bigas MA,Chang GJ,et al.DNA Mismatch Repair Deficiency in Rectal Cancer:Benchmarking Its Impact on Prognosis,Neoadjuvant Response Prediction,and Clinical Cancer Genetics[J].J Clin Oncol,2016,34(25):3039-3046.doi:10.1200/JCO.2016.66.6826.
[17]唐伟森,廖明媚,屈展,等.结直肠癌肿瘤组织 PMS2蛋白表达状态与其临床病理特征的关系[J].中国普通外科杂 志,2019,28(10):1297-1301.doi:10.7659/j.issn.1005-6947.2019.10.019.
Tang WS,Liao MM,Qu Z,et al.Expression status of PMS2 protein in colorectal cancer tumor tissue and the relationship with its clinicopathological characteristics[J].Chinese Journal of General Surgery,2019,28(10):1297-1301.doi:10.7659/j.issn.1005-6947.2019.10.019.
[18]Kuan SF,Ren B,Brand R,et al.Neoadjuvant therapy in microsatellite-stable colorectal carcinoma induces concomitant loss of MSH6 and Ki-67 expression[J].Hum Pathol,2017,63:33-39.doi:10.1016/j.humpath.2017.02.003.
[19]Lim SH,Chua W,Henderson C.Predictive and prognostic biomarkers for neoadjuvant chemoradiotherapy in locally advanced rectal cancer[J].Crit Rev Oncol Hematol,2015,96(1):67-80.doi:10.1016/j.critrevonc.2015.05.003.
[20]Bohlok A,Hendlisz A,Bouazza F,et al.The potential benefit of adjuvant chemotherapy in locally advanced rectal cancer treated with neoadjuvant chemoradiotherapy is not predicted by tumor regression grade[J].Int J Colorectal Dis,2018,33(10):1383-1391.doi:10.1007/s00384-018-3115-6.
[21]Huang Q,Qin H,Xiao J,et al.Association of tumor differentiation and prognosis in patients with rectal cancer undergoing neoadjuvant chemoradiation therapy[J].Gastroenterol Rep (Oxf),2019,7(4):283-290.doi:10.1093/gastro/goy045.
[22]Gash KJ,Baser O,Kiran RP.Factors associated with degree of tumour response to neo-adjuvant radiotherapy in rectal cancer and subsequent corresponding outcomes[J].Eur J Surg Oncol,2017,43(11):2052-2059.doi:10.1016/j.ejso.2017.07.024.
[23]Reggiani Bonetti L,Lionti S,Domati F,et al.Do pathological variables have prognostic significance in rectal adenocarcinoma treated with neoadjuvant chemoradiotherapy and surgery?[J].World J Gastroenterol,2017,23(8):1412-1423.doi:10.3748/wjg.v23.i8.1412.
[24]Tan Y,Fu D,Li D,et al.Predictors and Risk Factors of Pathologic Complete Response Following Neoadjuvant Chemoradiotherapy for Rectal Cancer:A Population-Based Analysis[J].Front Oncol,2019,9:497.doi:10.3389/fonc.2019.00497.
[25]Choi CH,Kim WD,Lee SJ,et al.Clinical predictive factors of pathologic tumor response after preoperative chemora diotherapy in rectal cancer[J].Radiat Oncol J,2012,30(3):99-107.doi:10.3857/roj.2012.30.3.99.
[26]Hosseini S,Nguyen N,Mohammadianpanah M,et al.Predictive Significance of Mucinous Histology on Pathologic Complete Response Rate Following Capecitabine-Based Neoadjuvant Chemoradiation in Rectal Cancer:a Comparative Study[J].J Gastrointest Cancer,2019,50(4):716-722.doi:10.1007/s12029-018-0136-x.
[27]Yılmaz Rakıcı S,Bedir R,Hatipoğlu C.Are there predictors that can determine neoadjuvant treatment responses in rectal cancer?[J].Turk J Gastroenterol,2019,30(3):220-227.doi:10.5152/tjg.2018.18179.
[28]Demes M,Scheil-Bertram S,Bartsch H,et al.Signature of microsatellite instability,KRAS and BRAF gene mutations in German patients with locally advanced rectal adenocarcinoma before and after neoadjuvant 5-FU radiochemotherapy[J].J Gastrointest Oncol,2013,4(2):182-192.doi:10.3978/j.issn.2078-6891.2013.012.
[29]Shin JS,Tut TG,Yang T,et al.Radiotherapy Response in Microsatellite Instability Related Rectal Cancer[J].Korean J Pathol,2013,47(1):1-8.doi:10.4132/KoreanJPathol.2013.47.1.1.
[30]Barwell J,Pangon L,Hodgson S,et al.Biallelic mutation of MSH2 in primary human cells is associated with sensitivity to irradiation and altered RAD51 foci kinetics[J].J Med Genet,2007,44(8):516-520.doi:10.1136/jmg.2006.048660.
