胃癌作为最常见的消化系统恶性肿瘤之一,严重威胁着人类健康安全。据GLOBOCAN 2018[1]数据表明,其发病率和病死率分别高居世界恶性肿瘤的第5位和第2位,这表明胃癌的治疗仍具有巨大的挑战性。晚期胃癌患者通常表现出较差的预后,肝脏是最常见的远处转移器官,约5%~14%的将会出现肝转移,即使在接受胃癌根治术后也有大约13.5%~30%的患者最终发生肝转移,这也使得肝转移成为胃癌患者最主要的死亡原因[2-4]。目前,尽管肿瘤的综合治疗技术获得了一定的进步,但是胃癌伴肝转移(gastric cancer with liver metastasis,GCLM)患者的预后仍然不甚理想[5]。因此,采取针对GCLM患者有效的个体化治疗和预后综合评估对临床策略的实施具有非常重要的意义。
目前,临床上常见的预后评价主要根据美国联合委员会癌症(American Joint Committee on Cancer,AJCC)分期指南[6],其内容主要包含肿瘤浸润深度、淋巴结转移数目、血行转移情况等病理指标,但未能充分考虑如年龄、性别、肿瘤分化程度、原发肿瘤数目以及其他治疗措施等多种被认为可能对个体化生存预测有重要意义的因素,因而其对于患者个体化预后的指导价值受到一定的局限。列线图预测模型[7]基于大量临床数据,利用多个独立预后评价因子结合后来量化个体的生存风险,而被认为对患者的生存预后评价具有重要价值。目前,国内外学者[8-9]对GCLM患者的临床预后因素进行了一定的探索,但是由于以往的研究存在病例量较小、研究内容不全面的缺陷,使得对患者的预后影响分析受到局限,同时也未能建立起一种综合多种独立预后因素以高效、简洁的评估GCLM患者生存预后的评价预测模型。
因此,本研究基于SEER(Surveillance,Epidemiology,and End Results)数据库临床病例样本量大、资料丰富的特点,系统分析GCLM患者的临床特征并探讨其预后相关因素,构建GCLM患者的列线图预后评价模型,以期为患者的个体化预后评估提供更多重要参考。
1 资料与方法
1.1 资料收集
SEER数据库[10]全称为美国国立癌症研究所监测、流行病学和结果数据库,该数据库详细记录了1973年以来美国部分州县大量患者的发病、病理、治疗及预后等信息,其具有数量大、临床资料相对全面的特点。本研究采用SEER*Stat 8.3.6软件,提取2010—2015年经影像学或病理诊断为GCLM患者的病例资料。
1.2 纳入和排除标准
纳入标准:⑴ 患者初诊时原发肿瘤位于胃部;⑵ 影像学或病理检查证实伴肝脏转移;⑶ 病理组织学类型为腺癌;⑷ 仅基于ICD-O-3的恶性行为;⑸ 有完整的临床、病理及随访资料。排除标准:⑴ 多源性的原发性肿瘤;⑵ 转移性胃癌;⑶ 不伴肝脏转移的胃癌;⑷ 伴肝外其他部位转移的胃癌;⑸ 经过尸检或死亡证明确诊的病例;⑹ 大量数据指标缺失的病例。
纳入分析的SEER数据编码名称包括:Sex、Age at Diagnosis、Primary Site、Histologic Type ICD-O-3、Grade、Stage-7th Edition、Derived AJCC 7th、RX Summ-Surg Prim Site、RX Summ-Surg Oth Reg/Dis、Radiation Recode、Chemotherapy Recode、Regional Nodes Examined、SEER Combined Mets at DX-liver、CS Tumor Size、SEER Cause-Specific Death Classification、SEER Other Cause of Death Classification、Survival Months、Vital Status Recode、First Malignant Primary Indicator、Total Number of in Situ/Malignant Tumors for Patient、Race Recode、Marital Status at Diagnosis、Insurance Recode、CS Site-Specific Factor 1。
1.3 纳入分析的指标
纳入研究的变量包括:性别、年龄、种族、肿瘤部位、肿瘤T分期、肿瘤N分期、分化程度、是否放疗、是否化疗、是否原发灶手术、是否转移灶手术、检出淋巴结数目、原发肿瘤数目、婚姻状态、保险状态、生存状态、死亡原因和生存时间等18个指标。肿瘤分期采用第7版美国癌症联合委员会(American Joint Committee of Cancer,AJCC)TNM分期标准。
1.4 统计学处理
采用R 3.6.3和SPSS 26软件进行数据分析。采用χ2检验比较各组间变量构成比差异。利用Cox等比例回归模型进行单因素、多因素分析各变量对GCLM患者总体生存期(overall survival,OS)的影响,并基于Kaplan-Meier和Log-rank检验方法采用R软件绘制各变量的生存曲线;利用Fine-Gray竞争风险模型分析各变量对GCLM患者癌症特异性生存期(cancer-specific survival,CSS)的影响,其中癌症相关死亡概率和竞争风险死亡概率用累积发生率(cumulative incidence function,CIF)表示。R软件建立GCLM患者OS和CSS的列线图预测模型,最后利用一致性指数(C-index)、ROC曲线和校正曲线验证模型的可靠性。以α=0.05作为检验水准。
2 结 果
2.1 建模集和验证集中患者临床基线特征比较
根据研究指标的纳入情况,逐步筛选符合要求的病例(图1),最终纳入伴肝转移的胃癌患者 2 554例,其中男性1 739例,女性815例,按7:3比例随机分成建模集(1790例)和验证集(764例),患者基本特征见表1。结果显示:建模集和验证集在性别、年龄、种族、肿瘤T分期、肿瘤N分期、肿瘤分级、肿瘤部位、检出淋巴结数目、原发肿瘤数目、原发灶手术、转移灶手术、放疗、化疗、婚姻状态和保险状态等方面均无统计学差异(均P>0.05)(表1)。
图1 病例筛选流程图
Figure1 The case selection process
表1 建模集和验证集中GCLM患者的基本特征情况
Table1 The basic characteristics of GCLM patients in modeling set and validation set
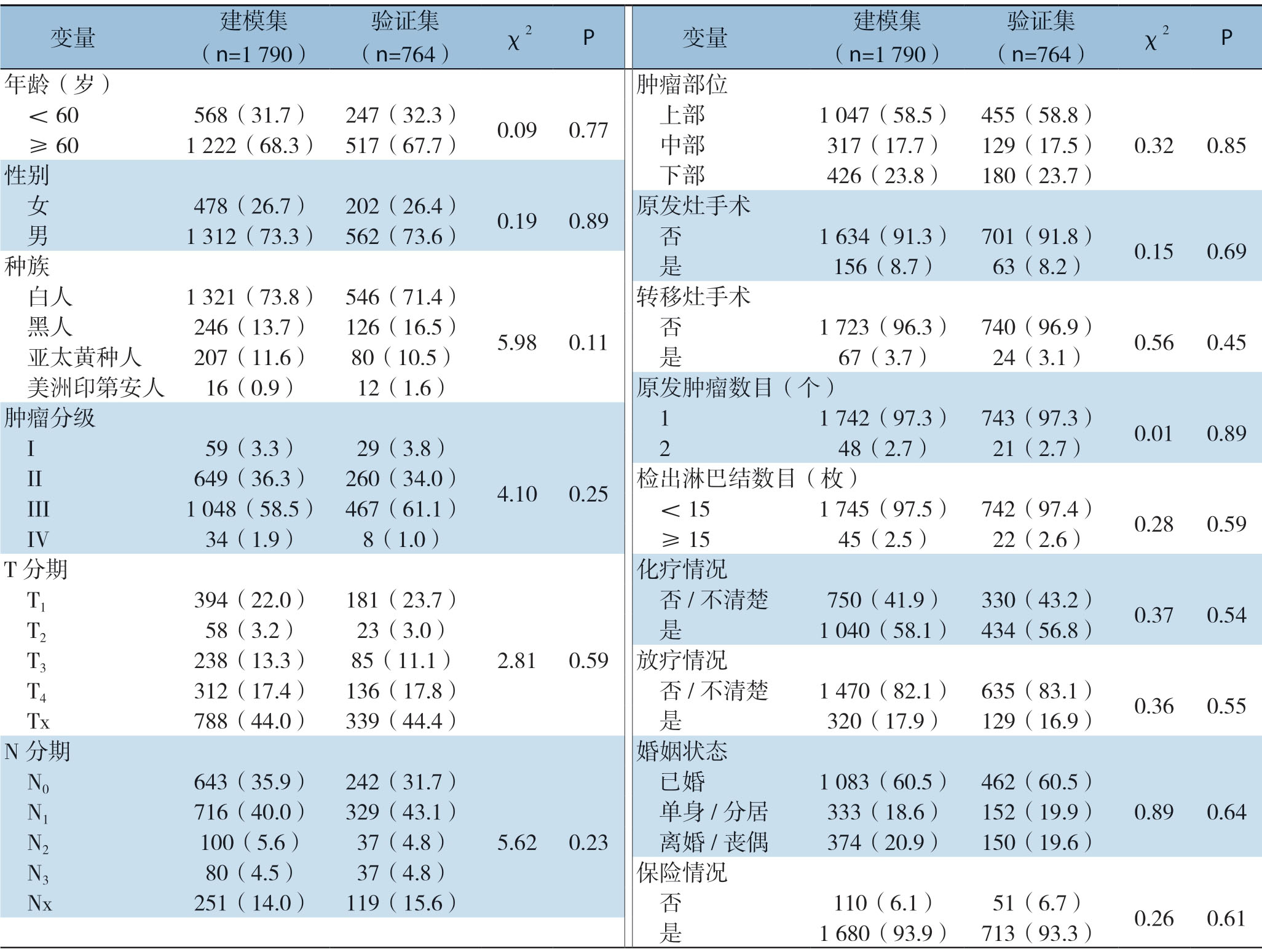
变量 建模集(n=1 790)验证集(n=764)χ2 P 变量 建模集(n=1 790)验证集(n=764)χ2 P年龄(岁)肿瘤部位<60 568(31.7)247(32.3)0.09 0.77 上部 1 047(58.5)455(58.8)≥60 1222(68.3)517(67.7)中部 317(17.7)129(17.5)0.32 0.85性别 下部 426(23.8)180(23.7)女 478(26.7)202(26.4)0.19 0.89 原发灶手术 男 1 312(73.3)562(73.6)否 1 634(91.3)701(91.8)0.15 0.69种族 是 156(8.7)63(8.2)白人 1 321(73.8)546(71.4)5.98 0.11转移灶手术 黑人 246(13.7)126(16.5)否 1 723(96.3)740(96.9)0.56 0.45 亚太黄种人 207(11.6)80(10.5)是 67(3.7)24(3.1)美洲印第安人 16(0.9)12(1.6)原发肿瘤数目(个)肿瘤分级 1 1 742(97.3)743(97.3)0.01 0.89 I 59(3.3)29(3.8)4.10 0.25 2 48(2.7)21(2.7)II 649(36.3)260(34.0)检出淋巴结数目(枚)III 1 048(58.5)467(61.1)<15 1 745(97.5)742(97.4)0.28 0.59 IV 34(1.9)8(1.0)≥15 45(2.5)22(2.6)T分期 化疗情况 T1 394(22.0)181(23.7)2.81 0.59 否/不清楚 750(41.9)330(43.2)0.37 0.54 T2 58(3.2)23(3.0)是 1 040(58.1)434(56.8)T3 238(13.3)85(11.1)放疗情况 T4 312(17.4)136(17.8)否/不清楚 1 470(82.1)635(83.1)0.36 0.55 Tx 788(44.0)339(44.4)是 320(17.9)129(16.9)N分期 婚姻状态 N0 643(35.9)242(31.7)5.62 0.23 已婚 1 083(60.5)462(60.5)N1 716(40.0)329(43.1)单身/分居 333(18.6)152(19.9)0.89 0.64 N2 100(5.6)37(4.8)离婚/丧偶 374(20.9)150(19.6)N3 80(4.5)37(4.8)保险情况 Nx 251(14.0)119(15.6)否 110(6.1)51(6.7)0.26 0.61 是 1 680(93.9)713(93.3)
2.2 各变量对患者OS的影响分析
Cox单因素生存分析显示,年龄、肿瘤分化程度、T分期、原发灶手术、转移灶手术、化疗、原发肿瘤数目、检出淋巴结数目和婚姻状态等9个指标与GCLM患者的OS预后有关(均P<0.05),经多因素Cox回归分析及AIC优化分析后显示,年龄、肿瘤分化程度、原发灶手术、原发肿瘤数目、化疗等5个指标是影响GCLM患者OS预后的独立影响因素(均P<0.05)(表2)。基于Kaplan-Meier和Log-rank检验方法,利用Cox风险模型绘制出各主要变量的生存曲线,结果显示:年龄越大、肿瘤分化程度越低的GCLM患者总的生存风险越高,而明确采取化疗或原发病灶手术切除措施的患者则具有更低的生存风险,并且患者的总生存风险亦随着原发肿瘤数目的减少而增大(图2)。
2.3 各变量对患者CSS的影响分析
本研究利用Fine-Gray竞争风险模型对CRLM患者CSS进行分析,竞争风险是指研究对象除了会出现研究者感兴趣的结局之外,还会出现其他意外结局,它的出现会导致感兴趣事件永远不会发生,两者相互竞争,从而易导致生存函数的错估。经过逐步筛选及多因素分析后最终结果显示,肿瘤分化程度、原发灶手术、原发肿瘤数目、化疗等4个因素是GCLM患者CSS的独立危险因素(表3)。绘制出各主要变量的累积发生率曲线,结果显示:GCLM患者肿瘤特异性死亡的发生,随着肿瘤分化程度的升高而降低,随着采取积极治疗措施如原发灶手术切除和化疗等方案而明显降低,而随着原发肿瘤数目减少死亡风险增大(图3)。
表2 影响GCLM患者OS的单因素和多因素分析
Table2 Univariate and multivariate analysis of factors for OS in patients with GCLM
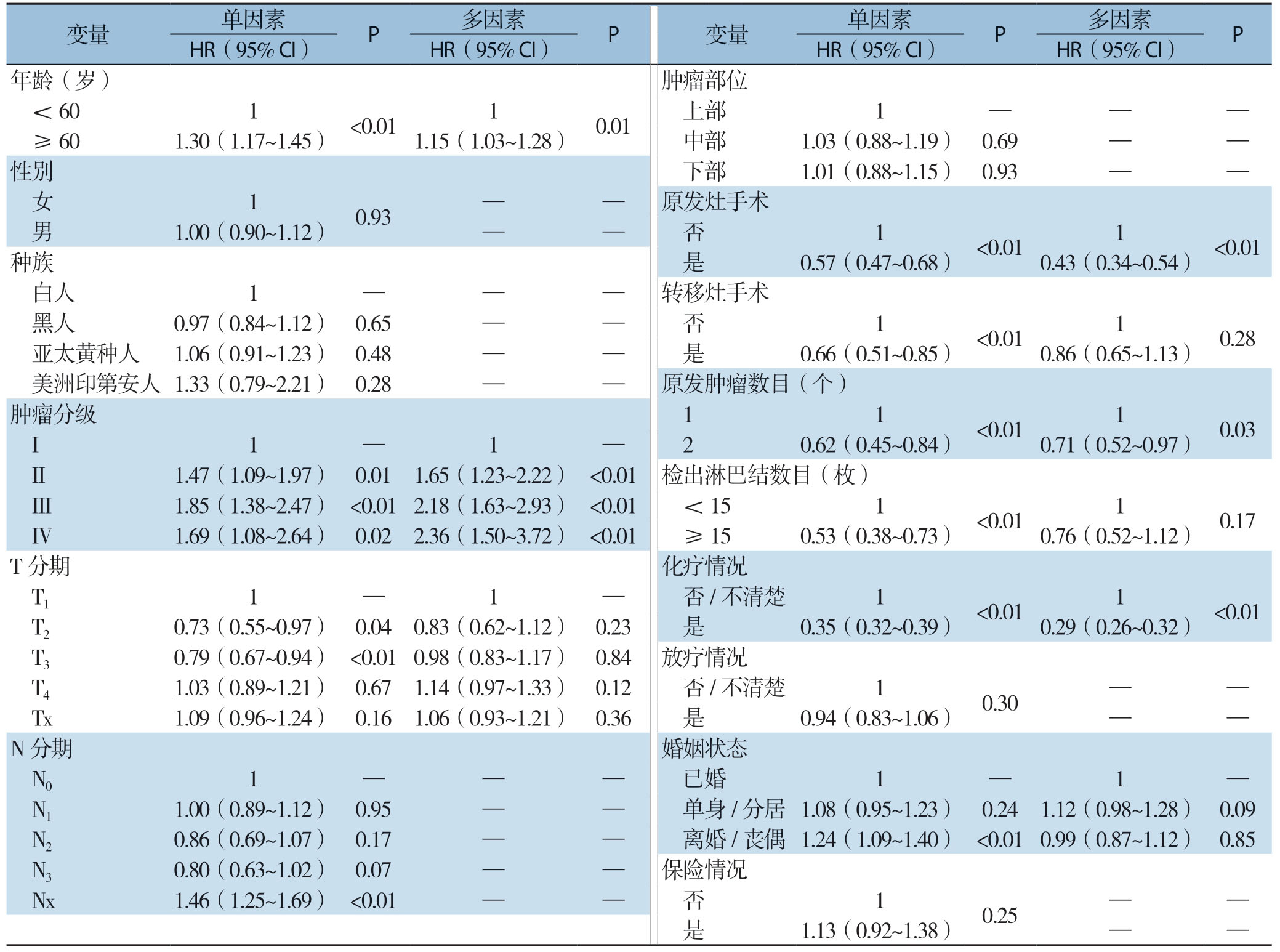
变量 单因素 P 多因素 P 变量 单因素 P 多因素 P HR(95% CI)HR(95% CI)HR(95% CI)HR(95% CI)年龄(岁)肿瘤部位<60 1<0.01 1 0.01 上部 1 — — — ≥60 1.30(1.17~1.45)1.15(1.03~1.28)中部 1.03(0.88~1.19)0.69 — —性别 下部 1.01(0.88~1.15)0.93 — — 女 1 0.93 — — 原发灶手术 男 1.00(0.90~1.12)— — 否 1<0.01 1<0.01种族 是 0.57(0.47~0.68)0.43(0.34~0.54)白人 1 — — — 转移灶手术 黑人 0.97(0.84~1.12)0.65 — — 否 1<0.01 1 0.28 亚太黄种人 1.06(0.91~1.23)0.48 — — 是 0.66(0.51~0.85)0.86(0.65~1.13)美洲印第安人1.33(0.79~2.21)0.28 — — 原发肿瘤数目(个)肿瘤分级 1 1<0.01 1 0.03 I 1 — 1 — 2 0.62(0.45~0.84)0.71(0.52~0.97)II 1.47(1.09~1.97)0.01 1.65(1.23~2.22)<0.01 检出淋巴结数目(枚)III 1.85(1.38~2.47)<0.012.18(1.63~2.93)<0.01<15 1<0.01 1 0.17 IV 1.69(1.08~2.64)0.02 2.36(1.50~3.72)<0.01 ≥15 0.53(0.38~0.73)0.76(0.52~1.12)T分期 化疗情况 T1 1 — 1 — 否/不清楚 1<0.01 1<0.01 T2 0.73(0.55~0.97)0.04 0.83(0.62~1.12)0.23 是 0.35(0.32~0.39)0.29(0.26~0.32)T3 0.79(0.67~0.94)<0.01 0.98(0.83~1.17)0.84 放疗情况 T4 1.03(0.89~1.21)0.67 1.14(0.97~1.33)0.12 否/不清楚 1 0.30 — — Tx 1.09(0.96~1.24)0.16 1.06(0.93~1.21)0.36 是 0.94(0.83~1.06)— —N分期 婚姻状态 N0 1 — — — 已婚 1 — 1 — N1 1.00(0.89~1.12)0.95 — — 单身/分居 1.08(0.95~1.23)0.24 1.12(0.98~1.28)0.09 N2 0.86(0.69~1.07)0.17 — — 离婚/丧偶 1.24(1.09~1.40)<0.01 0.99(0.87~1.12)0.85 N3 0.80(0.63~1.02)0.07 — — 保险情况 Nx 1.46(1.25~1.69)<0.01 — — 否 1 0.25 — — 是 1.13(0.92~1.38)— —
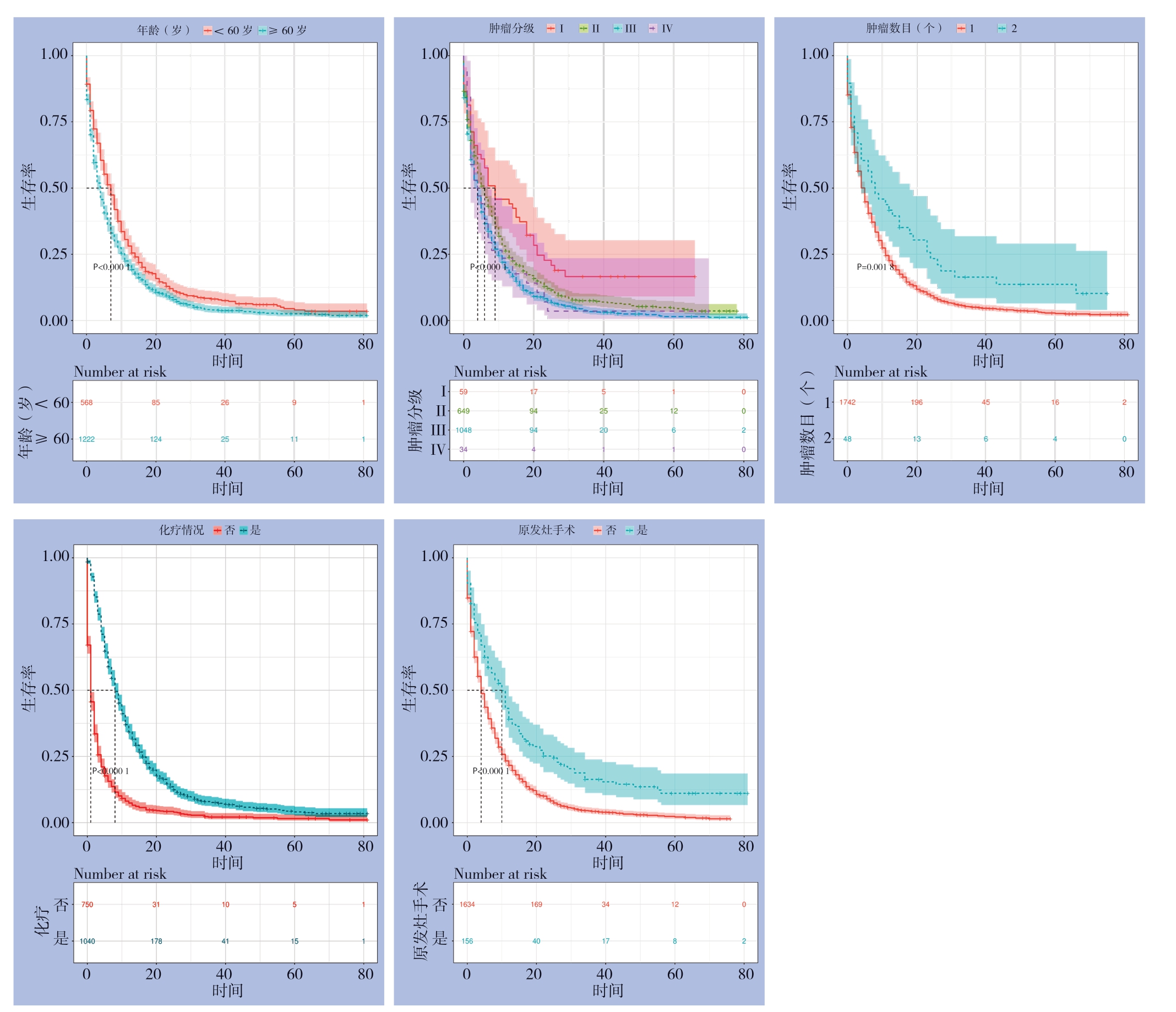
图2 主要变量对GCLM患者OS的影响生存曲线分析
Figure2 Survival curve analysis of influences of the main variables on the OS of GCLM patients
表3 影响GCLM患者特异生存期的多因素分析
Table3 Multivariate analysis of factors for CSS in patients with GCLM
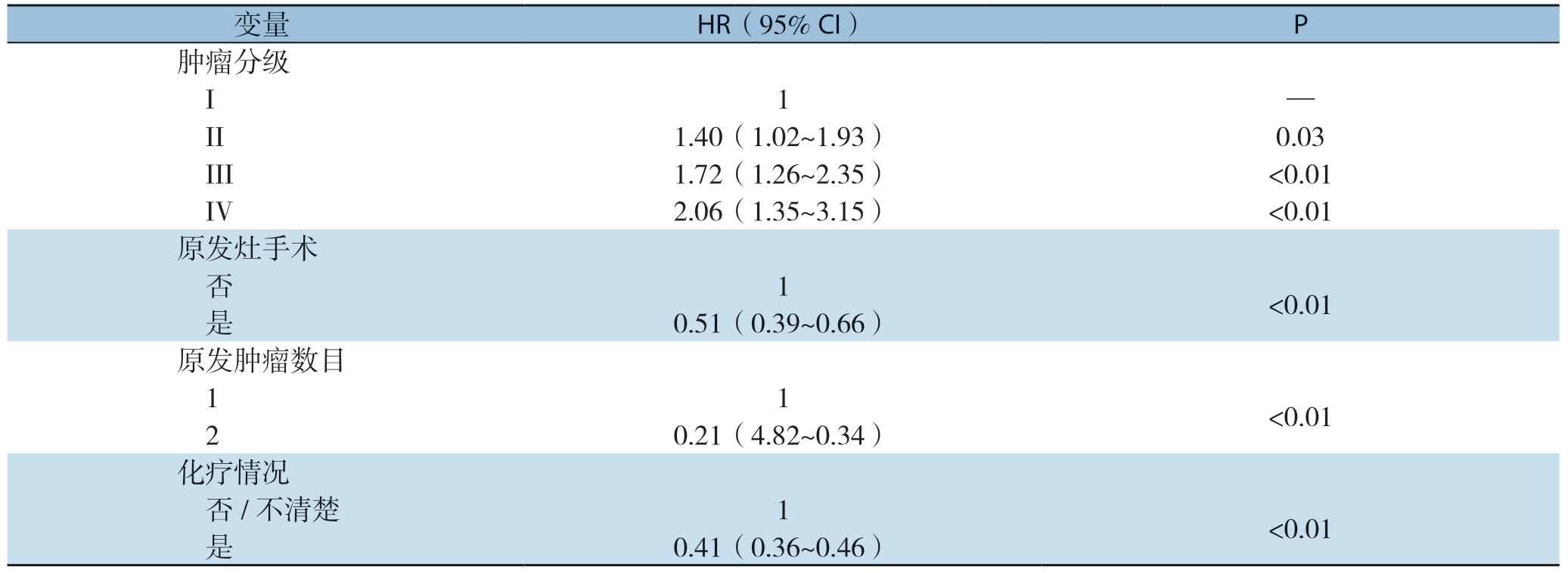
变量 HR(95% CI)P肿瘤分级 I 1 — II 1.40(1.02~1.93)0.03 III 1.72(1.26~2.35)<0.01 IV 2.06(1.35~3.15)<0.01原发灶手术 否 1<0.01 是 0.51(0.39~0.66)原发肿瘤数目 1 1<0.012 0.21(4.82~0.34)化疗情况 否/不清楚 1<0.01 是 0.41(0.36~0.46)
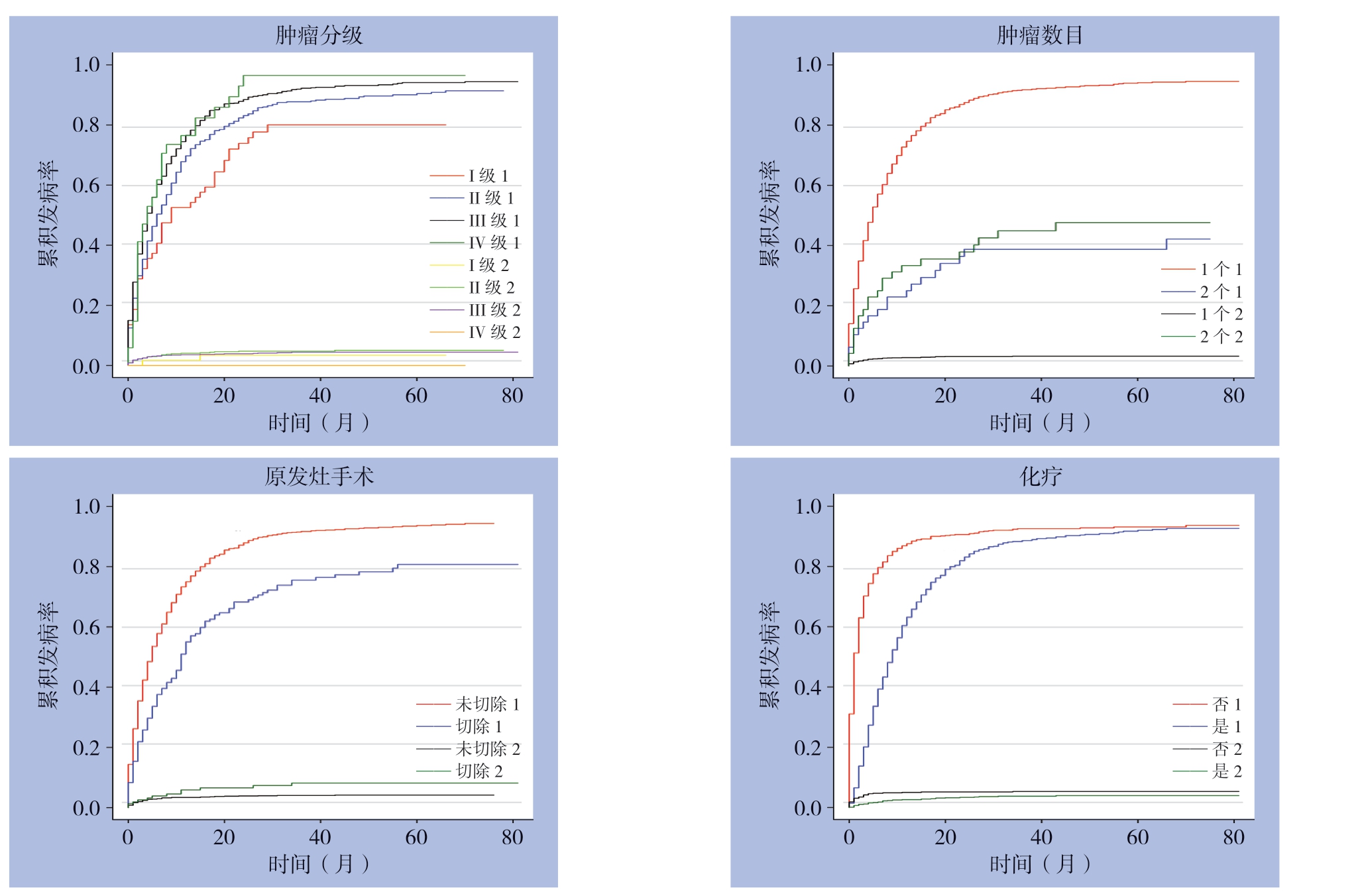
图3 主要变量对GCLM患者CSS的影响生存曲线分析(1表示死亡为该肿瘤导致,2表示死亡为其他原因导致)
Figure3 Survival curve analysis of influences of the main variables on the CSS of GCLM patients (1 standing for death caused by the tumor,2 standing for death caused by other reasons)
2.4 GCLM的生存预后列线图模型构建
基于建模集中的Cox分析模型和Fine-Gray分析模型的结果(图4),将多因素Cox回归分析中显示有统计学意义的5个变量纳入GCLM患者OS预后的列线图模型,将竞争风险模型中分析显示有统计学意义的4个变量纳入GCLM患者CSS预后的列线图模型。整合所有的独立预测因子,构建列线图模型预测GCLM患者1、3、5年的预后生存期(图5)。
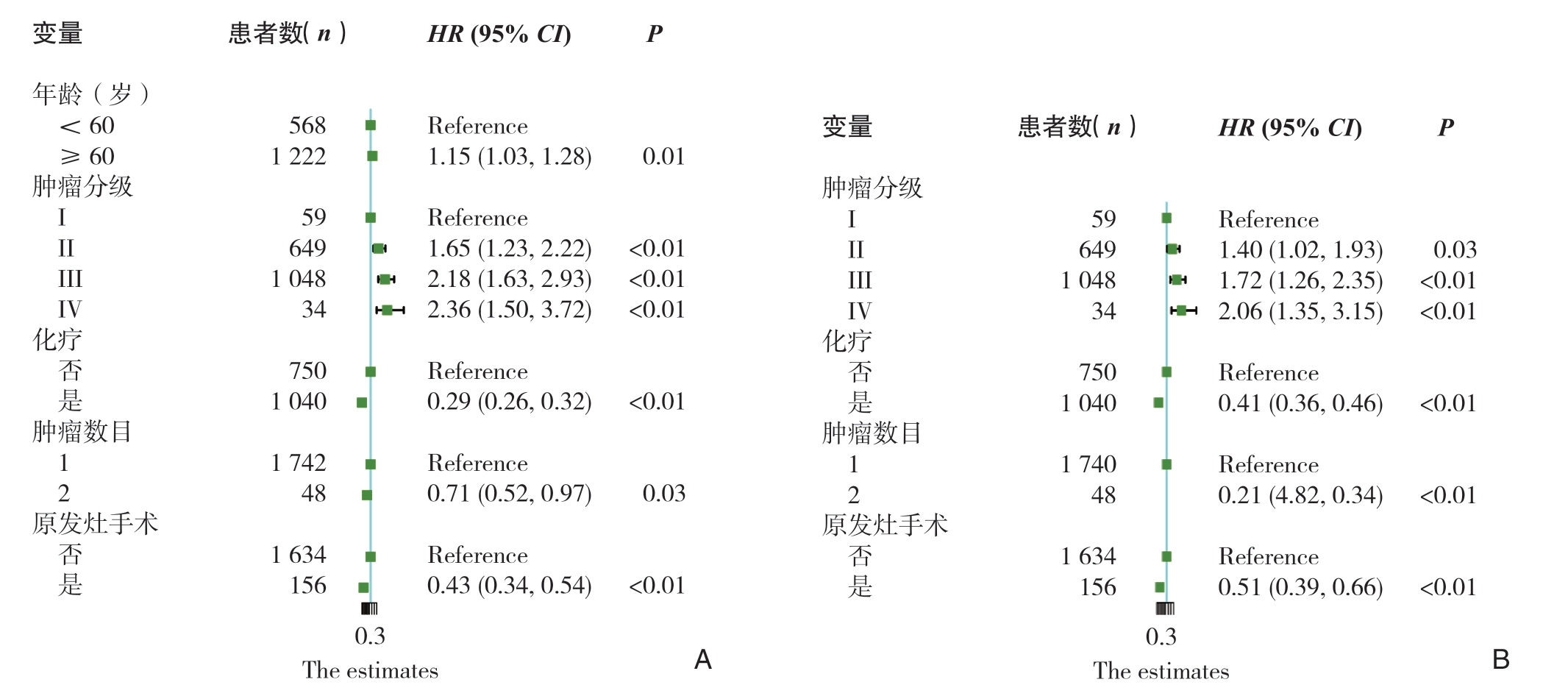
图4 GCLM患者OS和CSS的比例危害模型森林图 A:OS;B:CSS
Figure4 The proportional hazard model forest map of OS and CSS in GCLM patients A:OS;B:CSS

图5 GCLM患者预后列线图预测模型 A:OS;B:CSS
Figure5 Nomogram prediction model for prognosis of GCLM patients A:OS;B:CSS
2.5 列线图预测模型的验证
依据确立的建模集和验证集,将构建好的模型进行内部验证,结果显示GCLM患者OS和CSS预后的列线图模型均有较高的预测准确性。建模集和验证集中患者OS的列线图模型的一致性指数明显高于TNM分期评价系统(0.706 vs.0.560;0.670 vs.0.554),而建模集和验证集中患者CSS的列线图模型的一致性指数与T N M分期评价系统相比亦明显提高(0.769 vs.0.534;0.744 vs.0.518)(表4)。同时,进行ROC曲线分析,结果显示评估患者OS和CSS的两组列线图模型均具有更大的曲线下面积,提示新模型具有更好的准确性(图6)。为了减少一致性指数出现过度拟合现象,对其一致性指数进行校正,本研究择取患者1年的生存状况用以构建校正曲线,结果显示出列线图预测模型的OS和CSS的1年生存率预测曲线与对角线具有较高的吻合度,提示实际观察和列线图模型预测的1年生存概率具有较好的一致性,说明构建的模型具有良好的辨别能力与准确性(图7)。
表4 列线图评价模型和AJCC-TNM 评价系统的一致性指数
Table4 The C-indexes of nomogram evaluation models and AJCC-TNM evaluation system
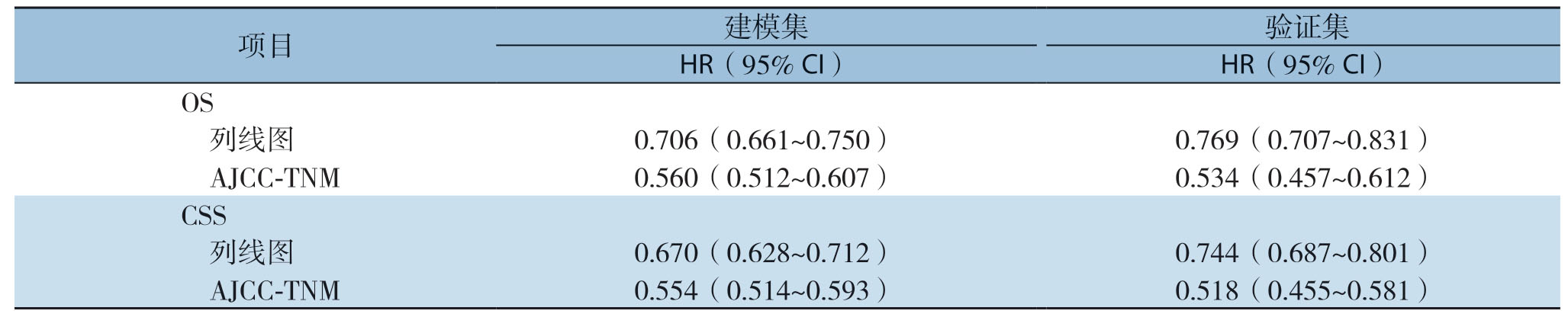
项目 建模集 验证集HR(95% CI)HR(95% CI)OS 列线图 0.706(0.661~0.750)0.769(0.707~0.831)AJCC-TNM 0.560(0.512~0.607)0.534(0.457~0.612)CSS 列线图 0.670(0.628~0.712)0.744(0.687~0.801)AJCC-TNM 0.554(0.514~0.593)0.518(0.455~0.581)
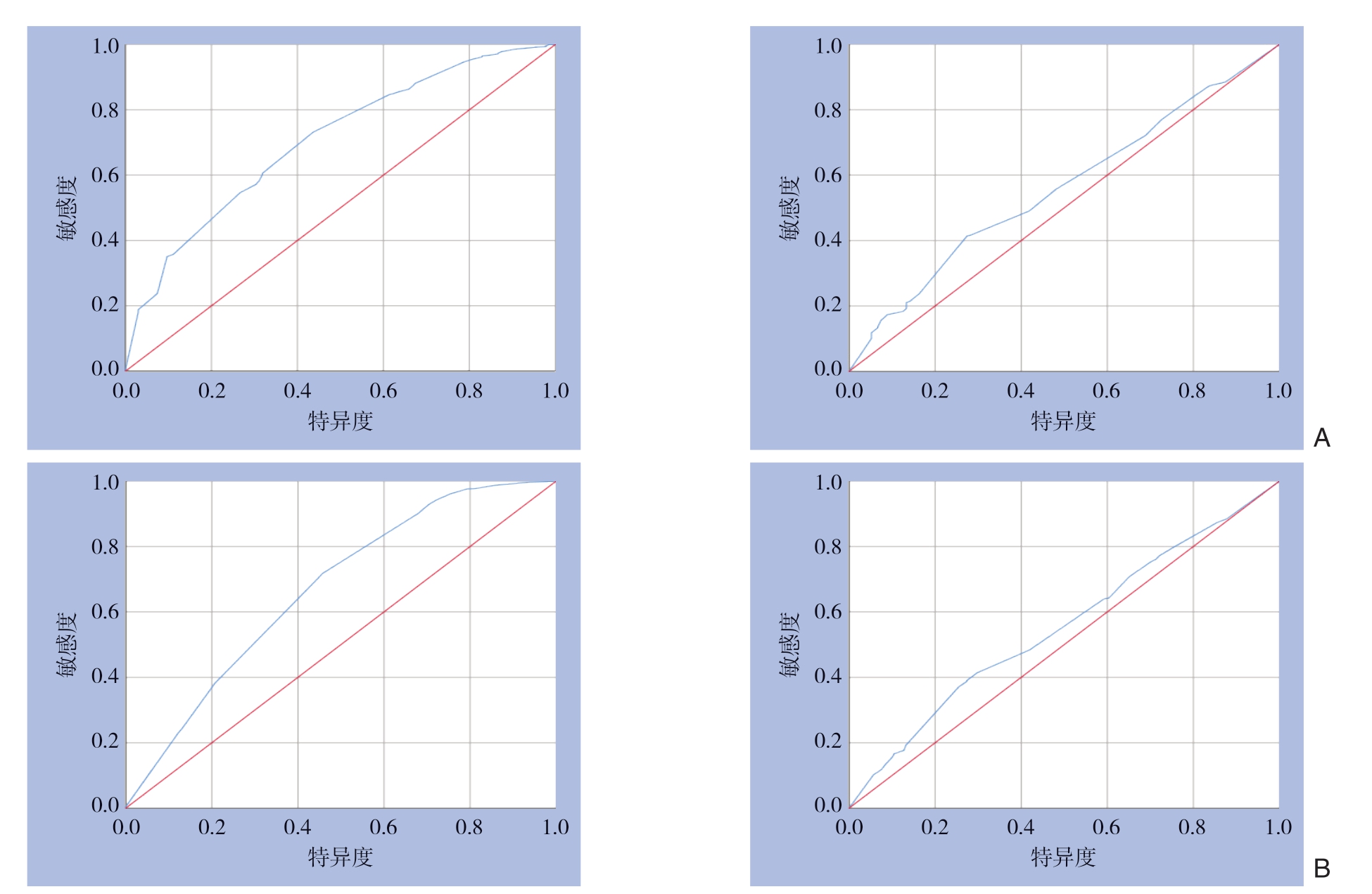
图6 评价预测模型可靠性的ROC曲线 A:OS;B:CSS
Figure6 ROC curves for evaluating the reliability of the prediction models A:OS;B:CSS
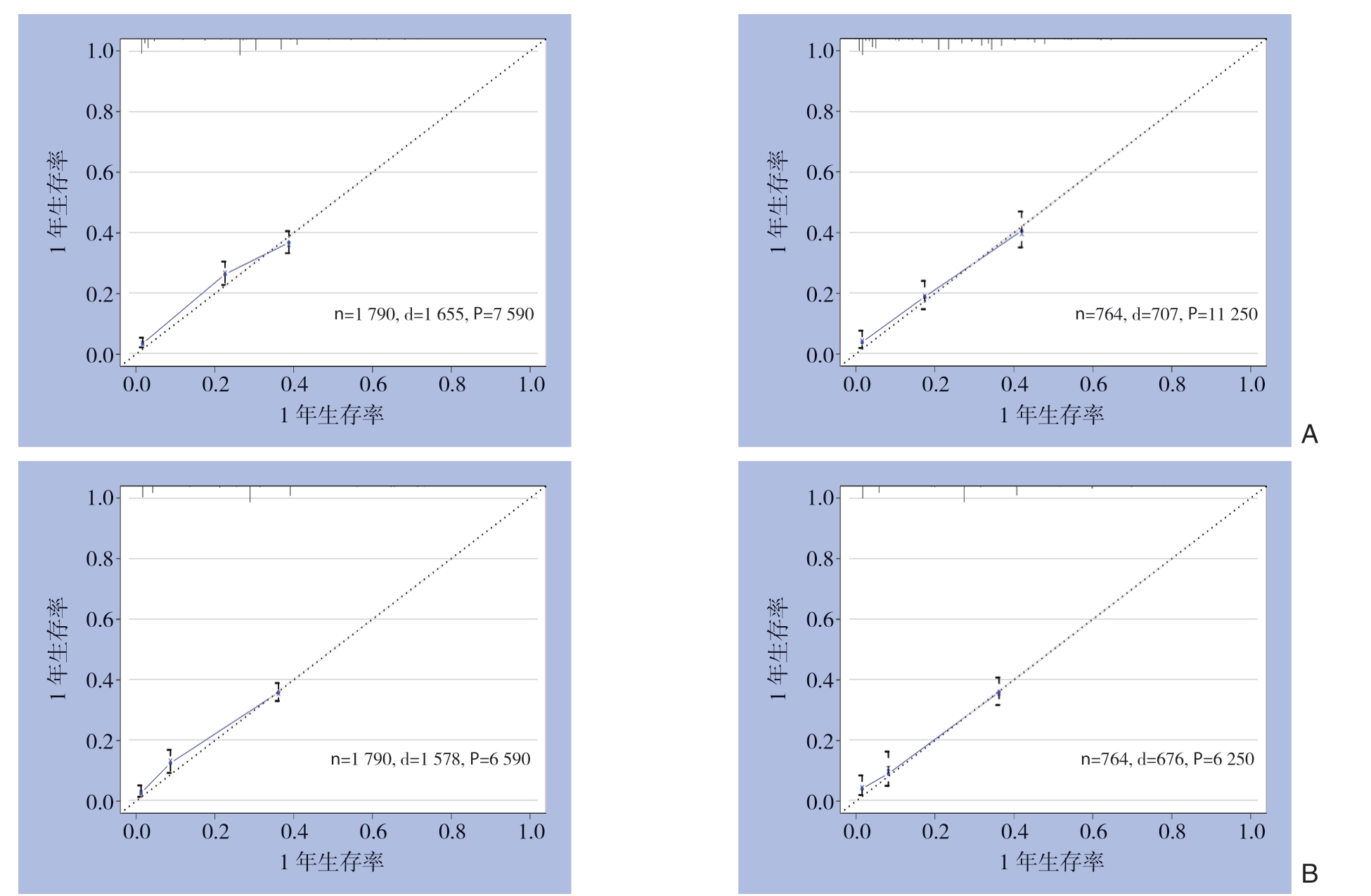
图7 建模集和验证集中GCLM患者OS和CSS的列线图预测模型1年生存率的校正曲线(图中横坐标表示列线图模型预测生存率,纵坐标表示Kaplan-Meier 法计算的实际生存率,对角线表示两者匹配完全一致性)A:OS;B:CSS
Figure7 The calibration curves of nomogram prediction model of 1-year survival for OS and CSS in GCLM patients in modeling set and validation set (the horizontal axis showing the predicted survival rates by the nomogram prediction model,and the vertical axis showing the actual survival rates obtained by Kaplan-Meier method) A:OS;B:CSS
3 讨 论
GCLM是一种具有严重不良结局的恶性疾病,近年来随着各种手术和辅助治疗技术的进步,多学科的综合治疗现已成为GCLM的主要治疗模式,并使得患者明显获益[11-12]。既往研究表明,患者的预后与临床、病理参数以及肿瘤的生物学特性关系密切[13-14]。因此,在优化综合治疗模式和预后评估手段时,应该充分考虑并结合各种相关的重要指标。本研究以大样本临床资料为依据,构建良好的肿瘤预后评估模型,以为患者的个体化综合治疗提供参考。
列线图作为一种新型的统计预测模型[15],相较于传统的预后分析模式具有准确性高、使用灵活、易于推广等众多优点,目前已被广泛应用于肝癌、膀胱癌、前列腺癌、宫颈癌以及胃癌等多种肿瘤类型中[16-20]。本研究构建了列线图模型用以预测GCLM患者的OS和CSS,并利用验证集数据对该模型进行验证,采用一致性指数、ROC曲线和校正曲线分析评估了该模型的准确性和可靠性。结果显示,建立的两组列线图模型能够有效地预测GCLM患者的OS和CSS,其具备良好的辨别和校准能力,并且均较AJCC-TNM分期系统具有更好的预测能力。因此,本研究认为构建的生存评价模型是可靠的,其预测能力是稳健的。
本研究结果显示,年龄、肿瘤病理分级、原发灶数目、原发灶切除和化疗等5个指标是影响GCLM患者生存预后的独立危险因素,并最终被纳入列线图评价模型。通过对比GCLM患者OS和CSS的列线图模型发现,其纳入评价的指标具有相当的共同性,仅有年龄指标被单独纳入OS评价模型中,这突显了年龄因素对评估患者OS预后的重要性。目前认为,大多数肿瘤性疾病的临床预后情况与年龄具有紧密的联系,而本研究结果显示出年龄越大将越不利于患者的OS预后,这与大部分学者的研究结果具有一致性[21-23],而导致这一结果的原因可能与高龄患者未及时的早期发现和诊治、接受姑息治疗的比例较高、机体免疫能力衰退以及较差的经济实力有关。目前,针对GCLM的治疗方法主要包括了手术切除、全身化疗、消融治疗、放射治疗以及最佳支持治疗等,但这些治疗的适应症和禁忌症仍存在较大争议,但多临床指南将系统性全身化疗认为是GCLM的主要辅助治疗措施,并获得了广泛的认可[24-26]。在本研究中发现,两种预后的评价模型均显示出患者的生存预期与全身化疗显著相关,明确采取化疗措施的患者无论是OS还是CSS均显著提高,这进一步地肯定了化疗对GCLM患者的重要性和必要性。胃癌原发灶联合肝转移灶切除被认为是治愈GCLM潜在可能的唯一方案,但由于该疾病常起病隐匿、多伴有肝内微小转移、腹膜转移、淋巴结转移以及肝外远处转移等,大多不宜进行肝病灶切除手术治疗[27-28]。为此,近年来临床研究开始积极讨论原发灶根治性手术切除等姑息治疗方案的可靠性,但是缺乏更多的循证医学证据。本研究结果显示,胃癌原发病灶的切除可以使得GCLM患者的OS和CSS的预后均显著获益,这充实了必要的循证医学证据。其可能的原因:一方面,有研究认为原发病灶的存在可能具有诱导转移灶癌旁组织产生有利于肿瘤细胞侵袭、转移和生长繁殖等所需要的肿瘤微环境的作用,并且原发灶中肿瘤干细胞的存在也可能增加了VEGF的表达,从而诱导血管的新生,共同促进肿瘤的发展[29-30]。另一方面,肿瘤原发灶中炎症因子的持续存在也可影响肿瘤的发展,其中以IFN-γ、IL-10等为代表的炎症因子,可通过发挥抗肿瘤免疫或诱导肿瘤免疫耐受等过程调节肿瘤的发展[31]。因此,肿瘤原发灶的切除可能转变了上述各种不利影响因素,从而改善了GCLM患者的生存预后。肿瘤分化程度反映了肿瘤的侵袭能力和恶性度,本研究结果显示原发肿瘤的分化程度越低,患者的生存预后风险越大,这一结论与多数研究报道一致[9,32]。近年来,有学者[33]对患者预后与肿瘤原发灶数目的关系进行了探索,并认为肿瘤病灶数目的增多和肿瘤侵袭性特征成正相关,这引起了学界对肿瘤原发灶数目特征的关注。本研究结果发现,较于原发灶数目为1的GCLM患者而言,原发灶数目为2的患者OS和CSS预后风险评分更低,展示出原发灶数目对于GCLM患者的预后而言可能是保护因子。黄彩平等[33]研究也发现原发肿瘤数目较多组比较少组具有更低的乳腺癌特异病死率,这与本研究结果相一致。不过这一结论仍值得进一步的商榷和验证,该结果初次在本研究中得出,还缺乏更多的参考资料支持,因此未来仍需进一步加大对此方面的研究探索,以证实该指标的可靠性。
综上所述,本研究利用SEER数据库中临床病理资料涵盖面广、数据量大的优势,在有效地确保了预测模型准确性和可靠性的前提下,构建的两组列线图预测模型均具有重要的临床实际应用价值,能够对GCLM患者OS和CSS生存预后进行有效的评估,因此建立的模型可作为咨询和指导GCLM患者临床治疗决策的重要工具。但是,需要提及的是SEER数据库也存在着一定的不足,比如某些重要信息的缺乏、部分信息不详细等,使得不能对某些重要内容进行研究,而且亦可能存在导致不同程度偏倚的风险。在本研究中不可否认的是也存在着一定的不足之处,如存在一些重要指标未能纳入研究、手术和化疗具体方案不详等不足,因此,未来仍需要更多的临床研究作进一步的验证支持。
[1]Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394-424.doi:10.3322/caac.21492.
[2]Kerkar SP,Kemp CD,Avital I.Liver resections in metastatic gastric cancer[J].HPB (Oxford),2010,12(9):589-596.doi:10.1111/j.1477-2574.2010.00224.x.
[3]Ganguly S,Biswas B,Ghosh J,et al.Metastatic Gastric cancer:Real world scenario from a developing country[J].South Asian J Cancer,2018,7(3):171-174.doi:10.4103/sajc.sajc_2_18.
[4]Song M,Rabkin CS,Camargo MC.Gastric Cancer:an Evolving Disease[J].Curr Treat Options Gastroenterol,2018,16(4):561-569.doi:10.1007/s11938-018-0203-1.
[5]Li Q,Li H,Jiang H,et al.Predictive factors of trastuzumab-based chemotherapy in HER2 positive advanced gastric cancer:a singlecenter prospective observational study[J].Clin Transl Oncol,2018,20(6):695-702.doi:10.1007/s12094-017-1772-5.
[6]Nicholls RJ,Zinicola R,Haboubi N.Extramural spread of rectal cancer and the AJCC Cancer Staging Manual 8th edition,2017[J].Ann Oncol,2019,30(8):1394-1395.doi:10.1093/annonc/mdz147.
[7]Chen T,Xu L,Ye L,et al.A new nomogram for recurrence-free survival prediction of gastrointestinal stromal tumors:Comparison with current risk classification methods[J].Eur J Surg Oncol,2019,45(6):1109-1114.doi:10.1016/j.ejso.2018.12.014.
[8]Kobayashi T,Mizuno S,Matsuba H,et al.Long-Term Survival for a Patient with Stage Gastric Cancer with Multiple Liver Metastases for Ten Years Who Was Treated with Only S-1Chemotherapy[J].Gan To Kagaku Ryoho,2020,47(4):615-619.PMID:32389963.
[9]姚强,金俊,邓建良,等.胃癌肝转移患者预后影响因素分析[J].肿瘤学杂志,2018,24(2):104-108.doi:10.11735/j.issn.1671-170X.2018.02.B005.
Yao Q,Jin J,Deng JL,et al.An Analysis of the Prognostic Factors of Gastric Cancer Patients with Liver Metastasis [J].Journal of Chinese Oncology,2018,24(2):104-108.doi:10.11735/j.issn.1671-170X.2018.02.B005.
[10]王俊男,闫枫尚,徐拯,等.基于SEER数据库的甲状腺髓样癌预后因素分析[J].中国普通外科杂志,2018,27(5):547-552.doi:10.3978/j.issn.1005-6947.2018.05.004.
Wang JN,Yan FS,Xu Z,et al.Analysis of prognostic factors for medullary thyroid carcinoma based on SEER database [J].Chinese Journal of General Surgery,2018,27(5):547-552.doi:10.3978/j.issn.1005-6947.2018.05.004.
[11]Sakamoto Y,Sano T,Shimada K,et al.Favorable indications for hepatectomy in patients with liver metastasis from gastric cancer[J].J Surg Oncol,2007,95(7):534-539.doi:10.1002/jso.20739.
[12]Liu SF,Lu CR,Cheng HD,et al.Comparison of Therapeutic Efficacy between Gastrectomy with Transarterial Chemoembolization Plus Systemic Chemotherapy and Systemic Chemotherapy Alone in Gastric Cancer with Synchronous Liver Metastasis[J].Chin Med J (Engl),2015,128(16):2194-2201.doi:10.4103/0366-6999.162497.
[13]Hu HK,Ke NW,Li A,et al.Clinical characteristics and prognostic factors of gastroenteropancreatic neuroendocrine tumors:a single center experience in China[J].Hepatogastroenterology,2015,62(137):178-183.doi:10.5754/hge13914.
[14]Xu X,Li J,Han X,et al.Clinical characteristics and prognostic factors of patients with gastric neuroendocrine carcinoma treated with radical surgery[J].Chin Med J (Engl),2014,127(13):2419-2422.doi:10.3760/cma.j.issn.0366-6999.20132415.
[15]Li G,Tian ML,Bing YT,et al.Nomograms predict survival outcomes for distant metastatic pancreatic neuroendocrine tumor:A population based STROBE compliant study[J].Medicine (Baltimore),2020,99(13):e19593.doi:10.1097/MD.0000000000019593.
[16]Wang YY,Xiang BD,Ma L,et al.Development and Validation of a Nomogram to Preoperatively Estimate Post-hepatectomy Liver Dysfunction Risk and Long-term Survival in Patients With Hepatocellular Carcinoma[J].Ann Surg,2020,doi:10.1097/SLA.0000000000003803.[Online ahead of print]
[17]Benoit L,Balaya V,Guani B,et al.Nomogram Predicting the Likelihood of Parametrial Involvement in Early-Stage Cervical Cancer:Avoiding Unjustified Radical Hysterectomies[J].J Clin Med,2020,9(7):2121.doi:10.3390/jcm9072121.
[18]Yang Z,Bai Y,Liu M,et al.Development and Validation of Prognostic Nomograms to Predict Overall and Cancer-Specific Survival for Patients with Adenocarcinoma of the Urinary Bladder:A Population-Based Study[J].J Invest Surg,2020,doi:10.1080/08941939.2020.1812776.[Online ahead of print]
[19]Kyei MY,Adusei B,Klufio GO,et al.Treatment of localized prostate cancer and use of nomograms among urologists in the West Africa sub-region[J].Pan Afr Med J,2020,36:251.doi:10.11604/pamj.2020.36.251.21419.
[20]戴赟,陆俊,李平,等.皮革胃患者术后生存情况预测的列线图模型研究[J].中国普通外科杂志,2019,28(4):461-466.doi:10.7659/j.issn.1005-6947.2019.04.012.
Dai Y,Lu J,Li P,et al.Establishment of nomogram model for predicting postoperative survival of patients with gastric linitis plastica [J].Chinese Journal of General Surgery,2019,28(4):461-466.doi:10.7659/j.issn.1005-6947.2019.04.012.
[21]康旭,范翠君,曹斌校,等.胃癌肝转移患者预后影响因素的分析[J].肿瘤学杂志,2010,16(3):220-222.
Kang X,Fan CJ,Cao BX,et al.Prognostic Analysis of Gastric Carcinoma with Liver Metastases [J].Journal of Oncology,2010,16(3):220-222.
[22]Kawahara K,Makino H,Kametaka H,et al.Outcomes of surgical resection for gastric cancer liver metastases:a retrospective analysis[J].World J Surg Oncol,2020,18(1):41.doi:10.1186/s12957-020-01816-9.
[23]Quinn BA,Deng X,Colton A,et al.Increasing age predicts poor cervical cancer prognosis with subsequent effect on treatment and overall survival[J].Brachytherapy,2019,18(1):29-37.doi:10.1016/j.brachy.2018.08.016.
[24]Zhang W,Yu Y,Fang Y,et al.Systemic chemotherapy as a main strategy for liver metastases from gastric cancer[J].Clin Transl Oncol,2015,17(11):888-894.doi:10.1007/s12094-015-1321-z.
[25]Chen L,Song MQ,Lin HZ,et al.Chemotherapy and resection for gastric cancer with synchronous liver metastases[J].World J Gastroenterol,2013,19(13):2097-2103.doi:10.3748/wjg.v19.i13.2097.
[26]Namikawa T,Tsuda S,Fujisawa K,et al.Conversion surgery after S-1 plus oxaliplatin combination chemotherapy for advanced gastric cancer with multiple liver metastases[J].Clin J Gastroenterol,2018,11(4):297-301.doi:10.1007/s12328-018-0842-8.
[27]张珂诚,王鹏鹏,陈凛.胃癌肝转移的外科治疗[J].中华肿瘤杂志,2019,41(3):183-186.doi:10.3760/cma.j.issn.0253?3766.2019.03.005.
Zhang KC,Wang PP,Chen L.Surgical teratment for gastric cancer patients with liver metastasis [J].Chinese Journal of Oncology,2019,41(3):183-186.doi:10.3760/cma.j.issn.0253?3766.2019.03.005.
[28]Oki E,Tokunaga S,Emi Y,et al.Surgical treatment of liver metastasis of gastric cancer:a retrospective multicenter cohort study (KSCC1302)[J].Gastric Cancer,2016,19(3):968-976.doi:10.1007/s10120-015-0530-z.
[29]van der Wal GE,Gouw AS,Kamps JA,et al.Angiogenesis in synchronous and metachronous colorectal liver metastases:the liver as a permissive soil[J].Ann Surg,2012,255(1):86-94.doi:10.1097/SLA.0b013e318238346a.
[30]Liu W,Dong Z,Hu R,et al.Association of Vascular Endothelial Growth Factor ( VEGF) Gene Polymorphisms With Gastric Cancer and Its Development,Prognosis,and Survival[J].Technol Cancer Res Treat,2018,17:1876021458.doi:10.1177/1533034617753810.
[31]Evans C,Morrison I,Heriot AG,et al.The correlation between colorectal cancer rates of proliferation and apoptosis and systemic cytokine levels;plus their influence upon survival[J].Br J Cancer,2006,94(10):1412-1419.doi:10.1038/sj.bjc.6603104.
[32]Yang L,Jin P,Wang X,et al.Risk factors associated with histological upgrade of gastric low-grade dysplasia on pretreatment biopsy[J].J Dig Dis,2018,19(10):596-604.doi:10.1111/1751-2980.12669.
[33]黄彩平,渠宁,张凌,等.肿瘤原发灶数目对于甲状腺乳头状癌预后的影响分析[C]//第六届全国甲状腺肿瘤学术大会论文汇编.天津:第六届全国甲状腺肿瘤学术大会委员会,2014:213.
Huang CP,Qu N,Zhang L,et al.Analysis of the influence of the number of primary tumor foci on the prognosis of papillary thyroid carcinom[C]//Proceedings of the 6th national academic conference of thyroid tumors.Tianjin:Committee of the 6th national academic conference of thyroid tumors,2014:213.
