乳腺癌是全球女性发病率最高的恶性肿瘤,也是导致女性死亡的主要原因。根据国家癌症中心发布的报告,2015年中国乳腺癌新发患者数为30.4万例,占全国癌症新发病例的7.81%,发病率在总人群中列第五位,女性中列第一位。中国乳腺癌5年生存率仍低于美国、澳大利亚等西方国家[1-3],其预后尚有进一步提高的空间。
三阴性乳腺癌(triple-negative breastcancer,TNBC)是指雌激素受体(estrogen receptor,ER)、孕激素受体(prosgestogen receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)均为阴性的一种特殊类型乳腺癌。TNBC具有复杂基因组、高度遗传不稳定异质性以及缺乏内分泌治疗和抗HER-2治疗的靶点等特点,预后较差。虽然近年来以PD-1,PD-L1抗体为代表的免疫检查点抑制剂治疗成为TNBC治疗的热点,但由于其治疗效果有限,辅助化疗仍是其主要治疗策略。然而,辅助化疗的毒副反应,尤其是骨髓抑制制约着化疗剂量、强度和化疗周期的实现,影响肿瘤的缓解率与治愈率。其中化疗引起的中性粒细胞减少(chemotherapy induced neutropenia,CIN)是最重要的剂量限制性毒性之一,并且经常是剂量减少的原因。此外有研究显示骨髓抑制可作为药代动力学参数,对不同组织的化疗敏感性提供参考[4],化疗诱导的骨髓抑制可能是早期乳腺癌治疗有效的标志之一[5]。TNBC作为一种特殊类型的乳腺癌,其发生、发展和转归具有更加复杂的特点,与化疗后骨髓抑制的关系尚不明确。本研究旨在比较不同骨髓抑制程度对TNBC患者预后的影响,以期为TNBC的治疗提供更为精准的策略。
目前,国内外关于TNBC辅助化疗期间出现骨髓抑制程度对复发及生存影响的研究较少。作者回顾性分析了郑州大学第三附属医院2012年1月—2017年12月168例TNBC患者的临床病理资料,探究了辅助化疗期间骨髓抑制程度对TNBC患者预后的影响,现报告如下。
1 资料与方法
1.1 一般资料
将2012年1月—2017年12月郑州大学第三附属医院乳腺外科收治的接受表柔比星联合环磷酰胺序贯多西他赛(EC-T)方案辅助化疗的TNBC患者纳入研究。化疗方案为前4个周期采用EC方案:化疗第1天表柔比星100 mg/m2、环磷酰胺600 mg/m2,静脉滴注,1次/d,21 d为1个周期;后4个周期采用T方案,化疗当天多西他赛100 mg/m2,静脉滴注,1次/d,21 d为1个周期。用多西他赛前1天,开始口服地塞米松 7.5 mg,2次/d,连服 3 d。
病例纳入标准:⑴ 女性,年龄<70岁;⑵ 病理证实为TNBC;病理学分期I~III期;⑶ 美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况评分0~2分;⑷ 术前未行肿瘤相关治疗;⑸ 无明显肝肾脑心等重要器官疾病;⑹ 手术方式为乳腺癌改良根治术;⑺ 化疗期间定期复查血常规且资料完善;⑻ 影像及病理学资料完善,在该院定期复查或随访者。排除标准:⑴ T4肿瘤,包括炎性乳腺癌;⑵ 病理证实为转移性乳腺癌,或者临床、影像学资料提示为转移性乳腺癌;⑶ 既往有乳腺癌或者其他恶性肿瘤病史;⑷ 妊娠或哺乳期乳腺癌;⑸ 化疗期间出现复发转移者;⑹ 各种原因未完成既定化疗方案,或化疗剂量减少的;⑺ 首疗程化疗后预防性使用粒细胞集落刺激因子者。
1.2 分组与预后评价
化疗后骨髓抑制分度采用WHO抗癌药物急性及亚急性毒性反应分度标准进行。因EC-T化疗方案主要抑制白细胞和中性粒细胞,所以本研究根据白细胞、中性粒细胞计数进行骨髓抑制分度,分为0、I、II、III、IV度。所有患者首疗程化疗后不预防性使用粒细胞集落刺激因子治疗,化疗第10天复查血常规并进行骨髓抑制分度。对于0~II度骨髓抑制不做治疗,III~IV度骨髓抑制使用重组人粒细胞集落刺激因子150 μg/d皮下注射,每天复查血常规至白细胞总数和中性粒细胞计数恢复正常停止用药。以后每个周期第10天复查血常规并进行骨髓抑制分度。在EC-T方案的8个周期内均为0~II度骨髓抑制者定义为轻度,纳入轻度组。任一周期出现III~1V度者定义为重度,纳入重度组,并在下一周期开始预防性使用粒细胞集落刺激因子(包括长效和短效)治疗。随访开始时间为第1疗程化疗开始第1天,随访截止时间为2019年12月31日。采用下列指标评价预后,包括无病生存率(disease-free survival,DFS)、总生存率(overall survival,OS)、无局部复发生存率(local recurrence-free survival,LRFS)、无远处复发生存率(distant recurrence-free survival,DRFS)。DFS事件包括自随访开始任何乳腺癌复发或因任何原因导致的死亡;OS事件包括自随访开始任何原因导致的死亡;LRFS事件包括自随访开始乳腺癌的胸壁和/或区域淋巴结复发;DRFS事件包括自随访开始任何部位的乳腺癌远处转移。本研究经郑州大学第三附属医院伦理委员会批准(2019医伦审第08号)。
1.3 统计学处理
应用SPSS 21.0统计软件进行数据分析,组间比较使用χ²检验,生存资料采用Kaplan-Meier法进行生存分析,采用Log-rank检验进行单因素分析。P<0.05认为差异有统计学意义。
2 结 果
2.1 基线特征
本研究共纳入168例患者,其中轻度组纳入102例,重度组纳入66例。两组患者的基线临床病理特征差异无统计学意义(均P>0.05)(表1)。
2.2 生存分析
轻度组的中位随访时间是66.5(22~95)个月,重度组的中位随访时间是67.5(28~96)个月。轻度组、重度组分别发生DFS事件38例和15例,轻度组的中位DFS为84个月,重度组未达到中位DFS。轻度组、重度组分别发生OS事件20例和8例,两组均未达到中位OS。轻度组、重度组分别发生LRFS事件17例和8例,两组均未达到中位LRFS。轻度组、重度组分别发生DRFS事件27例和10例,两组均未达到中位DRFS。
重度组的5年DFS率较轻度组高,差异具有统计学意义(78.3% vs.69.2%,HR=0.45,P=0.037);重度组与轻度组的5年OS率差异无统计学意义(91.1%vs.83.3%,HR=0.602,P=0.183);重度组与轻度组的5年LRFS率差异无统计学意义(89.1% vs.83.3%,HR=0.625,P=0.270);重度组的5年DRFS率较轻度组高,差异具有统计学意义(85.5% vs.77.0%,HR=0.41,P=0.048)(表2)(图1)。
表1 168例TNBC患者的临床病理基线特征[n(%)]
Table1 Clinicopathologic baseline characteristics of the 168 TNBC patients [n (%)]
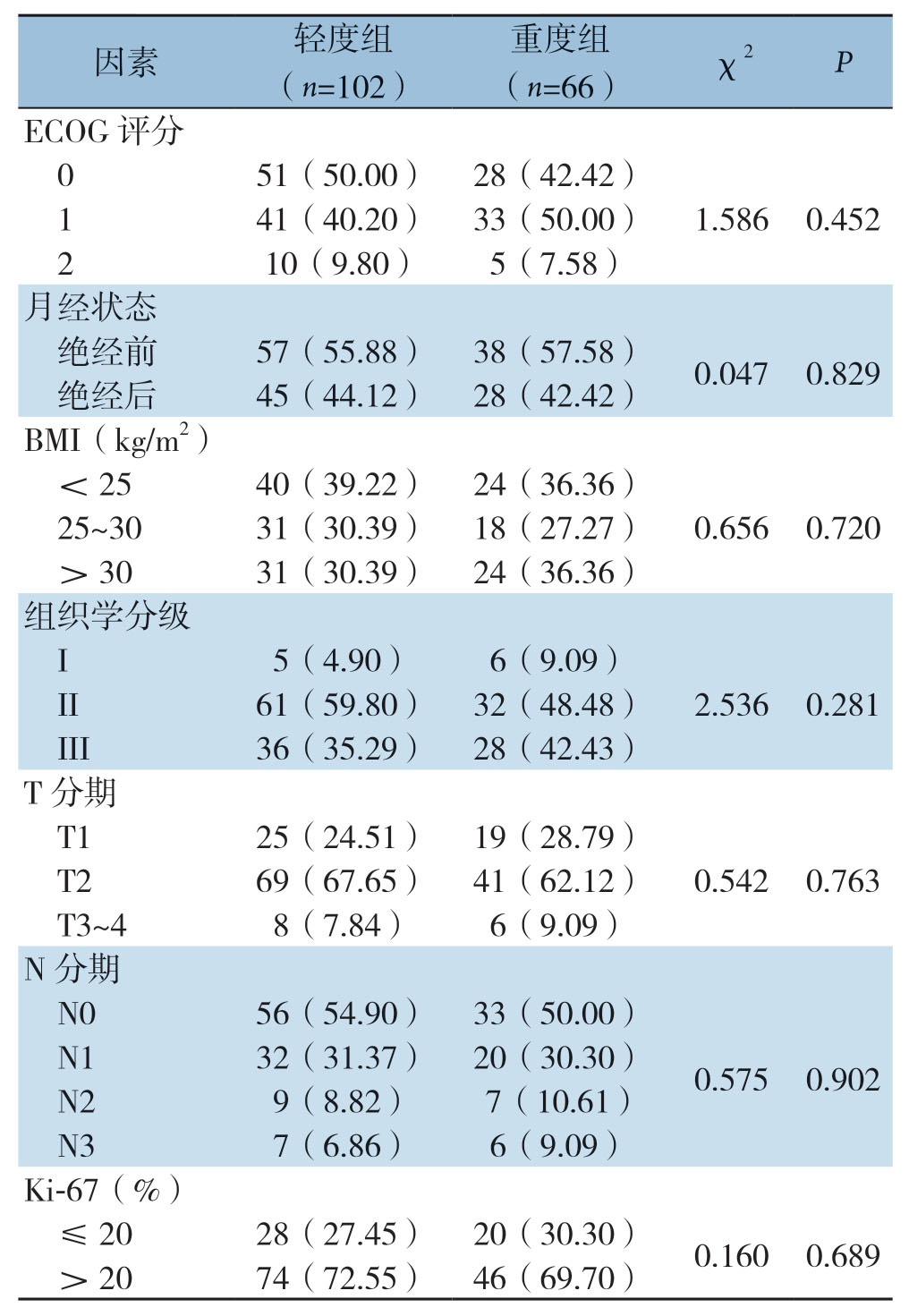
因素 轻度组(n=102)重度组(n=66) χ2 P ECOG 评分0 51(50.00) 28(42.42)1 41(40.20) 33(50.00) 1.586 0.452 2 10(9.80) 5(7.58)月经状态绝经前 57(55.88) 38(57.58) 0.047 0.829绝经后 45(44.12) 28(42.42)BMI(kg/m2)<25 40(39.22) 24(36.36)25~30 31(30.39) 18(27.27) 0.656 0.720>30 31(30.39) 24(36.36)组织学分级I 5(4.90) 6(9.09)II 61(59.80) 32(48.48) 2.536 0.281 III 36(35.29) 28(42.43)T 分期T1 25(24.51) 19(28.79)T2 69(67.65) 41(62.12) 0.542 0.763 T3~4 8(7.84) 6(9.09)N 分期N0 56(54.90) 33(50.00)N1 32(31.37) 20(30.30) 0.575 0.902 N2 9(8.82) 7(10.61)N3 7(6.86) 6(9.09)Ki-67(%)≤20 28(27.45) 20(30.30) 0.160 0.689>20 74(72.55) 46(69.70)
表2 两组的预后比较(%)
Table2 Comparison of the prognosis of the two groups (%)
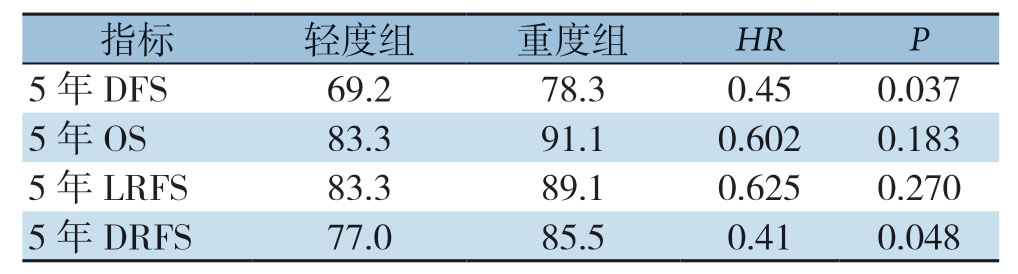
指标 轻度组 重度组 HR P 5年DFS 69.2 78.3 0.45 0.037 5年OS 83.3 91.1 0.602 0.183 5年LRFS 83.3 89.1 0.625 0.270 5年DRFS 77.0 85.5 0.41 0.048
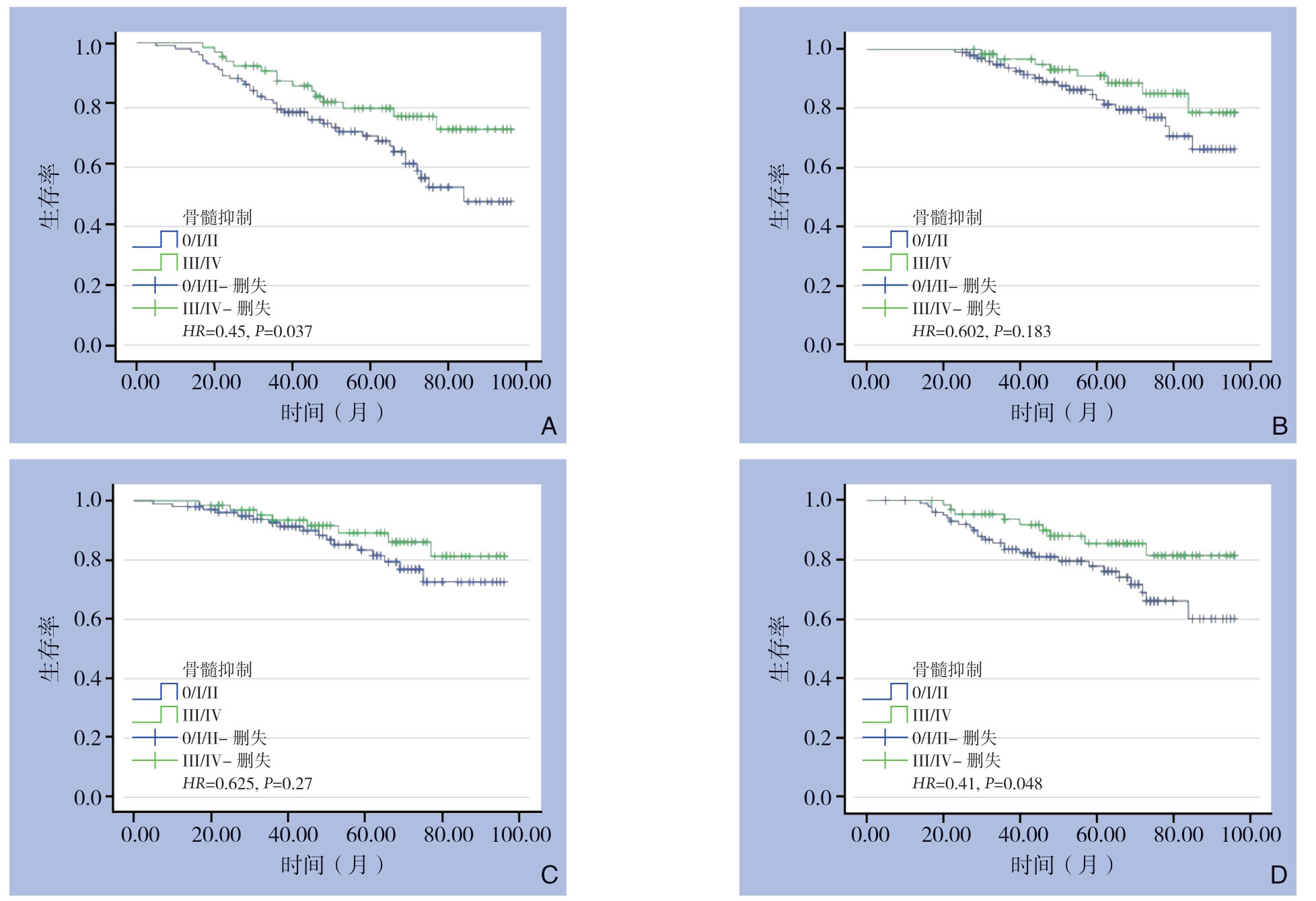
图1 两组患者 Kaplan-Meier 生存曲线 A:DFS曲线;B OS曲线:C:LRFS曲线;D:DRFS曲线
Figure1 Kaplan-Meier survival curves of the two groups of patients A:DFS curves; B:OS curves; C:LRFS curves; D:DRFS curves
3 讨 论
TNBC是一种高侵袭性的乳腺癌亚型,占所有乳腺癌的15%~20%[6]。此类乳腺癌与乳腺癌易感基因1(breast cancer susceptibility gene 1,BRCA1)相关乳腺癌相似,具有分化差、组织学分级高、复发和转移率高的特点[7-9],复发高峰通常出现在术后1~3年,且以内脏转移为主,一旦复发,患者往往在5年内死亡[10-12]。同时TNBC又是一种高度异质性的肿瘤,Lehmann等[13]采用基因芯片方法,将TNBC分为基底细胞样1型、基底细胞样2型、免疫调节型、间充质细胞型、间充质干细胞样型和管腔内雄激素受体型,提示对不同分型可以采用不同的治疗策略。在临床研究中也发现对于TNBC采用免疫治疗、多聚二磷酸腺苷核糖聚合酶(PARP)抑制剂治疗及抗血管生成治疗均有一定的疗效,但由于缺少内分泌治疗及抗HER-2治疗的靶点,目前对TNBC的主要治疗仍为化疗[14]。
TNBC虽然预后较差,但对化疗具有较高的敏感性,在新辅助化疗中,采用蒽环和紫衫类药物的联合或序贯化疗方案可以取得较高的PCR率[15-17]。目前,AC-T方案(包括EC-T)仍为TNBC的标准化疗方案之一,并获得中国临床肿瘤协会(CSCO)2020指南的一级推荐。骨髓抑制尤其是中性粒细胞减少是AC-T方案的常见化疗副反应,可能导致化疗剂量减少和延期,从而影响化疗疗效。在NCCN髓细胞生长因子指南中,AC-T方案属于导致粒细胞减少性发热(febrile neutropenia,FN)的中风险化疗方案,其发生风险为10%~20%,可不预防性使用粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF),但如前一疗程出现FN或者FN的高危因素,则下一疗程需要预防性使用G-CSF[18]。在本研究中,化疗后并未常规预防性使用G-CSF,不会影响骨髓抑制程度的判断,如任一周期出现III~IV度骨髓抑制,则已确定纳入重度组,因III~IV度骨髓抑制是FN的高危因素,存在感染的风险,会在下一周期开始预防性使用G-CSF治疗。
既往研究[19-20]显示,化疗方案和化疗剂量的不同、骨转移是导致重度骨髓抑制的独立风险因子。在本研究中,在化疗方案一致并排除了骨转移的前提下,轻度骨髓抑制组和重度骨髓抑制组的基线ECOG评分、绝经状态、BMI、组织学分级、肿瘤大小、腋窝淋巴结状态、Ki-67水平差异均无统计学意义。提示这些常见的临床病理因素并不影响骨髓抑制的严重程度。在相同的化疗剂量下,骨髓抑制程度的不同可能代表着不同患者骨髓细胞对于化疗药物的敏感性。此外有学者从基因层面探讨了这个问题,认为骨髓抑制的发生可能与CYP2B6和ERCC1的遗传多态性相关[21]。
有研究[22]显示,骨髓抑制尤其是CIN可能是药物生物学活性的替代指标。Ma等[23]的研究分析了410例浸润性乳腺癌的临床病理特征及预后,发现与非CIN组相比,CIN组的5年DFS和DMFS显著延长,但两组的OS和LRFS差异无统计学意义。Abraham等[24]的研究表明,与II级及以下中性粒细胞减少的早期乳腺癌患者相比,III级、IV级中性粒细胞减少症的患者DFS、OS延长,中性粒细胞减少症可能是肿瘤干细胞死亡的潜在标志。本研究发现,在接受EC-T方案辅助化疗的TNBC中,III~IV度骨髓抑制患者的DFS及DRFS均较0~II度骨髓抑制患者具有优势,提示骨髓抑制的程度对于TNBC的预后具有预测价值。至于LRFS无统计学差异,可能与TNBC的复发以远处转移多见,局部复发较少。而OS无统计学差异,则可能与III~IV度骨髓抑制患者在复发转移后进行后续化疗时耐受性差,无法足剂量使用有关。
III~IV度骨髓抑制的TNBC患者为何具有更好的预后?作者分析原因在于出现重度骨髓抑制间接说明化疗药物剂量充足,抗肿瘤作用更强。而仅轻度骨髓抑制说明化疗剂量相对不足,仍有提高的空间。同时因为TNBC对化疗高度敏感,中性粒细胞和乳腺癌细胞都属于代谢旺盛的细胞,容易被化疗药物杀伤,而中性粒细胞被杀伤的程度可能代表了肿瘤细胞被杀伤的程度。此外有学者认为中性粒细胞可能是乳腺癌细胞扩散的帮凶,Park等[25]在TNBC小鼠模型中发现,中性粒细胞能够释放出一种名为NET-DNA的胞外陷阱帮助癌细胞在小鼠机体中扩散。Yang等[26]的研究也发现中性粒细胞所释放的胞外陷阱中的DNA可以充当癌细胞的趋化物质,促进乳腺癌细胞的肝转移。另有多项研究显示中性粒细胞可能参与了肿瘤的进展和转移[27-29]。而化疗相关性骨髓抑制会导致中性粒细胞减少,从而削弱这种胞外陷阱作用。再者,有研究[30]显示相较于轻度骨髓抑制,重度骨髓抑制患者骨髓中的弥散性肿瘤细胞相应减少,而弥散性肿瘤细胞是TNBCDFS和OS的不良预测因子。
综上所述,TNBC患者EC-T方案辅助化疗期间出现III~IV度骨髓抑制较0~II度骨髓抑制预后好,有助于判断疗效和制定治疗决策。对于仅轻度骨髓抑制的患者,可能后续需要强化治疗。值得注意的是,重度骨髓抑制会增加粒细胞减少性发热及感染的风险,必须权衡利弊、严密监控并进行对症治疗。本研究不足之处在于样本量较少,需要进一步扩大研究样本研究。
[1]Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394–424.doi:10.3322/caac.21492.
[2]郑荣寿,孙可欣,张思维,等.2015年中国恶性肿瘤流行情况分析[J].中华肿瘤杂志,2019,41(1):19–28.doi:10.3760/cma.j.issn.0253–3766.2019.01.008.
Zheng RS,Sun KX,Zhang SW,et al.Report of cancer epidemiology in China,2015[J].Chinese Journal of Oncology,2019,41(1):19–28.doi:10.3760/cma.j.issn.0253–3766.2019.01.008.
[3]Chen W,Sun K,Zheng R,et al.Cancer incidence and mortality in China,2014[J].Chin J Cancer Res,2018,30(1):1–12.doi:10.21147/j.issn.1000–9604.2018.01.01.
[4]Friberg LE,Henningsson A,Maas H,Model of chemotherapyinduced myelosuppression with parameter consistency across drugs[J].J Clin Oncol,2002,20(24):4713–4721.doi:10.1200/JCO.2002.02.140.
[5]范洪玮,向倩,张卓,等.早期乳腺癌患者化疗骨髓抑制与药物疗效关系的分析[J].中国临床药理学杂志,2017,33(19):1963–1965.doi:10.13699/j.cnki.1001–6821.2017.19.033.
Fan HW,Xiang Q,Zhang Z,et al.Analysis of the relationship between chemotherapy-induced myelotoxicity and clinical efficacy in patients with early breast cancer[J].The Chinese Journal of Clinical Pharmacology,2017,33(19):1963–1965.doi:10.13699/j.cnki.1001–6821.2017.19.033.
[6]Zhang Y,Wang S,Yang B,et al.Adjuvant treatment for triplenegative breast cancer:a retrospective study of immunotherapy with autologous cytokine-induced killer cells in 294 patients[J].Cancer Biol Med,2019,16(2):350–360.doi:10.20892/j.issn.2095–3941.2018.0378.
[7]Rakha EA,Ellis IO.Triple-negative/basal-like breast cancer:review[J].Pathology,2009,41(1):40–47.doi:10.1080/00313020802563510.
[8]Christiana N,Panagiotis B,Panagiotis P.Molecular Mechanisms and Emerging Therapeutic Targets of Triple-Negative Breast Cancer Metastasis[J].Front Oncol,2018,22(8):31.doi:10.3389/fonc.2018.00031.
[9]Mou E,Wang H.LncRNA LUCAT1 facilitates tumorigenesis and metastasis of triple-negative breast cancer through modulating miR-5702[J].Biosci Rep,2019,39(9):BSR20190489.doi:10.1042/BSR20190489.
[10]曹希,徐雅莉,孙强.年龄与三阴性乳腺癌患者预后的关系[J].中国普通外科杂志,2020,29(5):515–524.doi:10.7659/ j.issn.1005–6947.2020.05.001.
Cao X,Xu YL,Sun Q.Relationship between age and prognosis in patients with triple-negative breast cancer[J].Chinese Journal of General Surgery,2020,29(5):515–524.doi:10.7659/j.issn.1005–6947.2020.05.001.
[11]Staněk L,Tesarova P,Vocka M,et al.Molecular analysis of JAK2 gene in patients with triple negative breast cancer in relation to disease prognosis-a pilot study[J].Breast J,2017,32:S46.doi:10.1016/S0960–9776(17)30169–8.
[12]He Z,Xu Q,Wang X,et al.RPLP1 promotes tumor metastasis and is associated with a poor prognosis in triple-negative breast cancer patients[J].Cancer Cell Int.2018 Oct 25;18:170.doi:10.1186/s12935–018–0658–0.
[13]Lehmann BD,Bauer JA,Chen X,et al.Identification of human triple-negative breast cancer subtypes and preclinical models for selection of targeted therapies[J].J Clin Invest,2011,121(7):2750–2767.doi:10.1172/ JCI45014.
[14]范东伟,姚昌洋,姚廷敬.三阴性乳腺癌的研究进展[J].医学综述,2018,24(1):71–75.doi:10.3969/j.issn.1006–2084.2018.01.014.
Fan DW,Yao CY,Yao TJ.Research Progress of Triple Negative Breast Cancer[J].Medical Recapitulate,2018,24(1):71–75.doi:10.3969/j.issn.1006–2084.2018.01.014.
[15]朱月梅,王国如,张沂,等.表柔比星联合紫杉醇新辅助化疗治疗乳腺癌保乳术患者的疗效及安全性[J].中国普通外科杂志,2019,28(11):1406–1413.doi:10.7659/j.issn.1005–6947.2019.11.014.
Zhu YM,Wang GR,Zhang Y,et al.Efficacy and safety of neoadjuvant chemotherapy with epirubicin plus paclitaxel in treatment of patients undergoing breast-preserving surgery for breast cancer[J].Chinese Journal of General Surgery,2019,28(11):1406–1413.doi:10.7659/j.issn.1005–6947.2019.11.014.
[16]蔡耿喜,蔡子杰,陈前军,等.乳腺癌新辅助化疗的现状与进展—南方乳腺癌论坛主要议题与共识[J].中国 普通外科杂志,2019,28(11):1309–1321.doi:10.7659/j.issn.1005- 6947.2019.11.001.
Cai GX,Cai ZJ,Chen QJ,et al.Current status and development of chemotherapy of breast cancer:the main topics and agreements of China South Breast Cancer Symposium[J].Chinese Journal of General Surgery,2019,28(11):1309–1321.doi:10.7659/j.issn.1005–6947.2019.11.001.
[17]刘杰娜,张建国,郭宝良,等.乳腺癌患者Ki-67表达水平对新辅助化疗后病理学完全缓解的预测价值[J].中国普通外科杂志,2018,27(5):608–614.doi:10.3978/j.issn.1005–6947.2018.05.013.
Liu JN,Zhang JG,Guo BL,et al.Values of Ki-67 expression level in predicting pathological complete response following neoadjuvant chemotherapy in breast cancer patients[J].Chinese Journal of General Surgery,2018,27(5):608–614.doi:10.3978/j.issn.1005–6947.2018.05.013.
[18]中国抗癌协会肿瘤临床化疗专业委员会,中国抗癌协会肿瘤支持治疗专业委员会.肿瘤化疗导致的中性粒细胞减少诊治专家共识(2019年版)[J].中国肿瘤临床,2019,46(17):876–882.doi:10.3969/j.issn.1000–8179.2019.17.913.
The Society of Chemotherapy of Chinese Anti-Cancer Association,The Society of Supportive Treatment of Chinese Anti-Cancer Association,Consensus on the clinical diagnosis,treatment,and prevention of chemotherapy-in-duced neutropenia in China(2019 edition)[J].Chinese Journal of Clinical Oncology,2019,46(17):876–882.doi:10.3969/j.issn.1000–8179.2019.17.913.
[19]Lyman GH,Kuderer NM,Crawford J,et al.Predicting individual risk of neutropenic complications in patients receiving cancer chemotherapy[J].Cancer,2011,117(9):1917–1927.doi:10.1002/cncr.25691.
[20]Lyman GH,Michels SL,Reynolds MW,et al.Risk of mortality in patients with cancer who experience febrile neutropenia[J].Cancer,2010,116(23):5555–5563.doi:10.1002/cncr.25332.
[21]Tsuji D,Ikeda M,Yamamoto K,et al.Drug-related genetic polymorphisms affecting severe chemotherapy-induced neutropenia in breast cancer patients:A hospital-based observational study[J].Medicine (Baltimore),2016,95(44):e5151.doi:10.1097/MD.0000000000005151.
[22]Kasi PM,Grothey A.Chemotherapy-Induced Neutropenia as a Prognostic and Predictive Marker of Outcomes in Solid-Tumor Patients[J].Drugs,2018,78(7):737–745.doi:10.1007/s40265–018–0909–3.
[23]Ma RM,Chen CZ,Zhang W,et al.Prognostic Value of Chemotherapy-Induced Neutropenia at the First Cycle in Invasive Breast Cancer[J].Medicine (Baltimore),2016,95(13):e3240.doi:10.1097/MD.0000000000003240.
[24]Abraham JE,Hiller L,Dorling L,et al.A nested cohort study of 6,248 early breast cancer patients treated in neoadjuvant and adjuvant chemotherapy trials investigating the prognostic value of chemotherapy- related toxicities[J].BMC Med,2015,13:306.doi:10.1186/s12916–015–0547–5.
[25]Park J,Wysocki RW,Amoozgar Z,et al.Cancer cells induce metastasis-supporting neutrophil extracellular DNA traps[J].Sci Transl Med,2016,8(361):361ra138.doi:10.1126/scitranslmed.aag1711.
[26]Yang L,Liu Q,Zhang X,et al.DNA of neutrophil extracellular traps promotes cancer metastasis via CCDC25[J].Nature,2020,583(7814):133–138.doi:10.1038/s41586–020–2394–6.
[27]Szczerba BM,Castro-Giner F,Vetter M,et al.Neutrophils escort circulating tumour cells to enable cell cycle progression[J].Nature,2019,566(7745):553–557.doi:10.1038/s41586–019–0915-y.
[28]Wculek SK,Malanchi I.Neutrophils support lung colonization of metastasis-initiating breast cancer cells[J].Nature,2015,528(7582):413–417.doi:10.1038/nature16140.
[29]Glogauer JE,Sun CX,Bradley G,et al.Neutrophils increase oral squamous cell carcinoma Invasion through an Invadopodia-Dependent Pathway[J].Cancer Immunol Res,2015,3(11):1218–1226.doi:10.1158/2326–6066.cir-15–0017.
[30]Stefanovic S,Diel I,Sinn P,et al.Disseminated tumor cells in the bone marrow of patients with operable primary breast cancer:prognostic impact in immunophenotypic subgroups and clinical implication for bisphosphonate treatment[J].Ann Surg Oncol,2016,23(3):757–766.doi:10.1245/ s10434–015–4895–3.
