乳腺分泌型癌比较少见,属于特殊类型的乳腺浸润性导管癌,被WHO单独列为一种疾病类型,病灶内含有乳汁样分泌物,故称之为乳腺分泌型癌,约占乳腺癌的0.15%,任何年龄段均可发病。乳腺分泌型癌恶性程度较低,预后较好。笔者对本院收治的1例乳腺分泌型癌进行讨论分析并文献复习,以提高临床医生对该病的认识,减少漏诊和误诊。
1 临床资料
患者 女,55岁,因“发现右乳肿物半年余”入院。体检:神清,皮肤巩膜无黄染。颈软,气管居中,颈部浅表淋巴结未及明显肿大,双乳外观正常,皮肤无发红,未见桔皮样变和乳头回缩、凹陷,未见乳头糜烂、溃疡,右乳7~8点钟可触及一肿块,直径约3.0 cm,质偏硬,边界欠清,活动度欠佳,无压痛,左乳未及明显肿物,双侧腋窝未触及肿大淋巴结,心肺听诊末闻及明显异常,腹平软,未及压痛反跳痛,肝脾肋下未及,未及肿块,移动性浊音阴性,肠鸣音4~5次/份,双下肢无水肿,神经病理征未引出。辅助检查:乳腺B超(图1A-B)提示右侧乳腺外下象限可及2.7 cm×1.9 cm×2.7 cm的实性低回声团块、形态不规则、边界清、边缘呈角状突起、内部回声欠均、未见明显钙化点、肿块与后间隙分界清晰、团块后方声衰不明显、CDFI示肿块内部棒状血流信号(RI=0.91)、弹性评分4~5分,双侧腋下淋巴结未见肿大,BI-RADS 6类,考虑右侧乳腺肿瘤。乳腺钼靶(图2A-B)提示右乳外侧一直径约2.8 cm结节影、边界部分欠清、中等密度、未见毛刺征和异常钙化灶、双腋下淋巴结未见肿大,BI-RADS 6类。入院前在杭州市肿瘤医院行右乳肿块粗针穿刺活检,病理提示(右乳)乳腺肿瘤上皮呈实性、微囊型、管状排列,细胞内及细胞外可见分泌物、略嗜酸性,巢团状肿瘤细胞内可见纤细血管轴心结构,细胞轻度异型,偶见分裂象,间质纤维增生,局灶淋巴浆细胞浸润,免疫组化:CK(+)、P63部分(+)、SMA(-)、ER部分(+)、Cerb-2(1+)、GCDFP-15部分(+)、S-100(+)、Ki-675%~10%(+)、黏液染色(+),根据病理形态学结合免疫组化倾向于乳腺分泌型癌。术前诊断:右乳分泌型癌 cT2N0M0。患者肿瘤较大,与患者及家属沟通后患者无保乳意愿,遂于2015年3月6日在全麻下行右乳癌改良根治术,术中可见右乳外下象限一质地偏硬肿块,直径约3.0 cm,边界欠清,活动度尚可,与皮肤和胸肌无粘连,右腋窝淋巴结未及肿大。术后常规病理(图3A-C):右乳分泌型癌,肿瘤最大径2.5 cm,肿瘤呈微囊状、管状排列,内含有伊红色分泌物,细胞轻度异型,核分裂最高处达1个/10HPF,乳头下大导管未见癌累及,基底切缘未累及,腋窝淋巴结未见癌转移(0/34);免疫组化:ER (+)约5%~0%,局灶弱(+)、PR(-)、HER-2(-)、Ki-67(+)2%~5%、P53局灶弱(+)、E-Cadherin(+)、CD117(-)、S-100(+) 特染:PAS(+)、PAS消化(+)、AB(-)。术后病理分期为pT2N0M0(II A期),根据ER/PR/HER-2状态评估该患者预后分期为II B期,患者55岁,肿瘤较大,术后仍存在复发及转移风险,并结合患者意愿,给予EC方案(表柔比星 130 mg+环磷酰胺0.7 g)化疗4次[1]。化疗结束后给予三苯氧胺口服治疗。随访至2019年3月(共48个月),未见局部复发和远处转移。
2 讨 论
乳腺分泌型癌是乳腺浸润性癌中一种少见亚型,由McDivitt等[2]首次报道,主要发生于青少年,当时称之为幼年性癌。随着成人病例的报道逐渐增多,发现此肿瘤可发生于任何年龄,随后由Tavassoli等[3]正式命名为乳腺分泌型癌。现在大约三分之二的乳腺分泌型癌病例发生在成年人中[4],平均年龄为56岁[5],如本例发病年龄为55岁。分泌型乳腺癌主要发生在女性,也可见于男性,发病于后者往往发病年龄较小,且肿瘤生物学行为更具侵袭性[6]。根据最近国家癌症数据库(National Cancer Data Base,NCDB)报道,分泌型乳腺癌男女比例为1:31[5,7]。
乳腺分泌型癌的典型临床表现为无症状、生长缓慢、可活动,边界尚清的肿块,质地偏硬,常单发,但也有多中心病变的报道[8]。该病好发于外上象限,但发生在各个象限及腋下异位的乳腺组织均有报道,笔者收治的该例患者则是发生于外下象限。青春期前女性及男性患者乳腺组织较少,故好发于乳头及乳晕区[9]。超声表现类似良性肿块,通常为单发、形态为圆形或椭圆形或不规则、边界清晰或呈多叶状、内部回声低回声或等回声(与皮下脂肪组织回声相比较)的肿块,常被误认为纤维腺瘤[10-13]。乳腺分泌型癌钼靶具有多种非特异性的特征,从边缘光滑或不规则的良性离散、分叶状、孤立肿块,到边缘有针状边缘的可疑不对称密度,以及很少有微钙化[7,11-12]。乳腺分泌型癌MRI表现文献报道的并不多,杨汉卿等[14]曾报道过1例,其MRI表现在T1WI、T2WI抑脂序列上可见散在云雾状的稍高信号影。由此可见乳腺分泌型癌在超声和钼靶的表现呈多样性,其MRI因其肿块内富含分泌物,具有特征性表现,遗憾的是乳腺MRI并没有成为临床常规检查,因此本例未行双乳MRI扫描。本例患者的超声检查与文献报道的大致相仿,但钼靶表现为边界较好的中等密度肿块,未见可疑的微钙化和毛刺。

图1 乳腺彩色超声(BI-RADS 6类) A:右乳外下象限一直径约2.7 cm 肿块,形态不规则、边界清、边缘呈角状突起、内部回声欠均、未见明显钙化点、肿块与后间隙分界清晰、团块后方声衰不明显;B:CDFI 示肿块内部棒状血流信号(RI=0.91)
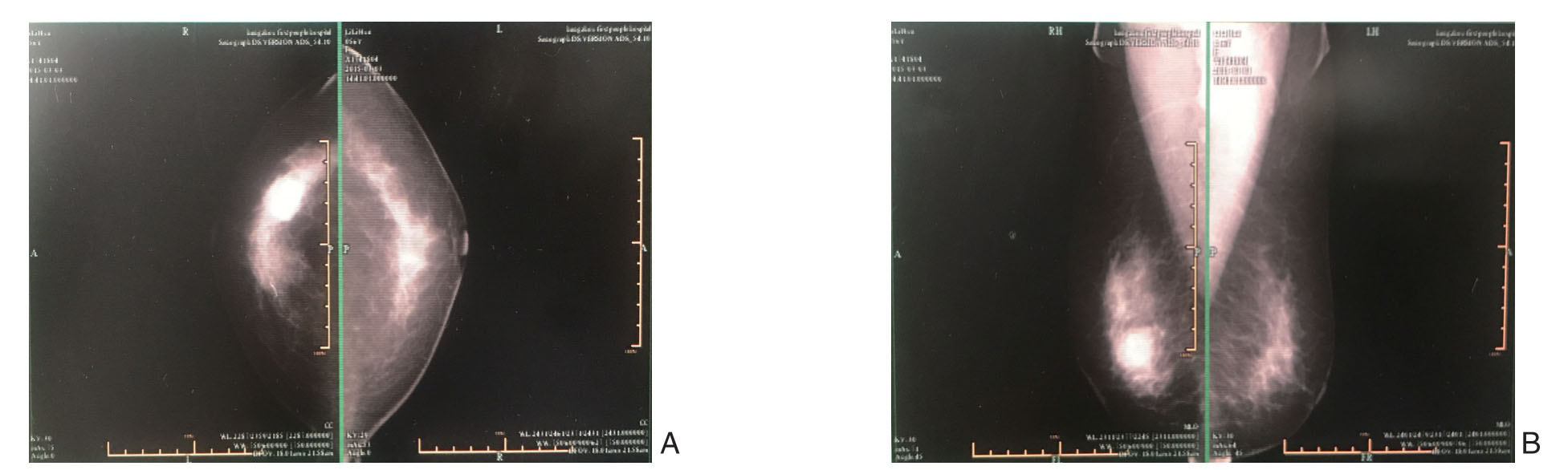
图2 乳腺钼靶(BI-RADS 6类) A-B:右乳外侧一直径约2.8 cm 结节影、边界部分欠清、中等密度、未见毛刺征和异常钙化灶。双腋下淋巴结未见肿大
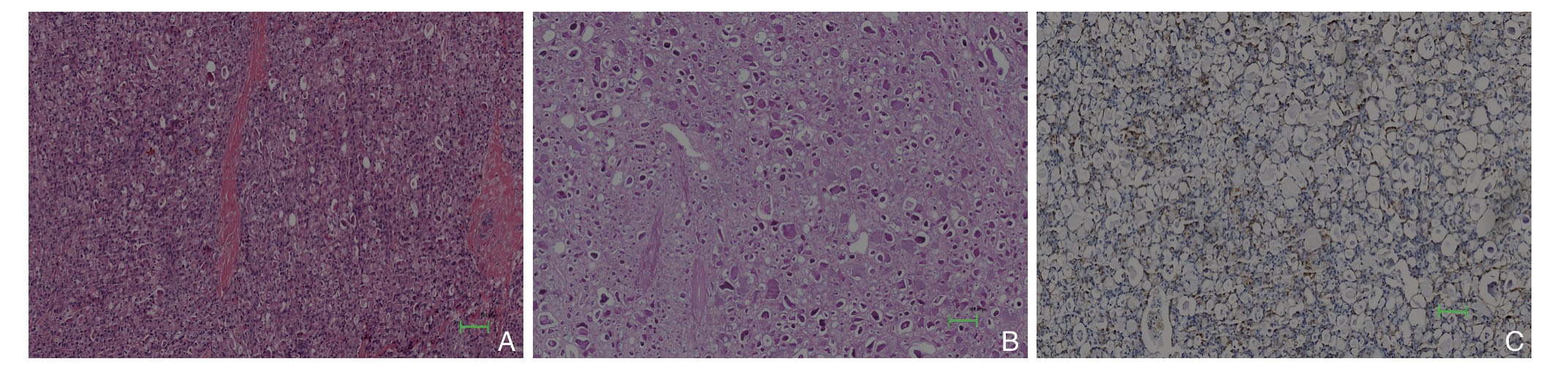
由于乳腺分泌型癌的临床表现和超声缺乏特异性,且临床上较少见,遂其诊断主要依赖组织病理检查。分泌型乳腺癌的组织学特点是肿瘤细胞排列成微囊、管状、实性片状结构,以不同比例混合存在,偶有乳头状、筛状结构。肿瘤细胞呈多角形,通常温和,异型性不明显,核染色质细,有时可见明显的小核仁,核分裂像不易见,具有丰富粉染或嗜双色胞质。肿瘤细胞内及细胞外常见丰富红染的嗜酸性分泌物,经过碘酸希夫染色(periodic acid-schiff,PAS)呈阳性,提示着肿瘤的分泌性特征,本例结果符合上述特征。免疫组化方面,大多数肿瘤细胞S-100蛋白阳性,ER、PR、HER-2均阴性[15],鉴于S-100蛋白在常见的乳腺浸润性导管癌和小叶癌中阴性,在其他少见及罕见类型的乳腺癌中亦极少阳性,因此可作为乳腺分泌型癌相对特异的诊断标记物,三阴型乳腺癌提示该肿瘤可能非激素依赖性,但也有激素受体阳性的病例报道[16]。大多数p53蛋白和Ki-67的低表达提示着该患者较好的预后。需要注意的是,该病需与导管内乳头状瘤、富脂质癌、黏液癌、印戒细胞癌、大汗腺癌、神经内分泌癌、腺泡细胞癌等相鉴别。
最近研究表明,乳腺分泌型癌分子遗传学具有特征性的改变,染色体t(12,15)的易位,导致出现ETV6-NTRK3融合基因[17-18],多达92%的乳腺分泌型癌中已被证实[19-22],但在其他类型乳腺癌中尚未被发现,具有特异性。位于12号染色体上的ETV6基因,编码E26转化特异性转录因子,产生ETV蛋白,在正常乳腺上皮细胞中表达。位于15号染色体上的NTRK3基因,编码位于包膜的酪氨酸激酶受体。当两个位点结合时,它们的基因融合编码一个嵌合酪氨酸激酶,该激酶通过激活Ras-Mek1和PI3K-Akt通路,对成纤维细胞和乳腺导管上皮细胞具有强大的转化活性[11,23]。所以有望对NTRK3酪氨酸激酶抑制剂进一步研究,发明新药物来治疗该疾病。
分泌型癌的治疗尚无统一意见,目前外科手术仍然是乳腺分泌型癌最基本的治疗手段。对于儿童和青少年,需综合考虑乳腺的发育情况,保证切除肿瘤的前提下尽可能的保留乳芽,同时行腋窝前哨淋巴结活检,为防止放射性肺纤维化及心肌病,不提倡术后行放疗;对于成人,可行单纯乳腺切除+腋窝前哨淋巴结活检或乳腺癌改良根治术。当成年患者肿瘤直径小于2 cm时,可行保乳手术,术后推荐常规进行放疗,能提高患者的总生存期[6]。辅助性化疗和放射治疗主要用于淋巴结阳性的患者[24-25]。关于辅助化疗的有效性,目前尚无可靠的数据。化疗可能导致潜在的生殖风险,但根据NCCN指南,即使是ER和PR阴性的乳腺癌(如小管癌、黏液癌)的一些有利的组织学结构也应作为典型乳腺癌进行治疗。一些作者推荐在淋巴结阳性患者中使用6个周期的环磷酰胺。但也有文献报道已经发生远处转移的患者无论是单独还是联合应用化疗药物都无法控制肿瘤进展[19,26]。
对于HER-2阳性的乳腺分泌性癌患者,Diallo等[27]研究显示HER-2的表达与乳腺分泌型癌的预后无关,同样性激素受体的表达与预后的关系也不明确,所以即使对于相应受体阳性的患者,也无证据支持对应治疗。但在NCDB的综述中发现[5],乳腺分泌型癌激素受体阳性,使用激素治疗结果与浸润性导管癌相似。本例患者年龄55岁,肿瘤大小3.0 cm,且无保乳意愿,经与患方充分沟通后,给予右乳癌改良根治术,术后EC方案化疗4次,未行放疗,因HER-2阴性,无靶向治疗指征,ER弱阳性,根据临床经验,有内分泌治疗指征,遂予三苯氧胺口服至今。
分泌型乳腺癌预后较好,Horowitz 等[6]将5年的致因特异性生存率(CSS)描述为94.4%(95% CI=89.1%~99.7%),10年的致因特异性生存率(CSS)描述为91.4%(95%CI=83.3%~99.5%)。个别乳腺分泌型癌有局部复发,大多数复发发生在首次表现后10~20年之间。转移虽然罕见,但也有少数腋下淋巴结转移的报道,主要为成人,其转移率小于30%,如有转移一般不超过4枚[28]。若肿瘤是多中心,直径大于2.0 cm,浸润性边界和大于3个淋巴结转移灶,提示预后较差,远处转移风险增加[29]。本例患者淋巴结未见转移,术后随访至2019年3月未见复发转移,预后良好。
综上所述,分泌型乳腺癌较少见,临床表现和超声有一定特征性,但缺乏特异性,最终确诊依靠组织病理。目前治疗尚无统一意见,但仍以手术治疗为主,术后病理常PAS染色呈阳性为其特征性表现,该病预后良好,但也有局部复发的可能,术后辅助治疗应根据患者病情选择个体化方案,建议患者进行至少20年的长期随访。
[1]中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2013版)[J].中国癌症杂志,2013,23(8):637–684.
Committee of Breast Cancer Society of Chinese Anti-Cancer Association.Guidelines and standards for diagnosis and treatment of breast cancer of the Chinese Anti-Cancer Association (2013 edition)[J].China Oncology,2013,23(8):637–684.
[2]McDivitt RW,Stewart FW.Breast carcinoma in children[J].JAMA,1966,195(5):388–390.
[3]Tavassoli FA,Norris HJ.Secretory carcinoma of the breast[J].Cancer,1980,45(9):2404–2413.doi:10.1002/1097–0142(19800501)45:9<2404::aid-cncr2820450928 >3.0.co;2–8.
[4]Cabello C,Alvarenga M,Alvarenga CA,et al.Case report and review of the literature:secretory breast cancer in a 13-yearold boy-10 years of follow up[J].Breast Cancer Res Treat,2012,133(3):813–820.doi:10.1007/s10549–011-1869–4.
[5]Jacob JD,Hodge C,Franko J,et al.Rare breast cancer:246 invasive secretory carcinomas from the National Cancer Data Base[J].J Surg Oncol,2016,113(7):721–725.doi:10.1002/jso.24241.
[6]Horowitz DP,Sharma CS,Connolly E,et al.Secretory carcinoma of the breast:results from the survival,epidemiology and end results database[J].Breast,2012,21(3):350–353.doi:10.1016/j.breast.2012.02.013.
[7]Ghilli M,Mariniello MD,Scatena C,et al.Male secretory breast cancer case in a 6-year-old boy with a peculiar gene duplication and review of the literature[J].Breast Cancer Res Treat,2018,170(3):445–454.doi:10.1007/s10549–018-4772–4.
[8]Kulkarni MM,Khandeparkar SG,Joshi AR,et al.A rare case of multicentric secretory carcinoma of breast in an adult female with review of literature[J].Indian J Pathol Microbiol,2016,59(2):209–211.doi:10.4103/0377–4929.182021.
[9]Gabal S,Talaat S.Secretory carcinoma of male breast:case report and review of the literature[J].Int J Breast Cancer,2011,2011:704657.doi:10.4061/2011/704657.
[10]Wang YQ,Wang Y,Zhang JH,et al.Secretory breast carcinoma in a 12-year-old girl:a case report[J].Oncol Lett,2014,8(4):1635–1637.doi:10.3892/ol.2014.2380.
[11]Vasudev P,Onuma K.Secretory breast carcinoma:unique,triple-negative carcinoma with a favorable prognosis and characteristic molecular expression[J].Arch Pathol Lab Med,2011,135(12):1606–1610.doi:10.5858/arpa.2010–0351-RS.
[12]Mun SH,Ko EY,Han BK,et al.Secretory carcinoma of the breast:sonographic features[J].J Ultrasound Med,2008,27(6):947–954.doi:10.7863/jum.2008.27.6.947.
[13]曾群英,汤兵辉,雷秋模等.乳腺分泌型癌的超声征象及病理特征分析[J].中国当代医药,2014,21(31):105–108.
Zeng QY,Tang BH,Lei QM,et al.Ultrasonographic features and pathological features analysis of the breast with secretory carcinoma[J].China Modern Medicine,2014,21(31):105–108.
[14]杨汉卿,姚伟根,黄国来,等.乳腺分泌性癌影像表现一例[J].中华放射学杂志,2015,49(8):634–635.doi:10.3760/cma.j.issn.1005–1201.2015.08.023.doi:10.3760/cma.j.issn.1005–1201.2015.08.023.
Yang HQ,Yao WG,Huang GL,et al.Imaging manifestations of one case of secretory breast carcinoma[J].Chinese Journal of Radiology,2015,49(8):634–635.doi:10.3760/cma.j.issn.1005–1201.2015.08.023.
[15]Li D,Xiao X,Yang W,et al.Secretory breast carcinoma:a clinicopathological and immunophenotypic study of 15cases with a review of the literature[J].Mod Pathol,2012,25(4):567–575.doi:10.1038/modpathol.2011.190.
[16]Lee SG,Jung SP,Lee HY,et al.Secretory breast carcinoma:a report of three cases and a review of the literature[J].Oncol Lett,2014,8(2):683–686.doi:10.3892/ol.2014.2213.
[17]Tognon C,Knezevich SR,Huntsman D et al.Expression of the ETV6–NTRK3 gene fusion as a primary event in human secretory breast carcinoma[J].Cancer Cell,2002,2(5):367–376.doi:10.1016/s1535–6108(02)00180–0.
[18]Li G,Zhong X,Yao J,et al.Secretory breast carcinoma in a 41-year-old man with long-term follow-up:a special report[J].Fut Oncol,2015,11(12):1767–1773.doi:10.2217/fon.15.60.
[19]Arce C,Cortes-Padilla D,Huntsman DG,et al.Secretory carcinoma of the breast containing the ETV6-NTRK3 fusion gene in a male:case report and review of the literature[J].World J Surg Oncol,2005,3:35.doi:10.1186/1477–7819-3–35.
[20]Laé M,Fréneaux P,Sastre-Garau X,et al.Secretory breast carcinomas with ETV6-NTRK3 fusion gene belong to the basallike carcinoma spectrum[J].Mod Pathol,2009,22(2):291–298.doi:10.1038/modpathol.2008.184.
[21]Yorozuya K,Takahashi E,Kousaka J,et al.A case of estrogen receptor positive secretory carcinoma in a 9-year-old girl with ETV6–NTRK3 fusion gene[J].Jpn J Clin Oncol,2012,42(3):208–211.doi:10.1093/jjco/hyr187.
[22]Krings G,Joseph NM,Bean GR,et al.Genomic profiling of breast secretory carcinomas reveals distinct genetics from other breast cancers and similarity to mammary analog secretory carcinomas[J].Mod Pathol,2017,30(8):1086–1099.doi:10.1038/modpathol.2017.32.
[23]Tognon C,Gamett M,Kenward E,et al.The chimeric protein tyrosine kinase ETV6-NTRK3 requires both Ras-Erk1/2 and PI3-kinase-Akt signaling for fibroblast transformation[J].Cancer Res,2001,61(24):8909–8916.
[24]王振宇,徐景伟,孙欠欠,等.乳腺分泌性癌一例[J].中华乳腺病杂志:电子版,2016,10(3):189–191.doi:10.3877/cma.j.issn.1674–0807.2016.03.019.
Wang ZY,Xu JW,Sun QQ,et al.Secretory breast carcinoma in one case[J].Chinese Journal of Breast Disease:Electronic Version,2016,10(3):189–191.doi:10.3877/cma.j.issn.1674–0807.2016.03.019.
[25]Cadoo KA,McArdle O,O’Shea AM,et al.Management of unusual histological types of breast cancer[J].Oncologist,2012,17(9):1135–1145.doi:10.1634/theoncologist.2012–0134.
[26]Herz H,Cooke B,Goldstein D.Metastatic secretory breast cancer.Non-responsiveness to chemotherapy:case report and review of the literature[J].Ann Oncol,2000,11(10):1343–1347.doi:10.1023/a:1008387800525.
[27]Diallo R,Schaefer KL,Bankfalvi A,et al.Secretory carcinoma of the breast:a distinct variant of invasive ductal carcinoma assessed by comparative genomic hybridization and immunohistochemistry[J].Hum Pathol,2003,34(12):1299–1305.doi:10.1016/S0046–8177(03)00423–4.
[28]Iglesias B,Monteagudo B,Rocco JS,et al.Secretory breast carcinoma in a 63-year-old man[J].J Cutan Pathol,2009,36(Suppl 1):86–88.doi:10.1111/j.1600–0560.2008.01240.x.
[29]Garlick JW,Olson KA,Downs-Kelly E,et al.Secretory breast carcinoma in an 8-year-old girl:A case report and literature review[J].Breast J,2018,24(6):1055–1061.doi:10.1111/tbj.13126.
