胆囊癌(gallbladder carcinoma,GBC)是消化系统中发病率第6位,病死率较高的恶性肿瘤[1-3]。近年来我国胆囊癌发病率呈上升趋势,每年新发病例数约5万例[3]。临床上对于胆囊癌的治疗首选根治性手术切除,由于该病早期无特异临床表现,发现较晚,发现时常伴局部及远端转移,随后病情发展迅速,预后极差,因此针对胆囊癌的放、化疗,分子靶向治疗等综合治疗逐渐成为胆囊癌的主要治疗手段[4]。随着化疗药物在实体肿瘤中的广泛应用,其在晚期胆囊癌治疗中起了一定作用[5-7]。目前胆囊癌的化疗方案以吉西他滨+铂类联合化疗为主[8],尽管化疗可增加肿瘤的可切除性和生存率,然而中位生存期仍不足15个月[9],因此,寻找新的治疗手段对胆囊癌的防治有重要的临床意义。
近年来,分子靶向治疗利用特异性阻断剂干扰肿瘤细胞表达的某种信号分子,抑制肿瘤生长和侵袭,从而达到肿瘤治疗效果,如用于治疗胃癌的阿帕替尼[10]、治疗甲状腺癌的仑伐替尼[11]在临床实验中都取得了很好的疗效。目前已知与胆囊癌相关的靶点有血管内皮生长因子(VEGF)和表皮生长因子受体(EGFR)家族等,针对这些靶点已有吉非替尼,厄洛替尼,贝伐珠单抗等靶向药物进入临床研究,但治疗效果良莠不齐[4,12]。吡咯替尼(pyrotinib)是在我国新批准上市用于治疗人表皮生长因子受体2(ErbB2,也称HER-2)阳性乳腺癌的靶向化疗药物,该药通过结合并抑制ErbB2的靶点,进一步引起下游信号通路的改变抑制肿瘤细胞生长[13-14],但目前该药物在胆囊癌中的应用国内、外尚无研究报道。随着二代基因测序技术发展,大量研究报道了胆囊癌组织存在ErbB2基因的异常表达,在此基础上,有实验研究对胆囊癌NOZ和SGC-996等细胞系进行该基因沉默表达,结果发现肿瘤细胞的生长受到抑制[12,15-17],这些数据显示了ErbB2的致癌潜力,在细胞实验水平靶向减少该基因的表达,可初步抑制肿瘤细胞的生长,因此本研究探讨吡咯替尼对胆囊癌细胞株的杀伤作用,并为进一步研究其可能作用机制。
1 材料与方法
1.1 实验材料
吡咯替尼原药由江苏恒瑞股份有限公司提供。二甲基亚砜(dimethyl sulfoxide,DMSO)购于生工生物工程(上海)股份有限公司。为进行体外研究,先将吡咯替尼溶解在DMSO中,生成浓度为100 mmol/L的储备液。对于工作液浓度,是将药物储备溶液用培养基进一步稀释产生。对照组是用等体积的DMSO处理。最终处理组和对照组需保持细胞培养基中DMSO浓度在0.1%以下。磷酸盐缓冲液(phosphate-buffered saline,PBS)、胎牛血清(fetal bovine serum,FBS)、高糖型Dulbecco's modified eagle medium(DMEM)培养基购于Gbico公司,penicillin-streptomycin双抗购于Hyclone公司,0.25%EDTA胰酶购于苏州新赛美生物科技有限公司,Transwell小室含和不含基质胶型均购于上海百赛生物技术公司,Cell Counting Kit-8(CCK-8试剂盒)购于上海翊圣生物科技有限公司,Annexin V-FITC细胞凋亡检测试剂盒、SDS(sodium dodecyl sulfate)-page快速配胶盒、BCA蛋白浓度测定试剂盒均购于上海碧云天生物技术公司。Bcl-2、Bax、cleaved-caspase 9、cleaved-caspase 3、cleaved-PARP和二抗(山羊抗兔)购自Cell Signaling Technology公司。
1.2 实验方法
1.2.1 细胞培养 用于本研究的NOZ和SGC-996胆囊癌细胞株由上海交通大学医学院附属新华医院普外科实验室保存,两种细胞系均在DMEM高糖型培养基中培养,该培养基中添加了10%的胎牛血清,100 μg/mL链霉素和100 U/mL青霉素。所有细胞均在37 ℃,含5% CO2的细胞培养箱环境中培养。
1.2.2 细胞活力和毒性实验 对于细胞活力的测定,按照CCK-8试剂制造商的操作说明进检测。取处于对数生长期的NOZ、SGC-996细胞,0.25% EDTA胰酶消化离心,重悬计数后,将细胞铺于96孔板中,每孔细胞数2×103个。在96孔板中处理组共设6个组,工作液终浓度分别为0、1、2、4、6、8 μmol/L 的吡咯替尼处理 24、48、72 h,用含浓度为0.1%的DMSO溶媒作为对照组,每个分组设置3个副孔。处理相应时间后,将10 μL CCK-8试剂添加到每个孔中,并在37 ℃下避光进一步孵育4 h,随后通过酶标仪(Bio-Tek,Winooski,VT,USA)测定在450 nm波长处吸光度值(OD),算得细胞存活率和25%(IC50)、50%(IC50)、75%(IC75)抑制浓度。细胞存活率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)。
1.2.3 克隆形成实验 根据CCK-8实验测结果,选取最适时间下吡咯替尼对两种细胞相应的IC50、IC50、IC75抑制浓度作为后续实验的处理浓度。对于平板克隆实验,将处于对数生长期的NOZ细胞和SGC-996细胞接种在6孔板中,每孔1×104个细胞,用上述浓度的吡咯替尼处理细胞,置于37 ℃,5% CO2培养箱中孵育48 h后,PBS洗涤2遍,胰酶消化离心,重悬计数,接种于新鲜培养基覆盖的6孔板中,每孔接种500个细胞,连续培养14 d,弃去培养基,PBS洗涤后用4%多聚甲醛固定,随后0.1%结晶紫染色,最后拍照计数,处理图片数据。
1.2.4 迁移侵袭实验 取对数期生长的NOZ和SGC-996细胞,胰酶消化离心,重悬计数后接种在6孔板中,待细胞长到融合度为70%左右时用前述浓度处理细胞12 h后,弃去培养基,胰酶消化离心,重悬计数细胞,将1×105个NOZ和SGC-996细胞接种在装有200 μL的无血清培养基Transwell(8.0 μm孔径)的上室(迁移实验Transwell小室上室底不含基质胶,侵袭实验Transwell小室上室底含基质胶)中培养。下室盛有300 μL含10%FBS的DMEM高糖培养基,置于培养箱中孵育24 h后,甲醇固定,并用结晶紫染色后在荧光显微镜下观察拍照,每组小室随机选择3个区域进行拍照定量分析。
1.2.5 流式细胞仪检测细胞凋亡率 用吡咯替尼处理NOZ、SGC-996细胞(处理浓度如前所述)48 h以评估细胞凋亡率,孵育结束后,培养基连同PBS洗涤1次后的液体一并与胰酶消化后细胞收集起来1 000 r/min离心5 min,再用PBS洗涤一遍离心后弃上清,随后加入195 μL Annexin V结合液,5 μL Annexin V-FITC和10 μL碘化丙啶混匀,室温下避光孵育20 min,上机检测。
1.2.6 Western blot分析 NOZ和SGC-996细胞用吡咯替尼按前述浓度处理48 h后,用预混蛋白酶抑制剂的细胞裂解液提取总蛋白,超声10 s,4 ℃,14 000 r/min 离心10 min,用BCA蛋白浓度试剂盒测定蛋白浓度。每组40 μg蛋白样品加入上样孔,在SDS-PAGE凝胶电泳分离总蛋白,随后转移到PVDF膜上,在室温下用5%脱脂牛奶封闭1 h。随后将膜与Bax、Bcl-2、cleaved-caspase 3、cleaved-caspase 9、cleaved-PARP、及内参抗体tubulin(1:2 000)4 ℃孵育过夜。后将膜与相应二抗在室温下孵育1 h,洗膜后进行化学发光显像分析。
1.3 统计学处理
每个实验均重复3次,统计资料结果均以平均值±标准差表示。t检验用于比较处理组和对照组之间的差异,单因素方差分析用于多组间比较,P<0.05被认为具有统计学意义。使用 SPSS 20.0软件进行统计分析,利用Graphpad软件及Image J软件进行图片处理。
2 结 果
2.1 吡咯替尼抑制胆囊癌细胞增殖
用CCK-8实验检测吡咯替尼对NOZ、SGC-996细胞活力的影响。结果显示。用吡咯替尼处理24、48、72 h后的NOZ、SGC-996细胞的活力随处理浓度增加,细胞活力逐渐下降,同时随着吡咯替尼作用时间延长,细胞活力呈明显下降趋势(图1)。在加药后48 h,细胞抑制率随加药浓度升高从20%升高到70%;对于NOZ和SGC-996细胞在24、48、72 h的IC50分别为11.5、3.6、1.4 μmol/L和5.5、5.2、2.4 μmol/L。按既定方案,后续实验处理NOZ细胞的药物浓度为1、3.5、12 μmol/L;处理SGC-996细胞的药物浓度为2.5、5、10 μmol/L。
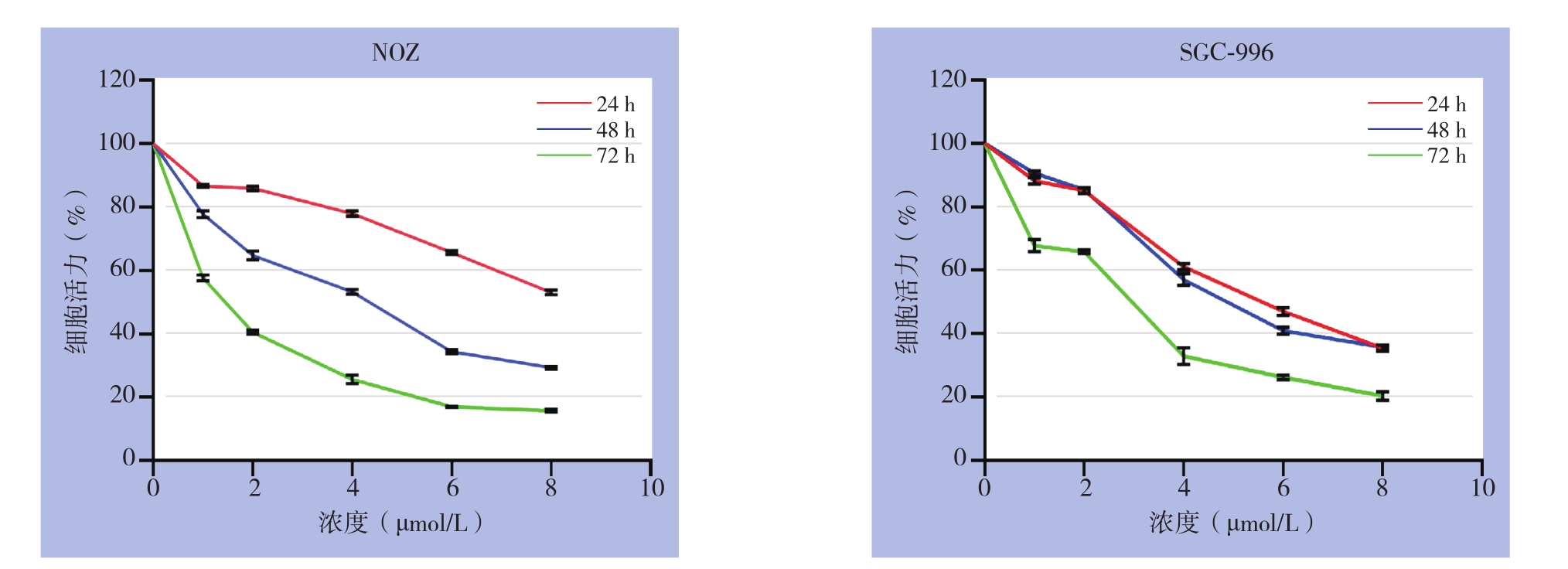
图1 吡咯替尼对胆囊癌NOZ、SGC-996细胞的抑制的时间、浓度效应
Figure 1 The time and concentration inhibitory effect of pyrotinib on gallbladder cancer cells
2.2 吡咯替尼对胆囊癌细胞克隆形成能力的影响
进行克隆形成实验以测定单细胞增殖能力。结果显示,吡咯替尼处理48 h更换正常培养基继续培养14 d后引起胆囊癌细胞集落形成能力呈现浓度依赖性降低,此外,各浓度吡咯替尼处理处理组中形成的集落数量和大小均明显小于对照组(均P<0.05)(图2)。
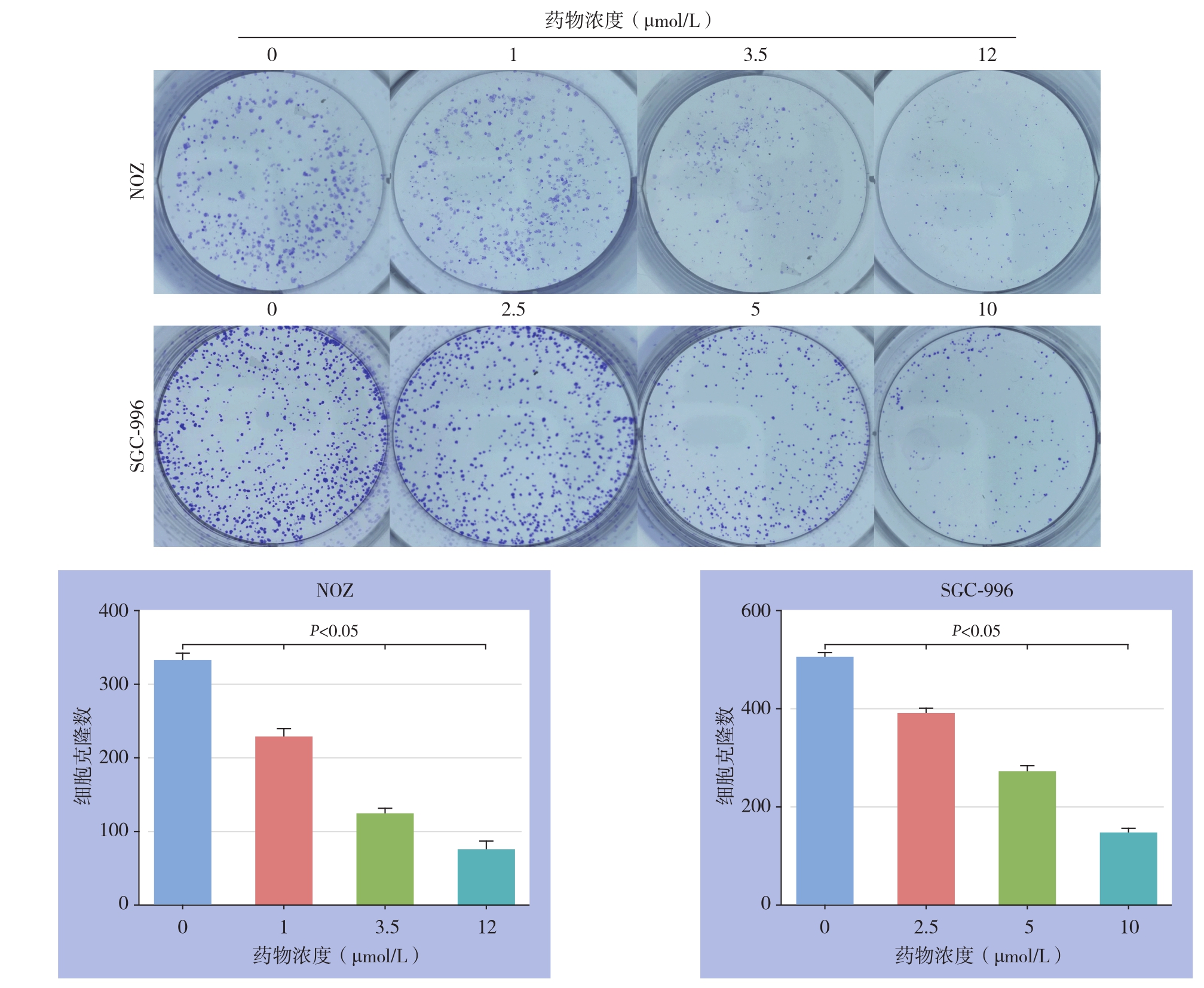
图2 吡咯替尼对胆囊癌NOZ、SGC-996细胞克隆形成的抑制作用
Figure 2 Inhibitory effects of pyrotinib on clone formation abilities of gallbladder cancer NOZ and SGC-996 cells
2.3 吡咯替尼对胆囊癌细胞侵袭和迁移能力的抑制作用
Transwell小室实验分析结果显示,与对照组相比,用吡咯替尼处理12 h后,穿过带基质胶和不带基质胶的Transwell小室膜的细胞数随处理浓度增加而减少(均P<0.05)(图3)。
2.4 吡咯替尼诱导胆囊癌细胞发生凋亡
为探讨吡咯替尼对胆囊癌细胞凋亡的影响,用前述浓度处理胆囊癌细胞NOZ、SGC-996 48 h后,使用流式细胞仪分析了细胞凋亡率。结果显示,在双参数散点图中,LL象限代表活细胞,LR和UR象限分别代表早期凋亡和晚期凋亡细胞。随着吡咯替尼处理浓度的增加,存活的细胞百分比减少,而早期凋亡和晚期凋亡的细胞数均增加(均P<0.05)(图4)。
为了进一步研究吡咯替尼诱导细胞凋亡的机制,通过Western blot检测了caspase家族,Bcl-2家族和其他在凋亡过程中期起关键作用的重要蛋白表达,结果表明,吡咯替尼增加了cleavedcaspase 3、cleaved-caspase 9、cleaved-PARP和Bax的表达,同时降低了抗凋亡蛋白Bcl-2的表达。此外,Bcl-2与Bax的比例呈浓度依赖性降低趋势(均P<0.05)(图5)
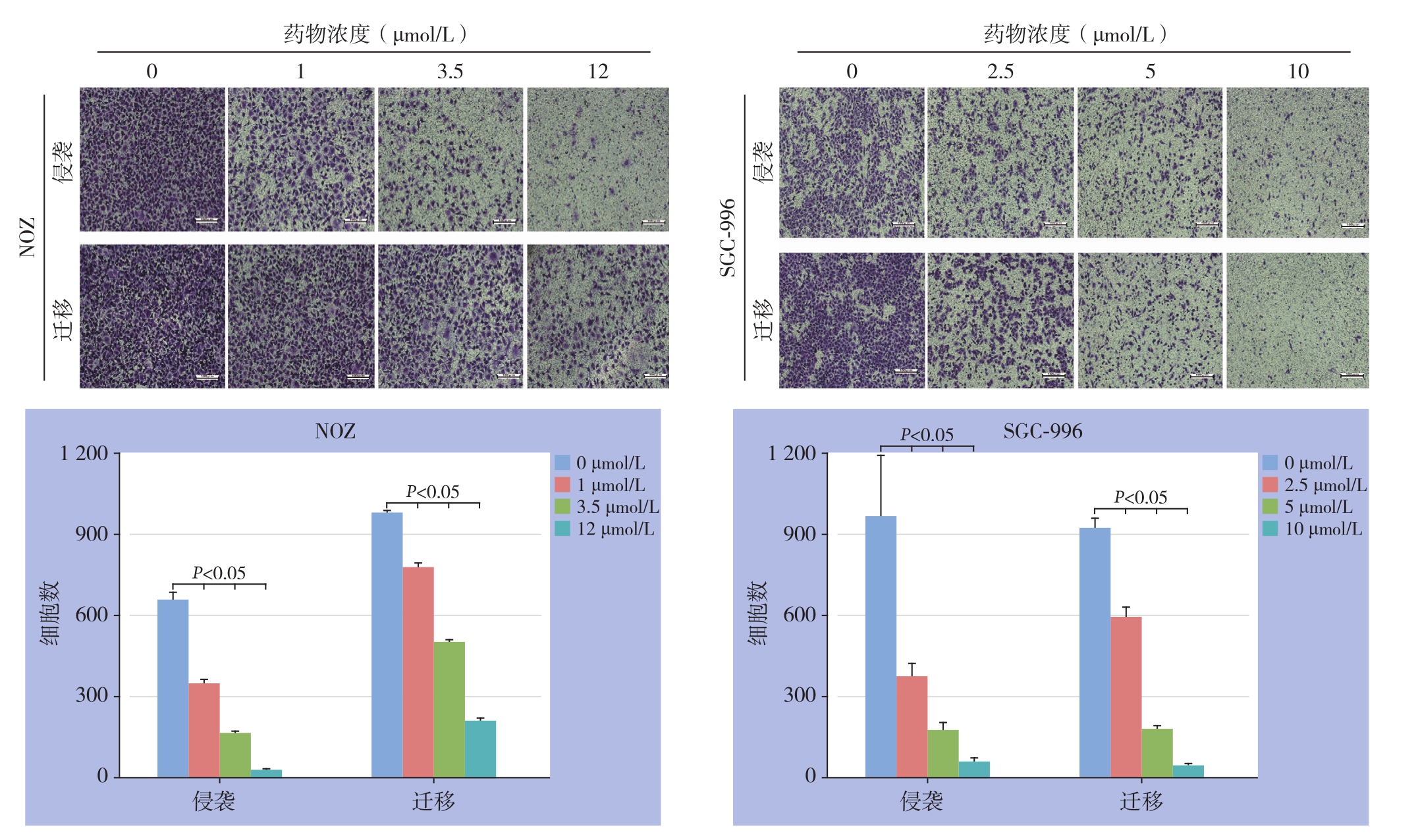
图3 吡咯替尼对胆囊癌NOZ、SGC-996细胞侵袭和迁移影响
Figure 3 Effects of pyrotinib on invasion and migration of gallbladder cancer NOZ and SGC-996 cells
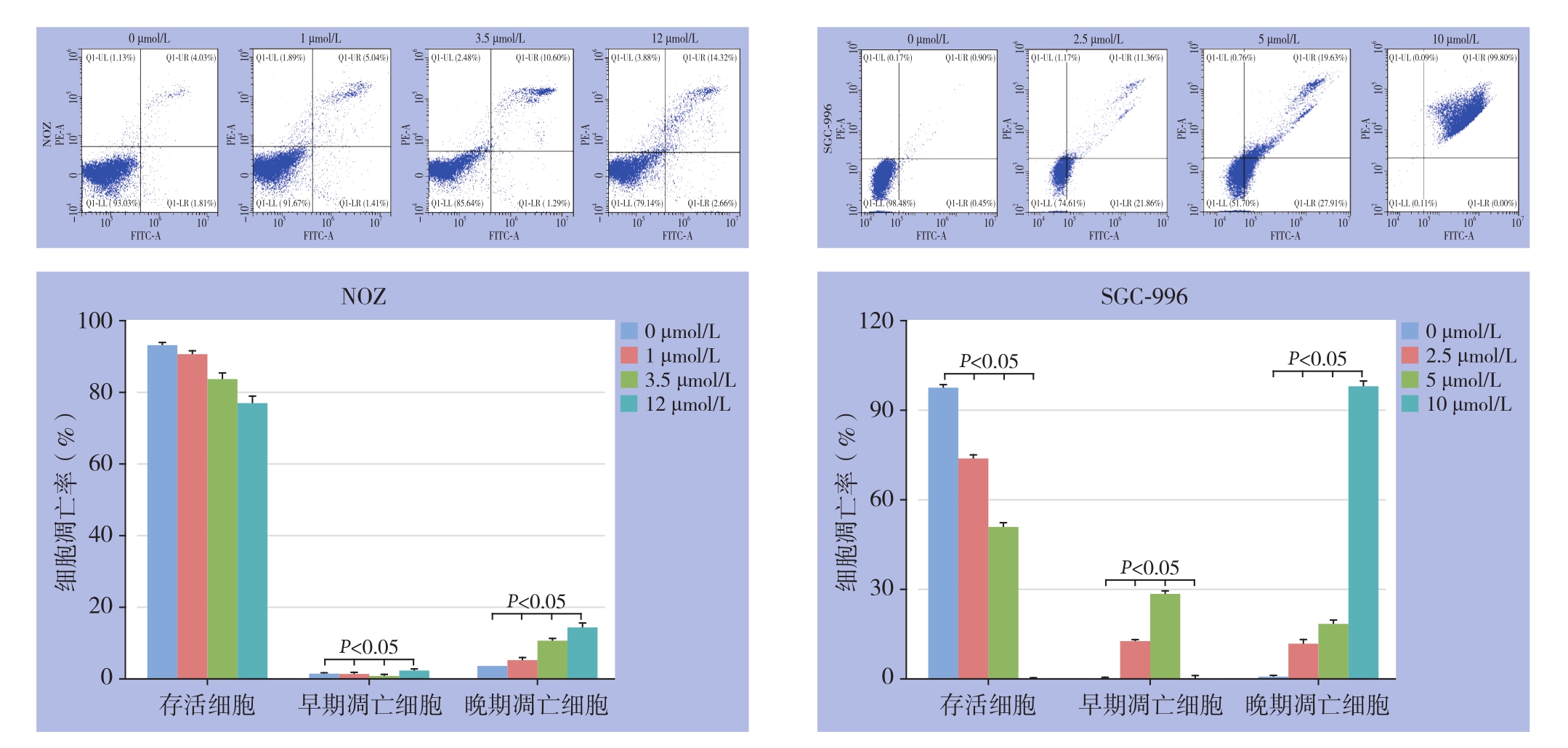
图4 流式分析吡咯替尼对胆囊癌NOZ、SGC-996细胞凋亡的影响
Figure 4 Flow cytometric analyzing the effects of pyrotinib on the apoptosis of gallbladder cancer NOZ and SGC-996 cells
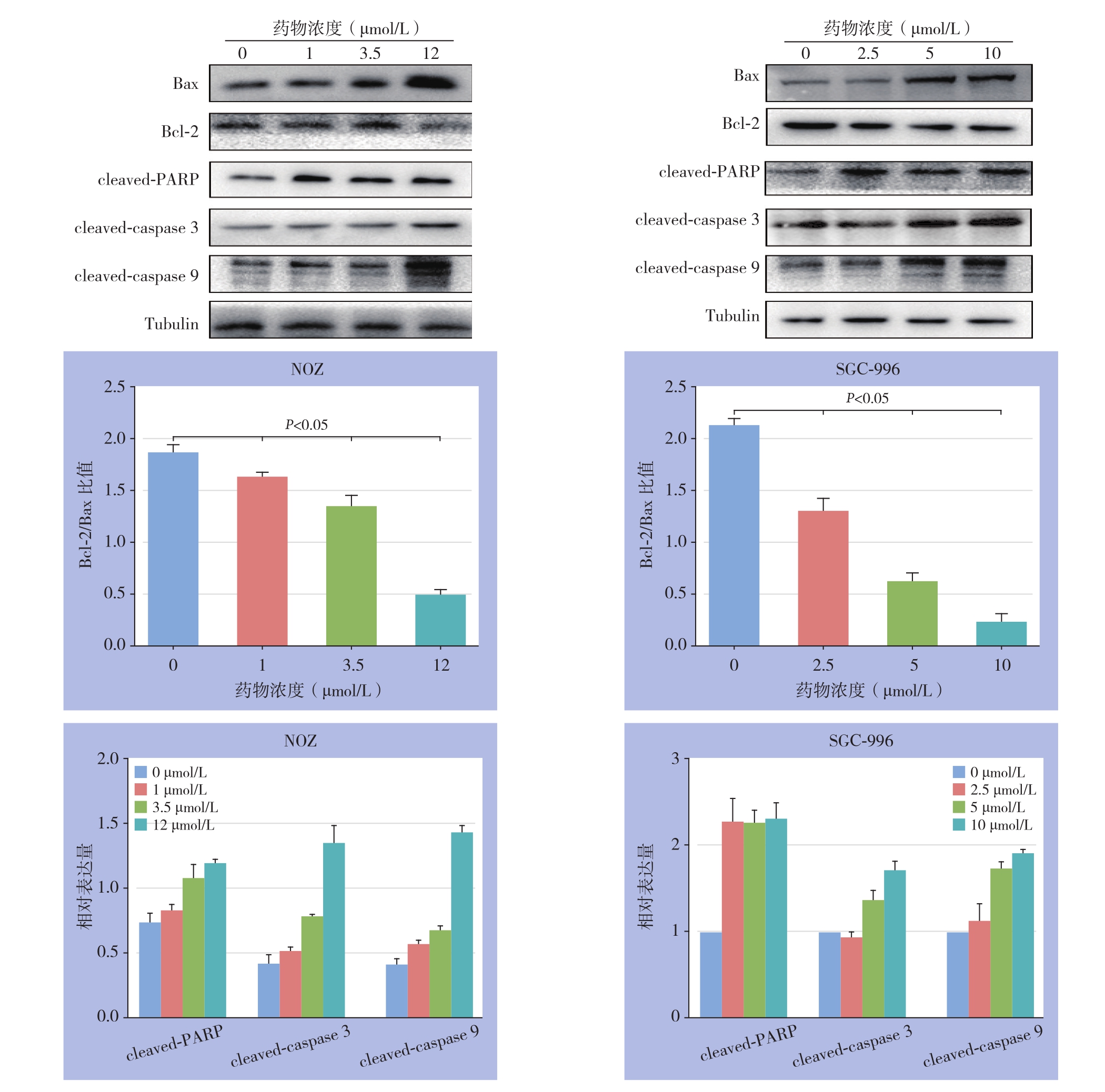
图5 Western blo检测吡咯替尼对胆囊癌NOZ、SGC-996细胞凋亡相关蛋白表达的影响
Figure 5 Western blot analyzing the effects of pyrotinib on the expressions of the apoptosis-related proteins in gallbladder cancer NOZ and SGC-996 cells
3 讨 论
迄今为止发现的与胆囊恶性肿瘤相关的癌基因有KRAS、TP53、Myc、ErbB2等[15-16,18],相关的信号通路有ErbB、angiogenesis、Hedgehog、PI3K/Akt/mTOR、MAPK/ERK[12,19-21]等,这些癌基因和相关信号通路及关键分子的异常表达和调控紊乱,参与了胆囊癌的发生与发展。其中又以ErbB家族及其信号通路的研究报道较多。ErbB家族一共包含了EGFR、ErbB2、HER-3及HER-4该4个酪氨酸激酶受体,这些受体与相应配体结合后,引起下游基因突变或扩增,调控细胞增殖、迁移、凋亡等[12,22]。现有报道称20%的非小细胞肺癌存在EGFR突变,大约有20%的乳腺癌患者存在ErbB2基因的扩增[22],而针对胆囊癌进行的基因检测及全外显子测序[12,15-17,23-24]结果显示ErbB2基因有扩增突变,引起ErbB信号通路改变,促进肿瘤的发生[16],这些异常的基因改变使之成为疾病不良预后的关键分子和治疗靶点。
因此,随着分子靶向治疗策略的提出,靶向治疗药物被大量开发,广泛应用于多种实体瘤中的治疗。如针对于肿瘤血管生成和细胞增殖的多靶点酪氨酸激酶受体抑制剂仑伐替尼在原发性肝癌和甲状腺癌中的应用,高选择性VEGFR-2激酶抑制剂阿帕替尼在胃癌中的应用,靶向小分子蛋白激酶抑制剂奥斯替尼用于转移性非小细胞肺癌一线治疗,以及ErbB2抑制剂拉帕替尼在乳腺癌中的应用都取得了良好的临床效果[10,11,22,25-27]。小分子酪氨酸激酶抑制剂吡咯替尼,是我国新批准的用于治疗ErbB2阳性乳腺癌的靶向化疗药物,在目前的临床研究结果中,吡咯替尼表现出良好的耐受性、安全性[28],甚至有报道称临床疗效超过了拉帕替尼[29],为吡咯替尼在胆囊癌的应用提供了可能性。
在本研究中,用吡咯替尼处理胆囊癌细胞NOZ和SGC-996,随后CCK-8实验检测细胞活力和细胞增殖情况,结果说明吡咯替尼能够明显抑制胆囊癌细胞的活力,抑制效果因不同细胞系而有差异,如吡咯替尼抑制NOZ细胞系的效果随时间延长呈现平缓均匀的速度;对于SGC-996细胞系,用吡咯替尼处理前24、48 h的抑制效果变化不大,而到72 h抑制效果突然增加。接着进行的克隆形成实验进一步说明了吡咯替尼有抑制胆囊癌细胞增殖的作用,并且对NOZ细胞系的效果明显。出现以上结果可能原因是ErbB2的在该两种细胞中表达量不同。Transwell实验表明了吡咯替尼对胆囊癌细胞迁移和侵袭的抑制作用。
拉帕替尼在治疗ErbB2/HER-2阳性乳腺肿瘤时可诱导增强体外细胞凋亡[28]。细胞凋亡是由一些列基因的激活、表达和调控等作用引起细胞的程序性的死亡,该过程可维持细胞内环境的稳定,在调控肿瘤发生发展中起了非常重要的作用[30-32]。为此,我们用吡咯替尼处理胆囊癌细胞后进行流式分析,通过检测早期和晚期凋亡细胞率发现吡咯替尼可诱导胆囊癌细胞凋亡,并呈浓度依赖方式。凋亡的发生由多种通路途径控制,最常见凋亡通路核心分子家族成员是Bcl-2家族和caspase家族[33],细胞在发生凋亡时,Bax、cleaved-caspase 3、cleaved-caspase 9、cleaved-PARP表达增加,对细胞凋亡起到促进作用,而另一方面,抗凋亡蛋白Bcl-2表达会降低[34-35],事实也是如此,本研究通过Western blot分析最后得到的蛋白条带变化与既往研究一致,即随着吡咯替尼处理胆囊癌NOZ、SGC-996细胞系浓度增加,Bcl-2蛋白表达量降低,Bax蛋白表达量上调,Bcl-2/Bax比值明显减小,相对的,cleaved-caspase 3、cleavedcaspase 9、cleaved-PARP蛋白表达量显著增加。以上研究结果显示,吡咯替尼可以促进胆囊癌细胞发生凋亡,其机制与诱导凋亡途径相关蛋白表达和抑制抗凋亡蛋白表达有关。
综上,吡咯替尼能够通过增加凋亡蛋白表达,抑制抗凋亡蛋白表达促进细胞凋亡来发挥对胆囊癌细胞株NOZ、SGC-996的杀伤作用,为胆囊癌的治疗提供了新的选择及一定的实验基础。但该药对临床胆囊癌患者疗效及安全性尚待进一步的研究,随着后期体内及临床试验的开展,可进一步评估该药物对胆囊癌患者的靶向治疗作用,并可能最终改善胆囊癌患者预后。
[1] 周少波, 靳浩.乙酰肝素酶与多配体蛋白聚糖1在胆囊癌细胞中表达的关系及意义[J].中国普通外科杂志, 2018, 27(9):1192-1197.doi:10.7659/j.issn.1005-6947.2018.09.017.Zhou SB, Jin H.Relationship of expression of heparanase and syndecan1 in gallbladder cancer cells and the significance[J].Chinese Journal of General Surgery, 2018, 27(9):1192-1197.doi:10.7659/j.issn.1005-6947.2018.09.017.
[2] 中华医学会外科学分会胆道外科学组.胆囊癌诊断和治疗指南(2015版)[J].临床肝胆病杂志, 2016, 32(3):411-419.doi:10.3969/j.issn.1001-5256.2016.03.002.Biliary Surgery Group of Surgery Branch of Chinese.Guideline for the diagnosis and treatment of gallbladder carcinoma (2015 edition) [J].Journal of Clinical Hepatology, 2016, 32(3):411-419.doi:10.3969/j.issn.1001-5256.2016.03.002.
[3] Chen W, Zheng R, Baade PD, et al.Cancer statistics in China,2015[J].CA Cancer J Clin, 2016, 66(2):115-132.doi: 10.3322/caac.21338.
[4] 刘立业, 仝林虎.胆囊癌治疗的研究进展[J].中国普通外科杂志,2018, 27(8):1048-1053.doi:10.3978/j.issn.1005-6947.2018.08.015.Liu LY, Tong LH.Progress in the treatment of gallbladder carcinoma[J].Chinese Journal of General Surgery, 2018,27(8):1048-1053.doi:10.3978/j.issn.1005-6947.2018.08.015.
[5] Takada T, Amano H, Yasuda H, et al.Is postoperative adjuvant chemotherapy useful for gallbladder carcinoma? A phase III multicenter prospective randomized controlled trial in patients with resected pancreaticobiliary carcinoma[J].Cancer, 2002, 95(8):1685-1695.doi: 10.1002/cncr.10831.
[6] Hickman L, Contreras C.Gallbladder Cancer: Diagnosis, Surgical Management, and Adjuvant Therapies[J].Surg Clin North Am,2019, 99(2):337-355.doi: 10.1016/j.suc.2018.12.008.
[7] Hakeem AR, Papoulas M, Menon KV.The role of neoadjuvant chemotherapy or chemoradiotherapy for advanced gallbladder cancer - A systematic review[J].Eur J Surg Oncol, 2019, 45(2):83-91.doi: 10.1016/j.ejso.2018.08.020.
[8] Shukla SK, Singh G, Shahi KS, et al.Staging, Treatment, and Future Approaches of Gallbladder Carcinoma[J].J Gastrointest Cancer, 2018, 49(1):9-15.doi: 10.1007/s12029-017-0036-5.
[9] Creasy JM, Goldman DA, Dudeja V, et al.Systemic Chemotherapy Combined with Resection for Locally Advanced Gallbladder Carcinoma: Surgical and Survival Outcomes[J].J Am Coll Surg,2017, 224(5):906-916.doi: 10.1016/j.jamcollsurg.2016.12.058.
[10] Geng R, Song L, Li J, et al.The safety of apatinib for the treatment of gastric cancer[J].Expert Opin Drug Saf, 2018, 17(11):1145-1150.doi: 10.1080/14740338.2018.1535592.
[11] Suyama K, Iwase H.Lenvatinib: A Promising Molecular Targeted Agent for Multiple Cancers[J].Cancer Control, 2018,25(1):1073274818789361.doi: 10.1177/1073274818789361.
[12] 周勇, 谭晶.ErbB信号通路及其对胆囊癌靶向治疗的研究进展[J].中国肿瘤生物治疗杂志, 2017, 24(4):447-452.doi:10.3872/j.issn.1007-385X.2017.04.019.Zhou Y, Tan J.ErbB signaling pathway and its targeted therapy in gallbladder cancer[J].Chinese Journal of Cancer Biotherapy, 2017,24(4):447-452.doi:10.3872/j.issn.1007-385X.2017.04.019.
[13] 张美玲, 潘家东.吡洛替尼治疗曲妥珠耐药HER2阳性双侧乳腺癌1例[J].安徽卫生职业技术学院学报, 2019, 18(4):140-142.doi:10.3969/j.issn.1671-8054.2019.04.065.Zhang ML, Pan JD.One case report of trastuzumb-resistant her-2 positive bilateral breast cancer treated pyrotinib[J].Journal of Anhui Health Vocational & Technical College, 2019, 18(4):140-142.doi:10.3969/j.issn.1671-8054.2019.04.065.
[14] Li Q, Guan X, Chen S, et al.Safety, Efficacy, and Biomarker Analysis of Pyrotinib in Combination with Capecitabine in HER2-Positive Metastatic Breast Cancer Patients: A Phase I Clinical Trial[J].Clin Cancer Res, 2019, 25(17):5212-5220.doi:10.1158/1078-0432.CCR-18-4173.
[15] Li M, Liu F, Zhang F, et al.Genomic ERBB2/ERBB3 mutations promote PD-L1-mediated immune escape in gallbladder cancer: a whole-exome sequencing analysis[J].Gut, 2019, 68(6):1024-1033.doi: 10.1136/gutjnl-2018-316039.
[16] Iyer P, Shrikhande SV, Ranjan M, et al.ERBB2 and KRAS alterations mediate response to EGFR inhibitors in early stage gallbladder cancer[J].Int J Cancer, 2019, 144(8):2008-2019.doi:10.1002/ijc.31916.
[17] Li M, Zhang Z, Li X, et al.Whole-exome and targeted gene sequencing of gallbladder carcinoma identifies recurrent mutations in the ErbB pathway[J].Nat Genet, 2014, 46(8):872-876.doi:10.1038/ng.3030.
[18] Ishak G, Leal MF, Dos Santos NP, et al.Deregulation of MYC and TP53 through genetic and epigenetic alterations in gallbladder carcinomas[J].Clin Exp Med, 2015, 15(3):421-426.doi: 10.1007/s10238-014-0311-8.
[19] Xu D, Li J, Jiang F, et al.The Effect and Mechanism of Vascular Endothelial Growth Factor (VEGF) on Tumor Angiogenesis in Gallbladder Carcinoma[J].Iran J Public Health, 2019, 48(4):713-721.
[20] Xie F, Xu X, Xu A, et al.Aberrant activation of Sonic hedgehog signaling in chronic cholecystitis and gallbladder carcinoma[J].Hum Pathol, 2014, 45(3):513-521.doi: 10.1016/j.humpath.2013.10.017.
[21] Bizama C, García P, Espinoza JA, et al.Targeting specific molecular pathways holds promise for advanced gallbladder cancer therapy[J].Cancer Treat Rev, 2015, 41(3):222-234.doi: 10.1016/j.ctrv.2015.01.003.
[22] Roskoski R Jr.Small molecule inhibitors targeting the EGFR/ErbB family of protein-tyrosine kinases in human cancers[J].Pharmacol Res, 2019, 139:395-411.doi: 10.1016/j.phrs.2018.11.014.
[23] 王连刚, 张惠中.癌基因c-erbB-2在胆囊癌中的异常表达及意义[J].细胞与分子免疫学杂志, 1998, 14(2):105-106.doi:10.1088/0256-307X/15/3/016.Wang LG, Zhang HZ.Abnormal ecpression of oncogene c-erbB-2 in gallbladder carcinoma and the significance[J].Chinese Journal of Cellular and Molecular Immunology, 1998, 14(2):105-106.doi:10.1088/0256-307X/15/3/016.
[24] 李晓光, 王慧.破译胆囊癌基因突变图谱[J].中国细胞生物学学报, 2014, 36(9):1213-1217.doi: 10.11844/cjcb.2014.09.9001.Li XG, Wang H.Deciphering mutations in gallbladder cancer genes[J].Chinese Journal of Cell Biology, 2014, 36(9):1213-1217.doi: 10.11844/cjcb.2014.09.9001.
[25] Matsuki M, Hoshi T, Yamamoto Y, et al.Lenvatinib inhibits angiogenesis and tumor fibroblast growth factor signaling pathways in human hepatocellular carcinoma models[J].Cancer Med, 2018,7(6):2641-2653.doi: 10.1002/cam4.1517.
[26] Nair A, Lemery SJ, Yang J, et al.FDA Approval Summary:Lenvatinib for Progressive, Radio-iodine-Refractory Differentiated Thyroid Cancer[J].Clin Cancer Res, 2015, 21(23):5205-5208.doi:10.1158/1078-0432.CCR-15-1377.
[27] Roviello G, Ravelli A, Polom K, et al.Apatinib: A novel receptor tyrosine kinase inhibitor for the treatment of gastric cancer[J].Cancer Lett, 2016, 372(2):187-191.doi: 10.1016/j.canlet.2016.01.014.
[28] Xuhong JC, Qi XW, Zhang Y, et al.Mechanism, safety and efficacy of three tyrosine kinase inhibitors lapatinib, neratinib and pyrotinib in HER2-positive breast cancer[J].Am J Cancer Res, 2019,9(10):2103-2119.
[29] [No authors listed].Pyrotinib Tops Lapatinib in Metastatic Breast Cancer[J].Cancer Discov, 2019, 9(11):OF3.doi: 10.1158/2159-8290.CD-NB2019-109.
[30] Song XL, Zhang YJ, Wang XF, et al.Casticin induces apoptosis and G0/G1 cell cycle arrest in gallbladder cancer cells[J].Cancer Cell Int, 2017, 17:9.doi: 10.1186/s12935-016-0377-3.
[31] Bao R, Shu Y, Wu X, et al.Oridonin induces apoptosis and cell cycle arrest of gallbladder cancer cells via the mitochondrial pathway[J].BMC Cancer, 2014, 14:217.doi: 10.1186/1471-2407-14-217.
[32] Wang G, Zhuang J, Ni J, et al.Combined effects of Lenvatinib and iodine-131 on cell apoptosis in nasopharyngeal carcinoma through inducing endoplasmic reticulum stress[J].Exp Ther Med, 2018,16(4):3325-3332.doi: 10.3892/etm.2018.6652.
[33] Pistritto G, Trisciuoglio D, Ceci C, et al.Apoptosis as anticancer mechanism: function and dysfunction of its modulators and targeted therapeutic strategies[J].Aging (Albany NY), 2016, 8(4):603-619.doi: 10.18632/aging.100934.
[34] Peña-Blanco A, García-Sáez AJ.Bax, Bak and beyondmitochondrial performance in apoptosis[J].FEBS J, 2018,285(3):416-431.doi: 10.1111/febs.14186.
[35] Shalini S, Dorstyn L, Dawar S, et al.Old, new and emerging functions of caspases[J].Cell Death Differ, 2015, 22(4):526-539.doi: 10.1038/cdd.2014.216.
