胰十二指肠切除术(pancreaticoduodenectomy,PD)是可切除的胰头癌、壶腹癌、远端胆管癌和十二指肠癌的首选治疗方法[1]。手术操作复杂,创伤大,手术时间长,手术涉及除肝脏以外的右上腹大部分脏器切除,导致术后并发症发生率高达30%~40%[2];同时,由于患者术前常伴有营养不良、免疫功能异常,术后机体易出现严重应激反应和多器官障碍综合征[3],且易发生胰瘘[4]、胆瘘、出血、感染[5-6]、胃潴留等严重并发症[7-10],导致住院时间延长和治疗费用增加。因此围手术期改善患者的营养状态,减少术后并发症发生率,缩短住院时间是必要的。
近年来,人们越来越关注快速康复中“早期康复”的重要性[11-13],即在手术前优化身体状况,旨在改善术后效果。免疫营养[14-17]是通过给予营养物质调节失衡的免疫应答的治疗方法,其除治疗营养缺失外,还能以特定的方式刺激免疫细胞增强应答功能、调控细胞因子的产生和释放、减轻炎症反应、维持肠黏膜的屏障功能。严重的恶性肿瘤患者多处于重度应激反应状态并伴有严重的营养不良,免疫营养的应用为改善患者的机体状况提供了条件,但是术前免疫营养在胰腺癌患者中的作用仍然存在争议。经检索目前仅有1篇Meta分析文章[18]描述了免疫营养在PD患者中的应用,得出了使用免疫营养会减少感染性并发症发生率和缩短住院时间,应该在临床进一步推广的结论,但该文纳入文献只有4篇。本文基于此,共检索8个中英文数据库,再次采用Meta分析的方法,对PD患者术前免疫营养支持的可行性进行荟萃分析,为相关临床PD患者术前是否补充免疫营养提供参考依据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 纳入标准 ⑴ 研究类型:国内外公开发表对PD 患者术前免疫营养支持的随机对照试验(RCT),数据资料完整,无语言限制。⑵ 研究对象:所有行术前免疫营养支持的PD 患者,营养给予时间不限。⑶ 干预措施:试验组术前给予免疫营养支持,对照组给予常规营养。⑷ 结局指标:主要结局指标为感染性并发症发生率、非感染性并发症发生率、住院时间;次要结局指标为手术时间、术中失血量、术中输血率、伤口感染、腹腔脓肿、肺炎、菌血症、尿路感染、胰瘘、胃排空延迟、腹腔内出血。
1.1.2 排除标准 ⑴ 非随机对照试验,如综述、系统评价、病例报道、疾病证型限定等;⑵ 非临床试验,如动物、细胞实验等;⑶ 无本研究结局指标或无法提取有效数据;⑷ 信息不全或重复发表;⑸ 重复文献。
1.2 文献检索策略
计算机检索PubMed、EMbase、The Cochrane Library、CBM、Web of Science、WanFang Data、VIP和 CNKI 数据库,检索比较PD患者术前免疫营养支持的R C T,检索时限均从建库至2 0 1 9 年7月1日。中文检索词包括:胰十二指肠切除术;术前;营养;食物;能量等。英文检索词包括:Nutrition;Malnutrition;Intake;Food;Feed;Energy;Supplement;Preoperative Period;Preoperative Care;Pancreatoduodenectomy;PD;Whipple;Pancreaticoduodenectomy;Pancreatic Resection;Pancreatectomy。根据检索后获得的参考文献进行第二次扩展检索,以提高符合条件的文献检出率。
1.3 文献筛选与资料提取
检出文献均导入EndNote X8软件,由2名研究者按照纳入与排除标准独立筛选文献和提取资料,若遇分歧两人协商解决。提取的资料包括:作者姓名、年份、国家、研究类型、样本量、性别、年龄、干预措施、结局指标等。
1.4 纳入研究的偏倚风险评价
由2名研究者独立对RCT参照Cochrane Hand Book偏倚风险评价工具进行评价。
1.5 统计学处理
采用RevMan 5.3软件进行Meta统计分析。输入原始数据并进行数据转换,对不同类型数据,计量资料采用均数差(mean difference,MD)、二分类变量采用比值比(odds ratio,OR)为效应分析统计量,各效应量均提供9 5%可信区间(CI)。首先对研究进行异质性检验,若P≥0.05,I 2≤50%,选用固定效应模型进行分析;若P<0.05,I 2 >50%,认为各研究间存在较大异质性,则进行亚组分析或采用逐一排除文献法,寻找异质性原因,若仍无法消除异质性,则采用随机效应模型合并效应量。
2 结 果
2.1 文献检索流程及结果
通过检索初步得到的研究文献有1 135篇,经逐层筛选,最终符合纳入标准的RCT共11篇,614例患者,其中试验组310例,对照组304例。具体文献筛选流程及结果见图1。

图1 文献筛选流程及结果
Figure 1 Literature screening process and results
2.2 纳入研究的基本特征和偏倚风险评价结果
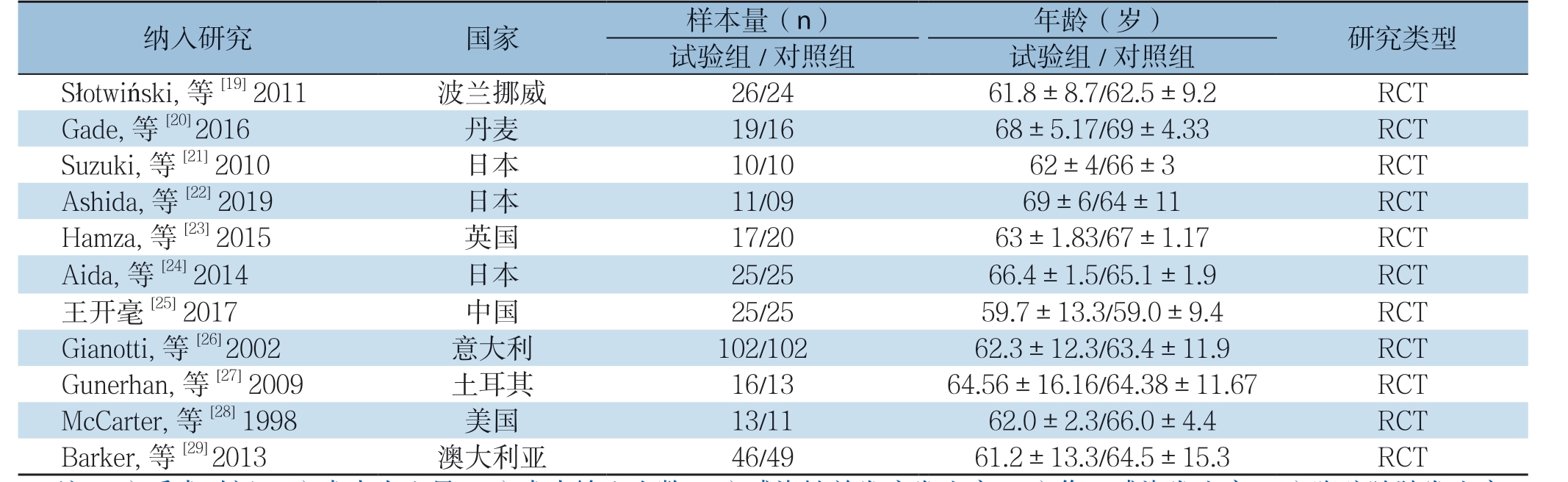
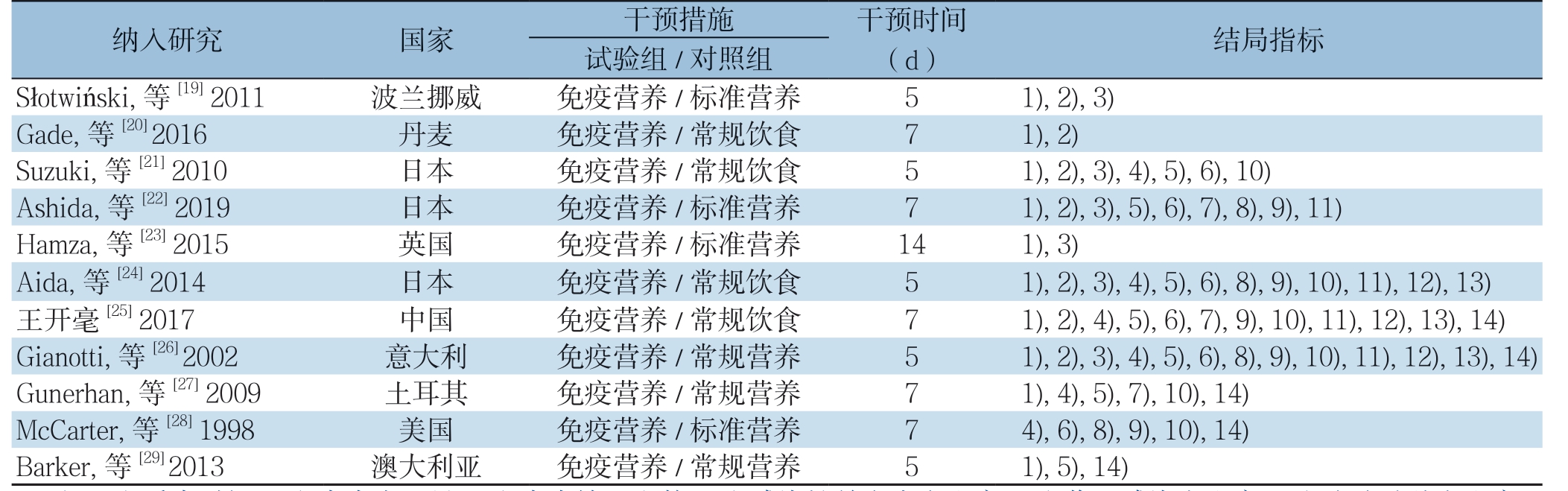
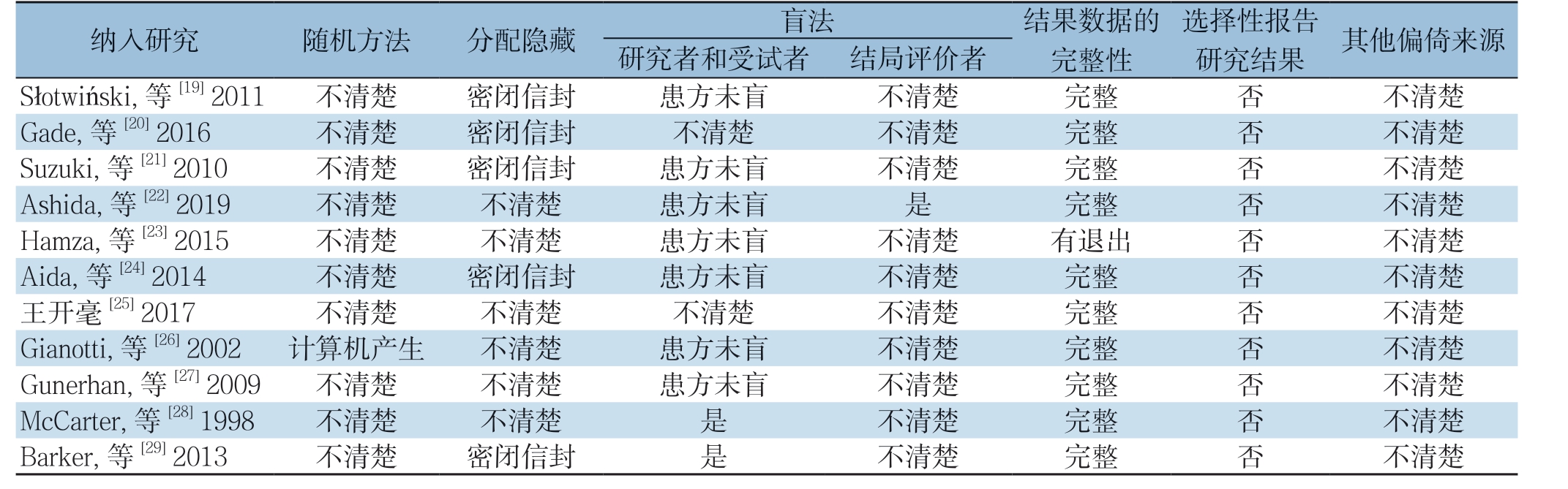
本研究共纳入11篇RCT[19-29],中文1篇,英文10篇,共614例患者。纳入的各研究中试验组与对照组患者的样本量、年龄及手术方式等一般情况具有可比性,两组患者的基本特征见表1,试验组与对照组的具体营养支持方案见表2,对各研究进行质量评价,质量中等,具体见偏倚风险评价表3。
表1 纳入研究的基本特征
Table 1 The general characteristics of the included studies
注:1)手术时间;2)术中失血量;3)术中输血人数;4)感染性并发症发生率;5)伤口感染发生率;6)腹腔脓肿发生率;7)肺炎发生率;8)菌血症发生率;9)尿路感染发生率;10)非感染性并发症发生率;11)胰瘘发生率;12)胃排空延迟发生率;13)腹腔内出血发生率;14)住院时间
Note: 1) Operative time; 2) Intraoperative blood loss; 3) Number of cases requiring intraoperative blood transfusion; 4) Incidence of infective complications; 5) Incidence of wound infection; 6) Incidence of intra-abdominal abscess; 7) Incidence of pneumonia; 8) Incidence of bacteremia;9) Incidence of urinary tract infection; 10) Incidence of non-infective complications; 11) Incidence of pancreatic fistula; 12) Incidence of delayed gastric emptying; 13) Incidence of intraperitoneal hemorrhage; 14) Length of hospital stay
纳入研究 国家 样本量(n) 年龄(岁) 研究类型试验组/对照组 试验组/对照组Słotwiński, 等[19] 2011 波兰挪威 26/24 61.8±8.7/62.5±9.2 RCT Gade, 等[20] 2016 丹麦 19/16 68±5.17/69±4.33 RCT Suzuki, 等[21] 2010 日本 10/10 62±4/66±3 RCT Ashida, 等[22] 2019 日本 11/09 69±6/64±11 RCT Hamza, 等[23] 2015 英国 17/20 63±1.83/67±1.17 RCT Aida, 等[24] 2014 日本 25/25 66.4±1.5/65.1±1.9 RCT王开毫[25] 2017 中国 25/25 59.7±13.3/59.0±9.4 RCT Gianotti, 等[26] 2002 意大利 102/102 62.3±12.3/63.4±11.9 RCT Gunerhan, 等[27] 2009 土耳其 16/13 64.56±16.16/64.38±11.67 RCT McCarter, 等[28] 1998 美国 13/11 62.0±2.3/66.0±4.4 RCT Barker, 等[29] 2013 澳大利亚 46/49 61.2±13.3/64.5±15.3 RCT
表1 纳入研究的基本特征(续)
Table 1 The general characteristics of the included studies (Continued)
注:1)手术时间;2)术中失血量;3)术中输血人数;4)感染性并发症发生率;5)伤口感染发生率;6)腹腔脓肿发生率;7)肺炎发生率;8)菌血症发生率;9)尿路感染发生率;10)非感染性并发症发生率;11)胰瘘发生率;12)胃排空延迟发生率;13)腹腔内出血发生率;14)住院时间
Note: 1) Operative time; 2) Intraoperative blood loss; 3) Number of cases requiring intraoperative blood transfusion; 4) Incidence of infective complications; 5) Incidence of wound infection; 6) Incidence of intra-abdominal abscess; 7) Incidence of pneumonia; 8) Incidence of bacteremia;9) Incidence of urinary tract infection; 10) Incidence of non-infective complications; 11) Incidence of pancreatic fistula; 12) Incidence of delayed gastric emptying; 13) Incidence of intraperitoneal hemorrhage; 14) Length of hospital stay
纳入研究 国家 干预措施 干预时间(d) 结局指标试验组/对照组Słotwiński, 等[19] 2011 波兰挪威 免疫营养/标准营养 5 1), 2), 3)Gade, 等[20] 2016 丹麦 免疫营养/常规饮食 7 1), 2)Suzuki, 等[21] 2010 日本 免疫营养/常规饮食 5 1), 2), 3), 4), 5), 6), 10)Ashida, 等[22] 2019 日本 免疫营养/标准营养 7 1), 2), 3), 5), 6), 7), 8), 9), 11)Hamza, 等[23] 2015 英国 免疫营养/标准营养 14 1), 3)Aida, 等[24] 2014 日本 免疫营养/常规饮食 5 1), 2), 3), 4), 5), 6), 8), 9), 10), 11), 12), 13)王开毫[25] 2017 中国 免疫营养/常规饮食 7 1), 2), 4), 5), 6), 7), 9), 10), 11), 12), 13), 14)Gianotti, 等[26] 2002 意大利 免疫营养/常规营养 5 1), 2), 3), 4), 5), 6), 8), 9), 10), 11), 12), 13), 14)Gunerhan, 等[27] 2009 土耳其 免疫营养/常规营养 7 1), 4), 5), 7), 10), 14)McCarter, 等[28] 1998 美国 免疫营养/标准营养 7 4), 6), 8), 9), 10), 14)Barker, 等[29] 2013 澳大利亚 免疫营养/常规营养 5 1), 5), 14)
表2 试验组与对照组的具体营养支持方案
Table 2 Nutrition support protocols of study group and control group
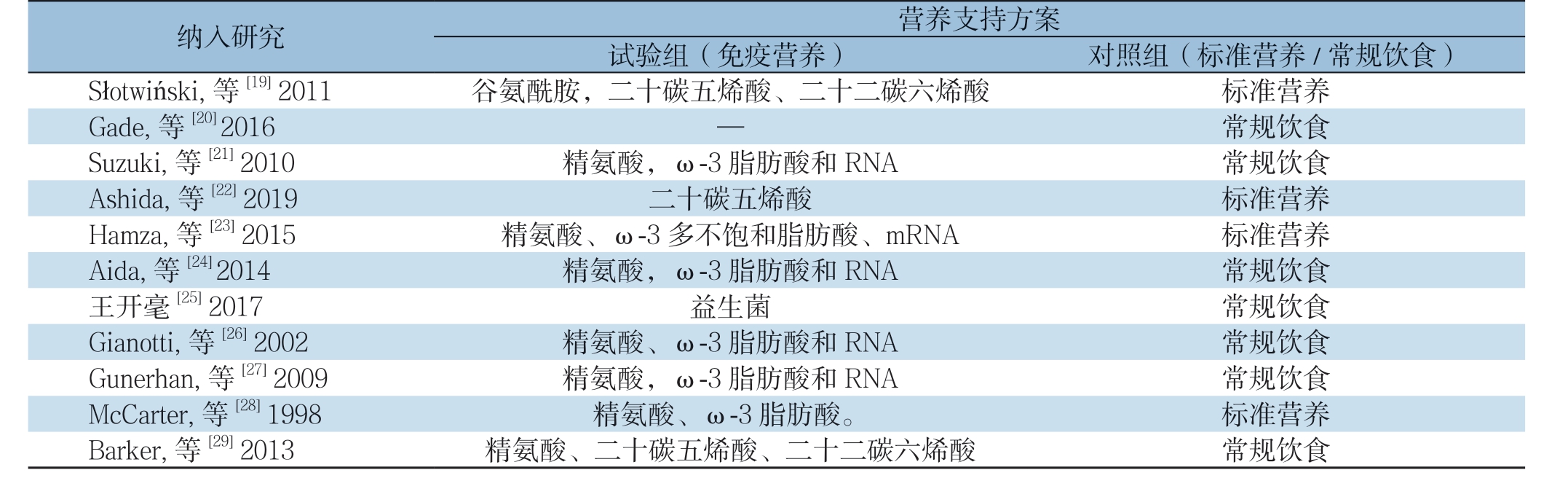
纳入研究 营养支持方案试验组(免疫营养) 对照组(标准营养/常规饮食)Słotwiński, 等[19] 2011 谷氨酰胺,二十碳五烯酸、二十二碳六烯酸 标准营养Gade, 等[20] 2016 — 常规饮食Suzuki, 等[21] 2010 精氨酸,ω-3 脂肪酸和RNA 常规饮食Ashida, 等[22] 2019 二十碳五烯酸 标准营养Hamza, 等[23] 2015 精氨酸、ω-3 多不饱和脂肪酸、mRNA 标准营养Aida, 等[24] 2014 精氨酸,ω-3 脂肪酸和RNA 常规饮食王开毫[25] 2017 益生菌 常规饮食Gianotti, 等[26] 2002 精氨酸、ω-3 脂肪酸和RNA 常规饮食Gunerhan, 等[27] 2009 精氨酸,ω-3 脂肪酸和RNA 常规饮食McCarter, 等[28] 1998 精氨酸、ω-3 脂肪酸。 标准营养Barker, 等[29] 2013 精氨酸、二十碳五烯酸、二十二碳六烯酸 常规饮食
表3 纳入研究的偏倚风险评价
Table 3 Assessment of risk of bias of the included studies
2.3 Meta 分析结果
2.3.1 术中指标 纳入文献中有10 项研究[19-27,29]报道了手术时间指标,合并效应后试验组与对照组手术时间比较差异无统计学意义(MD=3.94,95% CI= -3.67~11.55,P=0.31);有7 项研究[19-22,24-26]报道了手术失血量指标,合并效应后试验组与对照组术中失血量比较差异无统计学意义(MD=60.75,95% CI=-78.86~200.35,P=0.39),但I2=81%,经逐一排除文献,其P 值始终>0.05,说明该分析结果的可靠性较高,PD 患者术前给予免疫营养不能减少术中失血量,但也不是危险因素;纳入文献中有6 项研究[19,21-24,26]报道了术中输血患者例数指标,合并效应后试验组与对照组术中输血患者例数比较差异无统计学意义(OR=1.23,95% CI=0.78~1.95,P=0.37)(表4)。
表4 试验组与对照组术中指标比较
Table 4 Comparison of the intraoperative variables between study group and control group
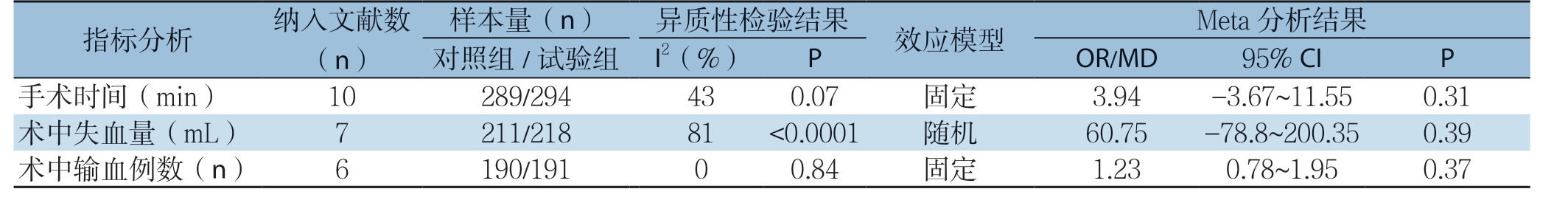
指标分析 纳入(文n)献数对样照本组量/(试n验)组 I异2(质%性)检 验 结P果 效应模型 OR/MD Meta 9 5分%析 C结I 果 P手术时间(min) 10 289/294 43 0.07 固定 3.94 -3.67~11.55 0.31术中失血量(mL) 7 211/218 81 <0.0001 随机 60.75 -78.8~200.35 0.39术中输血例数(n) 6 190/191 0 0.84 固定 1.23 0.78~1.95 0.37
2.3.2 感染性并发症 纳入文献中有7 项研究[21-22, 24-28]报道了感染性并发症指标,随机效应模型合并分析结果显示,两组患者总感染性并发症发生率差异无统计学意义(OR=0.51,95% CI=0.23~1.13,P=0.10),但I2>50%,以文献发表年份2010 年为界,经亚组分析,发表年份在2010 年之后的文献研究表明,两组患者感染性并发症发生率差异有统计学意义(OR=0.28,95% CI=0.14~0.58,P=0.0007),通过逐一排除文献法进一步查找异质性的来源,最终确定文献[28]为异质性的主要来源,去除该文献之后,两组患者总感染性并发症发生率差异有统计学意义(OR=0.37,95% CI=0.23~0.59,P<0.0001)。在各感染性并发症中,试验组伤口感染发生率比对照组低(OR=0.51,95% CI=0.29~0.89,P=0.02),两者差异有统计学意义;试验组腹腔脓肿发生率(OR=0.82,95% CI= 0.34~1.96,P=0.65)、肺炎发生率(OR=1.13,95% CI=0.26~4.89,P=0.87)、菌血症发生率(OR=0.31,95% CI=0.07~1.34,P=0.12)、尿路感染发生率(OR=0.97,95% CI=0.29~3.27,P=0.96)比非营养支持组低,但两组之间发生率差异无统计学意义(表5)。
表5 试验组与对照组感染性并发症发生率比较
Table 5 Comparison of the incidence rates of infective complications between study group and control group
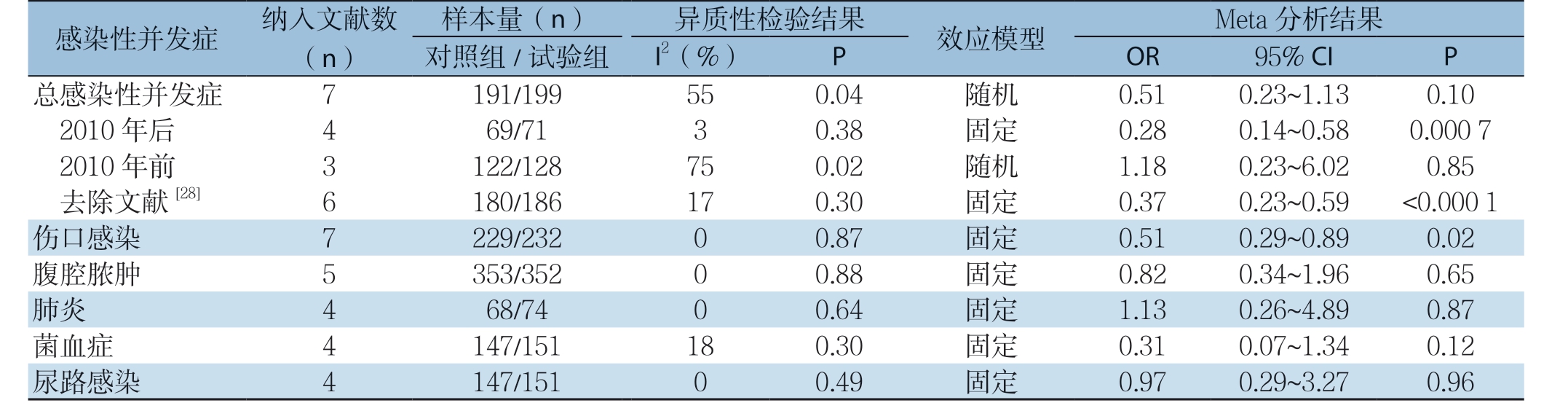
感染性并发症 纳入(文n)献数对样照本组量/(试n验)组I2(异%质)性 检验结P果 效应模型 OR Met 9 a 5分%析 CI结 果P总感染性并发症 7 191/199 55 0.04 随机 0.51 0.23~1.13 0.10 2010 年后 4 69/71 3 0.38 固定 0.28 0.14~0.58 0.000 7 2去0 1除0 文年献前 [28] 3 6 1 1 2 8 2 0//1 1 2 8 8 6 7 1 5 7 0 0..0 3 2 0 随固机定 1 0..1 3 8 7 0 0..2 2 3 3~~6 0..0 5 2 9 <0 0.0.8 0 5 0 1伤口感染 7 229/232 0 0.87 固定 0.51 0.29~0.89 0.02腹腔脓肿 5 353/352 0 0.88 固定 0.82 0.34~1.96 0.65肺炎 4 68/74 0 0.64 固定 1.13 0.26~4.89 0.87菌血症 4 147/151 18 0.30 固定 0.31 0.07~1.34 0.12尿路感染 4 147/151 0 0.49 固定 0.97 0.29~3.27 0.96
2.3.3 非感染性并发症 纳入文献中有5 项研究[21,24,26-28]报道了非感染性并发症指标,固定效应模型合并分析结果显示,两组患者总非感染性并发症发生率差异无统计学意义(OR=0.89,95% CI=0.67~1.18,P=0.41),其 中 试 验 组 胰瘘 发 生 率(OR=-0.01,95% CI=-0.08~0.06,P=0.73)、胃排空延迟发生率(OR=1.00,95% CI=0.48~2.10,P=1.00)、腹腔出血发生率(OR=0.53,95% CI=0.14~1.97,P=0.34)与对照组的差异均无统计学意义(表6)。
表6 试验组与对照组非感染性并发症发生率比较
Table 6 Comparison of the incidence rates of non-infective complications between study group and control group

非感染性并发症 纳入(文n)献数对照样组本/试量验 组 I2(异%质)性 检验结P果 效应模型 OR Meta 9 5分%析 C结I 果 P总非感染性并发症 5 157/163 0 0.64 固定 0.89 0.67~1.18 0.41胰瘘 4 161/163 0 0.85 固定 -0.01 -0.08~0.06 0.73胃排空延迟 3 152/152 0 0.47 固定 1.00 0.48~2.10 1.00腹腔出血 3 152/152 0 0.86 固定 0.53 0.14~1.97 0.34
2.3.4 住院时间 纳入文献中有5 项研究[25-29]报道了住院时间指标,随机效应模型合并分析结果显示,两组患者住院时间差异无统计学意义(MD=0.18,95% CI=-2.91~3.28,P=0.91)。但其异质性>50%,以文献发表年份2010 年为界,经亚组分析,发表年份在2010 年之前或之后的文献研究表明,两组患者住院时间差异无统计学意义,通过逐一排除文献法进一步查找异质性的来源,最终确定文献[28]为异质性的主要来源,去除该文献之后,两组患者住院时间差异有统计学意义(MD=-1.91,95% CI=-3.21~-0.60,P=0.004)(表7)。
表7 试验组与对照组住院时间比较
Table 7 Comparison of the length of hospital stay between study group and control group
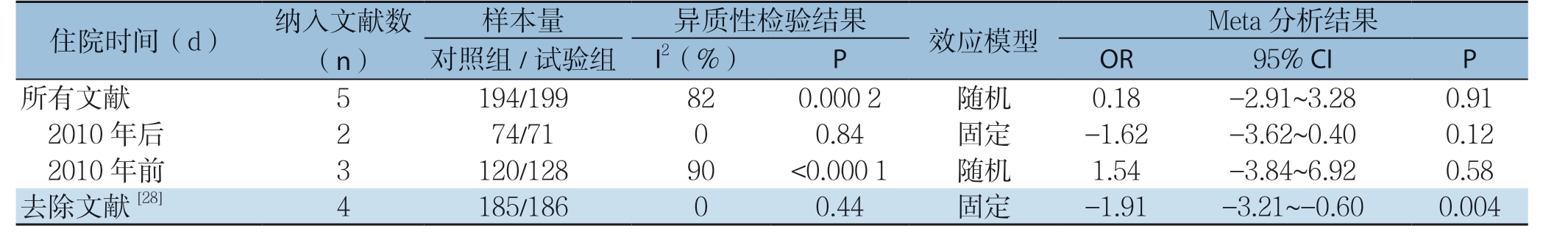
住院时间(d) 纳入(文n)献数对照样组本/试量验 组 I2(异%质)性 检 验结P果 效应模型 OR Meta 9 5分%析 C结I 果 P所有文献 5 194/199 82 0.000 2 随机 0.18 -2.91~3.28 0.91 2010 年后 2 74/71 0 0.84 固定 -1.62 -3.62~0.40 0.12去2除0 1文0 献年前[28] 3 4 1 1 2 8 0 5//1 1 2 8 8 6 9 00 <0 0.0.4 0 40 1 随固机定 -1 1.5.9 4 1 --33.2.8 1 4~~-6 0.9.6 2 0 0 0..05 08 4
3 讨 论
3.1 术前营养干预的必要性
目前52%~88%[30]接受胰腺癌切除术的患者由于胰腺内分泌和外分泌功能受损[9]及术前禁食[31]等原因,术前存在中度至重度营养不良的风险;而且胰腺切除术的手术区域位于消化系统的交叉点,恶性肿瘤的位置和手术重建会影响食物流动[32],激素刺激和胰酶释放等,因此是全身炎症反应的强大刺激因素,如果刺激过度和控制不当,则会快速消耗内源性能量储存,必需营养素耗尽,免疫应答失调,最终导致术后并发症,尤其是术后感染等一系列的分解代谢应激,甚至器官功能恶化[33]。
围手术期营养支持是一种广泛接受的护理标准[34]。迄今为止,大多数研究都集中在营养不良胰腺切除术患者在围手术期补充营养以改善围手术期营养状况或早期临床结果[35],但仍没有为围手术期患者提供最佳营养的数据。因此在术前识别处于风险中的患者可能对改善预后至关重要,所以应对患者进行营养风险筛查,并在治疗早期提供营养干预以优化降低住院患者的发病率,住院时间和入院费用[36-37]。
3.2 术前免疫营养的现状
免疫营养[38]可以改善机体营养状态,调节机体免疫系统,控制机体内的过度炎症反应,缩短住院时间。当然,免疫营养也存在一些有待于进一步研究的问题,如:营养物质的配比、免疫营养的时机以及部分免疫营养成分尚存在一定副作用等。目前临床常用的免疫营养物质主要有:谷胺酰胺、精氨酸、支链氨基酸、核苷酸、多链不饱和脂肪酸及益生菌等。针对目前术前免疫营养是否能改善PD患者的预后尚无定论[39-43]。本文对相关文章Meta分析结果显示,试验组与对照组手术时间、术中失血量、术中输血患者例数间差异均无统计学意义,但这可能与术者的医疗水平与很大关系;两组患者总感染性并发症发生率差异无统计学意义(OR=0.51,95% CI=0.23~1.13,P=0.1 0),但在亚组分析和逐一排除文献法去除导致异质性的文献之后,两组患者感染性并发症发生率差异有统计学意义(O R=0.3 7,9 5% C I=0.2 3 ~0.5 9,P <0.0 0 0 1),在感染性并发症中,试验组伤口感染发生率比对照组低(OR=0.51,95% CI=0.29~0.89,P=0.02),两者差异有统计学意义;同样的方法分析显示,两组患者住院时间差异有统计学意义(MD=-1.91,95% CI=-3.21~-0.60,P=0.004)。综上所述,术前给予免疫营养支持可以减少感染性并发症发生率,缩短住院时间,促进患者的预后。
3.3 本研究的局限性
本次Meta分析较全面的评价了PD前给予免疫营养的疗效,但仍存在较多局限性:⑴ 纳入研究的整体质量相对不高,部分不清楚其随机方法,偏倚风险较大,研究结论的可信度可能会相应降低。⑵ 尽管各RCT在病例特征上具有可比性,但纳入病例特征不完全一致;而且研究报道的研究对象肿瘤种类及分期及给予营养物质的配比差异较大,故不能排除对两组均衡性的影响,导致研究间存在一定的异质性。⑶ 纳入研究均未进行随访,因此未能对远期并发症进行分析。⑷ 各项研究的纳入标准不同,这可能导致不同的结果。
总之,当前有限证据显示,在PD前给予免疫营养可减少术后感染性并发症的发生,提高临床疗效,且安全性较好。受纳入研究数量和质量的限制,上述结论尚待更多设计严格的多中心、大样本的高质量RCT研究予以验证,临床应用中应充分评估风险-获益比,根据实际情况采用合适的术前营养支持方案,进而有效改善患者的营养状况,促进患者的恢复。
[1] Gerritsen A, Besselink MG, Gouma DJ, et al.Systematic review of five feeding routes after pancreatoduodenectomy[J].Br J Surg,2013, 100(5):589-598.doi: 10.1002/bjs.9049.
[2] Buscemi S, Damiano G, Palumbo VD, et al.Enteral nutrition in pancreaticoduodenectomy: a literature review[J].Nutrients, 2015,7(5):3154-3165.doi: 10.3390/nu7053154.
[3] 王庆华.肠内营养对胰十二指肠切除患者术后营养、免疫和预后的影响[J].中国老年学杂志, 2014, 34(24):6953-6954.doi:10.3969/j.issn.1005-9202.2014.24.049.Wang QH.Influence of enteral nutrition on postoperative nutritional status, immune functionandprognosis in patients undergoing pancreaticoduodenectomy[J].Chinese Journal of Gerontology, 2014, 34(24):6953-6954.doi:10.3969/j.issn.1005-9202.2014.24.049.
[4] Li D, Morris JS, Liu J, et al.Body mass index and risk, age of onset, and survival in patients with pancreatic cancer[J].JAMA,2009, 301(24):2553-2562.doi: 10.1001/jama.2009.886.
[5] Su Z, Koga R, Saiura A, et al.Factors influencing infectious complications after pancreatoduodenectomy[J].J Hepatobiliary Pancreat Sci, 2010, 17(2):174-179.doi: 10.1007/s00534-009-0128-0.
[6] House MG, Fong Y, Arnaoutakis DJ, et al.Preoperative predictors for complications after pancreaticoduodenectomy: impact of BMI and body fat distribution[J].J Gastrointest Surg, 2008, 12(2):270-278.doi: 10.1007/s11605-007-0421-7.
[7] Tan WJ, Kow AW, Liau KH.Moving towards the New International Study Group for Pancreatic Surgery (ISGPS) definitions in pancreaticoduodenectomy: a comparison between the old and new[J].HPB (Oxford), 2011, 13(8):566-572.doi: 10.1111/j.1477-2574.2011.00336.x.
[8] Welsch T, Borm M, Degrate L, et al.Evaluation of the International Study Group of Pancreatic Surgery definition of delayed gastric emptying after pancreatoduodenectomy in a high-volume centre[J].Br J Surg, 2010, 97(7):1043-1050.doi: 10.1002/bjs.7071.
[9] Hashimoto D, Chikamoto A, Ohmuraya M, et al.Impact of Postoperative Weight Loss on Survival After Resection for Pancreatic Cancer[J].JPEN J Parenter Enteral Nutr, 2015,39(5):598-603.doi: 10.1177/0148607114520992.
[10] Sledzianowski JF, Duffas JP, Muscari F, et al.Risk factors for mortality and intra-abdominal morbidity after distal pancreatectomy[J].Surgery, 2005, 137(2):180-185.doi: 10.1016/j.surg.2004.06.063.
[11] Buhrman WC, Lyman WB, Kirks RC, et al.Current State of Enhanced Recovery After Surgery in Hepatopancreatobiliary Surgery[J].J Laparoendosc Adv Surg Tech A, 2018, 28(12):1471-1475.doi: 10.1089/lap.2018.0314.
[12] 肖文海, 杨政伟, 陈静.快速康复外科理念在胰十二指肠切除术围手术期中应用疗效的Meta分析[J].中国普通外科杂志, 2018,27(9):1102-1112.doi:10.7659/j.issn.1005-6947.2018.09.004.Xiao WH, Yang ZW, Chen J.Efficacy of using enhanced recovery after surgery program in perioperative management of pancreaticoduodenectomy:a Meta-analysis[J].Chinese Journal of General Surgery, 2018, 27(9):1102-1112.doi:10.7659/j.issn.1005-6947.2018.09.004.
[13] 王征征, 周进学, 李庆军, 等.加速康复外科理念在胰十二指肠切除术围手术期的应用[J].中国普通外科杂志, 2018, 27(3):289-293.doi:10.3978/j.issn.1005-6947.2018.03.004.Wang ZZ, Zhou JX, Li QJ, et al.Application of enhanced recovery after surgery program in perioperative management of pancreaticoduodenectomy[J].Chinese Journal of General Surgery,2018, 27(3):289-293.doi:10.3978/j.issn.1005-6947.2018.03.004.
[14] Sánchez-Guillén L, Arroyo A.Immunonutrition in patients with colon cancer[J].Immunotherapy, 2020, 12(1):5-8.doi: 10.2217/imt-2019-0179.
[15] Soares JDP, Howell SL, Teixeira FJ, et al.Dietary amino acids and immunonutrition supplementation in cancer-induced skeletal muscle mass depletion: A mini review[J].Curr Pharm Des, 2020, doi: 10.21 74/1381612826666200218100420.[Epub ahead of print]
[16] Russo E, Giudici F, Fiorindi C, et al.Immunomodulating Activity and Therapeutic Effects of Short Chain Fatty Acids and Tryptophan Post-biotics in Inflammatory Bowel Disease[J].Front Immunol,2019, 10:2754.doi: 10.3389/fimmu.2019.02754.
[17] Achilli P, Mazzola M, Bertoglio CL, et al.Preoperative immunonutrition in frail patients with colorectal cancer: an intervention to improve postoperative outcomes[J].Int J Colorectal Dis, 2020, 35(1):19-27.doi: 10.1007/s00384-019-03438-4.
[18] Guan H, Chen S, Huang Q.Effects of Enteral Immunonutrition in Patients Undergoing Pancreaticoduodenectomy: A Meta-Analysis of Randomized Controlled Trials[J].Ann Nutr Metab, 2019, 74(1):53-61.doi: 10.1159/000495468.
[19] Słotwiński R, Olszewski W, Słodkowski M, et al.Apoptosis in lymphocytes of pancreatic cancer patients: influence of preoperative enteral immunonutrition and extensive surgery[J].Arch Immunol Ther Exp (Warsz), 2011, 59(5):385-397.doi: 10.1007/s00005-011-0140-3.
[20] Gade J, Levring T, Hillingsø J, et al.The Effect of Preoperative Oral Immunonutrition on Complications and Length of Hospital Stay After Elective Surgery for Pancreatic Cancer--A Randomized Controlled Trial [J].Nutr Cancer, 2016, 68(2):225-233.doi:10.1080/01635581.2016.1142586.
[21] Suzuki D, Furukawa K, Kimura F, et al.Effects of perioperative immunonutrition on cell-mediated immunity, T helper type 1 (Th1)/Th2 differentiation, and Th17 response after pancreaticoduodenectomy[J].Surgery, 2010, 148(3):573-581.doi:10.1016/j.surg.2010.01.017.
[22] Ashida R, Okamura Y, Wakabayashi-Nakao K, et al.The Impact of Preoperative Enteral Nutrition Enriched with Eicosapentaenoic Acid on Postoperative Hypercytokinemia after Pancreatoduodenectomy:The Results of a Double-Blinded Randomized Controlled Trial[J].Dig Surg, 2019, 36(4):348-356.doi: 10.1159/000490110.
[23] Hamza N, Darwish A, O'Reilly DA, et al.Perioperative Enteral Immunonutrition Modulates Systemic and Mucosal Immunity and the Inflammatory Response in Patients With Periampullary Cancer Scheduled for Pancreaticoduodenectomy: A Randomized Clinical Trial[J].Pancreas, 2015, 44(1):41-52.doi: 10.1097/MPA.0000000000000222.
[24] Aida T, Furukawa K, Suzuki D, et al.Preoperative immunonutrition decreases postoperative complications by modulating prostaglandin E2 production and T-cell differentiation in patients undergoing pancreatoduodenectomy[J].Surgery, 2014, 155(1):124-133.doi:10.1016/j.surg.2013.05.040.
[25] 王开毫.术前应用益生菌对胰十二指肠切除术后患者的影响[D].天津:天津医科大学, 2017:13-18.Wang KM.Effects of preoperative probiotics administration on patients after pancreaticoduodenectomy[D].Tianjin: Tianjin Medical University, 2017:13-18.
[26] Gianotti L, Braga M, Nespoli L, et al.A randomized controlled trial of preoperative oral supplementation with a specialized diet in patients with gastrointestinal cancer[J].Gastroenterology, 2002,122(7):1763-1770.doi: 10.1053/gast.2002.33587.
[27] Gunerhan Y, Koksal N, Sahin UY, et al.Effect of preoperative immunonutrition and other nutrition models on cellular immune parameters[J].World J Gastroenterol, 2009, 15(4):467-472.doi:10.3748/wjg.15.467.
[28] McCarter MD, Gentilini OD, Gomez ME, et al.Preoperative oral supplement with immunonutrients in cancer patients[J].JPEN J Parenter Enteral Nutr, 1998, 22(4):206-211.doi:10.1177/0148607198022004206.
[29] Barker LA, Gray C, Wilson L, et al.Preoperative immunonutrition and its effect on postoperative outcomes in well-nourished and malnourished gastrointestinal surgery patients: a randomised controlled trial[J].Eur J Clin Nutr, 2013, 67(8):802-807.doi:10.1038/ejcn.2013.117.
[30] Afaneh C, Gerszberg D, Slattery E, et al.Pancreatic cancer surgery and nutrition management: a review of the current literature[J].Hepatobiliary Surg Nutr, 2015, 4(1):59-71.doi: 10.3978/j.issn.2304-3881.2014.08.07.
[31] Can MF, Yagci G, Dag B, et al.Preoperative administration of oral carbohydrate-rich solutions: Comparison of glucometabolic responses and tolerability between patients with and without insulin resistance[J].Nutrition, 2009, 25(1):72-77.doi: 10.1016/j.nut.2008.07.021.
[32] Akizuki E, Kimura Y, Nobuoka T, et al.Prospective nonrandomized comparison between pylorus-preserving and subtotal stomachpreserving pancreaticoduodenectomy from the perspectives of DGE occurrence and postoperative digestive functions[J].J Gastrointest Surg, 2008, 12(7):1185-1192.doi: 10.1007/s11605-008-0513-z.
[33] Giger-Pabst U, Lange J, Maurer C, et al.Short-term preoperative supplementation of an immunoenriched diet does not improve clinical outcome in well-nourished patients undergoing abdominal cancer surgery[J].Nutrition, 2013, 29(5):724-729.doi: 10.1016/j.nut.2012.10.007.
[34] Goonetilleke KS, Siriwardena AK.Systematic review of perioperative nutritional supplementation in patients undergoing pancreaticoduodenectomy[J].JOP, 2006, 7(1):5-13.
[35] Kim E, Kang JS, Han Y, et al.Influence of preoperative nutritional status on clinical outcomes after pancreatoduodenectomy[J].HPB(Oxford), 2018, 20(11):1051-1061.doi: 10.1016/j.hpb.2018.05.004.
[36] Kanda M, Fujii T, Kodera Y, et al.Nutritional predictors of postoperative outcome in pancreatic cancer[J].Br J Surg, 2011,98(2):268-274.doi: 10.1002/bjs.7305.
[37] Karagianni VT, Papalois AE, Triantafillidis JK.Nutritional status and nutritional support before and after pancreatectomy for pancreatic cancer and chronic pancreatitis[J].Indian J Surg Oncol,2012, 3(4):348-359.doi: 10.1007/s13193-012-0189-4.
[38] 张著杰, 张振名, 赵晓晨.不同配方肠内营养支持对重症急性胰腺炎患者应用效果比较[J].中国普通外科杂志, 2016, 25(3):339-344.doi:10.3978/j.issn.1005-6947.2016.03.006.Zhang ZJ, Zhang ZM, Zhao XC.Comparison of the effects of different formulas of enteral nutrition support on patients with severe acute pancreatitis[J].Chinese Journal of General Surgery,2016, 25(3):339-344.doi:10.3978/j.issn.1005-6947.2016.03.006.
[39] Miyauchi Y, Furukawa K, Suzuki D, et al.Additional effect of perioperative, compared with preoperative, immunonutrition after pancreaticoduodenectomy: A randomized, controlled trial[J].Int J Surg, 2019, 61:69-75.doi: 10.1016/j.ijsu.2018.11.028.
[40] Nakajima H, Yokoyama Y, Inoue T, et al.Clinical Benefit of Preoperative Exercise and Nutritional Therapy for Patients Undergoing Hepato-Pancreato-Biliary Surgeries for Malignancy[J].Ann Surg Oncol, 2019, 26(1):264-272.doi: 10.1245/s10434-018-6943-2.
[41] Shirakawa H, Kinoshita T, Gotohda N, et al.Compliance with and effects of preoperative immunonutrition in patients undergoing pancreaticoduodenectomy [J].J Hepatobiliary Pancreat Sci, 2012,19(3):249-258.doi: 10.1007/s00534-011-0416-3.
[42] Nanno Y, Toyama H, Terai S, et al.Effect of Oral Branched-Chain Amino Acid Supplementation on Postoperative Blood Lactate Levels in Patients Undergoing Pancreatoduodenectomy[J].JPEN J Parenter Enteral Nutr, 2018, 42(5):960-964.doi:10.1177/0148607117718494.
[43] Klek S, Szybinski P, Szczepanek K.Perioperative immunonutrition in surgical cancer patients: a summary of a decade of research[J].World J Surg, 2014, 38(4):803-812.doi: 10.1007/s00268-013-2323-z.
