胃癌是全球高发的恶性肿瘤之一,据2015年我国国家癌症中心统计,胃癌在我国恶性肿瘤病死率排名第3位[1-2]。microRNAs(miRNAs)是一类由内源基因编码的长度约为18~25个核苷酸序列的小分子RNA,作为肿瘤标志物参与胃癌的发生发展、侵袭转移及化疗抵抗,受到学术界越来越多的关注[3-4]。据文献[5-6]报道,miRNA发挥癌基因和抑癌基因的功能,参与细胞增殖、凋亡和分化的调控,在肿瘤的发生发展过程中具有重要作用。其中,miR-124在多种肿瘤中发挥抑癌基因的功能,如膀胱癌、肺癌、乳腺癌和前列腺癌[7-10]。磷脂酰肌醇3激酶(phosphatidylinositol-3-kinases,PI3K)/蛋白质丝氨酸苏氨酸激酶(protein-serine-threonine kinase,Akt)信号通路在肿瘤的发生和发展过程中常被激活,被认为是肿瘤治疗的关键信号途径,是肿瘤治疗的关键靶点[11]。有研究[12]发现,miR-107表达抑制胃癌细胞的增殖和转移;过表达miR-107可通过调控PI3K/Akt信号通路抑制胃癌细胞增殖。近年,有学者[13]发现,miR-124在胃癌细胞及组织中表达下调,且在胃癌的发生发展中发挥重要调控作用。但目前miR-124对胃癌细胞增殖、凋亡影响的机制研究较少。本研究主要探讨miR-124对胃癌细胞增殖、凋亡的影响,并进一步研究其调控PI3K/Akt信号通路的作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞株 胃癌细胞系MGC803、AGS、MNK-45、SGC-7901 和人正常胃黏膜上皮细胞GES-1 均购自上海中科院细胞库,由本科室实验室保存。
1.1.2 主要试剂 TRIzol™Reagent、Lipofectamine™2000试剂均购自Invitrogen公司;SYBR Green qPCR Mix、4×Reverse Transcription Master Mix均购自TaKaRa 公司;CCK8 试剂盒购自上海碧云天生物技术有限公司;Transwell 小室购自上海子起生物科技有限公司;miR-124 模拟物、阴性对照序列购自上海吉玛公司;胎牛血清购自美国PeproTech 公司;DMEM 培养基购自美国Gibco 公司;PI3K、Akt、p-PI3K 和p-AKT 单克隆抗体、HRP 标记山羊抗兔IgG 二抗均购自美国Abcam公司;引物均由上海生工生物工程公司设计合成(其中miR-124 引物序列正向:5'-GCT AAG GCA CGC GGT G-3', 反 向:5'-GTG CAG GGT CCG AGG T-3';U6 正向:5'-GCT CGC TTC GGC AGC ACA-3',反向:5'-AAC GCT TCA CGA ATT TGC GT-3')。
1.1.3 主要仪器 1658033 小型蛋白垂直电泳转印系统(武汉科昊佳生物科技有限公司);ABI 7500 荧光定量PCR 仪(美国ABI 公司);美国SHELLAB 2406-2 CO2培养箱( 美 国SHELLAB公司);CLARIOstar 全功能多功能酶标仪(德国BMG LABTECH 公司);凝胶成像系统(美国Bio-Rad 公司)。
1.2 方法
1.2.1 细胞培养及miR-124 的表达水平检测 将各胃癌细胞系及人正常胃黏膜上皮细胞GES-1 培养在含10% 的胎牛血清的RPMI-1640 培养基中,置于37℃、5%CO2 的细胞培养箱中培养,用于后续的实验。采用qRT-PCR 技术检测各细胞系内miR-124 的表达。收集细胞后,PBS 洗涤2 遍,离心取细胞沉淀,按照Trizol™Reagent 说明书提取胃癌细胞MGC803 的总RNA,依据4×Reverse Transcription Master Mix 试剂盒说明书将组织总RNA 逆转录为总cDNA,按照SYBR Green qPCR Mix 试剂盒说明书操作,以cDNA 为模板,进行荧光定量PCR 反应。反应条件:94℃ 2 min,94℃20 s,60℃30 s,共40 个循环。以U6 为内参,miR-124 基因的相对表达量以2-ΔΔCt 表示。
1.2.2 细胞转染 选择MGC803 细胞作为研究对象,分别设置miR-124m 模拟物与阴性对照组,待MGC803 细胞培养至对数生长期时,使用胰酶消化细胞后,洗涤2 遍后应用完全培养基将细胞调至3.0×106 个/mL, 取200μL 细胞液接种至corning6孔板中培养24 h。分别向3个EP管中加入5μL LipofectamineTM2000,5μL LipofectamineTM2000+ 阴性质粒,5μL LipofectamineTM2000+5μL miR-124模拟物,室温静置5 min 后混合,加入不含血清的DMEM 培养基调整终体积至2 mL,置于37℃、5%CO2、饱和湿度下培养6 h 后,更换完全培养基继续培养,完成MGC803 细胞转染,并继续扩大培养以用于后续实验。
1.2.3 qRT-PCR 检测转染后细胞内miR-124 的表达 细胞转染成功后,采用qRT-PCR 技术检测细胞内miR-124 的表达。按“1.2.1”项下方法进行PCR 扩增,均以U6 为内参,miR-124 基因的相对表达量以2-ΔΔCt 表示。
1.2.4 CCK8 检测细胞增殖水平 待转染后的MGC803 细胞生长至对数期时,使用胰酶消化细胞后,洗涤2 遍后应用完全培养基将细胞调至3.0×103 个/mL,每孔(96 孔板) 接种100μL细胞液。分别培养24、48、72 h,加入配置好的CCK8 试剂(10μL CCK8 试剂+90μL 完全培养基)孵育2 h,采用酶标仪检测OD450 值。
1.2.5 细胞克隆实验 两组细胞以200 个/ 皿接种 于60 mm 的细胞培养皿(含10mL培养液)中,置37℃、5%CO2 的培养箱中孵育,2 周后肉眼可见细胞克隆的形成。小心吸弃培养液,用PBS 洗涤2 次,将两组细胞以4% 的多聚甲醛固定15 min,再用0.1% 的结晶紫染色20 min,用清水清洗染液并风干,于荧光显微镜下随机选取5 个视野统计形成的细胞克隆数(大于50 个克隆数为有效克隆)。
1.2.6 流式细胞术检测细胞凋亡 消化MGC803细胞后使用含血清DMEM 培养基将细胞浓度调至3×105 个/mL,收集对数生长的各组细胞,据说明书进行操作,采用Annexin V/PI 凋亡试剂盒检测不同时间点各组细胞的凋亡率。其中,各组样品分别加入500μL 结合缓冲液,5μL Annexin V,5μL PI,混匀,室温避光反应5~15 min,用流式细胞仪检测细胞凋亡水平。
1.2.7 miR-124 对MGC803 细 胞PI3K/Akt 信 号通路的调控作用 按照1:10(g/mL)的比例加入RIPA 裂解液,按BCA 蛋白定量试剂盒说明书方法测定所提取的各组细胞的总蛋白含量,以确保每组样本之间的上样量相同。裂解、提取各组蛋白后,经SDS-PAGE 电泳分离,转至硝酸纤维素(PVDF)膜,将转好的PVDF 膜于5% 脱脂奶粉溶液中室温封闭2 h,TBST 洗涤液漂洗3~4 次。加入一抗,4℃孵育过夜。再漂洗3~4 次,加入HRP 标记的二抗体,室温孵育2 h,漂洗3~4 次。化学发光检测底物ECL 工作液显色,采用Image J 图像分析系统对蛋白显影图进行灰度分析,以β-actin 为内参,分析PI3K、Akt、p-PI3K 和p-Akt 蛋白相对表达水平。再次收集MGC803 细胞后,PBS 洗涤2 次,离心取细胞沉淀,按照TRIzol™Reagent 说明书提取miR-124 模拟物组与miR-124 阴性对照组胃癌细胞MGC803 的总RNA,按“1.2.1”项下方法进行PCR 扩增,均以β-actin 为内参,分别检测PI3K、Akt 的mRNA 水平。引物由上海生工生物工程公司设计提供,引物序列见表1。
表1 PI3K/Akt 信号通路关键基因引物序列
Table 1 Primer sequences of key genes in PI3K/Akt signaling pathway

基因 引物序列PI3K 正向:5'-CATCACTACGTGCTGCTCTAA-3'反向:5'-CAGTAGTTCCGATTGTTCATG-3'Akt 正向:5'-GCTGATGGCGCATGCTGACA-3'反向:5'-CGGTGCGTCAGCTCGATCAT-3'β-actin 正向:5'-CAGTGTCATGCCGTACAGCT-3'反向:5'-TGAACAGCAATCGCTATC AC-3'
1.3 统计学处理
采用SPSS 17.0统计软件对本研究数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,应用单因素方差分析和LSD-t检验比较两组间各指标水平差异,P <0.05 为差异有统计学意义。
2 结 果
2.1 各胃癌细胞系及人正常胃黏膜上皮细胞中miR-124 的表达水平
与人正常胃黏膜上皮细胞GES-1(1.00±0.06)比较,miR-124 在胃癌细胞MGC803(0.28±0.05)、AGS(0.30±0.09)、MNK-45(0.46±0.07)、SGC-7901(0.34±0.09)中均明显降低,差异具有统计学意义(F=48.884,P<0.01),而miR-124在MGC803细胞中表达水平最低,因此本研究采用MGC803细胞作为研究对象(图1)。
2.2 转染效率检测
MGC803细胞转染miR-124模拟物后,miR-124的表达量为4.15 ± 0.18 ,阴性对照组胃2.01±0.14,差异有统计学意义(t=17.984,P=0.006)(图2)。
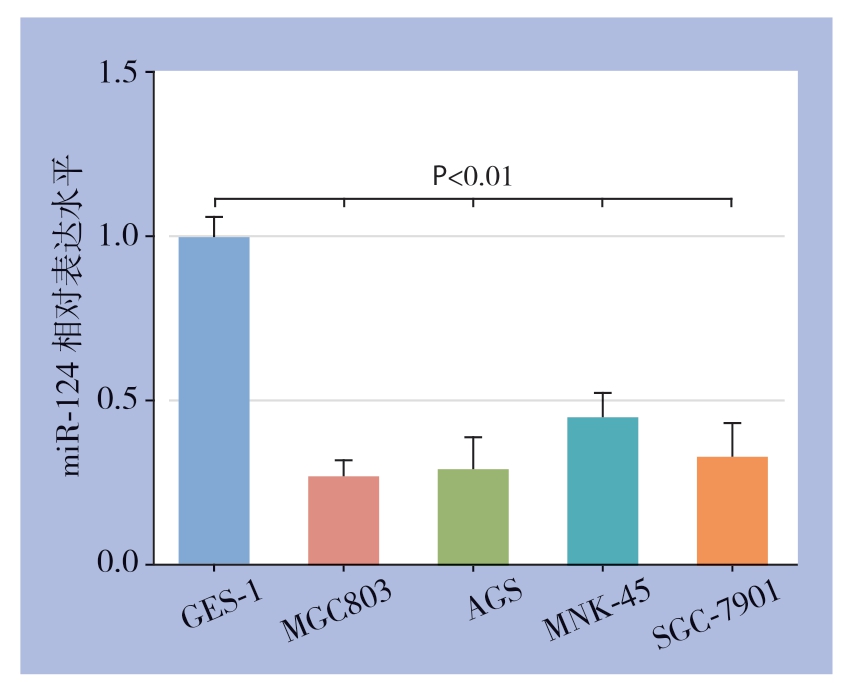
图1 各胃癌细胞系及人正常胃黏膜上皮细胞中miR-124 的表达水平
Figure 1 Expression levels of miR-124 in gastric cancer cell lines and human normal gastric mucosa epithelial cells
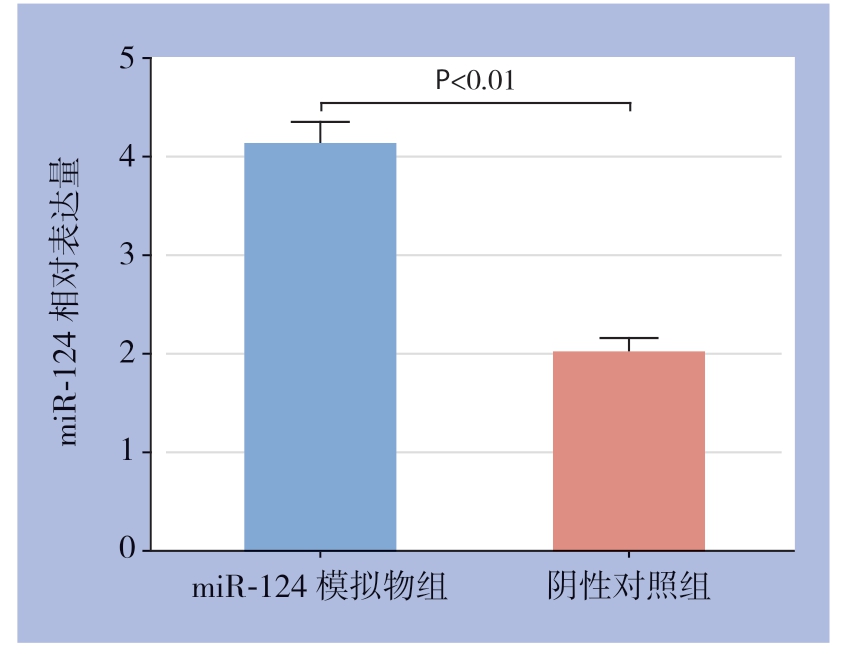
图2 转染效率检测结果
Figure 2 Results of transfection efficiency determination
2.3 miR-124 的表达对细胞增殖的影响
转染24、48、72h 后,miR-124 模拟物组细胞的OD450值分别为0.46±0.09、0.86±0.08、1.08±0.13;其中,转染48、72 h后,miR-124模拟物组显著低于miR-124阴性对照组的(1.25±0.14)和(1.72±0.17)(t=8.245、14.257,P=0.027、0.008)(图3)。
2.4 miR-124 对MGC803 细胞克隆实验
miR-124 模拟物组细胞克隆形成数为(71.3±4.5)个,阴性对照组(103.8±10.1)个,差异有统计学意义(t=9.450,P<0.001)。
2.5 miR-124对MGC803 细胞凋亡的影响
细胞转染24、48、72h 后,miR-124 模拟物组细胞凋亡率分别(12.70±5.14)%、(51.80±8.14)%、(70.40±7.14)%。
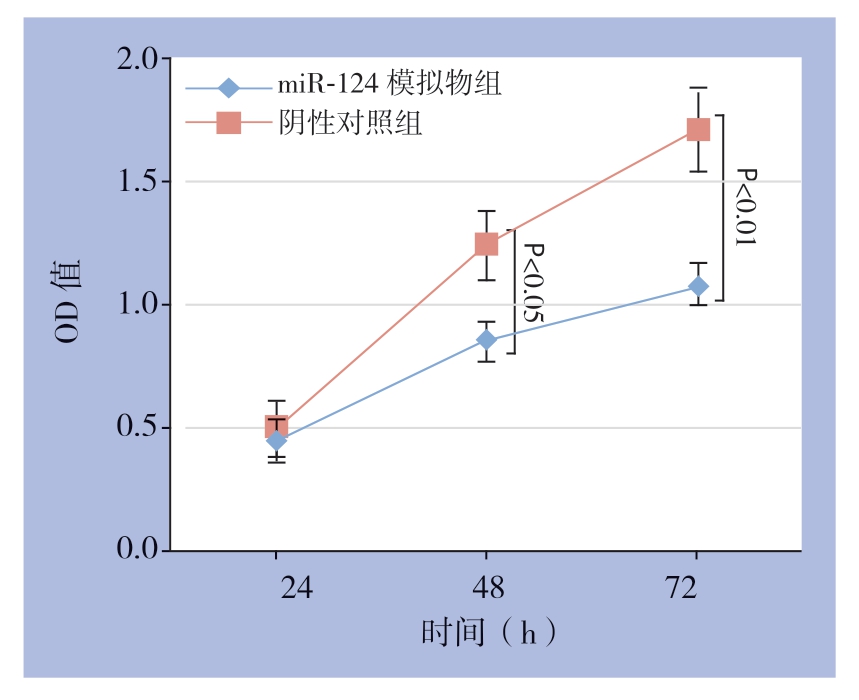
图3 miR-124 对MGC803 细胞增殖的影响
Figure 3 Effect of miR-124 on proliferation of MGC803 cells
2.6 miR-124 对MGC803 细胞PI3K/Akt 信号通路的影响
细胞转染后,miR-124模拟物组PI3K/Akt信号通路中关键靶点PI3K、Akt、p-PI3K和p-AKT蛋白相对表达分别为0.87±0.05、0.95±0.11、0.89±0.09、0.91±0.10,均明显低于阴性对照组(1.25±0.13、1.34±0.08、0.95±0.12、miR-124 模拟物组转染48、72 h 后的细胞凋亡率明显高于阴性对照组[(24.81±7.41)%、(33.21±8.29)%],差有统计学意义(t=17.565、18.147,P=0.007、0.005)(图4)。1.12±0.09),差异有统计学意义(t=13.542、15.224、4.159、12.357,P=0.007、0.008、0.035、0.006)。同时,miR-124模拟物组PI3K/Akt信号通路中PI3K及Akt基因相对表达分别为0.73±0.08、0.64±0.11,阴性对照组分别为0.87±0.15、0.94±0.10,差异有统计学意义(t=8.365、10.324,P=0.007、0.009)(图5)。
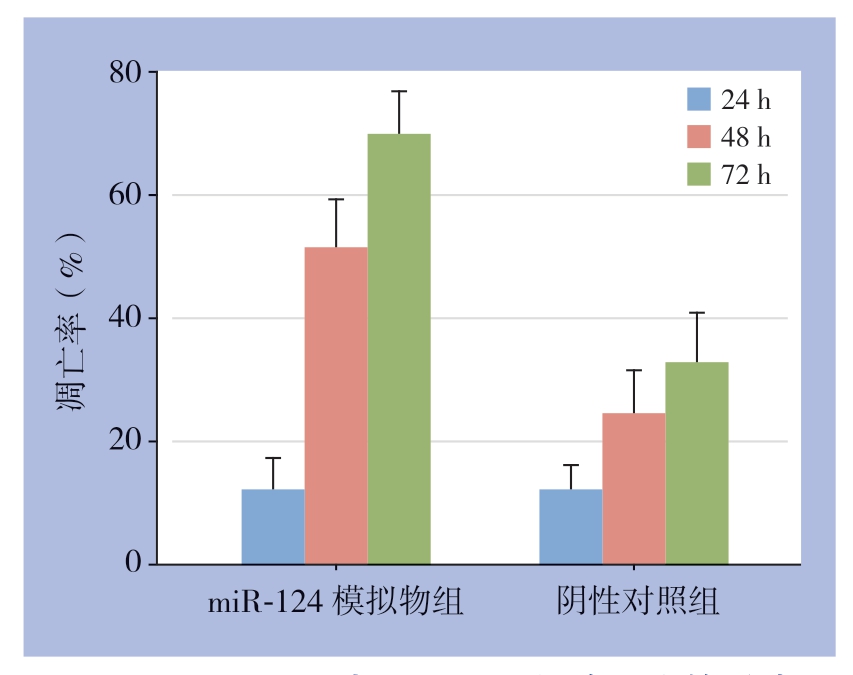
图4 miR-124 对MGC803 细胞凋亡的影响
Figure 4 Effect of miR-124 on apoptosis of MGC803 cells
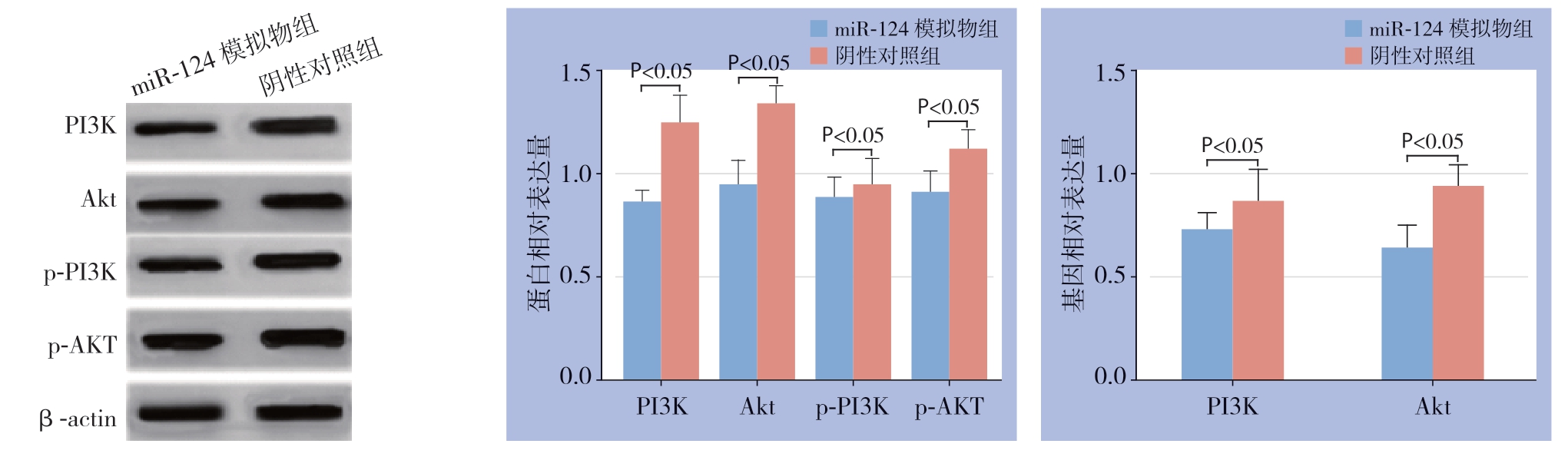
图5 miR-124 对MGC803 细胞PI3K/Akt 信号通路的影响
Figure 5 Effect of miR-124 on PI3K/Akt signaling pathway in MGC803 Cells
3 讨 论
胃癌是一种起源于胃黏膜上皮的全球性常见恶性肿瘤,我国胃癌发病率和病死率均占全球胃癌发病率和病死率的50%[14-15]。由于胃癌的发病隐匿及诊断水平限制,多数胃癌患者在确诊时已经发展为中晚期,失去了手术机会,即使早期胃癌患者在接受手术治疗后仍有可能发生局部复发或远处转移,导致治疗失败[16-17]。故寻找新的药物靶点已成为近年来的研究热点,旨在为胃癌的治疗寻找新的突破。近年的研究[18]表明miRNA可通过调控细胞增殖、凋亡和分化,促进或抑制肿瘤的恶性表型,相比正常细胞,肿瘤组织中miRNA存在明显异常表达,这些异常表达的miRNA在肿瘤形成中扮演重要角色,可作为肿瘤病因学、生物学特性、组织分型和临床分级分期的分子标志物。
miRNA是一种小的非编码RNA,能够通过切割靶信使RNA或抑制靶基因翻译的方式来抑制靶基因的表达[19]。miR-124在多种肿瘤包括消化系统肿瘤的细胞或组织中均表达下调。有研究[20]发现,miR-124与多种癌症有关,其在胃癌细胞中表达降低,并与临床分期、淋巴结转移、总生存期缩短和无病生存率有关,可能是胃癌患者生存和治疗策略的独立指标。Xie等[21]研究发现,通过上调miR-124表达水平,高浓度的miR-124不仅可抑制胃癌细胞增殖,还可促进胃癌细胞凋亡的作用;同时发现,与5-氟尿嘧啶联合使用后,miR-124对胃癌细胞的抑制作用更加明显,这为miR-124作为胃癌治疗的潜在药物靶点提供了有力的证据。但目前国内关于miR-124与胃癌发生发展及相关机制的研究报道较少。基于此,本研究成功将miR-124转染至人胃癌MGC803细胞中,并进一步考察miR-124对胃癌细胞MGC803增殖及凋亡的影响,结果显示miR-124模拟物组中细胞的miR-124高表达;转染48 h后miR-124模拟物组MGC803细胞的增殖较阴性对照组显著降低;同时流式细胞术结果显示,miR-124模拟物组MGC803细胞凋亡率较阴性对照组显著提高。由此可见,miR-124可抑制胃癌细胞MGC803增殖并促进MGC803细胞凋亡。
虽然miRNA 调控异常在胃癌中普遍存在,但miRNA在肿瘤发生和发展中的确切作用尚不清楚,目前有关miRNA的机制主要集中在细胞增殖、凋亡和侵袭等细胞过程中的关键途径上[22-24]。有研究[25-26]发现,miR-124在非小细胞肺癌组织和细胞系中均下调;miR-124可抑制非小细胞肺癌细胞增殖,并促进电离辐射诱导非小细胞肺癌细胞凋亡。为了进一步探讨miR-124对人胃癌细胞MGC803增殖及凋亡的作用机制,本研究采用Western blot法和qRT-PCR法测定PI3K/Akt信号通路关键靶点蛋白和mRNA水平。研究证实,PI3K/Akt信号通路参与调节细胞的增殖、凋亡等重要活动,其调控的失衡与多种肿瘤的发生、发展及耐药密切相关,已成为值得深入研究的治疗靶点[27]。研究[28]表明,PI3K/Akt信号激活后可促进Akt的磷酸化水平,从而防止氧化损伤,因此PI3K/Akt信号通路在细胞存活过程中起重要作用。Akt蛋白处于PI3K/AKt信号通路的中心位置,经磷酸化后被激活形成p-AkT,后者进一步使多个Akt下游蛋白发生磷酸化(包括PI3K等),从而调控肿瘤细胞的增殖与凋亡等[29]。有学者[30]分别检测胃癌干细胞和胃癌细胞中PI3K、Akt的表达,发现胃癌干细胞中PI3K、Akt蛋白与mRNA的表达明显高于胃癌细胞,推测PI3K/Akt信号通路与胃癌进展密切相关。本研究考察了miR-124对人胃癌MGC803细胞PI3K、Akt、p-PI3K和p-Akt蛋白表达及PI3K、Akt基因水平,发现miR-124模拟物组上述蛋白及基因表达均较阴性对照组显著降低。提示,miR-124可抑制PI3K/Akt信号通路,从而促进人胃癌MGC803细胞凋亡,并抑制细胞增殖,与文献报道一致[31]。
综上所述,miR-124表达的下调可促进胃癌细胞的增殖,并抑制其凋亡,其可能的机制与抑制PI3K/Akt信号通路表达有关。本研究可为胃癌的诊断与基因治疗提供参考。
[1]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.doi:10.3322/caac.21338.
[2]牛荣,王转兄,白悦,等.miR-143-3p在胃癌组织中的表达和临床意义研究以及生信分析[J].中国普外基础与临床杂志,2019,26(5):538-544.doi:10.7507/1007-9424.201901023.
Niu R,Wang ZX,Bai Y,et al.The expression and clinical significance of miR-143-3p in gastric cancer tissues with bioinformatical analysis[J].Chinese Journal of Bases and Clinics in General Surgery,2019,26(5):538-544.doi:10.7507/1007-9424.201901023.
[3]Obermannova R,Redova-Lojova M,Vychytilova-Faltejskova P,et al.Tumor Expression of miR-10b,miR-21,miR-143 and miR-145 Is Related to Clinicopathological Features of Gastric Cancer in a Central European Population[J].Anticancer Res,2018,38(6):3719-3724.doi:10.21873/anticanres.12651.
[4]Tang H,Wang Z,Liu X,et al.LRRC4 inhibits glioma cell growth and invasion through a miR-185-dependent pathway[J].Curr Cancer Drug Targets,2012,12(8):1032-1042.doi:10.2174/156800912803251180.
[5]张雷,王宇锋,王亮,等.miR-105-5p在胃癌中的表达及其意义与生物学功能[J].中国普通外科杂志,2019,28(4):423-432.doi:10.7659/j.issn.1005-6947.2019.04.007.
Zhang L,Wang YF,Wang L,et al.Expression of miR-105-5p in gastric cancer and its significance and biological function[J].Chinese Journal of General Surgery,2019,28(4):423-432.doi:10.7659/j.issn.1005-6947.2019.04.007.
[6]谢黎明,张大利,贺荣芳.miR-124抑制胃癌MKN-45细胞的侵袭与转移[J].中国现代医生,2012,50(36):1-2.
Xie LM,Zhang DL,He RF.miR-124 inhibits the invasion and metastasis of gastric carcinoma MKN-45 cells[J].China Modern Doctor,2012,50(36):1-2.
[7]Zhang T,Wang J,Zhai X,et al.MiR-124 retards bladder cancer growth by directly targeting CDK4[J].Acta Biochim Biophys Sin(Shanghai),2014,46(12):1072-1079.doi:10.1093/abbs/gmu105.
[8]Li X,Yu Z,Li Y,et al.The tumor suppressor miR-124 inhibits cell proliferation by targeting STAT3 and functions as a prognostic marker for postoperative NSCLC patients[J].Int J Oncol,2015,46(2):798-808.doi:10.3892/ijo.2014.2786.
[9]Li W,Zang W,Liu P,et al.MicroRNA-124 inhibits cellular proliferation and invasion by targeting Ets-1 in breast cancer[J].Tumour Biol,2014,35(11):10897-10904.doi:10.1007/s13277-014-2402-2.
[10]Qin W,Pan Y,Zheng X,et al.MicroRNA-124 regulates TGFα-induced epithelial-mesenchymal transition in human prostate cancer cells[J].Int J Oncol,2014,45(3):1225-1231.doi:10.3892/ijo.2014.2506.
[11]刘锋,谢黎明,张志伟,等.miR-124在胃癌中的表达及临床意义[J].中国癌症杂志,2016,26(3):215-220.doi:10.3969/j.issn.1007-3969.2016.03.003.
Liu F,Xie LM,Zhang ZW,et al.Expression of miR-124 in gastric cancer and its clinical signi-ifcance[J].China Oncology,2016,26(3):215-220.doi:10.3969/j.issn.1007-3969.2016.03.003.
[12]Hamzehzadeh L,Atkin S L,Majeed M,et al.The versatile role of curcumin in cancer prevention and treatment:A focus on PI3K/AKT pathway[J].J Cell Physiol,2018,233(10):6530-6537.doi:10.1002/jcp.26620.
[13]Cheng F,Yang Z,Huang F,et al.microRNA-107 inhibits gastric cancer cell proliferation and metastasis by targeting PI3K/AKT pathway[J].Microb Pathog,2018,121:110-114.doi:10.1016/j.micpath.2018.04.060.
[14]钱海权,周海宁,刘轲,等.多梳蛋白4与含FERM结构域蛋白4A在胃癌组织中的表达及与意义[J].中国普通外科杂志,2019,28(10):1237-1244.doi:10.7659/j.issn.1005-6947.2019.10.011.
Qian HQ,Zhou HN,Liu K,et al.Expressions of chromobox homolog 4 and FERM do-main-containing protein 4A in gastric cancer tissue and their significance[J].Chinese Journal of General Surgery,2019,28(10):1237-1244.doi:10.7659/j.issn.1005-6947.2019.10.011.
[15]Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359-386.doi:10.1002/ijc.29210.
[16]Seo HS,Jung YJ,Kim JH,et al.Long-Term Nutritional Outcomes of Near-Total Gastrectomy in Gastric Cancer Treatment:a Comparison with Total Gastrectomy Using Propensity Score Matching Analysis[J].J Gastric Cancer,2018,18(2):189-199.doi:10.5230/jgc.2018.18.e21.
[17]Zhao CL,Han SN,Wang ZJ,et al.Concomitant modulation of PTEN and Livin in gastric cancer treatment[J].Int J Mol Med,2018,41(5):2901-2908.doi:10.3892/ijmm.2018.3475.
[18]安娟,潘元明,康倩,等.胃癌患者血清miR-181d与PDCD4的表达及意义[J].肿瘤防治研究,2019,46(2):131-137.doi:10.3971/j.issn.1000-8578.2019.18.0486.
An J,Pan YM,Kang Q,et al.Expression and clinical signigicance of miR-181d and PDCD4 in serum of gastric cancer patients[J].Cancer Research on Prevention and Treatment,2019,46(2):131-137.doi:10.3971/j.issn.1000-8578.2019.18.0486.
[19]李亚昭,姚博文,石磊.microRNA-671-5p在肝细胞癌中的表达及其负向调控丝切蛋白2与上皮细胞-间质转化的关系[J].中国普通外科杂志,2020,29(1):43-52.doi:10.7659/j.issn.1005-6947.2020.01.006.
Li YZ,Yao BW,Shi L.Expression of microRNA-671-5p in hepatocellular carcinoma and the relationship between its negative regulating cofilin 2 and epithelial-mesenchymal transition[J].Chinese Journal of General Surgery,2020,29(1):43-52.doi:10.7659/j.issn.1005-6947.2020.01.006.
[20]Liu F,Hu H,Zhao J,et al.miR-124-3p acts as a potential marker and suppresses tumor growth in gastric cancer[J].Biomed Rep,2018,9(2):147-155.doi:10.3892/br.2018.1113.
[21]Xie L,Zhang Z,Tan Z,et al.MicroRNA-124 inhibits proliferation and induces apoptosis by directly repressing EZH2 in gastric cancer [J].Mol Cell Biochem,2014,392(1-2):153-159.doi:10.1007/s11010-014-2028-0.
[22]Hu M,Zhu S,Xiong S,et al.MicroRNAs and the PTEN/PI3K/Akt pathway in gastric cancer(Review)[J].Oncol Rep,2019,41(3):1439-1454.doi:10.3892/or.2019.6962.
[23]Sun Z,Shi K,Yang S,et al.Effect of exosomal miRNA on cancer biology and clinical applica-tions[J].Mol Cancer,2018,17(1):147-156.doi:10.1186/s12943-018-0897-7.
[24]Qi R,Wang D T,Xing L F,et al.miRNA-21 promotes gastric cancer growth by adjusting pros-taglandin E2[J].Eur Rev Med Pharmacol Sci,2018,22(7):1929-1936.doi:10.26355/eurrev_201804_14717.
[25]Wang M,Meng B,Liu Y,et al.MiR-124 Inhibits Growth and Enhances Radiation-Induced Apoptosis in Non-Small Cell Lung Cancer by Inhibiting STAT3[J].Cell Physiol Biochem,2017,44(5):2017-2028.doi:10.1159/000485907.
[26]Pan Y,Wu A,Xu F,et al.Lentivirus-mediated overexpression of miR-124 suppresses growth and invasion by targeting JAG1 and EZH2 in gastric cancer[J].Oncol Lett,2018,15(5):7450-7458.doi:10.3892/ol.2018.8194.
[27]Provinciali N,Lazzeroni M,Cazzaniga M,et al.Metformin:riskbenefit profile with a focus on cancer[J].Expert Opin Drug Saf,2015,14(10):1573-1585.doi:10.1517/14740338.2015.1084289.
[28]Xu X,Liu X,Zhang Y.Osthole inhibits gastric cancer cell proliferation through regulation of PI3K/AKT[J].PLoS One,2018,13(3):e0193449.doi:10.1371/journal.pone.0193449.
[29]祁迪,谭群友,王如文,等.吴茱萸碱抑制PI3K/AKT通路诱导小细胞肺癌H1688和H446细胞凋亡[J].第三军医大学学报,2016,38(4):330-337.doi:10.16016/j.1000-5404.201508031.
Qi D,Tan QY,Wang RW,et al.Evodiamine induces apoptosis of small-cell lung cancer H1688 and H446 cells via inhibiting PI3K/AKT pathway[J].Journal Of Third Military Medical University,2016,38(4):330-337.doi:10.16016/j.1000-5404.201508031.
[30]查璐琴,韩本高,张超杰.二甲双胍通过Akt通路调控胃癌干细胞的增殖与凋亡[J].中国组织工程研究,2019,23(5):657-662.doi:10.3969/j.issn.2095-4344.1544.
Zha LQ,Han BG,Zhang CJ.Metformin regulates proliferation and apoptosis of gastric cancer stem cells through the Akt pathway[J].Chinese Journal of Tissue Engineering Research,2019,23(5):657-662.doi:10.3969/j.issn.2095-4344.1544.
[31]叶群立,张洋洋,罗金健.柚皮素联合Bcl-2抑制剂ABT-263调控信号通路AKT对胃癌细胞增殖凋亡的影响[J].中国老年学杂志,2019,39(8):1948-1951.doi:10.3969/j.issn.1005-9202.2019.08.050.
Ye QL,Zhang YY,Luo JJ.Effects of Naringenin combined with the Bcl-2 inhibitor ABT-263 on the proliferation and apoptosis of gastric cancer cells by controlling the signa-ling pathways AKT[J].Chinese Journal of Gerontology,2019,39(8):1948-1951.doi:10.3969/j.issn.1005-9202.2019.08.050.
