肝细胞癌(hepatocellular carcinoma,HCC)是最常见的原发性肝癌[1],也是全球第五大常见恶性肿瘤[2-3]。此外,由于各种危险因素,HCC的发病率也有所增加[4],但目前仍缺乏理想的防治方法。人体肠道菌群存在一定的动态平衡,在维持人体健康方面具有重要的作用。若肠道菌群的平衡受到各种不良因素的影响,就会形成肠道菌群失调(intestinal dysbacteriosis,ID),导致或促进各种疾病的发生发展[5]。因此,肠道菌群在生理和病理过程中起着至关重要的作用[6]。近年来,随着对肝-肠轴认识的逐渐深入,肠道菌群与HCC之间的重要联系越来越受到重视[7-8]。一方面,研究显示ID促进HCC[9];另一方面,HCC的发生影响肠道菌群,导致ID的发生[8,10],这是一个恶性循环的过程。因此,肝脏与肠道通过肝-肠轴相关联的特征提示,除了治疗肝脏原发病变外,肠道微生态系统的稳态也应作为HCC治疗的重要靶点[3,11]。了解HCC患者肠道菌群的影响因素,有助于找到肠道菌群调节的潜在靶点。然而,目前大多数关于肠道菌群与HCC相关性的研究都是动物实验。哪些因素是HCC患者肠道菌群的主要影响因素?根据HCC的特点,综合考虑各种因素,探讨HCC患者肠道菌群的主要影响因素鲜有报道。因此,本研究的目的是探讨HCC患者肠道菌群的主要影响因素。这些因素与肠道菌群之间的相关性有助于为HCC患者肠道菌群的调控提供潜在靶点以及肠道菌群干预治疗HCC提供理论依据。
1 材料与方法
1.1 研究对象和数据收集
选取2018年11月—2019年7月广西医科大学第一附属医院肝胆外科符合条件的121例HCC患者为研究对象。所有患者均自愿参与本研究,并签署书面知情同意书。本研究经广西医科大学第一附属医院伦理委员会批准。纳入标准:⑴年龄为18~65岁;⑵ 术后病理确诊为HCC;⑶ 首次进行HCC肝切除术;⑷ HCC合并乙肝;⑸ 自愿参加本次研究,并签署知情同意书。排除标准:⑴ 有复发、转移或合并其他恶性肿瘤;⑵ HCC破裂急诊手术;⑶ 入院前1个月内使用抗生素或益生菌制剂;⑷ 术前未能收集粪便标本。
所有数据均由研究人员收集。除肠道菌群的检测和焦虑的评估外,其他数据均在医院系统收集,包括性别;年龄;肝功能指标:总胆红素(total bilirubin,TBIL)、白蛋白(albumin,ALB)、总胆汁酸(total bile acid,TBA)、天冬氨酸转氨酶(aspartate transaminase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、Child-Pugh评分、ISHAK炎症评分、ISHAK纤维化评分;免疫炎性指标:超敏C反应蛋白(hypersensitive c-reactive protein,hs-CRP)、白细胞计数(white blood cell,WBC)、中性粒细胞计数(neutrophil,NEU)、淋巴细胞计数(lymphocyte,LYM)、单核细胞计数(monocyte,MONO),空腹血糖(fasting blood glucose,GLU);血脂、肥胖指标:高密度脂蛋白胆固醇/低密度脂蛋白胆固醇(high-density lipoprotein cholesterol/low-density liporprotein cholesterol,HDL-C/LDL-C)、高密度脂蛋白胆固醇/总胆固醇(high-density lipoprotein cholesterol/total cholesterol,HDL-C/T-CHO)、体质量指数(body mass index,BMI);HCC分期:巴塞罗那临床肝癌(Barcelona Clinical Liver Cancer,BCLC)分期、中国分期(Chinese Stage,CS)。其中,使用术前的粪便标本检测肠道菌群;入院第2天的外周血检测TBIL、ALB、TBA、AST、ALT、hs-CRP、WBC、NEU、LYM、MONO、GLU、HDL-C/LDL-C、HDL-C/T-CHO;术后的病理标本评估ISHAK炎症、纤维化评分。
1.2 肠道菌群失调诊断
双歧杆菌/肠杆菌(Bifidobacterium/Enterobacteriaceae,B/E)值>1表示肠道菌群的组成正常,B/E值<1表示ID,而且B/E值越低,提示ID越严重[12]。
1.3 焦虑评估和粪便标本收集
研究人员使用状态焦虑评估量表评估HCC患者术前的焦虑水平。并在术前使用粪便标本采集管留取中段粪便作为标本,避免尿液污染,留取标本后放入装有冰袋的泡沫盒中。研究人员尽快将粪便样本送往实验室,分装成0.2 g/管后放入-80 ℃的冰箱中保存。
1.4 肠道菌群检测
使用粪便基因组DNA提取试剂盒(离心柱型)(北京天根,DP328-02)提取粪便标本的总DNA,具体步骤严格按照说明书进行。本研究使用的引物[13-14]见表1,由生工生物工程(上海)股份有限公司合成。双歧杆菌(126 bp)正向:5'-GCG TGC TTA ACA CAT GCA AG TC-3',反向:5'-CAC CCG TTT CCA GGA GCT ATT-3';肠杆菌(195 bp)正向:5'-CAT TGA CGT TAC CCG CAG AAG AAG C-3',反向:5'-CTC TAC GAG ACT CAA GCT TGC-3'。
使用TB GreenTM Premix Ex TaqTM II(Tli RNaseH Plus)(北京TaKaRa,RR820A)在Applied Biosystems 7500(美国)进行实时荧光定量PCR扩增,扩增的菌群包括双歧杆菌和肠杆菌。在冰上配置PCR反应液,每1份PCR反应液 (20 μL)包括TB GreenPremix Ex Taq II(Tli RNaseH Plus)(2×)10 μL、PCR Forward Primer(10 μmol/L)1 μL、PCR Reverse Primer(10 μmol/L)1 μL、ROX Reference Dye II 0.4 μL、DNA模板2 μL、灭菌水5.6 μL。扩增程序为:预变性95 ℃(30 s),变性95 ℃(5 s),退火延伸[双歧杆菌:60 ℃(34 s),肠杆菌:59 ℃(34 s)],40个循环,融解曲线步骤为仪器默认。引物的特异性通过扩增产物的融解曲线来确定。在每1次PCR扩增中均构建标准曲线并设置阴、阳性对照。
1.5 标准曲线构建
双歧杆菌和肠杆菌的质粒标准品由生工生物工程(上海)股份有限公司合成。先检测标准品的浓度,计算其DNA拷贝数,然后将质粒标准品5倍比8个梯度稀释后进行实时荧光定量PCR,以DNA拷贝数的对数值为横坐标,PCR扩增的结果CT值为纵坐标来构建标准曲线。最后,粪便样本中双歧杆菌和肠杆菌的拷贝数通过其标准曲线来定量。
1.6 统计学处理
采用SPSS 22.0进行统计分析。计量资料以均数±标准差(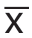 ±s)表示。采用配对t检验比较菌群的丰度。使用Pearson相关、Spearman秩相关或两样本t检验进行单因素分析,然后将单因素分析结果为P<0.1的变量纳入多重线性回归(逐步回归法)。以P<0.05表示差异具有统计学意义。
±s)表示。采用配对t检验比较菌群的丰度。使用Pearson相关、Spearman秩相关或两样本t检验进行单因素分析,然后将单因素分析结果为P<0.1的变量纳入多重线性回归(逐步回归法)。以P<0.05表示差异具有统计学意义。
2 结 果
2.1 标准曲线
双歧杆菌、肠杆菌质粒标准品构建的标准曲线的斜率、决定系数和扩增效率分别为-2.46、0.99、92%和-2.55、0.99、88%,均达到定量的标准(图1)。
2.2 肠道菌群的定量分析
HCC患者肠杆菌的丰度明显高于双歧杆菌[Log5(6.24±1.30)/g vs.Log5(7.59±1.11)/g,P=0.000]。ID(B/E<1)的发生率为77.69%(94/121)。
2.3 单因素分析结果
单因素分析显示,双歧杆菌中,性别、TBA、WBC、NEU、MONO、HDL-C/LDL-C、HDL-C/T-CHO的差异具有统计学意义(均P<0.05)。对于肠杆菌,TBIL、性别、GLU的差异具有统计学意义(均P<0.05)。对于B/E值,MONO差异有统计学意义(P<0.05)(表1)。
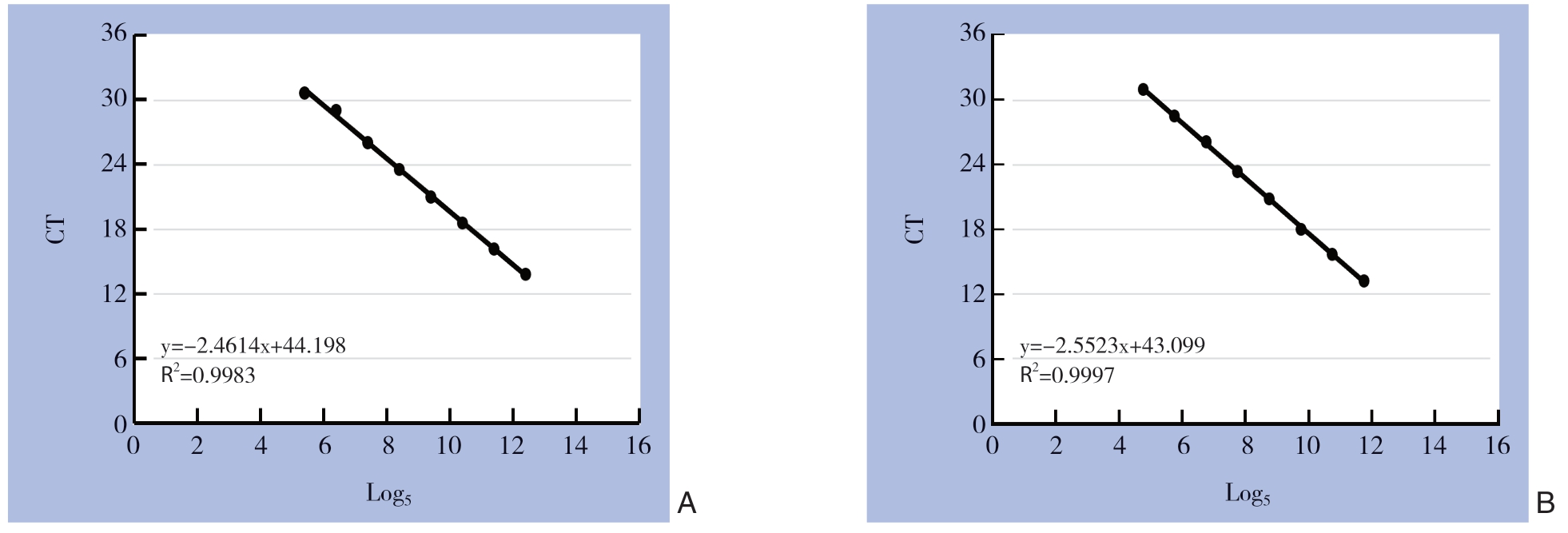
图1 质粒标准品的标准曲线
Figure 1 Standard curves of plasmid DNA standards
A:双歧杆菌标准品的标准曲线;B:肠杆菌标准品的标准曲线
A:Standard curve for standard of Bifidobacterium;B:Standard curve for standard of Enterobacteriaceae
表1 单因素分析肠道菌群的影响因素
Table 1 Univariate analysis of the influencing factors for gut microbiota
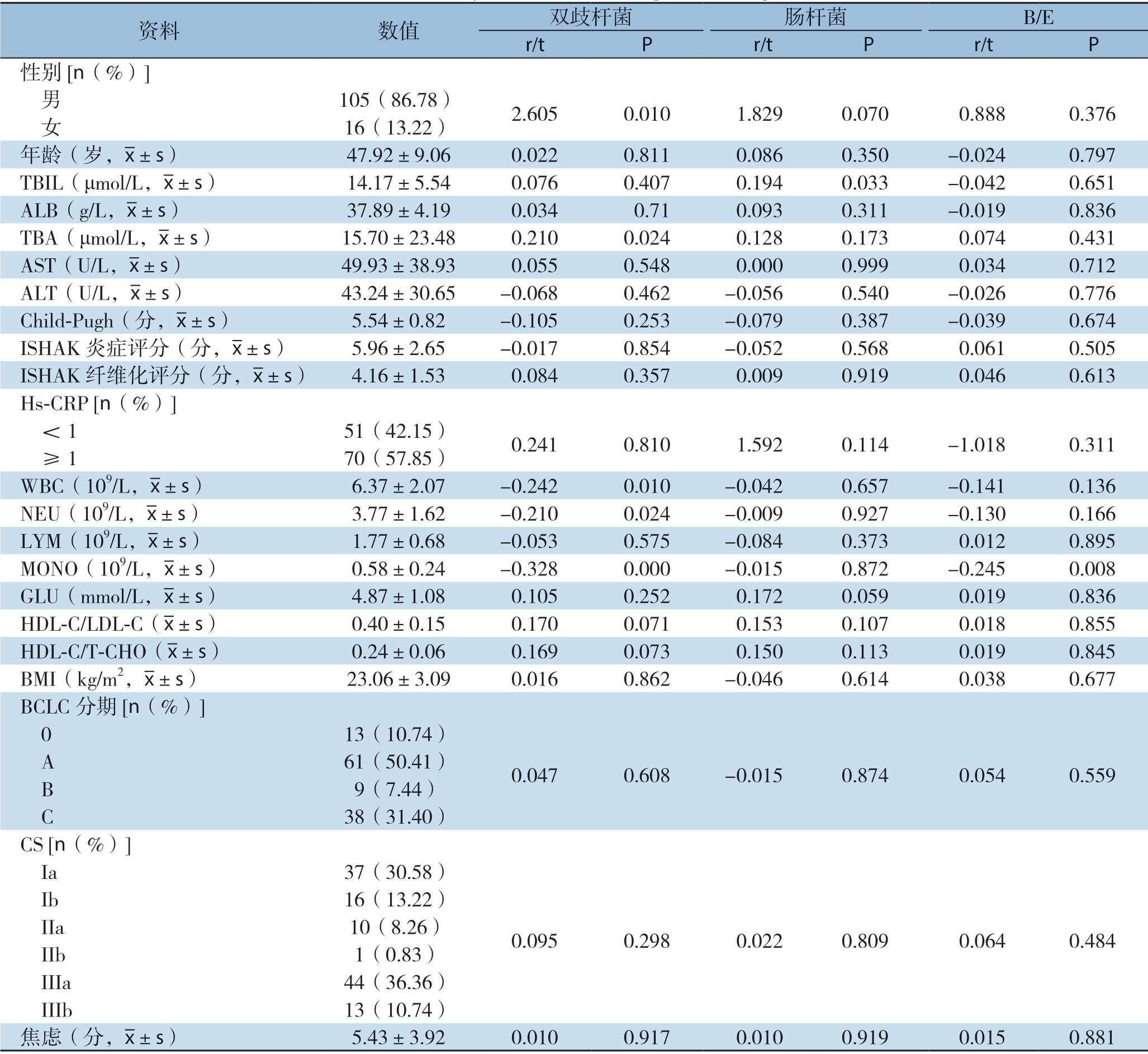
资料 数值 双歧杆菌 肠杆菌 B/E r/t P r/t P r/t P性别[n(%)]男 105(86.78) 2.605 0.010 1.829 0.070 0.888 0.376 女 16(13.22)年龄(岁,images/BZ_40_1331_2693_1363_2730.png±s) 47.92±9.06 0.022 0.811 0.086 0.350 -0.024 0.797 TBIL(μmol/L,images/BZ_40_1331_2693_1363_2730.png±s) 14.17±5.54 0.076 0.407 0.194 0.033 -0.042 0.651 ALB(g/L,images/BZ_40_1331_2693_1363_2730.png±s) 37.89±4.19 0.034 0.71 0.093 0.311 -0.019 0.836 TBA(μmol/L,images/BZ_40_1331_2693_1363_2730.png±s) 15.70±23.48 0.210 0.024 0.128 0.173 0.074 0.431 AST(U/L,images/BZ_40_1331_2693_1363_2730.png±s) 49.93±38.93 0.055 0.548 0.000 0.999 0.034 0.712 ALT(U/L,images/BZ_40_1331_2693_1363_2730.png±s) 43.24±30.65 -0.068 0.462 -0.056 0.540 -0.026 0.776 Child-Pugh(分,images/BZ_40_1331_2693_1363_2730.png±s) 5.54±0.82 -0.105 0.253 -0.079 0.387 -0.039 0.674 ISHAK炎症评分(分,images/BZ_40_1331_2693_1363_2730.png±s) 5.96±2.65 -0.017 0.854 -0.052 0.568 0.061 0.505 ISHAK纤维化评分(分,images/BZ_40_1331_2693_1363_2730.png±s) 4.16±1.53 0.084 0.357 0.009 0.919 0.046 0.613 Hs-CRP [n(%)]<1 51(42.15) 0.241 0.810 1.592 0.114 -1.018 0.311 ≥1 70(57.85)WBC(109/L,images/BZ_40_1331_2693_1363_2730.png±s) 6.37±2.07 -0.242 0.010 -0.042 0.657 -0.141 0.136 NEU(109/L,images/BZ_40_1331_2693_1363_2730.png±s) 3.77±1.62 -0.210 0.024 -0.009 0.927 -0.130 0.166 LYM(109/L,images/BZ_40_1331_2693_1363_2730.png±s) 1.77±0.68 -0.053 0.575 -0.084 0.373 0.012 0.895 MONO(109/L,images/BZ_40_1331_2693_1363_2730.png±s) 0.58±0.24 -0.328 0.000 -0.015 0.872 -0.245 0.008 GLU(mmol/L,images/BZ_40_1331_2693_1363_2730.png±s) 4.87±1.08 0.105 0.252 0.172 0.059 0.019 0.836 HDL-C/LDL-C(images/BZ_40_1331_2693_1363_2730.png±s) 0.40±0.15 0.170 0.071 0.153 0.107 0.018 0.855 HDL-C/T-CHO(images/BZ_40_1331_2693_1363_2730.png±s) 0.24±0.06 0.169 0.073 0.150 0.113 0.019 0.845 BMI(kg/m2,images/BZ_40_1331_2693_1363_2730.png±s) 23.06±3.09 0.016 0.862 -0.046 0.614 0.038 0.677 BCLC分期[n(%)]0 13(10.74) A 61(50.41) 0.047 0.608 -0.015 0.874 0.054 0.559 B 9(7.44) C 38(31.40)CS [n(%)]Ia 37(30.58)0.095 0.298 0.022 0.809 0.064 0.484 Ib 16(13.22) IIa 10(8.26) IIb 1(0.83) IIIa 44(36.36) IIIb 13(10.74)焦虑(分,images/BZ_40_1331_2693_1363_2730.png±s) 5.43±3.92 0.010 0.917 0.010 0.919 0.015 0.881
2.4 多重线性回归分析结果
多重线性回归显示,MONO是双歧杆菌(P<0.000)和ID(P=0.008)的主要影响因素;TBIL(P=0.011)、性别(P=0.027)、GLU(P=0.038)是肠杆菌的主要影响因素(表2)。
表2 多重线性回归分析肠道菌群的影响因素
Table 2 Multiple linear regression analysis of the influencing factors for gut microbiota
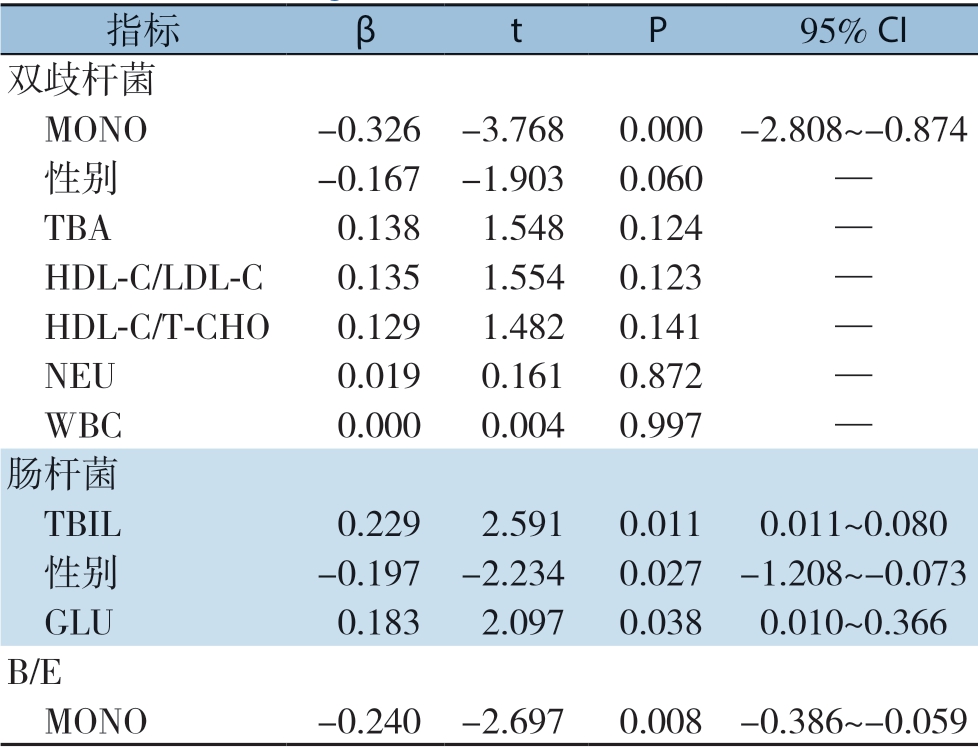
指标 β t P 95% CI双歧杆菌 MONO -0.326 -3.768 0.000 -2.808~-0.874 性别 -0.167 -1.903 0.060 — TBA 0.138 1.548 0.124 — HDL-C/LDL-C 0.135 1.554 0.123 — HDL-C/T-CHO 0.129 1.482 0.141 — NEU 0.019 0.161 0.872 — WBC 0.000 0.004 0.997 —肠杆菌 TBIL 0.229 2.591 0.011 0.011~0.080 性别 -0.197 -2.234 0.027 -1.208~-0.073 GLU 0.183 2.097 0.038 0.010~0.366 B/E MONO -0.240 -2.697 0.008 -0.386~-0.059
3 讨 论
健康人的肠道菌群主要由专性厌氧有益菌组成,如双歧杆菌,维持肠道菌群的平衡。本研究发现HCC患者中双歧杆菌的丰度显著低于肠杆菌,与健康人菌群的组成相反,这与之前的报道是一致的[15]。B/E值包括主要的有益菌双歧杆菌和主要的条件致病菌肠杆菌,构成肠道的定植抗性。因此,B/E值可以用来代表ID。B/E<1表示ID,而且B/E越低,表示ID越严重[12]。本研究还发现,HCC患者ID的发生率为77.69%。以往研究报道,HCC患者肠道细菌过度生长的发生率为71.8%,明显高于肝硬化患者的发生率(41.1%)[16]。
本研究中,TBIL与肠杆菌呈正相关,是肠杆菌的主要影响因素之一;MONO与双歧杆菌和ID呈负相关,是双歧杆菌和ID的主要影响因素。其分子机制为:趋化因子CC家族(C-C motif chemokine ligand,CCL)如CCL3、CCL4、CCL5等,由肝肿瘤细胞分泌并参与MONO的激活[17-19]。作为肝功能的重要指标,TBIL升高提示肝功能异常。肝脏功能障碍降低了肝脏清除内毒素的能力,其主要活性成分脂多糖进入体循环。当脂多糖与MONO表面的相应受体结合时,一系列的信号转导可诱导大量的炎症介质,导致全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)的发生[20-21]。一方面,SIRS导致组织内高代谢状态,组织内氧需求量增加,肠上皮细胞氧分压降低。另一方面,由于SIRS灌注量低,肾素-血管紧张素的激活引起小动脉收缩,而小肠缺血又进一步加剧了小动脉的收缩[22]。此外,在动物研究中发现大量的炎症介质使肠道黏膜的通透性增加[23]。肠黏膜屏障因缺氧、缺血和肠黏膜通透性增加遭到破坏,导致肠道菌群的改变。Li等[24] 的研究表明,TBIL与内毒素呈正相关,而血浆内毒素水平与慢性重型肝炎患者粪肠杆菌数量呈正相关。研究发现HCC患者伴随着双歧杆菌的减少,肠杆菌的增加,循环MONO的激活[14]。此外,Chen等[25]的研究证实了肠道菌群与MONO亚群之间的密切联系。这些结果与本研究结果一致。本研究证明了肝功能、炎症指标与肠道菌群的相关性,提示肝功能损伤和炎症的治疗有利于促进肠道菌群的平衡,也为肠道菌群干预作为HCC的治疗靶点提供了理论依据。
性别与肠道菌群具有相关性,女性和男性的肠道菌群存在明显的差异[26]。Huang等[27]发现,兼性厌氧细菌相对丰度的增加和厌氧细菌相对丰度的降低可以作为女性HCC的风险指标,但对于男性HCC无效,因为雌性的肠道菌群比雄性对肝损伤更敏感。本研究结果也发现了类似的现象,即兼性厌氧菌肠杆菌在女性HCC中比在男性HCC中更为丰富。男性和女性肠道菌群的差异不仅有利于建立不同的HCC预警模型,也为肠道菌群的调节提供了不同的针对性干预措施。
此外,本研究结果还提示GLU是HCC患者肠杆菌的主要影响因素之一,两者呈正相关。HCC的发生伴随着代谢功能的改变,从而引起血糖的改变。葡萄糖转运蛋白GLUT2直接参与高血糖对肠上皮细胞的转录重编,改变肠上皮细胞紧密连接和黏附连接的完整性,增加了肠道屏障的通透性,引起肠道菌群的改变[28]。还有研究发现肠道菌群与个体化血糖控制相关[29]。以往研究[30]和本研究都证实了血糖与肠道菌群的相关性。这意味着良好的血糖控制有助于个人保持肠道菌群的平衡。
综上所述,MONO、TBiL、性别和GLU被证实影响HCC患者的肠道菌群,从而导致ID。这些因素与肠道菌群的相关性可能为HCC患者肠道菌群的调节提供潜在靶点,同时也为肠道菌群干预治疗HCC提供理论依据。
[1]Tu T,Budzinska MA,Maczurek AE,et al.Novel aspects of the liver microenvironment in hepatocellular carcinoma pathogenesis and development[J].Int J Mol Sci,2014,15(6):9422-9458.doi:10.3390/ijms15069422.
[2]El-Serag HB.Epidemiology of viral hepatitis and hepatocellular carcinoma[J].Gastroenterology,2012,142(6):1264-1273.doi:10.1053/j.gastro.2011.12.061.
[3]Yu LX,Schwabe RF.The gut microbiome and liver cancer:mechanisms and clinical translation[J].Nat Rev Gastro Hepat,2017,14(9):527-539.doi:10.1038/nrgastro.2017.72.
[4]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China[J].CA Cancer J Clin,2016,66(2):115-132.doi:10.3322/caac.21338.
[5]Dethlefsen L,McFall-Ngai M,Relman DA.An ecological and evolutionary perspective on human-microbe mutualism and disease[J].Nature,2016,449(7164):811-818.doi:10.1038/nature06245.
[6]Betrapally NS,Gillevet PM,Bajaj JS.Gut microbiome and liver disease[J].Transl Res,2017,179:49-59.doi:10.1016/j.trsl.2016.07.005.
[7]Ponziani FR,Nicoletti A,Gasbarrini A,et al.Diagnostic and therapeutic potential of the gut microbiota in patients with early hepatocellular carcinoma[J].Ther Adv Med Oncol,2019,11:1758835919848184.doi:10.1177/1758835919848184.
[8]Ni J,Huang R,Zhou H,et al.Analysis of the Relationship Between the Degree of Dysbiosis in Gut Microbiota and Prognosis at Different Stages of Primary Hepatocellular Carcinoma[J].Front Microbiol,2019,10:1458.doi:10.3389/fmicb.2019.01458.
[9]Dapito DH,Mencin A,Gwak GY,et al.Promotion of hepatocellular carcinoma by the intestinal microbiota and TLR4[J].Cancer Cell,2012,21(4):504-516.doi:10.1016/j.ccr.2012.02.007.
[10]Schnabl B,Brenner DA.Interactions between the intestinal microbiome and liver diseases[J].Gastroenterology,2014,146(6):1513-1524.doi:10.1053/j.gastro.2014.01.020.
[11]Woodhouse CA,Patel VC,Singanayagam A,et al.Review article:the gut microbiome as a therapeutic target in the pathogenesis and treatment of chronic liver disease[J].Aliment Pharmacol Ther,2018,47(2):192-202.doi:10.1111/apt.14397.
[12]《中华消化杂志》编委会,王兴鹏.肠道菌群失调诊断治疗建议[J].中华消化杂志,2009,29(5):335-337.doi:10.3760/cma.j.issn.0254-1432.2009.05.014.
Editorial Committee of Chinese Journal of Digestion,Wang XP.Recommendation for management of intestinal microbial flora disorders[J].Chinese Journal of Digestion,2009,29(5):335-337.doi:10.3760/cma.j.issn.0254-1432.2009.05.014.
[13]Penders J,Thijs C,van den Brandt PA,et al.Gut microbiota composition and development of atopic manifestations in infancy:the KOALA Birth Cohort Study[J].Gut,2007,56(5):661-667.doi:10.1136/gut.2006.100164.
[14]Bartosch S,Fite A,Macfarlane GT,et al.Characterization of bacterial communities in feces from healthy elderly volunteers and hospitalized elderly patients by using real-time PCR and effects of antibiotic treatment on the fecal microbiota[J].Appl Environ Microbiol,2004,70(6):3575-3581.doi:10.1128/AEM.70.6.3575-3581.2004.
[15]Ponziani FR,Bhoori S,Castelli C,et al.Hepatocellular Carcinoma Is Associated With Gut Microbiota Profile and Inflammation in Nonalcoholic Fatty Liver Disease[J].Hepatology,2019,69(1):107-120.doi:10.1002/hep.30036.
[16]周东晓,马英杰,陈光耀,等.肝细胞癌患者外周血单个核细胞表面Toll样受体2和4与小肠细菌过度生长的关系[J].中华肝脏病杂志,2019,27(4):286-290.doi:10.3760/cma.j.issn.1007-3418.2019.04.009.
Zhou XD,Ma YJ,Chen GY,et al.Relationship of TLR2 and TLR4 expressions on the surface of peripheral blood mononuclear cells to small intestinal bacteria overgrowth in patients with hepatocellular carcinoma[J].Chinese Journal of Hepatology,2019,27(4):286-290.doi:10.3760/cma.j.issn.1007-3418.2019.04.009.
[17]Yang X,Lu P,Fujii C,et al.Essential contribution of a chemokine,CCL3,and its receptor,CCR1,to hepatocellular carcinoma progression[J].Int J Cancer,2010,118(8):1869-1876.doi:10.1002/ijc.21596.
[18]Mohs A,Kuttkat N,Reißing J,et al.Functional role of CCL5/RANTES for HCC progression during chronic liver disease[J].J Hepatol,2017,66(4):743-753.doi:10.1016/j.jhep.2016.12.011.
[19]Sadeghi M,Lahdou I,Oweira H,et al.Serum levels of chemokines CCL4 and CCL5 in cirrhotic patients indicate the presence of hepatocellular carcinoma[J].Br J Cancer,2015,113(5):756-762.doi:10.1038/bjc.2015.227.
[20]Gouwy M,Struyf S,Verbeke H,et al.CC chemokine ligand-2 synergizes with the nonchemokine G protein-coupled receptor ligand fMLP in monocyte chemotaxis,and it cooperates with the TLR ligand LPS via induction of CXCL8[J].J Leukoc Biol,2009,86(3):671-680.doi:10.1189/jlb.1008638.
[21]Li P,Wu YH,Zhu YT,et al.Requirement of Rab21 in LPS-induced TLR4 signaling and pro-inflammatory responses in macrophages and monocytes[J].Biochem Biophys Res Commun,2019,508(1):169-176.doi:10.1016/j.bbrc.2018.11.074.
[22]Reilly PM,Wilkins KB,Fuh KC,et al.The mesenteric hemodynamic response to circulatory shock:an overview[J].Shock,2001,15(5):329-343.doi:10.1097/00024382-200115050-00001.
[23]Shu X,Zhang J,Wang Q,et al.Glutamine decreases intestinal mucosal injury in a rat model of intestinal ischemia-reperfusion by downregulating HMGB1 and inflammatory cytokine expression[J].Exp Ther Med,2016,12(3):1367-1372.doi:10.3892/etm.2016.3468.
[24]Li L,Wu Z,Ma W,et al.Changes in intestinal microflora in patients with chronic severe hepatitis[J].Chin Med J (Engl),2001,114(8):869-872.
[25]Chen H,Qian L,Lv Q,et al.Change in gut microbiota is correlated with alterations in the surface molecule expression of monocytes after Roux-en-Y gastric bypass surgery in obese type 2 diabetic patients[J].Am J Transl Res,2017,9(3):1243-1254.
[26]Xie G,Wang X,Zhao A,et al.Sex-dependent effects on gut microbiota regulate hepatic carcinogenic outcomes[J].Sci Rep,2017,7:45232.doi:10.1038/srep45232.
[27]Huang R,Li T,Ni J,et al.Different Sex-Based Responses of Gut Microbiota During the Development of Hepatocellular Carcinoma in Liver-Specific Tsc1-Knockout Mice[J].Front Microbiol,2018,9:1008.doi:10.3389/fmicb.2018.01008.
[28]Thaiss CA,Levy M,Grosheva I,et al.Hyperglycemia drives intestinal barrier dysfunction and risk for enteric infection[J].Science,2018,359(6382):1376-1383.doi:10.1126/science.aar3318.
[29]Shen L,Ao L,Xu H et al.Poor short-term glycemic control in patients with type 2 diabetes impairs the intestinal mucosal barrier:a prospective,single-center,observational study[J].BMC Endocr Disord,2019,19(1):29.doi:10.1186/s12902-019-0354-7.
[30]廖孝枫,刘合利.肠道微生态与糖尿病的关系及研究进展[J].中国普通外科杂志,2018,27(4):506-513.doi:10.3978/j.issn.1005-6947.2018.04.017.
Liao XF,Liu HL.Association of intestinal microecological environments with diabetes mellitus and the research progress[J].Chinese Journal of General Surgery,2018,27(4):506-513.doi:10.3978/j.issn.1005-6947.2018.04.017.
