肝细胞肝癌(hepatocellular carcinoma,HCC)好发于30~60岁男性[1]。由于部分患者不具备临床典型特征,各种病灶造影重叠,难以被发现,而失去了最佳治疗时间[2]。早期鉴别诊断、选择合适的治疗方案,控制病情进展是治疗HCC的关键之所在[3]。肝脏穿刺是诊断HCC的“金标准”,但其具有有创性,导致临床使用受限,目前多采用影像学进行诊断[4-5]。目前用于检查HCC的主要方法包括B超、CT、X线等,其中CT检查是主要方法,能够明显观察到病灶大小、边缘、病灶周围及转移情况,但对于影像学特点不典型的HCC则存在一定的难度[6-7]。随着MRI技术的发展,其对软组织的分辨率提高,成为检查肿瘤病变的常用方法[8]。多模态MRI包括动态增强检查(dynamic contrast enhancement,DCE)和弥散加权成像(diffusion weighted imaging,DWI),DCE可反映组织血供情况,DWI可反映分子运动情况[9]。目前MRI技术广泛应用于乳腺肿瘤良恶性鉴别[9]以及缺血性脑卒中[10]的诊断,在影像学特点不典型的HCC中研究较少。本研究选取我院收治的80例影像学特点不典型的HCC患者作为研究对象,分析多模态磁共振成像的临床应用价值。
1 资料与方法
1.1 一般资料
选取我院2018年8月—2020年2月80例影像学特点不典型的HCC患者为研究对象,女28例,男52例;年龄25~73岁,平均年龄(50.35±20.92)岁。纳入标准:⑴ 符合《原发性肝癌诊疗规范(2017年版)》诊断标准,即:甲胎蛋白>400μg/L维持4周以上或者是甲胎蛋白>200μg/L维持8周以上且病理活检确诊为HCC[11];⑵ 缺乏HCC典型的“快升快降”影像表现;⑶年龄28~75岁;⑷ 临床资料完整;⑸ 患者及其家属自愿签署知情同意书。排除标准:⑴ 检查前接受治疗者;⑵ 意识模糊、精神障碍者;⑶ 妊娠或哺乳期妇女。本研究经安徽省立医院医学伦理委员会审批(伦理批件号:2018KY伦审第08号)。
1.2 方法
1.2.1 CT扫描 检查前去除患者身上的电子、磁性级金属器件。检查前需禁食6~8 h,取仰卧位,扫描肝脏。所有患者均行CT动态增强扫描:采用GE Discovery CT750 HD螺旋CT扫描仪(美国通用公司),从膈顶向下扫描,至肝脏下缘。先平扫,再经肘静脉给予碘海醇(国药准字H10970327,扬子江药业集团有限公司),1.5 mL/kg,行动态增强扫描,速率3.5 mL/s,30 s后动脉期扫描,60 s后门脉期扫描,120 s延迟期扫描,图像分析。
1.2.2 多模态MRI扫描 采用3.0T磁共振(Siemens Trio 3.0 Tesla超导型磁共振扫描仪和体部相控柔软线圈,德国西门子)。扫描序列:平扫T1WI,快速扰相梯度回波序列(TE 3.5 ms,TR 180.0 ms,矩阵320×320,层厚6.5 mm,间隔2 mm,视野400 mm×300 mm),激励2次,T2WI,呼吸触发快速自旋回波序列(TE 87.8 ms,TR 4500.0 ms,矩阵320×210)。扫描序列:层间隔2 mm,厚度6.5 mm,视野:380 mm×380 mm,矩阵256×256,激励2次。DWI扫描:单次激发自旋回波-平面回波(single-shot spin echo-plane echo,SE-EPI)序列,TR4 800.0 ms,层厚6.5 mm,TE 120.0 ms,矩阵256×256,间隔2 mm,视野450 mm×450 mm,激励2次。扩散敏感系数(b值)依次取(0、600、1 000 s/mm2),同时在X、Y、Z轴上施加梯度脉冲。DCE扫描:三维容积式插入法屏气检查序列,静脉注射钆喷酸葡胺注射液10 mL,速度2.5 mL/s,生理盐水10 mL。注射后20、60、120 s在门静脉期、动脉期、延迟期采集图像。
1.2.3 图像分析 将得到的DWI图像及DEC图像数据传入西门子工作站,使用软件包处理图像。观察病灶形态、数目、大小、病灶周围及信号特点。测量b值为400、800、1 000 s/mm2时病灶感兴趣区(region of interest,ROI)。ROI选 择:以 病变组织类圆形或圆形范围,避开坏死区域、血管、中央出血、胆管等,为保证正常组织和病灶ROI区域相一致,尽量选取相同层面位置。
获得ADC、相对表观弥散系数(relative apparent diffusion coefficient,rADC)值及动态时间信号强度曲线(time intensity curve,TIC)。至少测量3次然后取平均值。采用双盲法分析图像及数据,两名或两名以上资深医师并不知诊断前的病理检查结果。
1.3 观察指标
选取不典型HCC多模态磁共振成像影像特点、不同b值下肝组织和肝癌组织ADC值、敏感度、特异度、准确度为观察指标。敏感度、特异度、准确度以病理结果为参照标准。
1.4 统计学处理
应用SPSS 19.0软件进行统计分析,计量资料以均数±标准差(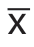 ±s)表示,计数资料采用百分率表示,采用χ2检验,不同b值采用方差分析,相同b值采用t检验,P<0.05为差异有统计学意义。
±s)表示,计数资料采用百分率表示,采用χ2检验,不同b值采用方差分析,相同b值采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 不典型HCC 患者多模态MRI 影像特点
80例不典型HCC患者共97个病灶,其中81个病灶(83.51%)为慢升快降型(门静脉和动脉期信号强,平衡期信号低,早期门静脉期最明显);11个病灶(11.34%)为平台型(动脉期信号较高,晚期强化明显,等信号为门静脉期、平衡期);5个病灶(5.15%)为无强化型(门静脉期、平衡期、动脉期均未见强化)。
2.2 不同b值下肝组织和肝癌组织ADC值比较
随b值升高,肝组织和肝癌组织ADC值逐渐降低。相同b值,与正常肝组织比,肝癌组织ADC值明显降低,差异有统计学意义(P<0.05)(表1)。
表1 不同b值下肝癌组织和正常组织ADC值比较
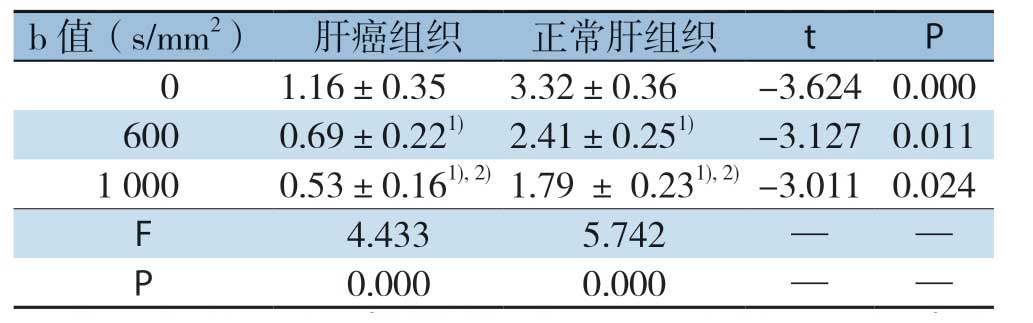
注:1)与0 s/mm2相比较,P<0.05;2)与600s/mm2相比较,P<0.05
b值(s/mm2) 肝癌组织 正常肝组织 t P 0 1.16±0.35 3.32±0.36 -3.624 0.0006000.69±0.221) 2.41±0.251) -3.127 0.011 1 0000.53±0.161),2) 1.79 ± 0.231),2) -3.011 0.024 F 4.433 5.742——P 0.0000.000——
2.3 多模态MRI诊断不典型HCC的敏感度、特异度、准确度
以病理结果为参照,97个病灶中经CT增强扫描发现89个病灶,错误诊断6个,其中转移瘤3个,血管瘤2个,胆管瘤1个。经多模态MRI(DCE+DWI)诊断均获确诊。多模态MRI诊断影像学特点不典型的HCC敏感度为100.00%、特异度100.00%、准确度100.00%,而CT增强扫描为95.06%、75.00%、91.75%,差异有统计学意义(均P<0.05)。两者诊断不典型的HCC的ROC曲线见图1。
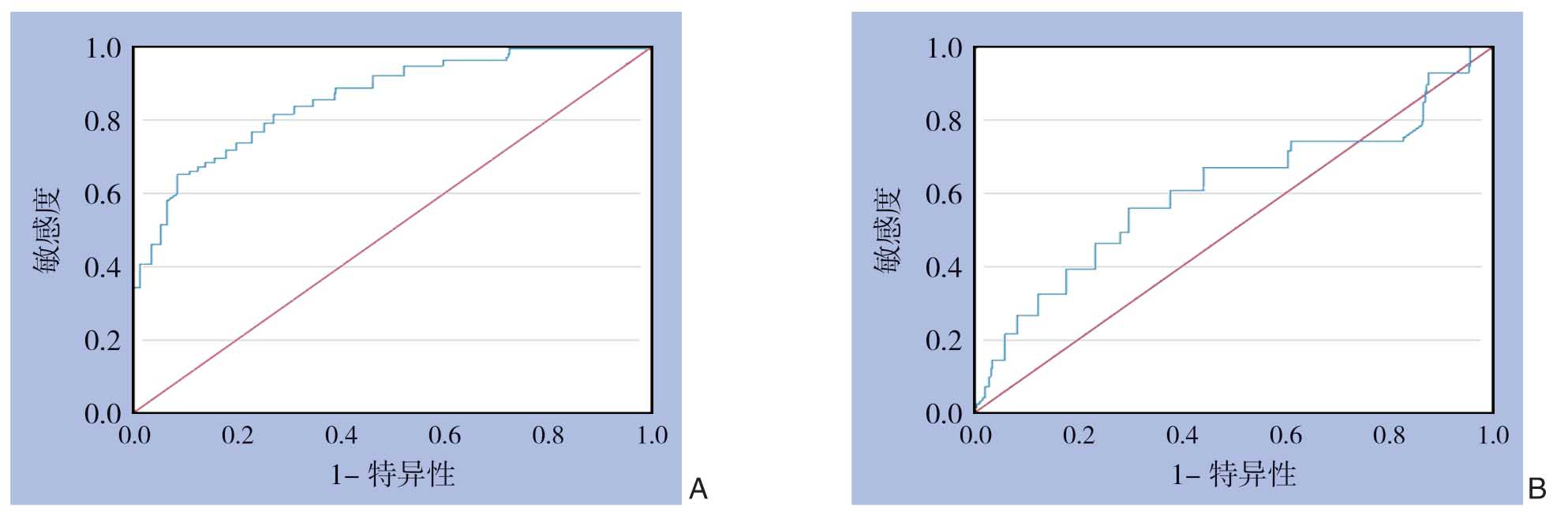
图1 两种诊断手段诊断不典型HCC的ROC曲线 A:多模态MRI;B:CT增强扫描
3 讨 论
影像学是诊断HCC的主要方法,包括、超声、MRI、CT等,典型HCC影像特点如下:肿瘤组织血供丰腴、形成假包膜、动脉与静脉分流、癌栓形成等,临床鉴别和诊断容易[12]。CT扫描多为肝癌低密度灶,少数为高密度或低密度,而密度的不同取决于肿瘤自身成分、分化以及周围肝脏密度[13]。若肝癌细胞呈良好分化,其密度与正常肝组织相近,等密度肝癌与背景密度一致,单一进行CT扫描易出现漏诊[14]。超声诊断获得的信息易受技术模式、操作水平的影响而导致结果失真。MRI在诊断肿瘤中具有一定的优势,包括多参数、高分辨率、多序列成像等,能够清楚的显示软组织病变特征及病理变化,肝动脉期是指动脉灌注期相,动脉相持续和灌注时间较短,随着门静脉相开,肝实质呈高表达直至到达高峰称为门静脉灌注期,正常肝脏是双重供血,且门静脉为主要供血,但肝癌则是以肝动脉供血,新血管生成,肿瘤组织损害血管壁,形成动静脉瘘,动脉血流量增加、动力学改变,而肿瘤组织多出现动脉期增强,到达门静脉期时,增强的病灶区域快速减退,但此种征象并非每个HCC患者均存在。近些年来影像学特点不典型的HCC患者数量呈现出明显增加态势,此类患者难以通过CT扫描、超声检查、MRI检查获得明确诊断[15]。多模态MRI成像的涌现给临床诊断工作提供了强大的助力,吴津民等[16]采用多模态MRI诊断和鉴别乳腺癌,结果显示,多模态MRI成像能够提高诊断正确率。但是,多模态MRI成像在影像学特点不典型的HCC诊断中仍需临床研究证实。
本研究中80例影像学特点不典型的HCC患者共97个病灶,包括慢升快降型、平台型、无强化型3种,各占比分别为83.51%、11.34%、5.15%,由此可知,在影像学特点不典型的HCC中慢升快降型十分常见。以病理结果为参照,多模态MRI诊断影像学特点不典型的HCC敏感度100.00%、特异度100.00%、准确度100.00%,均大于CT增强扫描的95.06%、75.00%、91.75%,由此表明多模态MRI诊断在影像学特点不典型的HCC诊断中能够取得良好的诊断结果。总结原因在于多模态MRI是在传统MRI上做出的改进,借助多种成像技术联合,不同模态信息融合,信息能够交叉互补,进而提高诊断准确性[17]。动态增强MRI可以根据病变组织性质增强行为改变,反映血管通透性和血流灌注的变化情况,对诊断病变定性具有决定性的作用[18-19]。在DWI成像中,用ADC值体现癌变组织水分子运动,使其成为病变诊断的重要指标[20]。MRI和DWI成像b值联合,能够提高肝癌诊断的准确率。除此之外,本研究中随b值升高,正常肝组织和肝癌组织ADC值逐渐降低,相同b值下正常肝组织ADC值均大于肝癌组织,表明不同组织的ADC值存在着明显的差异。王迎等[21]分析多模态MRI在小肝癌中的诊断价值,显示DCE-MRI与多b值DWI联合能够提高诊断效能,所得近结果与本研究相吻合。原因在于磁共振DWI是探测活体中水分子运动仅有的方法,它反映了常规ADC分析水分子扩散的布朗运动[22-23]。水分子布朗运动由细胞膜内、外、跨膜运动、循环灌注组成,细胞膜外和微循环灌注的水分子运动是形成DWI信号的生理基础[24]。DWI通过水分子自由扩散运动,反映细胞密度、组织结构等信息,病变不同水分子扩散情况不同,所以可以采用DWI定性诊断[25]。水分子运动的大小用弥散系数表示,弥散系数越大,水分子扩散越强[26]。不同b值下,不同组织的弥散系数不同,由获得的图像信号可计算出。虽然弥散系数能反映弥散运动程度,但其还受脉搏、呼吸、血压、血流灌注、细胞膜通透性等的影响,所以测得的弥散系数大于真实的弥散系数[27]。相对于弥散系数,目前临床多采用ADC反映水分子运动,其更接近于真实运动情况[28]。章智敬等[29]在其研究中发现,在原发性肝癌和转移性肝癌鉴别诊断中b值设定400、800、1000s/mm2时获得的细胞学特征效果越好。本研究中将b值分别设置为400、800、1 000s/mm2,更有利于探究肝脏病变真实的信号强度及ADC,所得结果与已有研究相吻合。原因在于人体内水分子运动与组织间隙有关,间隙越大,扩散运动越不会受到限制,ADC值就越大[30]。间隙大小与细胞成分有关,成分越复杂,细胞越密集,间隙也就越小,所以病变组织不同扩散运动情况就会不同[31]。肝转移瘤、肝细胞癌、胆管癌等成分复杂,细胞密集,组织间隙小,自由扩散运动受限,因此b值增加,DWI信号减慢,ADC值减小[32]。
本研究局限性在于样本量少,ADC值在肝脏与其他肿瘤恶性病变之间的变化规律,需扩大样本量更深一步的研究。另外,对于多b值DWI需进一步探究如何降低组织血流灌注并且目前关于多b值DWI诊断肿瘤良恶性的ADC值未统一。主要有两方面原因:一是血流灌注容易影响DWI,二是各家医院的MRI设备不一样,b值的选择以及他扫描参数选择也不同。
综上所述,在影像学特点不典型的HCC诊断中多模态MRI成像诊断效能较CT动态增强扫描更高,可作为优选影像学检查手段推广使用。
[1]Forner A,Reig M,Bruix J.Hepatocellular carcinoma[J].Lancet,2018,391(10127):1301-1314.doi:10.1016/S0140-6736(18)30010-2.
[2]Casadei Gardini A,Conti F,Foschi FG,et al.Imbalance of Neutrophils and Lymphocyte Counts Can Be Predictive of Hepatocellular Carcinoma Occurrence in Hepatitis C-related Cirrhosis Treated With Direct-acting Antivirals[J].Gastroenterology,2018,154(8):2281-2282.doi:10.1053/j.gastro.2017.12.051.
[3]van der Windt DJ,Sud V,Zhang H,et al.Neutrophil extracellular traps promote inflammation and development of hepatocellular carcinoma in nonalcoholic steatohepatitis[J].Hepatology,2018,68(4):1347-1360.doi:10.1002/hep.29914.
[4]Cui Y,Xu HF,Liu MY,et al.Mechanism of exosomal microRNA-224 in development of hepatocellular carcinoma and its diagnostic and prognostic value[J].World J Gastroenterol,2019,25(15):1890-1898.doi:10.3748/wjg.v25.i15.1890.
[5]孙茂盛.超声引导下穿刺活检与常规超声诊断肝脏肿瘤的价值比较[J].影像研究与医学应用,2020,4(2):169-170.
Sun MS.Comparison of the diagnostic values between ultrasoundguided aspiration biopsy and conventional ultrasonic diagnosis for liver tumors[J].Journal of Imaging Research and Medical Applications,2020,4(2):169-170.
[6]Ailianou A,Mundada P,De Perrot T,et al.MRI with DWI for the Detection of Posttreatment Head and Neck Squamous Cell Carcinoma:Why Morphologic MRI Criteria Matter[J].AJNR Am J Neuroradiol,2018,39(4):748-755.doi:10.3174/ajnr.A5548.
[7]Hectors SJ,Lewis S,Besa C,et al.MRI radiomics features predict immuno-oncological characteristics of hepatocellular carcinoma[J].Eur Radiol,2020,30(7):3759-3769.doi:10.1007/s00330-020-06675-2.
[8]Sanghvi T,Boyum J,Spilseth B,et al.MRI for hepatocellular carcinoma:a primer for magnetic resonance imaging interpretation[J].Abdom Radiol (NY),2018,43(5):1143-1151.doi:10.1007/s00261-017-1280-7.
[9]Leithner D,Moy L,Morris EA,et al.Abbreviated MRI of the Breast:Does It Provide Value?[J].J Magn Reson Imaging,2019,49(7):e85-100.doi:10.1002/jmri.26291.
[10]Kalita J,Singh RK,Misra UK,et al.Evaluation of cerebral arterial and venous system in tuberculous meningitis[J].J Neuroradiol,2018,45(2):130-135.doi:10.1016/j.neurad.2017.09.005.
[11]李民,熊俊.《原发性肝癌诊疗规范(2017年 版)》解读[J].中国普通外科杂志,2019,28(7):785-789.doi:10.7659/ j.issn.1005-6947.2019.07.003.
Li M,Xiong J.Interpretation of guidelines for diagnosis and treatment of primary liver cancer (2017 edition)[J].Chinese Journal of General Surgery,2019,28(7):785-789.doi:10.7659/j.issn.1005-6947.2019.07.003.
[12]康靖.肝脏增强CT技术与肝脏MRI技术诊断肝癌的效果分析[J].中国校医,2019,33(8):631-633.
Kang J.Analysis of the diagnostic efficacy of enhanced CT scan and MRI in diagnosis of liver cancer[J].Chinese Journal of School Doctor,2019,33(8):631-633.
[13]Johnstone E,Wyatt JJ,Henry AM,et al.Systematic Review of Synthetic Computed Tomography Generation Methodologies for Use in Magnetic Resonance Imaging-Only Radiation Therapy[J].Int J Radiat Oncol Biol Phys,2018,100(1):199-217.doi:10.1016/j.ijrobp.2017.08.043.
[14]Cai X,Zhu Q,Zeng Y,et al.Manganese Oxide Nanoparticles As MRI Contrast Agents In Tumor Multimodal Imaging And Therapy[J].Int J Nanomedicine,2019,14:8321-8344.doi:10.2147/IJN.S218085.
[15]Ghafoor S,Burger IA,Vargas AH.Multimodality Imaging of Prostate Cancer[J].J Nucl Med,2019,60(10):1350-1358.doi:10.2967/jnumed.119.228320.
[16]吴津民,王海宝,徐丽艳,等.多模态磁共振成像在乳腺癌诊断中的应用价值[J].安徽医学,2017,38(8):963-965.doi:10.3969/j.issn.1000-0399.2017.08.002.
Wu JM,Wang HB,Xu LY,et al.Application value of multimodal magnetic resonance imaging in breast cancer diagnosis[J].Anhui Medical Journal,2017,38(8):963-965.doi:10.3969/j.issn.1000-0399.2017.08.002.
[17]Staffaroni AM,Ljubenkov PA,Kornak J,et al.Longitudinal multimodal imaging and clinical endpoints for frontotemporal dementia clinical trials[J].Brain,2019,142(2):443-459.doi:10.1093/brain/awy319.
[18]Woloszyk A,Wolint P,Becker AS,et al.Novel multimodal MRI and MicroCT imaging approach to quantify angiogenesis and 3D vascular architecture of biomaterials[J].Sci Rep,2019,9(1):19474.doi:10.1038/s41598-019-55411-4.
[19]Tower-Rader A,Jaber WA.Multimodality Imaging Assessment of Fabry Disease[J].Circ Cardiovasc Imaging,2019,12(11):e009013.doi:10.1161/CIRCIMAGING.119.009013.
[20]Hasan KM,Keser Z,Schulz PE,et al.Multimodal Advanced Imaging for Concussion[J].Neuroimaging Clin N Am,2018,28(1):31-42.doi:10.1016/j.nic.2017.09.001.
[21]王迎,闫海龙,王亮,等.磁共振多模态功能成像在小肝癌诊断中的价值[J].新乡医学院学报,2018,35(6):521-524.doi:10.7683/xxyxyxb.2018.06.018.
Wang Y,Yan HL,Wang L,et al.Diagnostic value of magnetic resonance multimode functional imaging in small hepatocellular carcinoma[J].Journal of Xinxiang Medical University,2018,35(6):521-524.doi:10.7683/xxyxyxb.2018.06.018.
[22]Abecassis JP,Ghazzar N,Peyromaure M,et al.Prostate imaging:Contribution of PET PSMA and MRI[J].Cancer Radiother,2020,24(5):423-428.doi:10.1016/j.canrad.2020.06.002.
[23]Talbot A,Devos L,Dubus F,et al.Multimodal imaging in radiotherapy:Focus on adaptive therapy and quality control[J].Cancer Radiother,2020,24(5):411-417.doi:10.1016/j.canrad.2020.04.007.
[24]Torres PPTES,Mançano AD,Zanetti G,et al.Multimodal indirect imaging signs of pulmonary embolism[J].Br J Radiol,2020,93(1108):20190635.doi:10.1259/bjr.20190635.
[25]刘昱峰.MRI多模态成像对肝动脉化疗栓塞联合射频消融治疗原发性肝癌术后复发的评估价值分析[J].实用中西医结合临床,2019,19(3):122-124.doi:10.13638/j.issn.1671-4040.2019.03.061.
Liu YF.Value of multimodal MRI imaging combined with radiofrequency ablation in assessment of postoperative recurrence of primary liver cancer after hepatic arterial chemoembolization[J].Practical Clinical Journal of Integrated Traditional Chinese and Western Medicine,2019,19(3):122-124.doi:10.13638/j.issn.1671-4040.2019.03.061.
[26]Boeve BF,Rosen HJ.Multimodal imaging in familial FTLD:phenoconversion and planning for the future[J].Brain,2019,142(1):8-11.doi:10.1093/brain/awy314.
[27]路芸,田建英,马田军,等.多模态MRI检查与CT动态增强对小肝癌的诊断效能对比[J].影像研究与医学应用,2019,3(18):21-22.
Lu Y,Tian JY,Ma TJ,et al.Comparison of multi-modal MRI and CT dynamic enhancement in the diagnosis of small hepatocellular carcinoma[J].Journal of Imaging Research and Medical Applications,2019,3(18):21-22.
[28]Czeibert K,Baksa G,Grimm A,et al.MRI,CT and high resolution macro-anatomical images with cryosectioning of a Beagle brain:Creating the base of a multimodal imaging atlas[J].PLoS One,2019,14(3):e0213458.doi:10.1371/journal.pone.0213458.
[29]章智敬,吴爱琴,张小宇,等.多b值扩散加权成像在原发性和转移性肝癌鉴别诊断中的价值[J].温州医科大学学报,2018,48(5):361-365.doi:10.3969/j.issn.2095-9400.2018.05.009.
Zhang ZJ,Wu AQ,Zhang XY,et al.Value of multi b-value diffusion weighted imaging in differential diagnosis of primary and metastatic hepatocellular carcinoma[J].Journal of Wenzhou Medical University,2018,48(5):361-365.doi:10.3969/j.issn.2095-9400.2018.05.009.
[30]Christy A,Murchison C,Wilson JL.Quick Brain Magnetic Resonance Imaging With Diffusion-Weighted Imaging as a First Imaging Modality in Pediatric Stroke[J].Pediatr Neurol,2018,78:55-60.doi:10.1016/j.pediatrneurol.2017.09.020.
[31]王晓青,王磊.动态增强技术联合磁共振弥散加权成像技术诊断乳腺良恶性病变的临床价值[J].中国基层医药,2019,26(2):186-189.doi:10.3760/cma.j.issn.1008-6706.2019.02.018.
Wang XQ,Wang L.Clinical value of dynamic enhancement combined with diffusion-weighted MRI in the diagnosis of benign and malignant breast lesions[J].Chinese Journal of Primary Medicine and Pharmacy,2019,26(2):186-189.doi:10.3760/cma.j.issn.1008-6706.2019.02.018.
[32]Yılmaz E,Sarı O,Yılmaz A,et al.Diffusion-Weighted Imaging for the Discrimination of Benign and Malignant Breast Masses;Utility of ADC and Relative ADC [J].J Belg Soc Radiol,2018,102(1):24.doi:10.5334/jbsr.1258.
