全球每年新发胃癌病例达103万,因胃癌死亡病例超78万之多[1]。我国是胃癌大国,总体生存情况不容乐观,国家癌症中心2015年数据表明,在所有恶性肿瘤中胃癌发病率占第2 位,病死率占第3 位[2],且我国胃癌大多处于进展期,预后较差,最新资料显示,我国胃癌5年生存率约为50%,严重威胁我国国民健康安全。手术切除是目前可能治愈胃癌的唯一方法,自1994年日本学者Kitano等[3]首次报道腹腔镜下早期胃癌根治术后,腹腔镜技术便在胃癌治疗中发挥着越来越重大的作用。由于相较于传统开腹胃癌手术,其具有手术创伤小,出血少,术后疼痛轻,恢复快,住院时间短等优势[4],提高了患者对手术的满意度及术后生存质量,得以在世界各地广泛开展。在我国,腹腔镜胃癌手术虽然只有10余年的历史,但由于胃癌手术微创化的理念被越来越多的胃肠外科医生所认可并接受,腹腔镜器械的不断发展进步,我国腹腔镜胃癌手术发展迅速并取得了长足进步。目前,腹腔镜胃癌手术已在我国各家医院普遍开展,但由于缺乏规范的腹腔镜胃癌手术培训体系,技术水平参差不齐,临床疗效不一,笔者将就如何做好腹腔镜下胃癌根治手术进行探讨,并提出iFIST理念,即:严格适应证(strict indications,i)、干净无血术野(clear and bloodless surgical field,F)、腹腔充分灌洗(adequate peritoneal irrigation,I)、标本完整(intact specimens,S)、全腹腔镜下手术(totally laparoscopic surgery,T)。
1 谨慎对待腹腔镜胃癌根治手术适应证
腹腔镜胃癌手术由于在淋巴结清除数目,切除范围等问题上一直存在争议,使腹腔镜胃癌根治手术适应证的选择受到限制,但随着科技的发展、腹腔镜器械的不断进步、胃肠外科医生水平的不断提高以及国内外重要临床试验和相关研究的支持,腹腔镜胃癌根治手术的适应证也在不断探索并扩展。历经20余年发展,腹腔镜胃癌根治手术在早期胃癌中的应用早已成熟,2004年日本胃癌学会指出[5]:局限于黏膜层(T1a)和局部淋巴结转移(N1)的胃癌,局限于黏膜下(T1b)和淋巴结转移处于N0或者N1的胃癌患者可行腹腔镜胃癌根治术。我国2007版《腹腔镜胃癌手术操作指南》[6]指出,腹腔镜胃癌根治术是根治早期胃癌及部分进展期胃癌安全有效的手术方式。2018年日本胃癌学会第5版《胃癌治疗指南》提出[7],临床I期胃癌行远端胃切除术,腹腔镜下手术能够作为常规选择。韩国和日本关于早期远端胃癌腹腔镜与开腹手术对比的两项多中心随机对照临床试验KLASS-01和JCOG0912的近期疗效及远期肿瘤学结果均已发表。韩国KLASS-01试验近期结果[8]表明,对处于I期的胃癌患者行远端胃癌切除术,腹腔镜组总的手术并发症发生率低于开腹手术组(13.0% vs.19.9%,P=0.001),病死率无统计学差异(0.6% vs.0.3%,P=0.687)。5年生存率而言[9],腹腔镜组不劣于开腹组(94.2% vs.93.3%,P=0.64)。日本JCOG0912结果表明[10],对处于IA期或IB期的胃癌患者行远端胃癌切除术,腹腔镜组与开腹手术组3~4级手术并发症发生率无统计学差异。5年无复发生存率(95.1% vs.94.1%)及5年总生存率(97.0% vs.95.2%)腹腔镜组与开腹组无明显差异[11]。KLASS-01及JCOG0912试验结果表明了早期胃癌腹腔镜远端胃癌根治术的安全性及有效性。但对于临床II期以上的胃癌是否推荐腹腔镜远端胃切除术,尚缺乏证据。目前也仍无关于早期胃癌腹腔镜下全胃切除术的前瞻性研究,日本内镜外科学会指南(2014版)提出,开展该手术的第1年术后并发症发生率较高,须慎重。据日本第5版《胃癌治疗指南》[7]认为,对cT1N0的胃癌,若肿瘤处于胃上部,且能保留1/2以上的胃,可考虑选择腹腔镜近端胃切除术。
在我国由于早期胃癌筛查普及率低,近80%的胃癌病例处于进展期[12]。进展期胃癌通常瘤体较大、肿瘤侵犯较深,且常伴有周围组织浸润,胃周淋巴广泛转移,使得腹腔镜治疗进展期胃癌手术难度较大,对进展期胃癌是否行腹腔镜治疗也争议不断。我国在腹腔镜治疗进展期胃癌方面积极探索并做出了卓越贡献,2009年,我国的胃肠外科专家成立了“中国腹腔镜胃肠外科研究组(Chinese laparoscopic gastrointestinal surgery group,CLASS)”,并于2012年发起了“腹腔镜与开腹胃癌根治术治疗局部进展期远端胃癌的肿瘤学疗效多中心、随机对照临床研究(CLASS-01)”,该研究共纳入1 056例受试者,主要观察指标是术后并发症、术后死亡情况、3年总生存率及3年无病生存率等。于2016年发表了近期安全性结果[13],腹腔镜组与开腹手术组相比,两组手术术中并发症发生率(4.8% vs.3.5%)和术后总体并发症发生率(15.2% vs.12.9%)相当,差异无统计学意义,且腹腔镜组术后恢复过程显著优于开腹组。因此,中国CLASS研究委员会认为:由具备丰富经验的团队施行腹腔镜远端胃癌D2根治术治疗局部进展期胃癌安全可行,这是世界上首个关于局部进展期胃癌腹腔镜微创治疗安全性的最高级别证据。后于2019年发表了中期肿瘤学疗效结果[14]显示:腹腔镜组与开腹手术组3年无病生存率(76.5% vs.77.8%)相比差异无统计学意义。该研究提示腹腔镜远端胃癌根治术治疗局部进展期胃癌与传统开腹手术相比不仅安全有效,而且因其具有的微创优势,可以加速患者术后康复,缩短住院时间等。2016年我国《腹腔镜胃癌手术操作指南》[15]认为,胃癌肿瘤浸润深度<T4a期并可达到D2根治切除术以及术前临床分期为I、II、IIIA期作为已被认可并应用于临床实践的手术适应证。综上所述,随着腹腔镜技术水平的发展及越来越多高级别研究证据的支持,腹腔镜胃癌根治手术的适应证也逐渐由早期胃癌向进展期胃癌不断扩展。笔者认为,对于腹腔镜下胃癌根治术的适应证应谨慎对待,对于肿瘤浸润深度≤T3的胃癌,腹腔镜手术可作为常规选择。而对于瘤体过大、浆膜层广泛受侵、胃周淋巴结广泛转移或融合成团及周围组织器官广泛浸润者则不适宜行腹腔镜胃癌根治手术。
2 做好腹腔镜胃癌根治术的关键要点
在严格把握腹腔镜胃癌根治术适应证的基础上,如何做好腹腔镜胃癌根治手术、减少术中术后并发症、提高患者生活质量就变得尤为重要,笔者将结合多年临床经验就如何做好腹腔镜下胃癌根治手术进行重点探讨。
2.1 干净无血的术野
相较与开腹手术,腹腔镜胃切除具有术中出血较少的优势。术中出血影响正确解剖平面的辨认,使患者处于危险之中。另外术中大量出血,可能导致术后腹腔粘连,并为术中可能脱落的癌细胞提供生长的温床。为了强调术中无血,我们医疗小组对手术术野常规进行评分(图1A-C)。干净无血的手术术野需要术者对解剖层面有深入的理解,熟悉血管正常解剖位置和解剖变异情况,显露正确手术平面,在熟练掌握腹腔镜各项操作技能的基础上,注意动作轻巧,超声刀“小步快跑”,减少术中出血。一旦发现术中出血,应沉着冷静,团队密切配合,正确使用止血工具,如“冲抽凝”等(图1D)。同时,良好的手术视野能清晰显示局部解剖结构利于术中精细操作,加快手术进程,减少手术时间,提高手术效率。

图1 腹腔镜下胃癌根治术手术视野分级与术中出血控制 A:干净无血,白色术野;B:出血较少,术野欠佳;C:出血较多,术野模糊;D:止血工具(冲抽凝)电凝十二指肠残端的渗血
Figure 1 Classification of surgical field of laparoscopic radical gastrectomy and intraoperative control of bleeding A: White surgical field with clear and bloodless vision; B: Relatively poor surgical field by a small amount of bleeding; C: Blurred surgical field by massive bleeding; D: Electrocoagulation in treatment of oozing bleeding from the duodenal stump with hemostatic tools (irrigation, suction, coagulation)
2.2 充分的腹腔灌洗
粗暴的手术操作可能引起肿瘤细胞脱落,癌周的淋巴管和血管损伤,癌细胞跟随外渗淋巴液和血液进入腹腔,成为腹腔游离癌细胞,在生长因子、趋化因子、黏附因子等作用下形成转移灶是胃癌术后复发或转移的重要原因之一[16-18]。故笔者主张在移除肿瘤标本后及消化道重建完后均应用大量温热生理盐水行腹腔冲洗(图2A),以尽量清除腹腔内游离癌细胞,冲洗液量一般为3 000 mL左右。合适温度的生理盐水冲洗腹腔可促进血管扩张,促进局部血液循环,改善其缺氧状况,从而避免因缺氧引起的促血管生成因子正性分泌, 起到抗粘连效果。腹腔冲洗还可以将腹腔内积液、积血等及时清除,有效防止腹腔感染。癌细胞受热也可造成癌细胞缺氧、代谢障碍,发生裂解[19-20]。 若术中脱落细胞病理学检查阳性者,或是明显T4a患者,建议术中和术后行腹腔温热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)(图2B)。
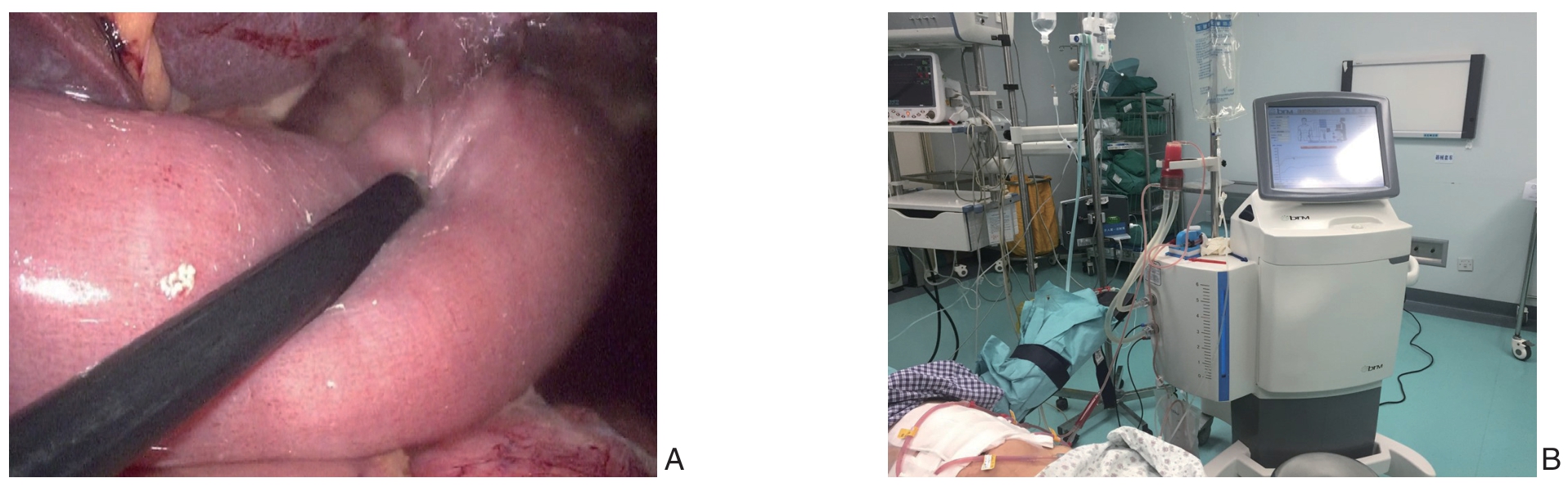
图2 腹腔灌洗理念 A:消化道重建完毕后,用大量盐水灌洗腹腔;B:胃癌患者术后HIPEC 治疗
Figure 2 Concept of peritoneal irrigation A: Peritoneal irrigation with large volume of saline after digestive tract reconstruction; B: HIPEC for gastric cancer patients after gastrectomy
2.3 标本完整
行腹腔镜胃癌淋巴结清扫后,保证足够切缘的前提下,以直线型切割闭合器切断标本远、近端,防止胃腔内的胃液泄露、溢落于腹腔,导致医源性腹腔种植的发生(图3A)。取出标本过程中,操作应轻柔,避免淋巴结掉落,防止肿瘤局部种植。组织标本以及腔镜小纱布须全部装入标本袋中(图3B),应避免腔镜小纱布单独从Trocar取出,以避免血液及渗液挤流入腹腔,带来污染。标本取出时要注意保护小切口,常规应用切口保护器,防止切口肿瘤种植,既往研究[21-22]发现,腹腔镜胃肠道癌症手术后,肿瘤的种植转移多发生于腹壁辅助小切口。
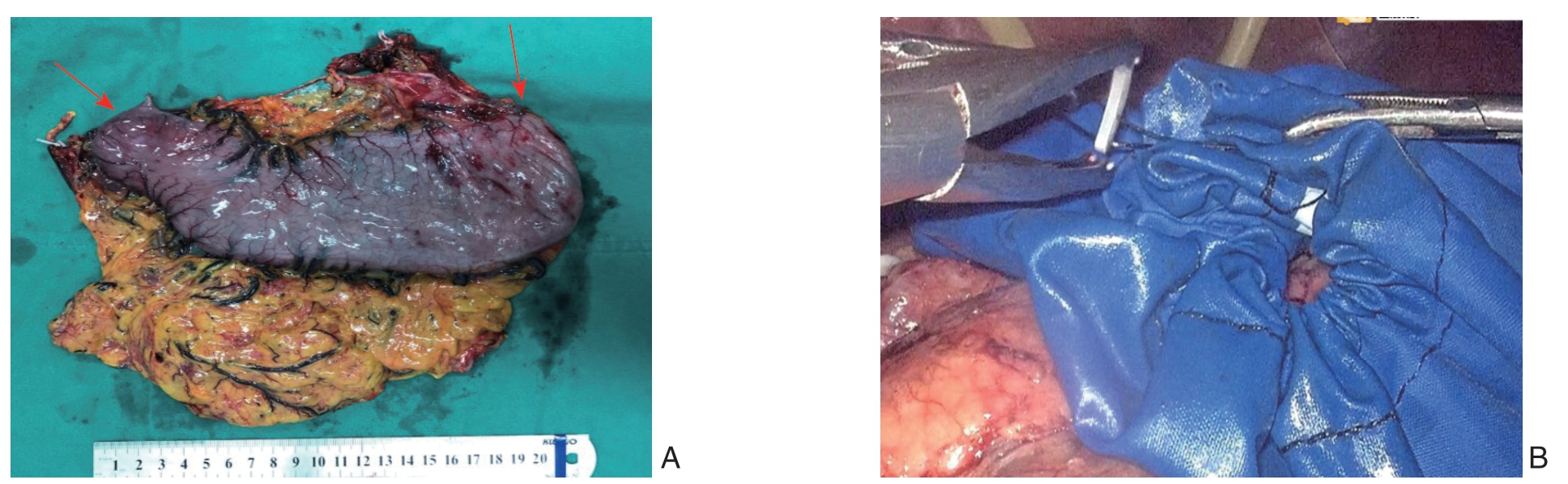
图3 手术标本完整理念 A:全胃切除标本,红色箭头示直线型切割闭合器完成的十二指肠切缘及食道切缘;B:将组织标本及腔镜小纱布全部装入标本袋中
Figure 3 Concept of intact specimens A: Total gastrectomy specimen and the red arrows showing the cut edges of the duodenum and the esophagus completed by a linear cutting stapler; B: Placement of the specimen and laparoscopic gauze into the specimen bag
2.4 全腹腔镜手术,减少炎症应急
腹腔镜胃癌手术可分为全腹腔镜下胃癌手术、手助腹腔镜下胃癌手术及腹腔镜辅助下胃癌手术3 种,腹腔镜辅助胃癌手术又称小切口辅助手术,胃游离、淋巴结清扫在腹腔镜下完成,胃切除和消化道重建经腹壁小切口辅助完成,由于其技术较为成熟、手术时间较短等原因,是目前应用最多的手术方式。全腹腔镜胃癌根治术由于胃切除、淋巴结清扫、消化道重建(图4A)均在腹腔镜下完成,仅需绕脐小切口取出手术标本(图4B)。全腔镜手术对术者技术有较高要求,所以目前仍未普遍开展,但全腹腔镜下胃癌手术对患者创伤最小,能有效减少炎症应急,促进患者术后恢复。对于肥胖及腹部前后径较长的患者,全腹腔镜胃切除具有手术野更开阔、操作更简便、术后恢复更快,切口下移更美观(图4B)、术后疼痛轻等诸多优势[23-24]。随着腹腔镜器械的改进、胃肠外科医生微创理念及操作技术水平的提高,腹腔镜胃癌根治术由腹腔镜辅助向完全腹腔镜发展,全腔镜下操作避免了上腹部辅助小切口也更加符合微创的概念与要求,并能有效改善患者近期疗效,提高患者术后生活质量,但其远期疗效仍需更多循证医学证据加以证实。据一项调查[25]显示,约73.4%的医生表示全腹腔镜胃癌手术有望成为胃癌主流术式。
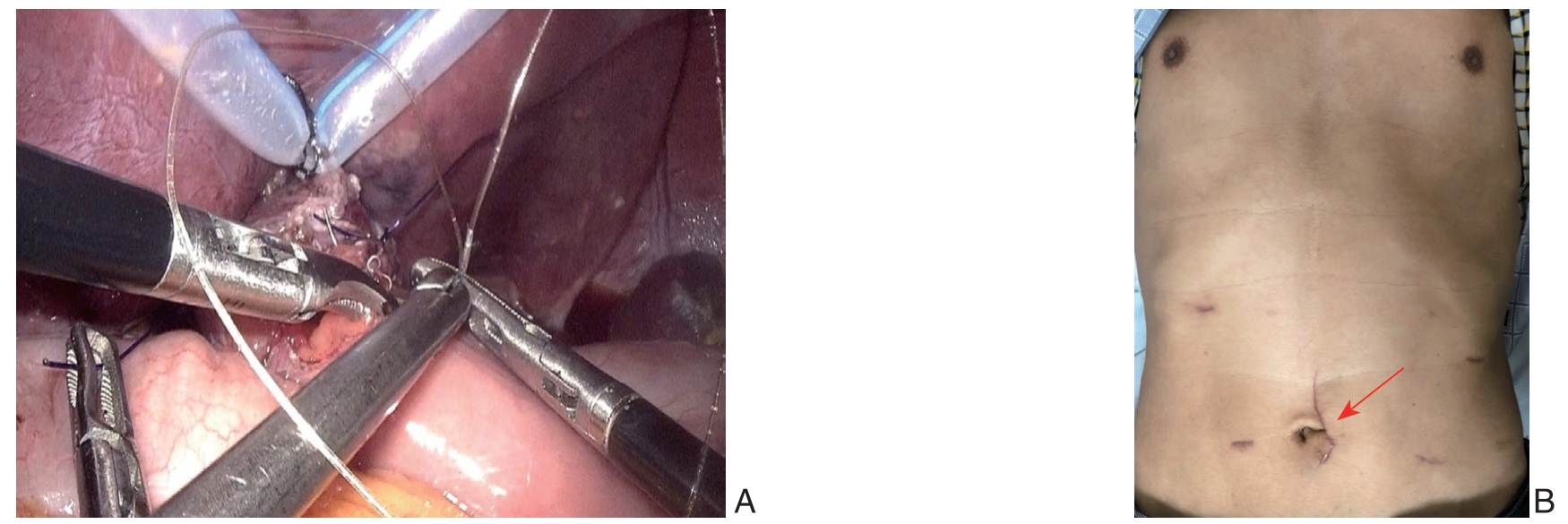
图4 全腹腔镜理念 A:全腹腔镜下消化道重建,腔镜下缝合食道空肠吻合口;B:全腔镜胃癌术后患者的绕脐小切口(红色箭头)
Figure 4 Concept of totally laparoscopic operation A: Tatally laparoscopic digestive tract reconstruction, and view of the oesophagojejunal anastomosis; B: A small incision around the umbilicus (shown by the red arrow) in patients after totally laparoscopic gastrectomy
3 结 语
目前,绝大部分腹腔镜下胃癌手术的临床研究为“非劣性”比较。怎么让腹腔镜这项先进技术在给患者带来伤口更加美观、术后疼痛减轻、术后康复加快的同时,为广大胃癌患者带来生存上的获益,是我们努力的方向。这迫使我们从各项细节上精益求精。iFIST理念的执行可能可以为患者带来远期的生存获益,但需要后期的多中心临床研究来证实。
[1] Bray F, Ferlay J, Soerjomataram I, et al.Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin, 2018, 68(6):394–424.doi: 10.3322/caac.21492.
[2] Chen W, Zheng R, Baade PD, et al.Cancer statistics in China, 2015[J].CA Cancer J Clin, 2016, 66(2):115–132.doi: 10.3322/caac.21338.
[3] Kitano S, Iso Y, Moriyama M, et al.Laparoscopy-assisted Billroth I gastrectomy[J].Surg Laparosc Endosc, 1994, 4(2):146–148.
[4] Li HZ, Chen JX, Zheng Y, et al.Laparoscopic-assisted versus open radical gastrectomy for resectable gastric cancer: Systematic review, meta-analysis, and trial sequential analysis of randomized controlled trials[J].J Surg Oncol, 2016, 113(7):756–767.doi: 10.1002/jso.24243.
[5] Shiraishi N, Yasuda K, Kitano S.Laparoscopic gastrectomy with lymph node dissection for gastric cancer[J].Gastric Cancer, 2006, 9(3):167–176.doi: 10.1007/s10120–006–0380–9.
[6] 中华医学会外科学分会腹腔镜与内镜外科学组.腹腔镜胃癌手术操作指南(2007版)[J].中华消化外科杂志, 2007, 6(6):476–480.doi:10.3760/cma.j.issn.1673–9752.2007.06.029.Laparoscopic and Endoscopic Surgery Group of Society of Surgery of Chinese Medical Association.Guidelines for laparoscopic operation for gastric cancer (2007 edition)[J].Chinese Journal of Digestive Surgery, 2007, 6(6):476–480.doi:10.3760/cma.j.issn.1673–9752.2007.06.029.
[7] 日本胃癌学会.日本胃癌学会編: 胃癌治療(Ⅰ)イドfflイas-医師用年月改訂版[M].5版.東京: 金原出版, 2018.
Japan Society of Gastric Cancer.Guidelines for gastric cancer treatment - Annual Revised Edition for Doctors[M].the 5th edition.Tokyo: Public Publication, 2018.
[8] Kim W, Kim HH, Han SU, et al.Decreased Morbidity of Laparoscopic Distal Gastrectomy Compared With Open Distal Gastrectomy for Stage I Gastric Cancer: Short-term Outcomes From a Multicenter Randomized Controlled Trial (KLASS-01)[J].Ann Surg, 2016, 263(1): 28–35.doi: 10.1097/SLA.0000000000001346.
[9] Kim HH, Han SU, Kim MC, et al.Effect of Laparoscopic Distal Gastrectomy vs Open Distal Gastrectomy on Long-term Survival Among Patients With Stage I Gastric Cancer: The KLASS-01 Randomized Clinical Trial[J].JAMA Oncol, 2019, 5(4):506–513.doi: 10.1001/jamaoncol.2018.6727.
[10] Katai H, Mizusawa J, Katayama H, et al.Short-term surgical outcomes from a phase III study of laparoscopy-assisted versus open distal gastrectomy with nodal dissection for clinical stage IA/IB gastric cancer: Japan Clinical Oncology Group Study JCOG0912[J].Gastric Cancer, 2017, 20(4):699–708.doi: 10.1007/s10120–016–0646–9.
[11] Katai H, Mizusawa J, Katayama H, et al.Survival outcomes after laparoscopy-assisted distal gastrectomy versus open distal gastrectomy with nodal dissection for clinical stage IA or IB gastric cancer (JCOG0912): a multicentre, non-inferiority, phase 3 randomised controlled trial[J].Lancet Gastroenterol Hepatol, 2020, 5(2):142–151.doi: 10.1016/S2468–1253(19)30332–2.
[12] Torre LA, Siegel RL, Ward EM, et al.Global Cancer Incidence and Mortality Rates and Trends—An Update[J].Cancer Epidemiol Biomarkers Prev, 2016, 25(1):16–27.doi: 10.1158/1055–9965.EPI-15–0578.
[13] Hu Y, Huang C, Sun Y, et al.Morbidity and Mortality of Laparoscopic Versus Open D2 Distal Gastrectomy for Advanced Gastric Cancer: A Randomized Controlled Trial[J].J Clin Oncol, 2016, 34(12):1350–1357.doi: 10.1200/JCO.2015.63.7215.
[14] Yu J, Huang C, Sun Y, et al.Effect of Laparoscopic vs Open Distal Gastrectomy on 3-Year Disease-Free Survival in Patients With Locally Advanced Gastric Cancer: The CLASS-01 Randomized Clinical Trial[J].JAMA, 2019, 321(20):1983–1992.doi: 10.1001/jama.2019.5359.
[15] 中华医学会外科学分会腹腔镜与内镜外科学组, 中国研究型医院学会机器人与腹腔镜外科专业委员会.腹腔镜胃癌手术操作指南(2016版)[J].中华消化外科杂志, 2016, 15(9):851–857.doi:10.3760/cma.j.issn.1673–9752.2016.09.001.
Laparoscopic and Endoscopic Surgery Group of Society of Surgery of Chinese Medical Association., Robotic and Laparoscopic Surgery Committee of Chinese Research Hospital Association.Guideline for laparoscopic gastrectomy for gastric cancer (2016 edition)[J].Chinese Journal of Digestive Surgery, 2016, 15(9):851–857.doi:10.3760/cma.j.issn.1673–9752.2016.09.001.
[16] Han TS, Kong SH, Lee HJ, et al.Dissemination of free cancer cells from the gastric lumen and from perigastric lymphovascular pedicles during radical gastric cancer surgery[J].Ann Surg Oncol, 2011, 18(10):2818–2825.doi: 10.1245/s10434–011–1620–8.
[17] Murakami N, Koufuji K, Shirouzu K.Influence of hepatocyte growth factor secreted from fibroblasts on the growth and invasion of scirhous gastric cancer[J].Int Surg, 2001, 86(3):151–157.
[18] 吴涛, 徐惠绵, 吴晓华, 等.转化生长因子β1小干扰RNA抑制SGC-7901腹膜转移[J].中华医学杂志, 2006, 86(5):343–345.doi:10.3760/j:issn:0376–2491.2006.05.016.
Wu T, Xu HM, Wu XH, et al.Inhibition of SGC-7901 peritoneal metastasis by small interfering RNA transforming growth factor β1[J].National Medical Journal of China, 2006, 86(5):343–345.doi:10.3760/j:issn:0376–2491.2006.05.016.
[19] Ohki A, Abe N, Yoshimoto E, et al.Gastric washing by distilled water can reduce free gastric cancer cells exfoliated into the stomach lumen[J].Gastric Cancer, 2018, 21(6):998–1003.doi: 10.1007/s10120–018–0824-z.
[20] Takemoto K, Shiozaki A, Ichikawa D, et al.Evaluation of the efficacy of peritoneal lavage with distilled water in colorectal cancer surgery: in vitro and in vivo study[J].J Gastroenterol, 2015, 50(3):287–297.doi: 10.1007/s00535–014–0971-x.
[21] Emoto S, Ishigami H, Yamaguchi H, et al.Port-site metastasis after laparoscopic surgery for gastrointestinal cancer[J].Surg Today, 2017, 47(3):280–283.doi: 10.1007/s00595–016–1346–0.
[22] Sakamoto K, Takahashi M, Takahashi R, et al.Repeated laparoscopic resection of extra-regional lymph node metastasis after laparoscopic radical resection for rectal cancer[J].J Minim Access Surg, 2018, 14(2):146–148.doi: 10.4103/jmas.JMAS_177_17.
[23] Kim MG, Kim KC, Kim BS, et al.A totally laparoscopic distal gastrectomy can be an effective way of performing laparoscopic gastrectomy in obese patients (body mass index≥30)[J].World J Surg, 2011, 35(6):1327–1332.doi: 10.1007/s00268–011–1034–6.
[24] Lin T, Mou TY, Hu YF, et al.Reduced Port Laparoscopic Distal Gastrectomy with D2 Lymphadenectomy[J].Ann Surg Oncol, 2018, 25(1):246.doi: 10.1245/s10434–017–6066–1.
[25] 马福海.全腹腔镜与腹腔镜辅助远端胃癌根治术的短期临床效果比较[D].北京: 北京协和医学院, 2018.
Ma FH.Comparison of Short-term Outcomes of Laparoscopy-Assisted and Totally Laparoscopic Distal Gastrectomt for Gastric Cancer[J].Beijing: Peking Union Medical College, 2018.

