胃癌是最常见的消化道恶性肿瘤之一,2020年全球癌症统计数据显示,胃癌在全世界的发病率和病死率分别位居于第五位和第四位[1]。虽然我国胃癌发病率和病死率呈逐年下降趋势,但由于人口基数大,每年有近一半的胃癌新发病例在中国,且诊断时多为进展期胃癌,预后差、病死率高[2-3]。腹膜转移是胃癌最常见的转移方式,胃癌患者中腹膜转移的诊断率为14%~30%,即使初始治疗没有发生腹膜转移,根治性胃癌手术后腹膜复发发生率为34%~60%,是影响胃癌患者预后的主要因素[4]。在过去的20年中,肿瘤腹膜转移的治疗模式通过引入腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)和肿瘤细胞减灭术(cytoreductive surgery,CRS)而发生了改变,这种治疗方式已经证明其在卵巢癌、结直肠癌、腹膜假黏液瘤等腹膜转移癌中的有效 性[5-8]。胃癌治疗过程中加入HIPEC的临床应用日渐增多,但是HIPEC治疗胃癌尚缺乏统一的标准,临床应用中加温及灌注方法迥异,存在控温精度差、安全系数不高等缺陷,易出现相关并发症,疗效存在较大差异,其安全性和有效性至今尚未明确[9]。国内、国外虽已注册、准备开展或已经开展众多HIPEC相关的前瞻性高级别临床研究,但目前多处在入组或随访阶段,缺乏有力的循证医学证据[10]。自2017年本中心熟练开展HIPEC治疗技术以来,即开展胃癌伴浆膜浸润患者术中预防性HIPEC的相关研究,在临床实际工作中,是否行HIPEC治疗,受各种客观、主观因素影响,如患者有无术前合并症、手术方式、肿瘤分期等,医患双方存在对于肿瘤分期晚的患者更倾向于加做HIPEC,而对于术前合并症多、手术方式较复杂(如涉及多个吻合、联合脏器切除等)往往考虑术后相关风险主观上产生迟疑,存在选择偏倚,随机化入组困难。本研究通过倾向性评分匹配(propensity score matching,PSM)降低混杂效应,均衡观察组与对照组之间的差异,旨在探讨局部进展期胃癌根治性手术联合术中雷替曲塞HIPEC的安全性和有效性,以期为临床治疗方案的制定提供更可靠的依据。
1 资料与方法
1.1 一般资料
调阅安徽医科大学附属安庆医院肿瘤外科胃癌云端数据库[Crabyter肿瘤科研数据管理系统,新屿信息科技(上海)有限公司],收集2017年1 2月—2019年1 2月连续性收治行手术治疗的胃癌患者临床病例资料。纳入标准:(1) 术前或术中病理学检查证实为胃癌;(2) 术后病理分期提示pT3/4NanyM0(AJCC/UICC第8版TNM分期系统);(3) 无远处转移,行胃癌根治性手术(D2淋巴结清扫);(4) 功能状态:0~2(美国东部肿瘤协作组ECOG评分标准)。排除标准:(1) 术前接受新辅助化疗、放疗等抗肿瘤治疗;(2) 存在同时性多原发性肿瘤;(3) 具有严重或未控制的内科疾患(如心绞痛、心功能不全,EF<50%,难控性高血压、糖尿病等)或精神疾病患者;(4) 血常规、肝肾功能提示存在化疗禁忌者;(5) 术后接受HIPEC治疗的患者;(6) 残胃癌患者。根据上述标准,研究共纳入155例患者,按照是否行术中HIPEC分组,52例行手术加HIPEC为观察组,103例行单纯手术为对照组。患者及家属签署知情同意书,安徽医科大学附属安庆医院医学伦理委员会审批通过本研究[医学伦审(2019)第7号]。
1.2 方法
根据日本胃癌学会的第4 版《胃癌治疗指南》,所有患者均行开腹或腹腔镜辅助胃癌根治术(D 2淋巴结清扫)。对照组患者行根治性D2胃切除术,观察组患者行根治性D2胃切除术后继续在麻醉监护下行术中HIPEC。灌注设备:BRTRG-I型体腔热灌注治疗系统(广州保瑞医疗技术有限公司),灌注温度设置为43 ℃,灌注流速设定为0.4~0.6 L/min,灌注时间设定为60 min。腹腔灌注化疗药物为雷替曲塞4 mg(注射用雷替曲塞2 mg/支,南京正大天晴制药有限公司)。
1.3 观察指标
(1) 临床一般资料:患者的性别、年龄、体质量指数(BMI)、吸烟史、腹部手术史、术前合并症(包括高血压、糖尿病、心脏病、脑血管疾病、慢性阻塞性肺病等)。(2) 手术资料:手术方法、手术方式、联合脏器切除、手术时间(包括术中HIPEC 时间)、术中出血量。(3) 病理资料:肿瘤部位、病理TNM 分期。(4) 术后资料:术后患者第1天实验室检查指标[包括白细胞计数(WBC)、中性粒细胞百分比(NE%)、血红蛋白(Hb)、血小板(PLT)、总胆红素(TBIL)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、白蛋白(ALB)、白蛋白/球蛋白比(A/G)、血尿素氮(BUN)、血肌酐(Cr)、C-反应蛋白(CRP)、降钙素原(PCT)]、术后首次通气时间、术后住院日、疼痛评分(术后前3 d)、围手术期死亡、非计划再次手术、术后并发症(吻合口漏、吻合口狭窄、肠梗阻、胃排空延迟、腹盆腔积液、腹盆腔感染、出血、呼吸系统并发症、心脑血管并发症、术后并发症Clavien-Dindo分级)、血液学毒性不良事件。疼痛评分采用数字等级评定量表法(numerical rating scale,NRS)[11]。术后并发症诊断、分级、登记管理等标准参照《中国胃肠肿瘤外科术后并发症诊断登记规范专家共识(2018 版)》[12]。 血液学毒性不良事件以美国国立癌症研究所通用不良事件术语标准5.0版(NCI-CTCAE v5.0)毒性标准分级1~4级评价。
1.4 统计学处理
运用IBM SPSS 26.0统计软件进行统计学数据分析。正态分布计量资料采用t检验,用均数±标准差( ±s)表示;非正态分布计量资料采用非参数Mann-Whitney U检验,用M(最小值~最大值)表示;无序计数资料采用χ2检验或Fisher确切概率法,等级计数资料采用非参数Mann-Whitney U检验,用例数(百分率)[n(%)]表示。PSM由IBM SPSS 26.0自带PSM模块完成,按1:1配对,卡钳值设定为0.2。P<0.05为差异有统计学意义。
±s)表示;非正态分布计量资料采用非参数Mann-Whitney U检验,用M(最小值~最大值)表示;无序计数资料采用χ2检验或Fisher确切概率法,等级计数资料采用非参数Mann-Whitney U检验,用例数(百分率)[n(%)]表示。PSM由IBM SPSS 26.0自带PSM模块完成,按1:1配对,卡钳值设定为0.2。P<0.05为差异有统计学意义。
2 结 果
2.1 匹配前、后两组临床及病理分期资料比较
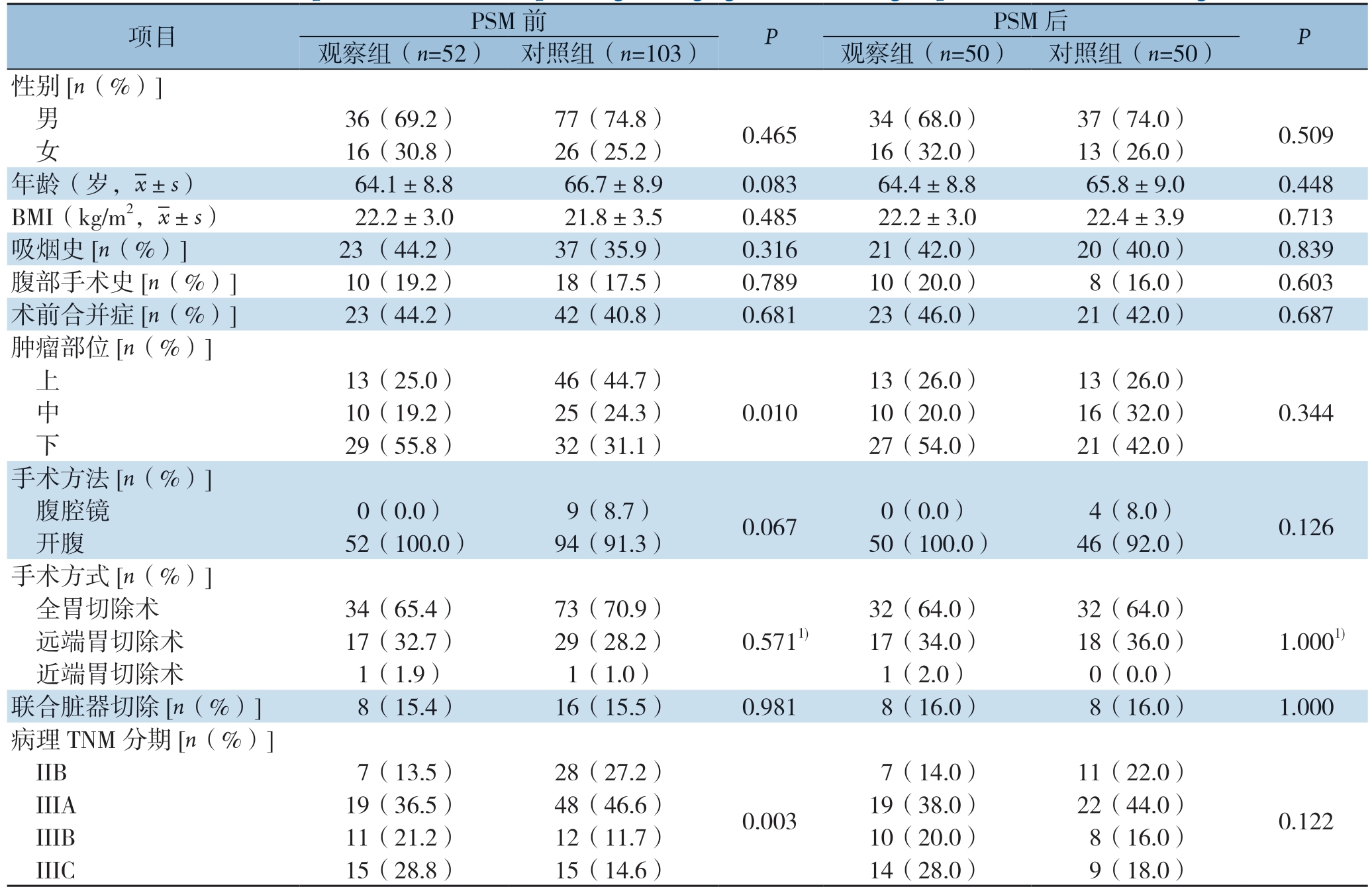
研究共纳入155例局部进展期胃癌患者,其中52例行胃癌根治性手术加HIPEC,103例单纯行胃癌根治性手术,PSM匹配前,两组在肿瘤部位、病理TNM分期比较差异均有统计学意义(均P<0.05),两组患者的基线数据不平衡。通过PSM方法,平衡两组患者的基线资料,匹配的因素包括性别、年龄、BMI、吸烟史、腹部手术史、术前合并症、肿瘤部位、手术方法、手术方式、联合脏器切除、病理TNM分期。100例患者(观察组和对照组各50例)配对成功,匹配后观察组患者的临床及病理分期资料与对照组患者比较差异均无统计学意义(均P>0.05)(表1)。
2.2 匹配前、后两组患者术后资料对比
PSM匹配前、后观察组手术时间均长于对照组手术时间,差异均有统计学意义(均P <0.001)。匹配前观察组术后第1 天复查实验室检查指标中AST、ALB低于对照组,差异有统计学意义(均P <0.05),匹配后两组患者术后 第1天复查实验室检查指标比较差异均无统计学意义(均P>0.05),匹配前、后观察组患者在术中出血量、术后首次通气时间、术后住院日、术后前3 d疼痛评分与对照组比较差异均无统计学意义(均P>0.05)(表2)。
表1 匹配前、后两组临床及病理分期资料比较
Table 1 Comparison of clinical and pathological staging data of the two group before and after matching
注:1)采用Fisher 确切概率法
Note: 1) Using Fisher's exact test
项目 PSM 前 P PSM 后 P观察组(n=52) 对照组(n=103) 观察组(n=50) 对照组(n=50)性别[n(%)] 男 36(69.2) 77(74.8) 0.465 34(68.0) 37(74.0) 0.509 女 16(30.8) 26(25.2) 16(32.0) 13(26.0)年龄(岁,images/BZ_66_1678_802_1700_852.png±s) 64.1±8.8 66.7±8.9 0.083 64.4±8.8 65.8±9.0 0.448 BMI(kg/m2,images/BZ_66_1678_802_1700_852.png±s) 22.2±3.0 21.8±3.5 0.485 22.2±3.0 22.4±3.9 0.713吸烟史[n(%)] 23 (44.2) 37(35.9) 0.316 21(42.0) 20(40.0) 0.839腹部手术史[n(%)] 10(19.2) 18(17.5) 0.789 10(20.0) 8(16.0) 0.603术前合并症[n(%)] 23(44.2) 42(40.8) 0.681 23(46.0) 21(42.0) 0.687肿瘤部位[n(%)] 上 13(25.0) 46(44.7) 13(26.0) 13(26.0) 中 10(19.2) 25(24.3) 0.010 10(20.0) 16(32.0) 0.344 下 29(55.8) 32(31.1) 27(54.0) 21(42.0)手术方法[n(%)] 腹腔镜 0(0.0) 9(8.7) 0.067 0(0.0) 4(8.0) 0.126 开腹 52(100.0) 94(91.3) 50(100.0) 46(92.0)手术方式[n(%)] 全胃切除术 34(65.4) 73(70.9) 32(64.0) 32(64.0) 远端胃切除术 17(32.7) 29(28.2) 0.5711) 17(34.0) 18(36.0) 1.0001) 近端胃切除术 1(1.9) 1(1.0) 1(2.0) 0(0.0)联合脏器切除[n(%)] 8(15.4) 16(15.5) 0.981 8(16.0) 8(16.0) 1.000病理TNM 分期[n(%)] IIB 7(13.5) 28(27.2) 7(14.0) 11(22.0) IIIA 19(36.5) 48(46.6) 0.003 19(38.0) 22(44.0) 0.122 IIIB 11(21.2) 12(11.7) 10(20.0) 8(16.0) IIIC 15(28.8) 15(14.6) 14(28.0) 9(18.0)
表2 匹配前、后两组患者术后资料比较
Table 2 Comparison of postoperative data between t he two group before and after matching
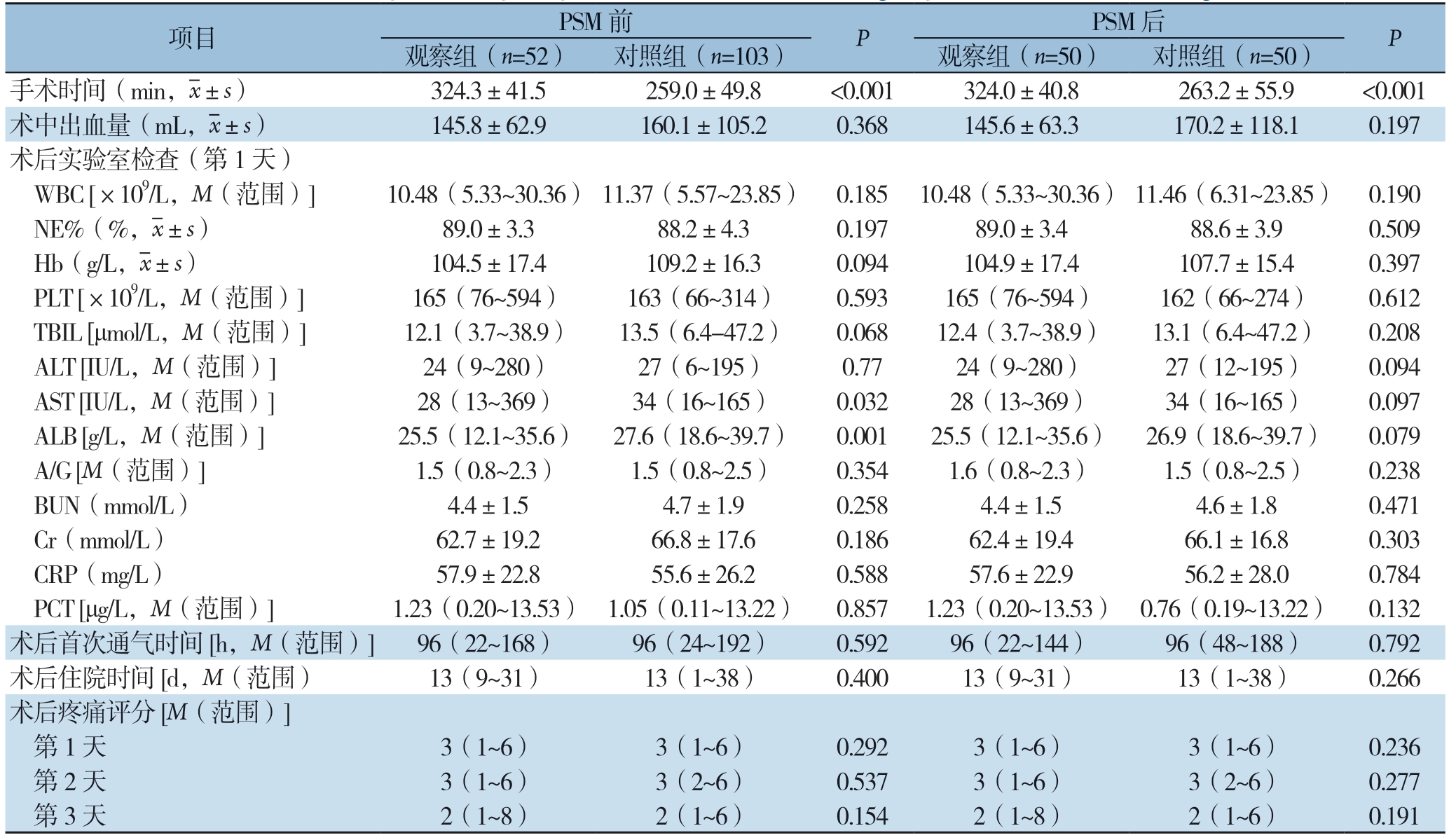
项目 PSM 前 PSM 后 P观察组(n=52) 对照组(n=103) 观察组(n=50) 对照组(n=50)手术时间(min,images/BZ_66_1678_802_1700_852.png±s) 324.3±41.5 259.0±49.8 324.0±40.8 263.2±55.9 <0.001术中出血量(mL,images/BZ_66_1678_802_1700_852.png±s) 145.8±62.9 160.1±105.2 0.368 145.6±63.3 170.2±118.1 0.197术后实验室检查(第1 天) WBC [×109/L,M(范围)] 10.48(5.33~30.36) 11.37(5.57~23.85) 0.185 10.48(5.33~30.36) 11.46(6.31~23.85) 0.190 NE%(%,images/BZ_66_1678_802_1700_852.png±s) 89.0±3.3 88.2±4.3 0.197 89.0±3.4 88.6±3.9 0.509 Hb(g/L,images/BZ_66_1678_802_1700_852.png±s) 104.5±17.4 109.2±16.3 0.094 104.9±17.4 107.7±15.4 0.397 PLT [×109/L,M(范围)] 165(76~594) 163(66~314) 0.593 165(76~594) 162(66~274) 0.612 TBIL [μmol/L,M(范围)] 12.1(3.7~38.9) 13.5(6.4-47.2) 0.068 12.4(3.7~38.9) 13.1(6.4~47.2) 0.208 ALT [IU/L,M(范围)] 24(9~280) 27(6~195) 0.77 24(9~280) 27(12~195) 0.094 AST [IU/L,M(范围)] 28(13~369) 34(16~165) 0.032 28(13~369) 34(16~165) 0.097 ALB [g/L,M(范围)] 25.5(12.1~35.6) 27.6(18.6~39.7) 0.001 25.5(12.1~35.6) 26.9(18.6~39.7) 0.079 A/G [M(范围)] 1.5(0.8~2.3) 1.5(0.8~2.5) 0.354 1.6(0.8~2.3) 1.5(0.8~2.5) 0.238 BUN(mmol/L) 4.4±1.5 4.7±1.9 0.258 4.4±1.5 4.6±1.8 0.471 Cr(mmol/L) 62.7±19.2 66.8±17.6 0.186 62.4±19.4 66.1±16.8 0.303 CRP(mg/L) 57.9±22.8 55.6±26.2 0.588 57.6±22.9 56.2±28.0 0.784 PCT [μg/L,M(范围)] 1.23(0.20~13.53) 1.05(0.11~13.22) 0.857 1.23(0.20~13.53) 0.76(0.19~13.22) 0.132术后首次通气时间[h,M(范围)] 96(22~168) 96(24~192) 0.592 96(22~144) 96(48~188) 0.792术后住院时间[d,M(范围) 13(9~31) 13(1~38) 0.400 13(9~31) 13(1~38) 0.266术后疼痛评分[M(范围)] 第1 天 3(1~6) 3(1~6) 0.292 3(1~6) 3(1~6) 0.236 第2 天 3(1~6) 3(2~6) 0.537 3(1~6) 3(2~6) 0.277 第3 天 2(1~8) 2(1~6) 0.154 2(1~8) 2(1~6) 0.191
2.3 匹配前、后两组组患者术后并发症对比
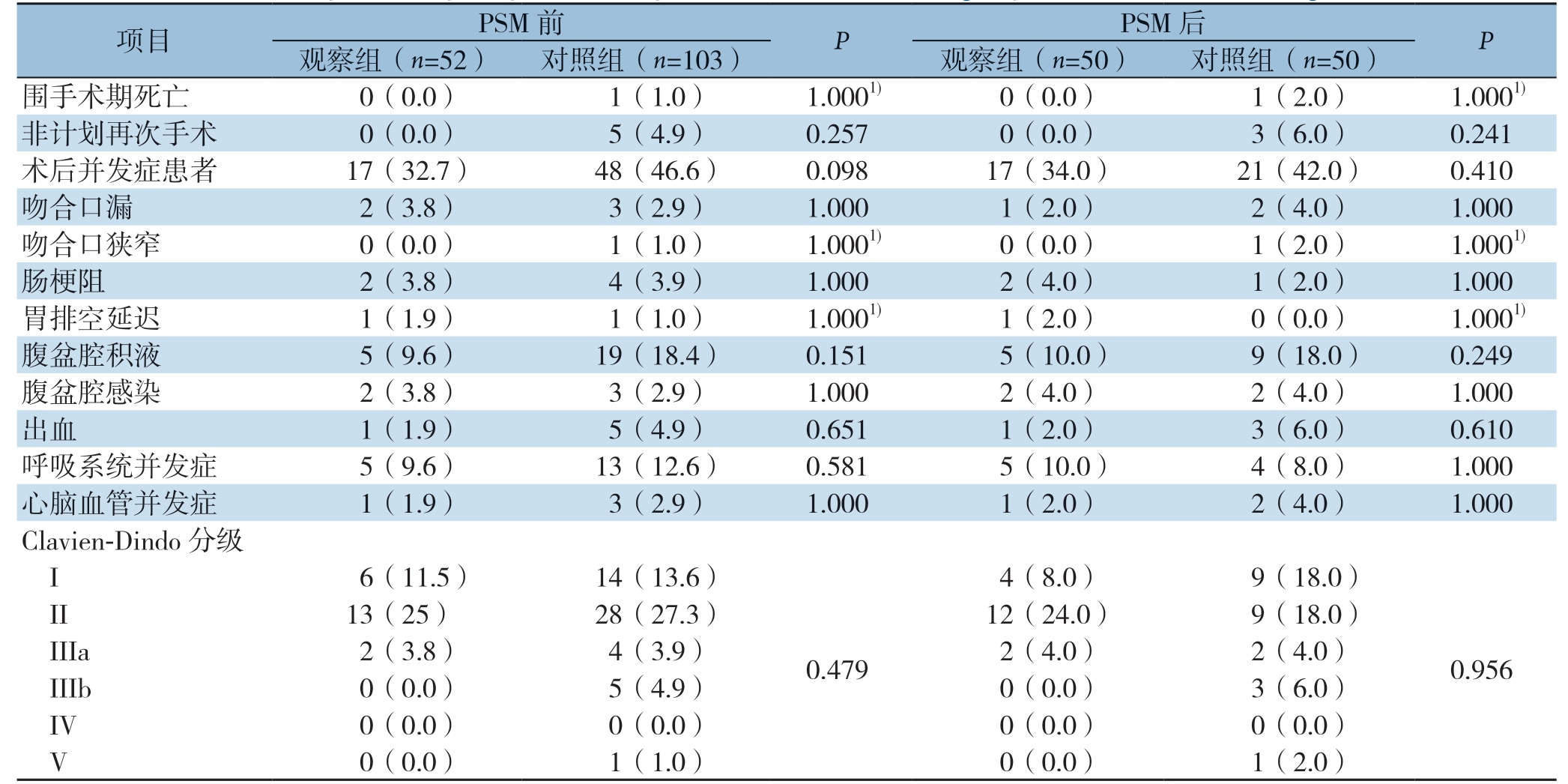
PSM匹配前围手术期对照组死亡1例(1%,患者术后第1天死于急性心肌梗死),观察组死亡0例,差异比较无统计学意义(P>0.05)。对照组5例患者因术后腹腔内出血再次行剖腹探查止血术,观察组无非计划再手术患者,差异比较无统计学意义(均P>0.05)。155例根治性胃切除术手术患者中,65例(42.0%)患者发生至少1种术后并发症,其中观察组17例(32.7%),对照组 48例(46.6%),并发症Clavien-Dindo分级多为I、II级,观察组III级及以上并发症2例(3.8%),对照组III级及以上并发症10例(9.7%)。PSM匹配前、后观察组患者总并发症发生率,吻合口漏、吻合口狭窄、肠梗阻、胃排空延迟、腹盆腔积液、腹盆腔感染、出血、呼吸系统并发症、心脑血管并发症等并发症发生率、术后并发症Clavien-Dindo分级与对照组比较差异均无统计学意义(均P>0.05)(表3)。
2.4 匹配前、后两组患者术后血液学毒性相关不良事件比较
观察组和对照组术后血液学毒性不良事件列在表4中,唯一的3级血液学毒性事件为转氨酶升高,匹配前观察组1例,对照组3例,给予保肝等对症治疗后好转,其余血液学毒性不良事件均为 1 级或2 级,无需特殊处理或对症治疗后好转。匹配前、后观察组在白细胞减低、血小板减低、胆红素升高、转氨酶升高、肌酐升高与对照组比较,两组差异均无统计学意义(P>0.05)。
表3 匹配前、后两组组患者术后并发症比较[n(%)]
Table 3 Comparison of postoperative complications between the two group before and after matching [n (%)]
注:1)采用Fisher 确切概率法
Note: 1) Using Fisher's exact test
项目 PSM 前 P PSM 后 P观察组(n=52) 对照组(n=103) 观察组(n=50) 对照组(n=50)围手术期死亡 0(0.0) 1(1.0) 1.0001) 0(0.0) 1(2.0) 1.0001)非计划再次手术 0(0.0) 5(4.9) 0.257 0(0.0) 3(6.0) 0.241术后并发症患者 17(32.7) 48(46.6) 0.098 17(34.0) 21(42.0) 0.410吻合口漏 2(3.8) 3(2.9) 1.000 1(2.0) 2(4.0) 1.000吻合口狭窄 0(0.0) 1(1.0) 1.0001) 0(0.0) 1(2.0) 1.0001)肠梗阻 2(3.8) 4(3.9) 1.000 2(4.0) 1(2.0) 1.000胃排空延迟 1(1.9) 1(1.0) 1.0001) 1(2.0) 0(0.0) 1.0001)腹盆腔积液 5(9.6) 19(18.4) 0.151 5(10.0) 9(18.0) 0.249腹盆腔感染 2(3.8) 3(2.9) 1.000 2(4.0) 2(4.0) 1.000出血 1(1.9) 5(4.9) 0.651 1(2.0) 3(6.0) 0.610呼吸系统并发症 5(9.6) 13(12.6) 0.581 5(10.0) 4(8.0) 1.000心脑血管并发症 1(1.9) 3(2.9) 1.000 1(2.0) 2(4.0) 1.000 Clavien-Dindo 分级 I 6(11.5) 14(13.6)0.479 4(8.0) 9(18.0)0.956 II 13(25) 28(27.3) 12(24.0) 9(18.0) IIIa 2(3.8) 4(3.9) 2(4.0) 2(4.0) IIIb 0(0.0) 5(4.9) 0(0.0) 3(6.0) IV 0(0.0) 0(0.0) 0(0.0) 0(0.0) V 0(0.0) 1(1.0) 0(0.0) 1(2.0)
表4 匹配前、后两组患者术后实验室检查相关不良事件(n)
Table 4 Adverse events related to postoperative laboratory examination of patients in the two group before and after matching (n)
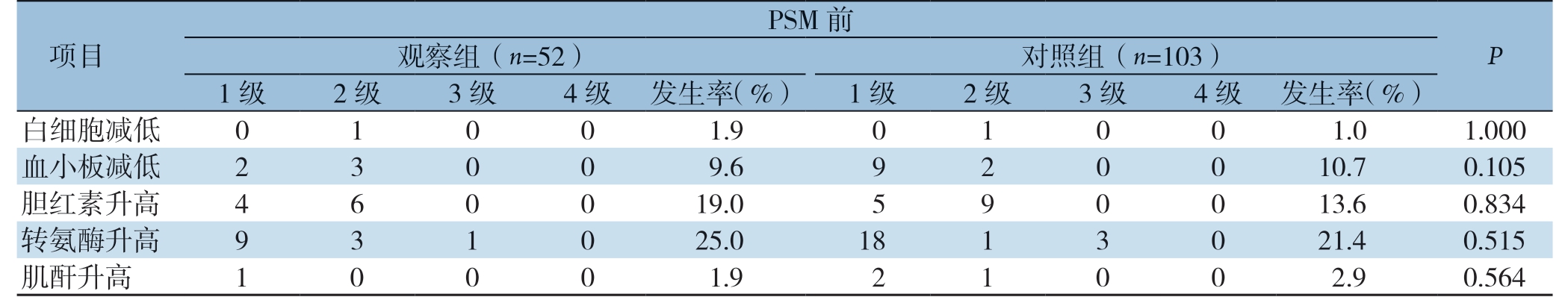
项目PSM 前P 观察组(n=52) 对照组(n=103)1 级 2 级 3 级 4 级 发生率(%) 1 级 2 级 3 级 4 级 发生率(%)白细胞减低 0 1 0 0 1.9 0 1 0 0 1.0 1.000血小板减低 2 3 0 0 9.6 9 2 0 0 10.7 0.105胆红素升高 4 6 0 0 19.0 5 9 0 0 13.6 0.834转氨酶升高 9 3 1 0 25.0 18 1 3 0 21.4 0.515肌酐升高 1 0 0 0 1.9 2 1 0 0 2.9 0.564
表4 匹配前、后两组患者术后实验室检查相关不良事件(n)(续)
Table 4 Adverse events related to postoperative laboratory examination of patients in the two group before and after matching (n) (continued)
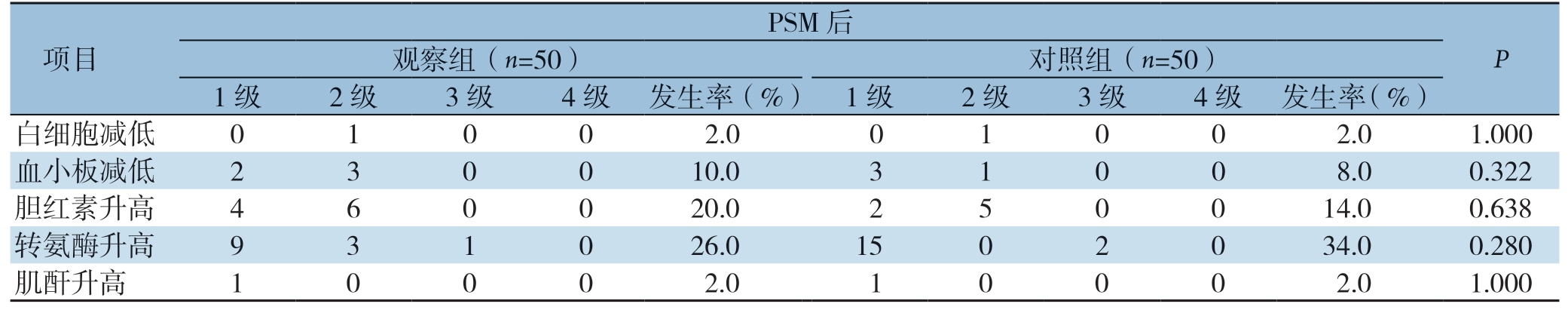
项目PSM 后P 观察组(n=50) 对照组(n=50)1 级 2 级 3 级 4 级 发生率(%) 1 级 2 级 3 级 4 级 发生率(%)白细胞减低 0 1 0 0 2.0 0 1 0 0 2.0 1.000血小板减低 2 3 0 0 10.0 3 1 0 0 8.0 0.322胆红素升高 4 6 0 0 20.0 2 5 0 0 14.0 0.638转氨酶升高 9 3 1 0 26.0 15 0 2 0 34.0 0.280肌酐升高 1 0 0 0 2.0 1 0 0 0 2.0 1.000
3 讨 论
局部进展期胃癌常常伴有亚临床腹膜转移,即使通过胃癌D2根治性手术,在治疗后的最初几个月或几年内,往往会出现腹膜转移复发。亚临床腹膜转移是导致术前、术后腹腔种植性转移的主要因素。如何治疗胃癌腹膜转移是延长患者生存和改善患者生存质量的关键,自1988年Fujimoto等[13]首次将HIPEC应用于胃癌患者后,国内外学者对该方法进行了深入研究,HIPEC可有效清除腹腔游离癌细胞和微小转移灶,预防和治疗胃癌腹膜转移[4,13-16]。Desiderio等[17]进行的Meta分析,共纳入11 项随机对照试验和21 项非随机对照试验,研究显示了预防性HIPEC可带来生存获益,特别是仅限于细胞学阳性和淋巴结受累有限的患者可能从HIPEC中获益最多。既往的研究发现胃癌患者手术治疗后腹膜转移复发的高危因素包括浆膜浸润(T3、T4 期肿瘤)、淋巴结转移、印戒细胞癌以及腹腔检测到游离癌细胞,这部分患者手术治疗失败主要归因于腹膜复发,因而有必要提供预防性治疗,降低这类患者腹膜复发的风 险[18-19]。本研究选取有浆膜浸润的局部进展期胃癌作为研究对象,探讨在局部进展期胃癌根治性手术中应用预防性HIPEC的安全性和疗效。
在本研究中,HIPEC 作为一种术中即刻的辅助化疗,用于预防和治疗胃癌根治性手术后的腹膜转移。腹部原发肿瘤切除时可能会遗漏腹膜转移,肿瘤切除术后的手术应激也可能导致癌细胞的快速生长,因此,HIPEC应与原发性肿瘤切除术同时进行[20]。根治性手术后腹腔内的肿瘤负荷最小,腹腔无粘连,灌注液循环灌注充盈整个腹腔,灌注治疗可以达到最佳疗效[21]。早期的HIPEC相关研究报道的并发症相对较多,随着研究的深入,HIPEC理论、治疗方法和设备不断创新和改进,其并发症发生率和病死率逐渐降低,不同时期Clavien-Dindo 分级III~V级并发症发生率为9.5%~25.0%,但是目前国内外缺乏足够的高级别循证医学证据,尚不能科学的评价其安全性和疗效[10,22]。法国的CYTO-CHIP研究[23]显示,HIPEC用于完全CRS后治疗胃癌腹膜转移,与单独CRS相比,CRS-HIPEC 可提高患者的总生存率和无复发生存率,无额外的并发症发生率和病死率。Newhook等[24]2019年对44例胃或胃食管交界处腺癌合并腹膜癌或腹腔细胞学阳性的患者进行了71次腹腔镜HIPEC,对手术后的围手术期结局和并发症率进行了描述,腹腔镜HIPEC是安全的,围手术期30 d的III、IV级并发症和CTCAE毒性发生率分别为1.4%和12.7%,大多数并发症和毒性为轻度1级,且多与胃肠道症状有关。张志平等[25]在对腹腔镜下D2胃癌根治术联合HIPEC的临床疗效和对免疫功能影响的研究中发现进展期胃癌根治性手术中行HIPEC,没有明显增加切口裂开、腹腔内出血、腹腔感染、吻合口漏、粘连性肠梗阻等并发症的发生率,安全有效,且有助于改善患者的免疫功能。本研究观察组PSM前、后Clavien-Dindo分级III级及以上并发症发生率分别为3.8%、4.0%,手术加HIPEC虽然延长了患者手术麻醉时间,但并未影响患者术后功能恢复及增加相关并发症发生率,术中HIPEC技术较前成熟完善,安全可靠,与前述研究一致。研究入组患者严格按照《中国胃肠肿瘤外科术后并发症诊断登记规范专家共识(2018版)》[12]记录患者术后相关并发症,不遗巨细,如引流管留置时间大于 1周则提示吻合口漏I级或腹盆腔积液、腹盆腔感染 I级,存在药物干预如抗生素的延长使用或更换则提示相关II级并发症。术后并发症登记详实,得益于共识对术后并发症诊断登记的规范化、标准化界定,但同时,如此之高的并发症发生率,虽多为I、II级并发症,需引起临床思考,对于术后引流管留置、药物干预,如无异常是否必须,或将是后续研究观察的重点。
目前HIPEC的最佳用药方案和剂量没有达成共识,腹腔灌注药物应选择可以在腹腔维持较高的药物浓度,药物分子量较大,吸收入血缓慢,药物对腹腔肿瘤的渗透力较强,且对腹膜刺激性小的药物,同时需兼顾药物对肿瘤的敏感度。雷替曲塞是水溶性胸苷酸合成酶的特异性选择抑制剂,药物的分子量为458,分子量大于奥沙利铂(397)、顺铂(300),腹腔清除缓慢,对肿瘤细胞有较强的穿透力,在不使用缓释药物基质的情况下与肿瘤细胞进行长时间的反应(半衰期198 h),其在胃肠道肿瘤静脉化疗中的疗效安全肯定[26-29]。现静脉化疗中顺铂多为奥沙利铂所替代,而奥沙利铂腹腔灌注需葡萄糖水作为灌注液,监控血糖的同时需联合氟尿嘧啶及亚叶酸钙静脉化疗增敏,临床应用繁琐[20]。雷替曲塞相较于紫杉醇,毒副作用及过敏反应发生概率明显减少,同时雷替曲塞在胃癌手术中腹腔化疗的安全性研究证实使用雷替曲塞腹腔化疗是一种安全、合理的策略,临床并发症发生率较低,大多数并发症和毒性为轻度1级或2级[30-31]。本研究以雷替曲塞作为腹腔热灌注化疗药物,血液学毒性中唯一的3级毒性为转氨酶升高,给予保肝等对症治疗后好转,其余血液学毒性不良事件均为1级或2级,无需特殊处理或对症治疗后好转。本研究提示雷替曲塞术中HIPEC是安全的,患者血液系统、肝肾功能的毒副作用无显著增加,且未增加患者术后并发症的发生风险,不影响患者术后肠道功能的恢复。
综上所述,局部进展期胃癌术后腹膜种植转移是影响患者预后的重要原因,通过PSM分析,消除组间选择偏移,研究认为胃癌根治性手术术中行HIPEC,安全可行,并未增加患者不良反应的发生率。同时,本研究存在一定缺陷,回顾性研究往往存在偏倚,虽通过PSM均衡组间变量,对比匹配前后患者的术后资料,进行敏感度分析,仅在术后患者第1天肝功能、白蛋白水平存在差异,其余术后实验室检查、术后资料、术后并发症、血液学毒性相关不良事件对比结果一致,表明受混杂因素影响不大,结果稳定,但仍不免存在选择偏倚及未知混杂偏倚。另外,由于研究样本量小且随访时间短,对于HIPEC能否降低局部进展期胃癌患者术后腹膜复发率,延长患者远期生存率,其对长期预后的影响仍需要进一步扩大样本、加强术后随访,这种治疗方法的有效性需要在更长期的研究中进行充分的评估,国内有关进展期胃癌根治性手术联合HIPEC治疗的多中心、前瞻性研究“HIPEC-01”研究也已完成入组,目前处于随访阶段,其结果令人期待。
[1] Sung H, Ferlay J, Siegel RL, et al.Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin, 2021, doi: 10.3322/caac.21660.[Online ahead of print]
[2] Chen W, Sun K, Zheng R, et al.Cancer incidence and mortality in China, 2014[J].Chin J Cancer Res, 2018, 30(1):1–12.doi: 10.21147/j.issn.1000–9604.2018.01.01.
[3] 曹毛毛, 李贺, 孙殿钦, 等.2000—2019年中国胃癌流行病学趋势分析[J].中华消化外科杂志, 2021, 20(1):102–109.doi:10.3760/cma.j.cn115610–20201130–00746.
Cao MM, Li H, Sun DQ, et al.Epidemiological trend analysis of gastric cancer in China from 2000 to 2019[J].Chinese Journal of Digestive Surgery, 2021, 20(1):102–109.doi:10.3760/cma.j.cn115610–20201130–00746.
[4] Yarema R, Mielko J, Fetsych T, et al.Hyperthermic intraperitoneal chemotherapy (HIPEC) in combined treatment of locally advanced and intraperitonealy disseminated gastric cancer: A retrospective cooperative Central-Eastern European study[J].Cancer Med, 2019, 8(6):2877–2885.doi: 10.1002/cam4.2204.
[5] van Driel WJ, Koole SN, Sikorska K, et al.Hyperthermic Intraperitoneal Chemotherapy in Ovarian Cancer[J].N Engl J Med, 2018, 378(3):230–240.doi: 10.1056/NEJMoa1708618.
[6] 李鑫宝, 林育林, 姬忠贺, 等.肿瘤细胞减灭术加腹腔热灌注化疗治疗腹膜假黏液瘤182例分析[J].中国肿瘤临床, 2018, 45(18):943–949.doi:10.3969/j.issn.1000–8179.2018.18.607.
Li XB, Lin YL, Ji ZH, et al.Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy in patients with pseudomyxoma peritonei:Analysis of 182 patients at a single center[J].Chinese Journal of Clinical Oncology, 2018, 45(18):943–949.doi:10.3969/j.issn.1000–8179.2018.18.607.
[7] 钟育波, 邱磊, 谢沛标, 等.腹腔镜下结直肠癌根治术中联合腹腔热灌注化疗的临床研究[J].中国普通外科杂志, 2015, 24(4):467–472.doi: 10.3978/j.issn.1005–6947.2015.04.002.
Zhong YB, Qiu L, Xie PB, et al.Laparoscopic colorectal cancer resection in combination with intraoperative intraperitoneal hyperthermic perfusion chemotherapy[J].Chinese Journal of General Surgery, 2015, 24(4):467–472.doi: 10.3978/j.issn.1005–6947.2015.04.002.
[8] 李晶晶, 魏志刚, 段雪飞, 等.T4期结直肠癌根治术后早期腹腔热灌注化疗的临床研究[J].中国普通外科杂志, 2016, 25(4):470–474.doi: 10.3978/j.issn.1005–6947.2016.04.002.
Li JJ, Wei ZG, Duan XF, et al.Clinical analysis of early hyperthermic intraperitoneal chemotherapy after radical resection of T4 colorectal cancer[J].Chinese Journal of General Surgery, 2016, 25(4):470–474.doi: 10.3978/j.issn.1005–6947.2016.04.002.
[9] 王洪波, 汪欣, 刘斯, 等.进展期胃癌术后腹腔热灌注化疗的研究进展[J].中国肿瘤临床, 2019, 46(2):99–102.doi:10.3969/j.issn.1000–8179.2019.02.846.
Wang HB, Wang X, Liu S, et al.Research progress of intraperitoneal hyperthermic perfusion chemotherapy after ad-vanced gastric cancer operation[J].Chinese Journal of Clinical Oncology, 2019, 46(2):99–102.doi:10.3969/j.issn.1000–8179.2019.02.846.
[10] 陈新华, 罗俊, 刘浩, 等.腹腔热灌注化疗预防局部进展期胃癌根治术后腹膜复发的研究进展[J].中华胃肠外科杂志, 2018, 21(5):593–599.doi:10.3760/cma.j.issn.1671–0274.2018.05.022.
Chen XH, Lou J, Liu H, et al.Progress in prophylatic hyperthermic intraperitoneal chemotherapy for advanced gastric carcinoma[J].Chinese Journal of Gastrointestinal Surgery, 2018, 21(5):593–599.doi:10.3760/cma.j.issn.1671–0274.2018.05.022.
[11] Karcioglu O, Topacoglu H, Dikme O, et al.A systematic review of the pain scales in adults: Which to use?[J].Am J Emerg Med, 2018, 36(4):707–714.doi: 10.1016/j.ajem.2018.01.008.
[12] 中国胃肠肿瘤外科联盟, 中国抗癌协会胃癌专业委员会.中国胃肠肿瘤外科术后并发症诊断登记规范专家共识(2018版)[J].中国实用外科杂志, 2018, 38(6):589–595.doi:10.19538/j.cjps.issn1005–2208.2018.06.01.
China Gastrointestinal Cancer Surgery Union, Chinese Gastric Cancer Association.Chinese expert concensus on registration standards for postoperative complications after surgery for gastrointestinal tumor (2018 edition)[J].Chinese Journal of Practical Surgery, 2018, 38(6):589–595.doi:10.19538/j.cjps.issn1005–2208.2018.06.01.
[13] Fujimoto S, Shrestha RD, Kokubun M, et al.Intraperitoneal hyperthermic perfusion combined with surgery effective for gastric cancer patients with peritoneal seeding[J].Ann Surg, 1988, 208(1):36–41.doi: 10.1097/00000658–198807000–00005.
[14] 中国抗癌协会腹膜肿瘤专业委员会, 广东省抗癌协会肿瘤热疗专业委员会.中国腹腔热灌注化疗技术临床应用专家共识(2019版)[J].中华医学杂志, 2020, 100(2):89–96.doi:10.3760/cma.j.issn.0376–2491.2020.02.003.
Chinese Peritoneal Cancer Association, Professional Committee of Tumor Hyperthermia of Guangdong Anticancer Association.Chinese expert concensus on clinical application of hyperthermic intraperitoneal chemotherapy (2019 edition)[J].National Medical Journal of China 2020, 100(2):89–96.doi:10.3760/cma.j.issn.0376–2491.2020.02.003.
[15] 阮强, 崔书中, 吴印兵, 等.晚期胃癌恶性腹水患者腹腔热灌注化疗期间应用不同营养支持的效果比较[J].中国普通外科杂志, 2014, 23(10):1385–1389.doi: 10.7659/j.issn.1005–6947.2014.10.015.
Ruan Q, Cui SZ, Wu YB, et al.Efficacy comparison of different nutritional support regimens during hyperthermic intraperitoneal chemoperfusion for patients with advanced gastric cancer and malignant ascites[J].Chinese Journal of General Surgery, 2014, 23(10):1385–1389.doi: 10.7659/j.issn.1005–6947.2014.10.015.
[16] Brandl A, Yonemura Y, Glehen O, et al.Long term survival in patients with peritoneal metastasised gastric cancer treated with cytoreductive surgery and HIPEC: A multi-institutional cohort from PSOGI[J].Eur J Surg Oncol, 2021, 47(1):172–180.doi: 10.1016/j.ejso.2020.10.006.
[17] Desiderio J, Chao J, Melstrom L, et al.The 30-year experience-A meta-analysis of randomised and high-quality non-randomised studies of hyperthermic intraperitoneal chemotherapy in the treatment of gastric cancer[J].Eur J Cancer, 2017, 79:1–14.doi: 10.1016/j.ejca.2017.03.030.
[18] Glehen O, Passot G, Villeneuve L, et al.GASTRICHIP: D2 resection and hyperthermic intraperitoneal chemotherapy in locally advanced gastric carcinoma: a randomized and multicenter phase III study[J].BMC Cancer, 2014, 14:183.doi: 10.1186/1471–2407–14–183.
[19] Rau B, Brandl A, Piso P, et al.Peritoneal metastasis in gastric cancer: results from the German database[J].Gastric Cancer, 2020, 23(1):11–22.doi: 10.1007/s10120–019–00978–0.
[20] Klaver CEL, Wisselink DD, Punt CJA, et al.Adjuvant hyperthermic intraperitoneal chemotherapy in patients with locally advanced colon cancer (COLOPEC): a multicentre, open-label, randomised trial[J].Lancet Gastroenterol Hepatol, 2019, 4(10):761–770.doi: 10.1016/S2468–1253(19)30239–0.
[21] 吴川清, 李源, 王点石, 等.腹腔热灌注化疗治疗胃癌腹膜转移的安全性及有效性单中心临床研究[J].临床外科杂志, 2020, 28(5):424–428.doi: 10.3969/j.issn.1005–6483.2020.05.007.
Wu CQ, Li Y, Wang DS, et al.The single-center clinical analysis of efficacy and safety in hyperthermic intraperitoneal chemotherapyfor gastric cancer patients with peritoneal metastasis[J].Journal of Clinical Surgery, 2020, 28(5):424–428.doi: 10.3969/j.issn.1005–6483.2020.05.007.
[22] Hsieh MC, Lu CY, Chang WW, et al.Experiences with cytoreduction surgery plus hyperthermic intraperitoneal chemotherapy in Taiwan[J] .Medicine (Baltimore), 2017,
[23] Bonnot PE, Piessen G, Kepenekian V, et al.Cytoreductive Surgery With or Without Hyperthermic Intraperitoneal Chemotherapy for Gastric Cancer With Peritoneal Metastases (CYTO-CHIP study): A Propensity Score Analysis[J].J Clin Oncol, 2019, 37(23):2028–2040.doi: 10.1200/JCO.18.01688.
[24] Newhook TE, Agnes A, Blum M, et al.Laparoscopic Hyperthermic Intraperitoneal Chemotherapy is Safe for Patients with Peritoneal Metastases from Gastric Cancer and May Lead to Gastrectomy[J].Ann Surg Oncol, 2019, 26(5):1394–1400.doi: 10.1245/s10434–018–07140–7.
[25] 张志平, 胡礼, 殷永芳, 等.腹腔镜胃癌根治术联合腹腔热灌注化疗治疗82例进展期胃癌临床效果分析[J].肿瘤学杂志, 2018, 24(6):631–633.doi: 10.11735/j.issn.1671–170X.2018.06.B020.
Zhang ZP, Hu L, Yin YF, et al.Clinical effect analysis of laparoscopic radical gastrectomy combined with hyperthermic intraperitoneal chemotherapy in the treatment for 82 cases with advanced gastric cancer[J].Journal of Chinese Oncology, 2018, 24(6):631–633.doi: 10.11735/j.issn.1671–170X.2018.06.B020.
[26] Khan K, Rane JK, Cunningham D, et al.Efficacy and Cardiotoxic Safety Profile of Raltitrexed in Fluoropyrimidines-Pretreated or High-Risk Cardiac Patients With GI Malignancies: Large Single-Center Experience[J].Clin Colorectal Cancer, 2019, 18(1):64–71.doi: 10.1016/j.clcc.2018.09.010.
[27] Wilson KS, Malfair Taylor SC.Raltitrexed: optimism and reality[J].Expert Opin Drug Metab Toxicol, 2009, 5(11):1447–1454.doi: 10.1517/17425250903307455.
[28] Sugarbaker PH, Mora JT, Carmignani P, et al.Update on chemotherapeutic agents utilized for perioperative intraperitoneal chemotherapy[J].Oncologist, 2005, 10(2):112–122.doi: 10.1634/theoncologist.10–2–112.
[29] Qiu C, Li Y, Liang X, et al.A study of peritoneal metastatic xenograft model of colorectal cancer in the treatment of hyperthermic intraperitoneal chemotherapy with Raltitrexed[J].Biomed Pharmacother, 2017, 92:149–156.doi: 10.1016/j.biopha.2017.04.053.
[30] Zhao P, Ding Z, Tang L, et al.Preliminary investigation of intraperitoneal raltitrexed in patients with gastric cancer[J].World J Surg Oncol, 2014, 12:403.doi: 10.1186/1477–7819–12–403.
[31] Picard M.Management of Hypersensitivity Reactions to Taxanes[J].Immunol Allergy Clin North Am, 2017, 37(4):679–693.doi: 10.1016/j.iac.2017.07.004.
