结直肠癌是消化系统常见的恶性肿瘤,全世界每年约有130多万新发的结直肠癌患者。男性结直肠癌的发病率居所有恶性肿瘤的第3位,病死率居第4位;在女性中,结直肠癌的发病率和病死率分别是第3位和第2位[1]。近年来,结直肠癌发病率在世界范围内呈上升趋势[2],转移是导致结直肠癌患者死亡的主要原因,术后5年大约40%的结直肠癌出现复发或转移[3]。因此,揭示结直肠癌的转移机制并探究有效的治疗新方法是治疗结直肠癌转移的关键。CXC趋化因子配体14(C-X-C motif chemokine ligand 14,CXCL14)是新近发现的趋化因子家族的一员,最早从乳腺和肾脏组织中提取得到[4],能够激活巨噬细胞、未成熟树突状细胞和自然杀伤细胞的趋化活性[5],CXCL14蛋白参与体内免疫反应,宿主对肿瘤特异免疫的激活以及肿瘤生长的自分泌调节等机制影响肿瘤的发生及发展[6-9]。目前CXCL14在结直肠癌进展、转移方面的作用机理尚不清楚。本研究目的是探讨自分泌及旁分泌的CXCL14对结直肠癌新生血管的影响机理,为临床治疗结直肠癌转移提供潜在的分子靶点。
1 材料与方法
1.1 材料
1.1.1 细胞株 本研究采用的大肠癌细胞株HT-29、WiDr、CaCo-2、Colo-320 和人脐静脉内皮细胞(HUVEC)购自于购自美国ATCC。
1.1.2 主要试剂 重组人CXCL14(rCXCL14)和兔抗人CXCL14 单克隆抗体购自美国R&D 公司。CXCL14 siRNA 购自大连宝生物工程公司。LipofectAMINETM2000 和 Opti-MEM®Ireduced serum medium均购自美国Invitrogen 公司。Premix WST-1 Cell Proliferation Assay System 购自日本Takara 公司。Diff-Quick 染色液购自北京索莱宝科技有限公司。8 μm 孔径的Transwell 上室购自美国Corning 公司。BioCoat Matrigel Invasion Chambers购自美国Corning公司。Angiogenesis Assay kit 购自日本Kurabo 公司。
1.2 方法
1.2.1 细胞培养 HT-29 细胞的培养采用McCoy's培养基,WiDr 细胞采用MEME 培养基进行培养,CaCo-2 和Colo-320 细胞应用RPMI1640 培养基培养。HUVEC 用HuMedia-EB2 培养液进行培养,上述培养基中均加入10% 热灭活胎牛血清(fetal bovine serum,FBS)和100 µg/mL 的链霉素。细胞放置于37 ℃、含5%CO2 的培养箱中培养,1~2 d更换培养基,经4~8 个传代培养后进行细胞实验。
1.2.2 RT-PCR 分析 依据GenBank 提供的CXCL14 基因全序列,应用Primer 3 软件设计引物,所有引物由宝生物工程(大连)有限公司合成。CXCL14(NM_004887)上游引物:5'-GGT TGC CAG AAA AAT GTG CT-3',下游引物:5'-GTT GGG AAC CTC ACA TGCT T-3',扩增片段长度为189 bp;β-actin(NM_001101)上游引物:5'-CTG GCA CCA CAC CTT CTA CAAT-3',下游引物:5'-AAT GTC ACG CAC GAT TTC CCG C-3',扩增片段长度为382 bp。42 ℃下30 min 进行逆转录,94 ℃变性3 min, 94 ℃变性30 s,62 ℃退火45 s,68 ℃延伸60 s,共进行35 个循环。经采用1.5% 琼脂糖凝胶对扩增产物电泳,用凝胶成像系统观察电泳条带。β-actin 为阳性对照。
1.2.3 Western blot 实验 Cell-Lysis buffer 裂解1×106/mL 的HT-29、WiDr、CaCo-2 和Colo-320 细胞细胞提取总蛋白,裂解后的裂解液在1 500 r/min、4 ℃下离心10 min 后,采集上清液,Bradford 法测定上清液中的蛋白浓度。在100 ℃、5 min 条件下进行蛋白变性,取30 μg 蛋白加入10% 的SDS-PAGE 胶加样孔内后电泳2 h,在250 mA、1 h、30 min 的条件下将电泳后胶板上的蛋白质转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜,室温下用5% 脱脂牛奶封闭1 h 后,TBST 缓冲液洗膜3 次, 每次5 min, 然后将PVDF 膜置于含鼠抗人CXCL14 单克隆抗体(稀释比为1:1 000)的封闭液中孵育2 h,TBST 液再洗膜3 次,每次10 min 后,将膜孵育在二抗溶液(稀释比例为1:5 000)中,洗膜3 次,ECL 法显色。应用Image J 软件测定条带的灰度值。
1.2.4 CXCL14 siRNA 的合成及转染 siRNA 序列由锐博科技有限公司提供,CXCL14 siRNA 正向序列:5'-GGG UCC AAA UGC AAG UGC UTT-3',反向序列:5'-AGC ACU UGC AUU UGG ACC CTT-3';阴性对照siRNA 正向序列:5-UUC UCC GAA CGU GUC ACG UTT-3',反向序列:5-ACG UGA CAC GUU CGG AGA ATT-3'。4种结直肠癌细胞以5×105/2.5 mL 种植于6 孔的培养皿中过夜,使细胞附壁。次日,500 μL Opti-MEM® I Reduced Serum Medium 稀 释200 nmol/L CXCL14 siRNA或对照siRNA,同时用同样试剂稀释10 μL 的LipofectamineTM 2000,于室温下静置5 min 后,快速将两者混合,再于室温下静置20 min,以便形成 siRNA/LipofectamineTM 复合物。然后将 100 μL 的siRNA/LipofectamineTM 复合物加入到包含结直肠癌细胞和培养基的6 孔培养皿的孔中,轻柔摇晃培养皿,混匀后置于37 ℃培养箱中转染,转染48 h 后,收集细胞用Western blot 法检测CXCL14 基因的沉默效果。
1.2.5 细胞增殖实验 WST-1 增殖实验依据血管内皮细胞培养基中CXCL14 浓度的分为对照组和实验组,其中培养基中加入0 ng/mL 的CXCL14组作为对照组;实验组又分为1 ng/mL、10 ng/mL和100 ng/mL 的CXCL14+1 µg/mL 的 抗CXCL14抗体5 个亚组。取对数生长期的各组结直肠癌细胞,按l×l05/mL 的浓度接种于96 孔的培养皿,细胞完全贴壁后,更换培养基含不同浓度的CXCL14或抗CXCL14 抗体后孵育72 h, 每孔内加入 100 µL 的 Cell Titer 96 Aqueous One Solution Reagent 液后置于37 ℃的孵育箱中4 h,在酶标仪上测定波长490 nm 每孔的吸光度值。
1.2.6 细胞迁移实验 Matrigel 基质胶与无血清培养基按1:5 的比例在4 ℃下混匀,吸取50 µL加入底部有多个8 µm 微孔的Transwell 小室底部。实验前30 min 再取50 µL 稀释的Matrigel 基质胶涂于Transwell 小室底部成胶,无血清培养基洗Transwell 小室使其基底胶膜水化。HUVEC以2×105/500 µL 的密度接种到成膜的Transwell小室内,将Transwell 小室置于24 孔的培养板的下室内,下室中加入1 000 µL 含有20%FBS、1、10、100 ng/mL 的 CXCL14、100 ng/mL 的CXCL14+1 µg/mL 的CXCL14 抗 体的培养基,在37 ℃培养箱中,孵育24 h。取出Transwell 小室,用棉签擦掉小室内未滤过细胞,用PBS 液洗3 次,5% 戊二醛固定后,加入Giemsa 染色30 min,再次用PBS 洗2 次,将Transwell 小室在显微镜下(×200)计数5 个随机视野穿膜的细胞数,计算平均每个视野的细胞数。
1.2.7 血管新生实验 人成纤维细胞与HUVEC 接种在24 孔的培养盘中共同培养,第2 天更换培养基并加入不同浓度的CXCL14,再于24 孔培养盘中均放入用带有0.45 μm 微孔聚碳酸酯膜底部覆盖的Transwell 小室,或不加CXCL14,但微孔内含2×104/mL HT-29 或CaCo-2 的Transwell 小室,组成共同培养系统。每天更换培养液,共同培养12 d 后,去除培养液,用PBS 液清洗培养孔3 次后用10% 甲醛固定30 min,然后用抗CD31 抗体进行血管染色后自然干燥。在显微镜下取10 个不同区域的新生血管拍照,然后每张照片用血管分析软件(日本Kurabo 公司)计算每张图片的血管总面积或总长度,以像素表示新生血管总长度。
1.3 统计学处理
用SPSS 19.0统计学软件对实验结果进行统计分析,计量资料以均数±标准差( ±s)表示,组内检验采用重复测量方差分析,组间差异性比较用单因素方差分析。P<0.05为差异有统计学意义。
±s)表示,组内检验采用重复测量方差分析,组间差异性比较用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 CXCL14 mRNA 与蛋白在结直肠癌细胞中的表达
RT-PCR结果显示,CXCL14 mRNA和蛋白表达于高肝转移结直肠癌细胞株HT29和WiDr,而在CaCo-2、Colo-320低肝转移结直肠癌细胞中未检测到表达(图1A);Western blot检测结果显示,CXCL14蛋白表达于高肝转移结直肠癌细胞株(HT-29和WiDr),而在低肝转移结直肠癌细胞中无表达,以β-actin为内参,Image软件对图像进行半定量结果显示,HT-29和WiDr细胞CXCL14的表达量分别为19 120±1 545、17 395±2 169,两者差异无统计学意义(t=6.328,P=0.072) (图1B)。
2.2 CXCL14 基因沉默结果
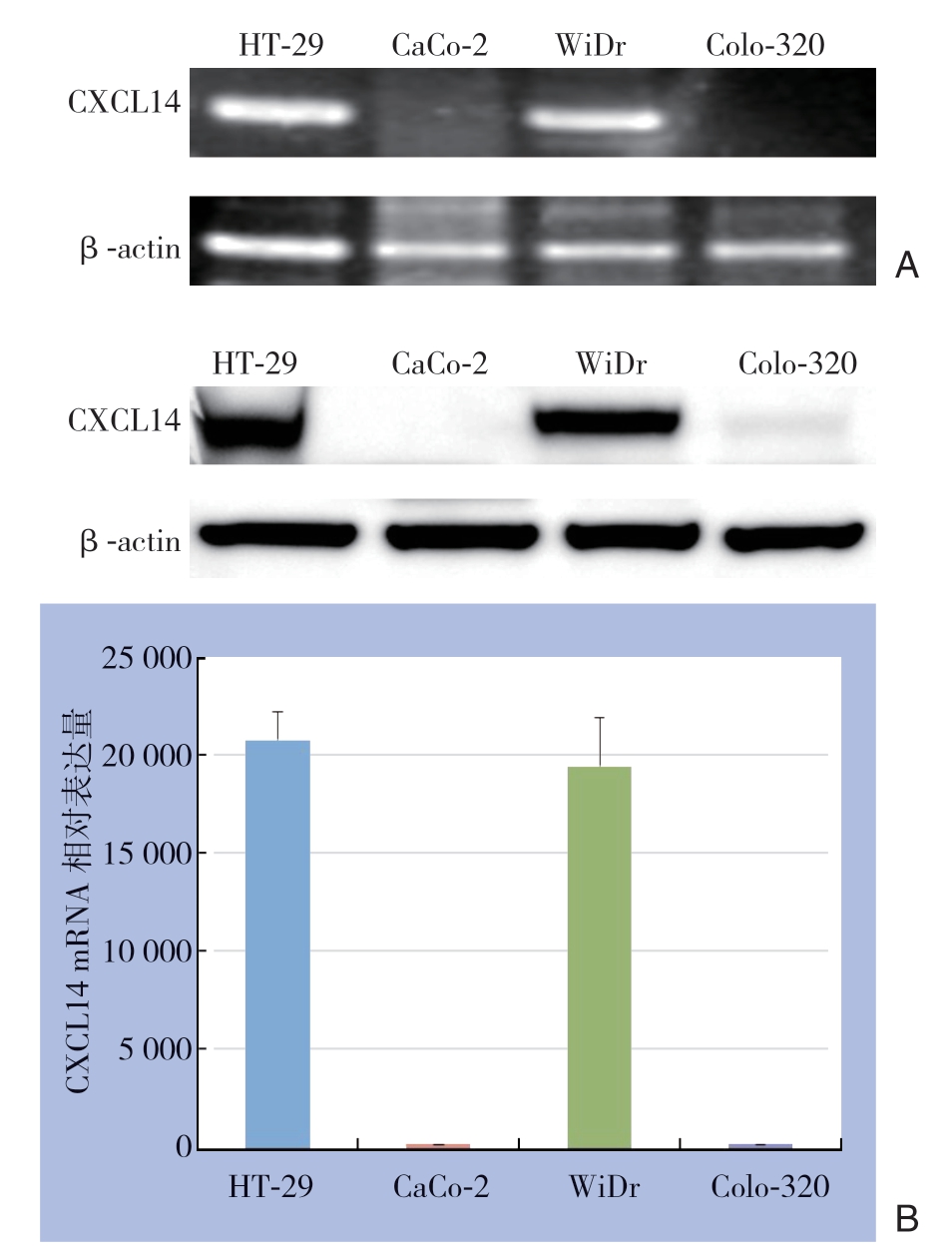
图1 CXCL14在结直肠癌细胞中的表达检测 A:CXCL14 mRNA表达;B:CXCL14 蛋白表达
Figure 1 Detection of CXCL14 expression in colorectal cancer cell lines A: CXCL14 Mrna expression; B: CXCL14 protein expression
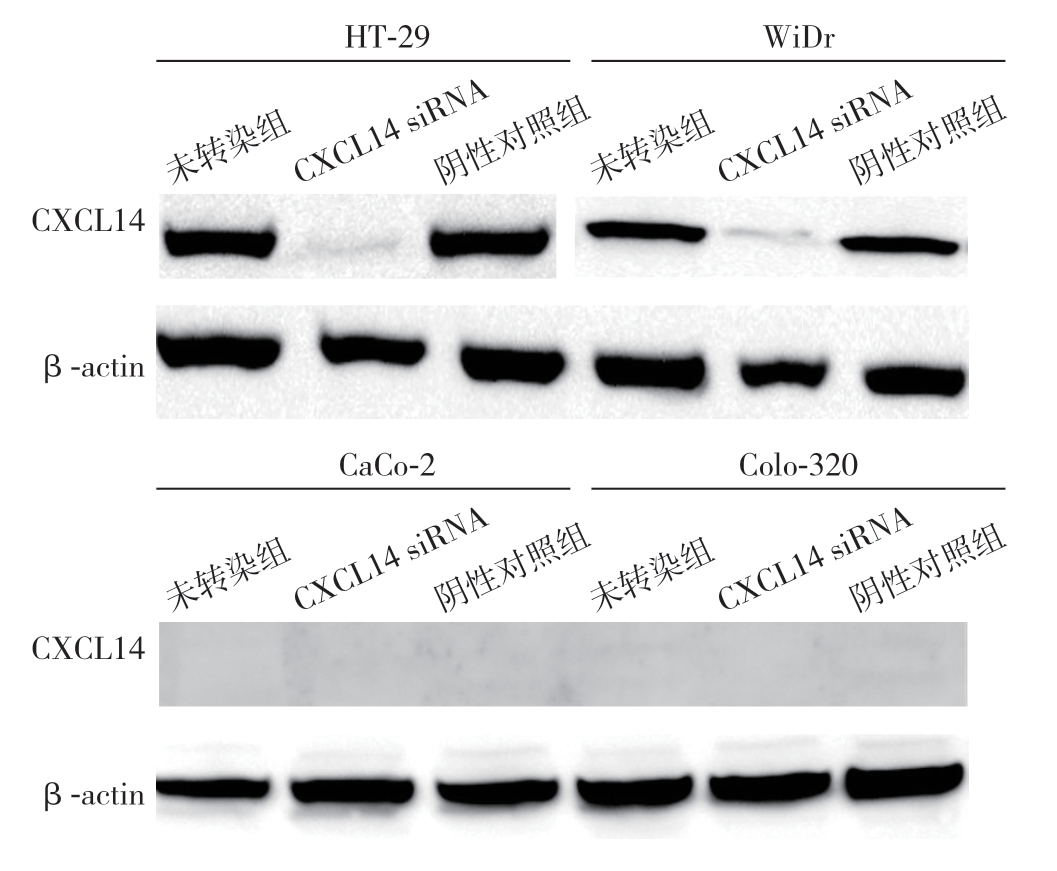
图2 CXCL14 基因沉默作用检测
Figure 2 Detection of effects of CXCL14 gene silencing
4株结直肠癌细胞转染CXCL14 siRNA后,HT-29和WiDr细胞CXCL14蛋白表达被抑制,而阴性对照组(controlsi RNA)和未转染组(untreated)仍表达CXCL14。CXCL14 siRNA转染与否,CaCo-2、Colo-320细胞均无CXCL14表达(图2)。
2.3 CXCL14 对HUVEC 增殖的影响
CXCL14 以浓度递增的方式增强HUVEC 的增殖,0、1、10、100 ng/mL CXCL14作用后的吸光度值分别为:1.13±0.12、1.49±0.093、1.76±0.142、2.11±0.106;CXCL14抗体能够抑制CXCL14对HUVEC增殖的增强作用(吸光度值:1.17±0.03)(图3)。
2.4 CXCL14 对HUVEC 迁移的影响
CXCL14 以浓度递增的方式提升HUVEC 的迁移能力, 0、1、10、100 ng/mL CXCL14作用后的迁移细胞数分别为:(1 5.3±1.4)、(20.6±2.0)、(24.9±1.9)、(31.5±2.6)个;CXCL14抗体能够拮抗CXCL14的作用,100 ng/mL CXCL14+CXCL14 抗体作用后的迁移细胞数为(14.7±2.3)个(图4)。
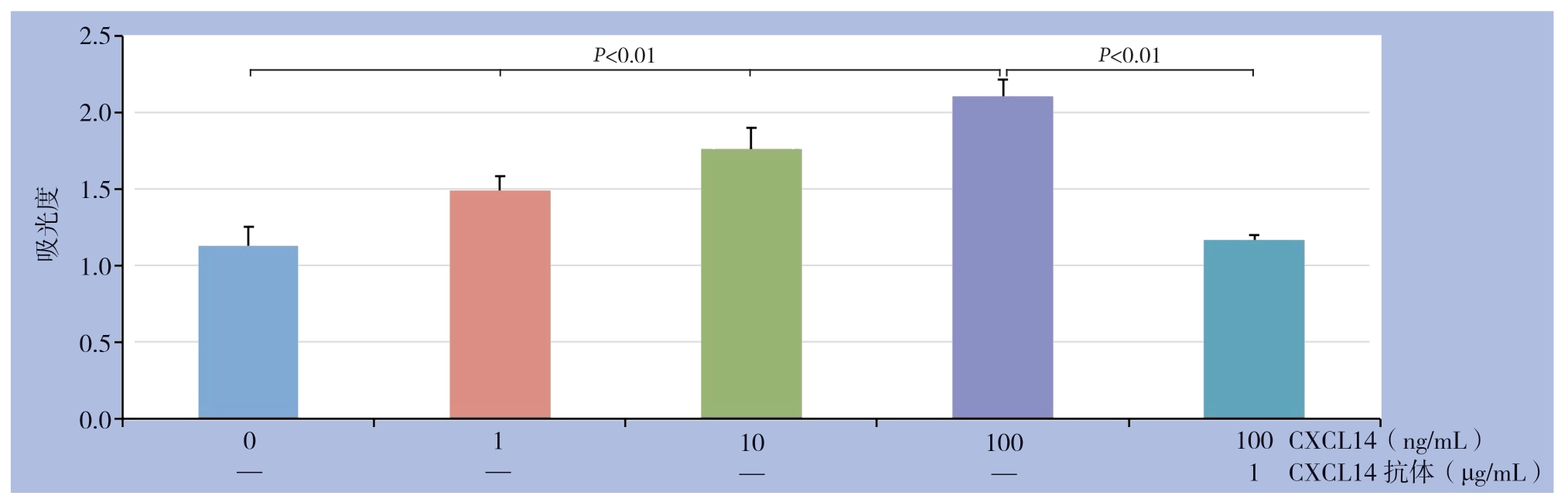
图3 不同浓度CXCL14 对HUVEC 增殖的影响
Figure 3 The effects of different concentrations of CXCL14 on proliferation of HUVECs
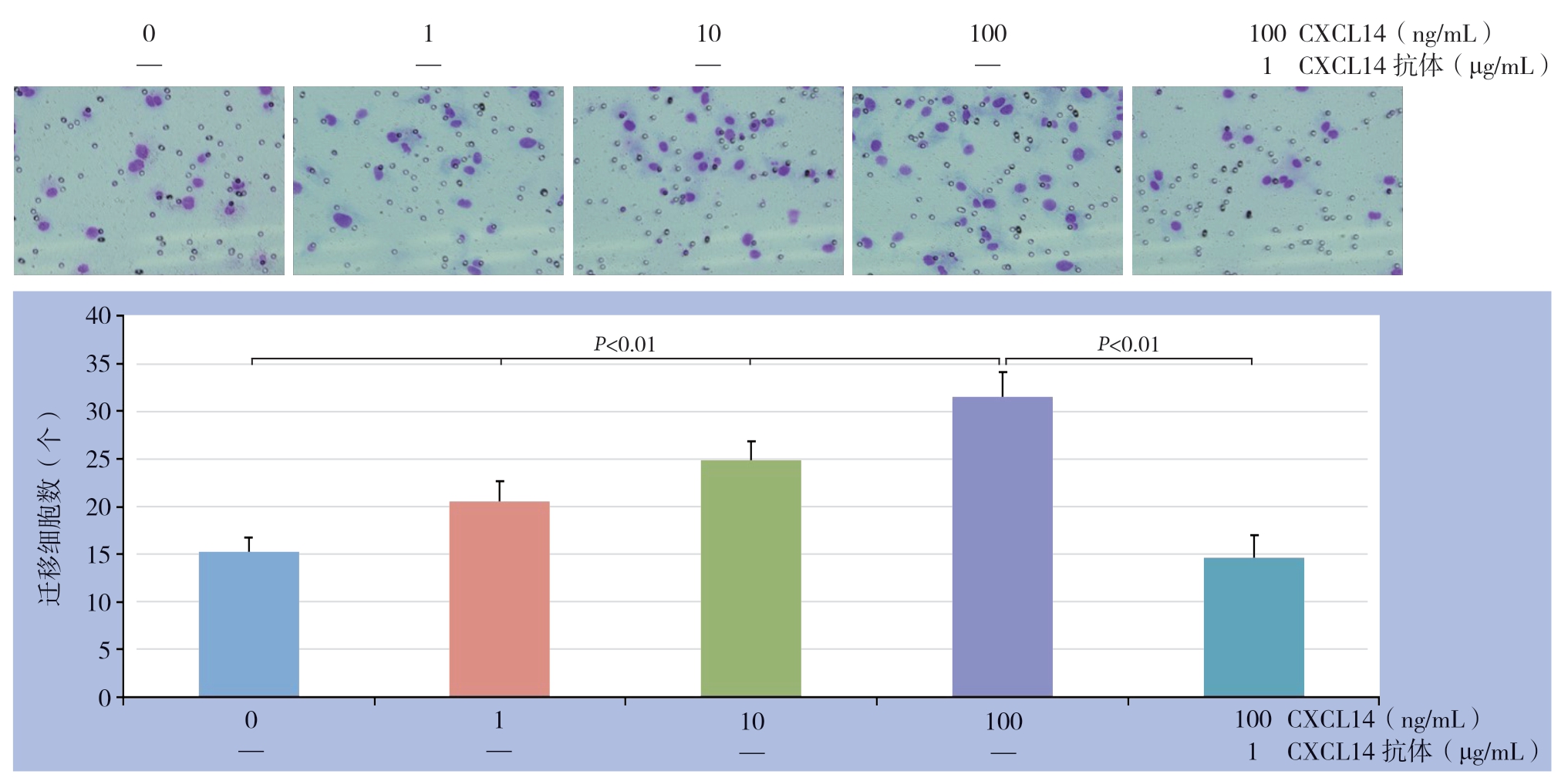
图4 不同浓度CXCL14 对HUVEC 迁移的影响
Figure 4 The effects of different concentrations of CXCL14 on migration of HUVECs
2.5 CXCL14 对HUVEC 血管生成的影响
CXCL14能够促进新生血管的形成,并与浓度呈依赖性,0、1、10、100 ng/mL CXCL14作用后CD31染色的像素值分别为:67 000±8 760、82 000± 7 054、110 000±13 075、129 000±11 009);CXCL14抗体能够拮抗CXCL14的作用,100 ng/mL CXCL14+CXCL14抗体作用后的CD31染色的像素值为68 329±12 698(图5)。
2.6 不同表达CXCL14 的结直肠癌细胞对HUVEC 血管生成的影响
结直肠癌细胞株H T-2 9 表达CXCL14,而CaCo-2细胞株不表达CXCL14,为观察不同表达的结直肠癌细胞对HUVEC新生血管的影响,在包含成纤维细胞+HUVEC的24孔培养盘上放置底部覆盖聚碳酸酯膜带有0.45 μm微孔的Transwell,内分别置有1×104/mL的HT-29或CaCo-2结直肠癌细胞组成共同培养系统,共同孵育12 d后,结果显示,与HT-29细胞共培养组的CD31像素值为148 765±17 000,而与CaCo-2细胞共培养组、无结直肠癌细胞对照组CD31像素值明显降低,分别为100 765±13 054、67 062±9 760;与比较转染CXCL14 siRNA的HT-29细胞共培养组的CD31像素值也明显降低,其值为113 250±11 009(图6)。
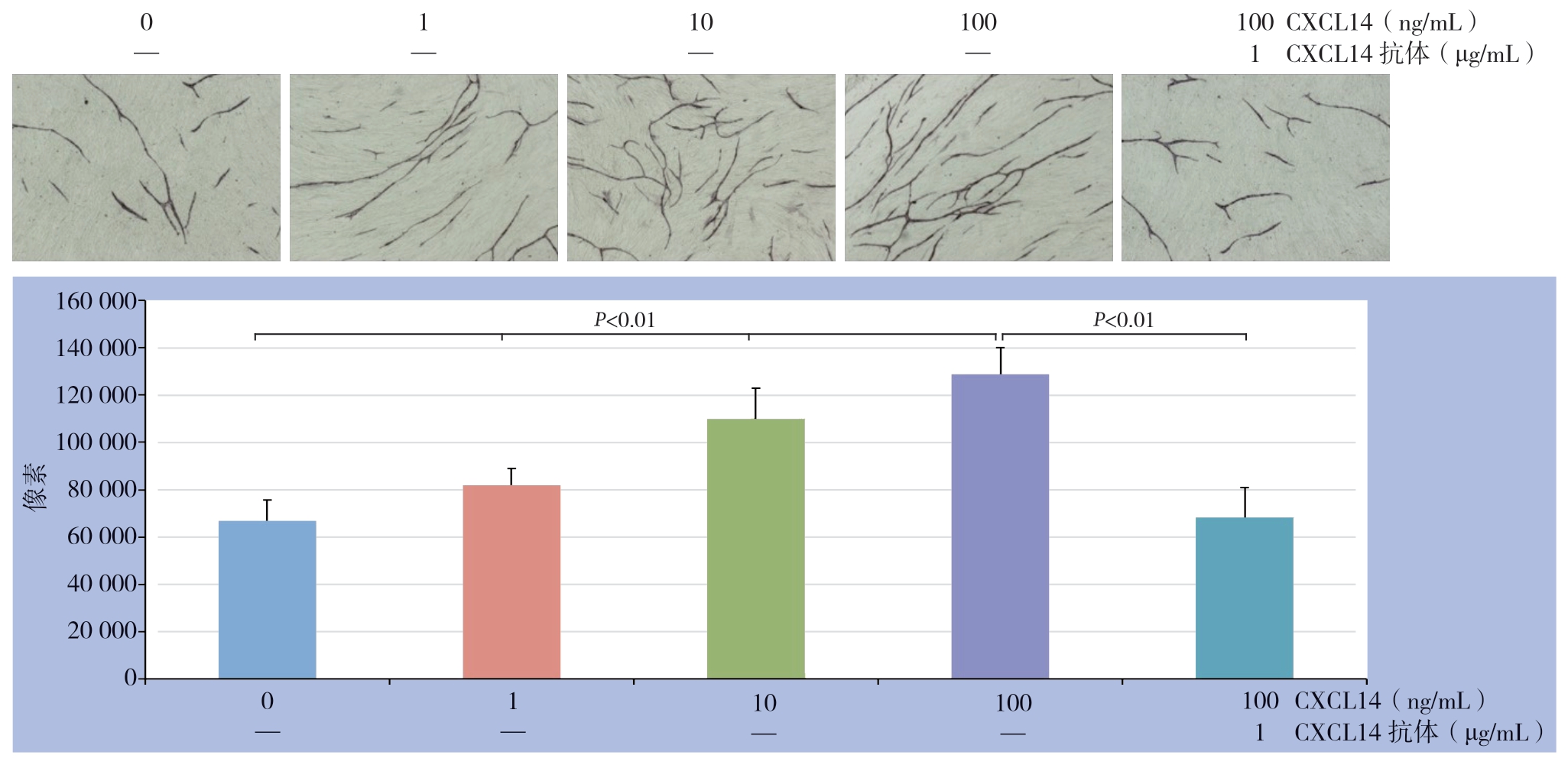
图5 不同浓度CXCL14 对HUVEC 血管生成的影响
Figure 5 The effects of different concentrations of CXCL14 on angiogenesis of HUVECs
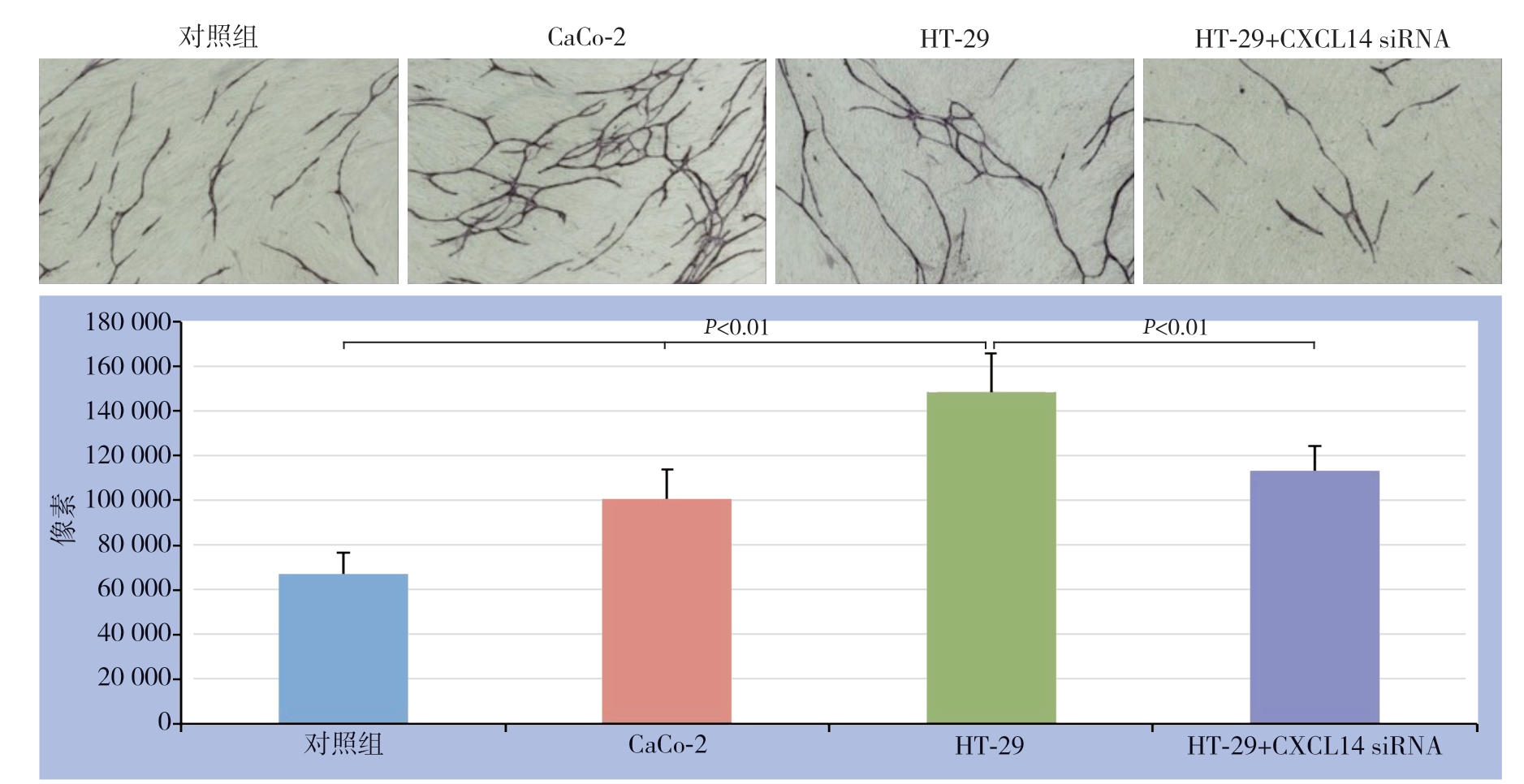
图6 不同CXCL 14 表达水平的结直肠癌细胞对HUVEC 血管生成的影响
Figure 6 The effects of colorectal cancer cells with different CXCL14 expression levels on angiogenesis of HUVECs
3 讨 论
趋化因子是器官形成和免疫防御过程中细胞迁移的重要调控因子,CXCL14是趋化因子CXC家族的新成员,CXCL14参与体内的多种生物学功能的调控,如肿瘤相关血管的形成、炎症免疫反应、宿主对肿瘤特异度免疫的激活以及肿瘤的自分泌调节等[10-14]。近期CXCL14在肿瘤方面的研究表明,CXCLl4与肿瘤的发生密切相关,CXCL14在卵巢癌、肺癌、宫颈癌组织中的表达减少或者缺失[15-17],在乳腺癌中CXCL14蛋白的表达与淋巴结转移具有负相关性[18]。而在胃癌,肝癌及直肠癌中存在着高表达[19-21]。趋化因子CXCL14的功能为细胞增殖、分化、迁移的调控因子[17]。
前期通过动物实验确定了4株结直肠癌细胞的肝转移能力,分为高肝转移株(HT-29和WiDr)和低肝转移株(CaCo-2和Colo-320)[22],这为本研究奠定了良好基础。本次研究结果表明:CXCL14基因和蛋白的表达与结直肠癌细胞的肝转移密切相关,即CXCL14只表达于高肝转移细胞株HT-29和WiDr,而在低肝转移株CaCo-2和Colo-320则未检测到表达。Zeng等[20]的研究证实CXCL14在结直肠癌组织中的表达显著高于正常的大肠组织并与肝转移相关,上述研究表明CXCL14的表达与结直肠癌的肝转移具有相关性。为了进一步研究CXCL14在结直肠癌转移中的作用及机制,本团队应用细胞增殖实验和迁移实验检测CXCL14对血管内皮细胞增生和迁移的影响,结果显示CXCL14以浓度递增的方式促强化血管内皮细胞的增殖和迁移。新生血管在肿瘤的进展和转移中发挥重要作用,为阐明CXCL14对肿瘤新生血管的作用,本研究纤维细胞与血管内皮细胞在体外孵育新生血管,发现CXCL14能够明显提升新生血管的生成。为进一步探究微环境中结直肠癌细胞起源的CXCL14对肿瘤新生血管的影响,本研究创造性的运用不同表达CXCL4的癌细胞与成纤维细胞与血管内皮细胞构建双层培养系统表明肿瘤微环境中结直肠癌细胞起源的CXCL14能够上调肿瘤新生血管的生成。另有研究[23]表明,趋化因子CXCL14通过上调MMP-2促进了乳腺癌SKOV-3细胞的迁移。分析上述结果,CXCL4在结直肠癌的转移中通过强化血管内皮细胞的增殖和迁移而上调肿瘤新生血管的生成,促进了结直肠癌的转移。CXCL14促进肿瘤生长的效果取决于表达CXCL14的细胞类型,肿瘤间质中的成纤维细胞表达CXCL14具有促进肿瘤生长的效果[24]。在乳腺癌中CXCL14 mRNA在肿瘤间质中的表达升高是患者预后不良的独立因素[25]。此外,在人前列腺癌中成纤维细胞中过表达的CXCL14可促进前列腺癌增殖、肿瘤新生血管的形成以及巨噬细胞浸润,其机制可能是过表达的CXCL14与成纤维细胞共同作用促进了前列腺癌细胞的增生和侵袭[26]。Pelicano等[27]的研究中指出,CXCL14 介导ROS-活化蛋白-1通路可调节线粒体功能和活性氧应激能力促进肿瘤细胞的迁移,乳腺癌细胞内线粒体呼吸链紊乱ROS上调导致新一代细胞亚克隆进而激活细胞的增殖、运动和侵袭 。还有研究表明低分化大肠腺癌CXCL14表达明显高于中高分化大肠腺癌,高临床分期大肠腺癌CXCL14的表达高于低临床分 期[28-30]的大肠腺癌。
综上所述,CXCL14在结直肠癌的表达与其转移密切相关,CXCL14通过提升肿瘤新生血管促进结直肠癌的转移,为此,通过阻断CXCL14的表达进而达到抑制结直肠癌的转移提供了潜在的治疗靶点。
[1] Torre LA, Bray F, Siegel RL, et al.Global cancer statistics, 2012[J].CA Cancer J Clin, 2015, 65(2):87–108.doi: 10.3322/caac.21262.
[2] 马家驰, 李渊, 李一平, 等.CXCL8 siRNA通过PI3K/Akt/NF-κB信号途径抑制结肠癌细胞的增殖和侵袭[J].肿瘤, 2015, 35(6):604–612.doi:10.3781/j.issn.1000–7431.2015.11.089.
Ma JC, Li Y, Li YP, et al.CXCL8 siRNA inhibits proliferation and invasion of human colon carcinoma cells through PI3K/Akt/NF-κB signaling pathway[J].Tumor, 2015, 35(6):604–612.doi:10.3781/j.issn.1000–7431.2015.11.089.
[3] 马家驰, 陈泉, 顾远晖, 等.结肠癌细胞起源的白细胞介素1α对血管内皮细胞增殖和迁移的影响[J].中华肿瘤杂志, 2015, 37(11):810–815.doi:10.3760/cma.j.issn.0253–3766.2015.11.003.
Ma JC, Chen Q, Gu YH, et al.Effect of colon cancer cell-derived IL-1α on the migration and proliferation of vascular endothelial cells[J].Chinese Journal of Oncology, 2015, 37(11):810–815.doi:10.3760/cma.j.issn.0253–3766.2015.11.003.
[4] Fazi B, Proserpio C, Galardi S, et al.The Expression of the Chemokine CXCL14 Correlates with Several Aggressive Aspects of Glioblastoma and Promotes Key Properties of Glioblastoma Cells[J].Int J Mol Sci, 2019, 20(10):2496.doi: 10.3390/ijms20102496.
[5] Westrich JA, Vermeer DW, Colbert PL, et al.The multifarious roles of the chemokine CXCL14 in cancer progression and immune responses[J].Mol Carcinog, 2020, 59(7):794–806.doi: 10.1002/mc.23188.
[6] Rodriguez LR, Emblom-Callahan M, Chhina M, et al.Global gene expression analysis in an in vitro fibroblast model of idiopathic pulmonary fibrosis reveals potential role for CXCL14/CXCR4[J].Sci Rep, 2018, 8(1):3983.doi: 10.1038/s41598–018–21889–7.
[7] Nakayama R, Arikawa K, Bhawal UK.The epigenetic regulation of CXCL14 plays a role in the pathobiology of oral cancers[J].J Cancer, 2017, 8(15):3014–3027.doi: 10.7150/jca.21169.
[8] Witte A, Chatterjee M, Lang F, et al.Platelets as a novel source of pro-Inflammatory chemokine CXCL14[J].Cell Physiol Biochem, 2017, 41(4):1684–1696.doi: 10.1159/000471821.
[9] Kondo T, Ozawa S, Ikoma T, et al.Expression of the chemokine CXCL14 and cetuximab-dependent tumour suppression in head andneck squamous cell carcinoma[J].Oncogenesis, 2016, 5(7):e240.doi: 10.1038/oncsis.2016.43.
[10] Ito S, Ozawa S, Ikoma T, et a1.Expression of a chemokine BRAK/CXCLl4 in oraI floor carcinoma cells reduces the settlement rate of the cells and suppresses their proliferation in vivo[J].Biomed Res, 2010, 31(3):199–206.doi: 10.2220/biomedres.31.199.
[11] Rajasekaran G, Dinesh Kumar S, Nam J, et al.Antimicrobial and anti-inflammatory activities of chemokine CXCL14-derived antimicrobial peptide and its analogs[J].Biochim Biophys Acta Biomembr, 2019, 1861(1):256–267.doi: 10.1016/j.bbamem.2018.06.016.
[12] 史新龙, 马家驰, 杨熊飞, 等.白细胞介素1α及其受体拮抗剂对大肠癌细胞增殖、侵袭的影响[J].中国普通外科杂志, 2012, 21(10):1231–1235.
Shi XL, Ma JC, Yang XF, et al.Effect of interleukin 1α and its receptor antagonist on proliferation and invasion of human colon cancer cell lines[J].Chinese Journal of General Surgery, 2012, 21(10):1231–1235.
[13] 陈晓昌, 马家驰, 苏河, 等.结肠癌根治术围手术期应用ω-3多不饱和脂肪酸的疗效[J].中国普通外科杂志, 2016, 25(12):1785–1791.doi:10.3978/j.issn.1005–6947.2016.12.019.
Chen XC, Ma JC, Su H, et al.Efficacy of perioperative use ofω-3 polyunsaturated fatty acids in colon cancer radical surgery[J].Chinese Journal of General Surgery, 2016, 25(12):1785–1791.doi:10.3978/j.issn.1005–6947.2016.12.019.
[14] 赵艳芳, 何訸.上皮性卵巢癌组织趋化因子CXCL14与金属基质蛋白酶2表达相关性研究[J].中国预防医学杂志, 2018, 19(10):757–760.doi:10.16506/j.1009–6639.2018.10.008.
Zhao YF, He H.The expression and clinical significance of the epithelial ovarian cancer tissue chemotactic factor CXCL14 and matrix metalloproteinase 2[J].China Preventive Medicine, 2018, 19(10):757–760.doi:10.16506/j.1009–6639.2018.10.008.
[15] 季晓芹, 沈泽天, 朱锡旭.CXC趋化因子配体14在非小细胞肺癌组织中的表达及其与患者预后的关系[J].中华肿瘤杂志, 2018, 40(9):676–678.doi:10.3760/cma.j.issn.0253–3766.2018.09.007.
Ji XQ, Shen ZT, Zhu XX.Relationship of CXCL14 level and the prognosis of patients with stage Ⅰ-ⅢA non-small cell lung cancer after radical resection[J].Chinese Journal of Oncology, 2018, 40(9):676–678.doi:10.3760/cma.j.issn.0253–3766.2018.09.007.
[16] Cai Z, Wei Q, Li X, et al.Chemical Syntheses and Biological evaluation of CXCL14 and its site-selectively modified methionine sulfoxide-containing derivatives[J].J Org Chem, 2020, 85(3):1740–1747.doi: 10.1021/acs.joc.9b02730.
[17] Li J, Liu C, Chen Y, et al.Tumor characterization in breast cancer identifies immune-relevant gene signatures associated with prognosis[J].Front Genet, 2019, 12(10):1119.doi: 10.3389/fgene.2019.01119.
[18] 潘建生, 江涛, 陈一杰, 等.GADD45α、CXCL14蛋白在胃癌组织中的表达及其与临床特征的关系[J].癌症进展, 2018, 16(12):1503–1505.doi:10.11877/j.issn.1672–1535.2018.16.12.15.
Pan JS, Jiang T, Chen YJ, et al.Expression of GADD45α and CXCL14 protein in gastric carcinoma and its relationship with clinical characteristcs[J].Oncology Progress, 2018, 16(12):1503–1505.doi:10.11877/j.issn.1672–1535.2018.16.12.15.
[19] 张婷, 吴东明, 许颖.CXCL14作为肝癌合并糖尿病诊断标志物的研究[J].现代肿瘤医学, 2017, 25(22):3656–3660.doi:10.3969/j.issn.1672–4992.2017.22.028.
Zhang T, Wu DM, Xu Y.The research of CXCL14 as a diagnostic marker for hepatocellular carcinoma with diabetes[J].Journal of Modern Oncology, 2017, 25(22):3656–3660.doi:10.3969/j.issn.1672–4992.2017.22.028.
[20] Zeng J, Yang X, Cheng L, et al.Chemokine CXCL14 is associated with prognosis in patients with colorectal carcinoma after curative resection[J].J Transl Med, 2013,11:6.doi: 10.1186/1479–5876–11–6.
[21] Park BY, Hong CS, Sohail FA, et a1.Developmental expression and regulation of the chemokine CXCLl4 inXenopus[J].Int J Dev Biol, 2009, 53(4):535–540.doi: 10.1387/ijdb.092855bp.
[22] Ma J, Sun X, Guo T, et al.Interleukin-1 receptor antagonist inhibits angiogenesis via blockage IL-1α/PI3K/NF-κβ pathway in human colon cancer cell[J].Cancer Manag Res, 2017, 9:481–493.doi: 10.2147/CMAR.S147699.
[23] 何剑, 王丹, 何浪.趋化因子CXCL14通过上调MMP-2表达促进人卵巢癌细胞的迁移[J].中外医学研究, 2012, 10(22):9–11.doi:10.3969/j.issn.1674–6805.2012.22.005.
He J, Wang D, He L.Chemokine CXCL14 Promotes Migration of Human Ovarian Cancer Cell Line by Upregulating MMP-2 Expression[J].Chinese And Foreign Medical Research, 2012, 10(22):9–11.doi:10.3969/j.issn.1674–6805.2012.22.005.
[24] Augsten M, Sjöberg E, Frings O, et al.Cancer-associated fibroblasts expressing CXCL14 rely upon NOS1-derived nitric oxide signaling for their tumor-supporting properties[J].Cancer Res, 2014, 74(11):2999–3010.doi: 10.1158/0008–5472.CAN-13–2740.
[25] Gu XL, Ou ZL, Lin FJ, et al.Expression of CXCL14 and its anticancer role in breast cancer[J].Breast Cancer Res Treat, 2012, l35(3):725–735.doi: 10.1007/s10549–012–2206–2.
[26] Augsten M, Hägglöf C, Olsson E,et a1.CXCL14 is an autocrine growth factor for fibroblasts and acts as a multi-modal stimulator of prostate tumor growth[J].Proc Natl Acad Sci U S A, 2009, 106(9):3414–3419.doi: 10.1073/pnas.0813144106.
[27] Pelicano H, Lu W, Zhou Y, et a1.Mitochondrial dysfunction and reactive oxygen species imbalance promote breast cancer cell motility through a CXCL14-mediated mechanism[J].Cancer Res, 2009, 69(6):2375–2383.
[28] Lin K, Zou R, Lin F, et a1.Expression and effect of CXCL14 in colorectal carcinoma[J].Mol Med Rep, 2014, 10(3):1561–1568.doi: 10.3892/mmr.2014.2343.
[29] 张乃友, 刘佳.EGFR和CXCL14在大肠癌组织中的表达[J].解剖科学进展, 2018, 24(6):567–569.doi:10.16695/j.cnki.1006–2947.2018.06.002.
Zhang NY, Liu J.Expression of EGFR and CXCL14 in colorectal carcinoma.Progress of Anatomical Sciences, 2018, 24(6):567–569.doi:10.16695/j.cnki.1006–2947.2018.06.002.
[30] Tong W, Duan Y, Yang R, et al.Foam Cell-Derived CXCL14 Muti-Functionally Promotes Atherogenesis and Is a Potent Therapeutic Target in Atherosclerosis[J].J Cardiovasc Transl Res, 2020, 13(2):215–224.doi: 10.1007/s12265–019–09915-z.
